TaqMan实时荧光定量PCR法检测对虾肝肠胞虫(EHP)步骤优化


摘要" 优化虾肝肠胞虫(EHP)的TaqMan实时荧光定量PCR检测流程,目的是更准确、快速地检测出虾苗,饵料,亲虾体内携带的EHP。本研究采用酚/氯仿抽提法与水生动物病原体核酸提取试剂盒两种DNA提取方法,对等量的病原组织样本进行了对比提取。此外,还设置不同浓度的裂解液以探究其对病原组织裂解效果的影响,并设定不同裂解时间以优化裂解步骤。最后,通过调整qPCR反应的循环数,确定最佳的检测条件。结果显示,水生动物病原体试剂盒提取的DNA检出率高于酚/氯仿抽提法提取,裂解液浓度90%时检测出的EHP含量最高;裂解时间30"min时检测出的EHP含量较高;循环数在40次时足以检测出EHP。综上,优化后的检测流程为用水生动物病原体核酸提取试剂盒提取病原组织DNA,裂解液浓度90%,裂解时间30"min及qPCR检测条件的循环数控制在40次。
关键词" 虾肝肠胞虫;DNA提取;条件优化;TaqMan实时荧光定量PCR
中图分类号" S945.1"""""" 文献标识码" A"""""" 文章编号" 1007-7731(2024)21-0032-05
DOI号" 10.16377/j.cnki.issn1007-7731.2024.21.007
基金项目 国家自然科学基金“罗非鱼CD209介导非特异性细胞毒性细胞(NCC)杀伤活性的分子机制”(32002426);广东省南美白对虾现代种业产业园项目“南美白对虾疫病防控体系的建立与实施”(K22219)。
作者简介 李慰欣(2001—),女,福建龙岩人,硕士研究生,从事鱼类免疫学及病害防控研究。
通信作者 黄瑜(1986—),男,安徽六安人,博士,副教授,从事鱼类免疫学及病害防控研究。
收稿日期 2024-07-18
Optimization of the steps of TaqMan real-time fluorescence quantitative PCR for the detection of Enterocytozoon hepatopenaei (EHP)
LI Weixin1,2""" CHEN Zhengsi1,2""" HUANG Yu1,2
(1College of Fishery, Guangdong Ocean University, Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animal, Zhanjiang 524088, China;
2Key Laboratory of Control for Disease of Aquatic Animals of Guangdong Higher Education Institutes, Southern Marine Science and Engineering Guangdong Laboratory, Zhanjiang 524088, China)
Abstract" Optimize the TaqMan real-time fluorescent quantitative PCR detection process of Enterocytozoon hepatopenaei (EHP) to detect EHP in larvae, bait, and parent shrimps more accurately and quickly. Two DNA extraction methods, phenol/chloroform extraction and aquatic animal pathogen nucleic acid extraction kit, were used to compare and extract the same amount of pathogenic tissue samples. In addition, different concentrations of lysates were set up to investigate the effect of lysates on the lysate of pathogenic tissues, and different lysate times were set up to optimize the lysate steps. Finally, the optimal detection conditions were determined by adjusting the number of qPCR cycles.The results showed that the detection rate of DNA extracted by the aquatic pathogen kit was higher than that of the phenol/chloroform extraction method, and the highest content of EHP was detected when the concentration of lysis solution was 90%; The highest content of EHP was detected when the lysis time was 30"min; The number of cycles of 40 was sufficient to detect EHP. To sum up, the optimized procedure was as follows: use aquatic animal pathogen nucleic acid extraction kit to extract DNA from pathogenic tissues, the concentration of lysate was set at 90%, the lysis time was set at 30"min, and the number of cycles of qPCR was controlled at 40"times for the reaction.
Keywords" Enterocytozoon hepatopenaei; DNA extraction; condition optimization; TaqMan real-time fluorescence quantitative PCR
虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)是一种可以感染多种真核生物的专性细胞内寄生虫。Tourtip等[1]通过组织病理学、超微结构和分子技术等手段对其进行分析研究,将这种新型胞子虫命名为EHP。江海仪等[2]将其归类为真菌界、微胞子虫门、单倍期纲、壶胞目、肠胞虫科、肠胞虫属。近年来,EHP的流行在一定程度上对虾类养殖造成影响[3]。
EHP的检测方法包括组织学方法和分子生物学方法。李楠英等[4]研究表明,组织学技术较费时且繁琐,特别是当病原体处于低水平或潜伏期时,容易漏诊或误诊,因此与分子生物学技术结合,以做出更确切的诊断;分子生物学方法包括原位杂交技术、套式PCR以及TaqMan实时荧光定量PCR方法等。关于EHP的检测,市场上出现了各式各样的快速检测试剂盒,其特点是便捷快速,但价格较高[5]。考虑到企业的生产规模和生产成本,普遍采用TaqMan实时荧光定量PCR检测方法。该方法通过对DNA模板的定量,来实现对病原的检测,对分析微孢子虫载量和开展病原防控研究具有重要意义。从样品核酸提取到检验完成,整个检测反应只需2"h,大大提高了EHP检测效率[6]。骆云慧等[7]研究表明,这种方法对EHP标准质粒的检测灵敏度和检测效率比常规PCR高数10倍,从样品核酸提取到检验完成,检测时间在2~3"h,可以满足虾苗培育基地大量检测样品的需求。张娜等[8]研究显示,TaqMan实时荧光定量PCR方法比组织学方法和套式PCR方法准确性更高,灵敏性更强。因此,为了在虾苗培育阶段保证EHP的检测覆盖率,及检测结果的准确率和稳定性,有必要对虾肝肠胞虫的TaqMan实时荧光定量PCR检测流程进行优化。刘珍等[9]对实时荧光定量PCR反应中的引物浓度、探针浓度、退火温度和反应循环数等条件进行优化,建立了EHP的SYBR Green I实时定量PCR检测方法,该方法灵敏度高、成本低且操作简单,适用于亲虾、苗种的快速检测。筛选简单易行、灵敏准确的EHP检测方法可为EHP早期预防控制提供便利。
目前针对EHP的检测方法大多是从特异性引物角度出发,在PCR检测程序上做优化,以建立一套新颖的检测流程,而有关EHP组织DNA的提取方法研究有待进一步深入,本研究从DNA提取流程和检测程序两部分对整个检测流程进行优化,提高虾苗组织的EHP检出准确性,为种苗产品的质量检测提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验品种 2022年5月在山东潍坊某养殖场采集发病凡纳滨对虾30尾,体重30"g左右,每一尾虾用95%的乙醇溶液保存。
1.1.2 试验试剂及器材 水生动物病原体核酸提取试剂盒(离心柱法)V2.0、EHP核酸检测试剂盒V2.0(广州华峰生物科技有限公司),PBS缓冲液、TE缓冲液、PCR八联管、1.5"mL离心管、0.2"mL薄壁管、2"mL离心柱和细胞裂解液(碧云天生物技术有限公司),10× Ex Taq Buffer和Premix Taq(Ex Taq V2.0)(上海百赛生物技术有限公司),高速离心机、荧光定量PCR仪(博日FQD-16BEA4)。
1.2 试验方法
根据EHP的检测步骤和虾苗培育基地实验室的客观条件,通过以下几个方面对检测流程进行优化并设计试验:DNA的提取(虾肝肠胞虫DNA用作阳性对照)与PCR反应条件的调控。
1.2.1 不同方式提取DNA (1)使用水生动物病原体核酸提取试剂盒(离心柱法) 提取DNA。步骤如下:取0.5"g的病虾肝胰腺置于1.5"mL的EP管中,分别加入少量无菌水,用小型电钻将其充分研磨,做好标记;分别取磨碎后的样品至3个新的离心管内,12"000"r/min,离心10"s,加入700"μL裂解液,充分混匀,使样品充分接触裂解液,静置15"min。取3个离心柱,分别加入500"μL离心柱活化液进行活化,12"000"r/min,离心1"min,弃滤液,套上离心柱收集管备用。静置后,离心管内样品12"000"r/min,离心1"min,将样品转移到活化后的离心柱中,12"000"r/min,离心1"min,弃滤液;加入700"μL 95%无水乙醇,12"000"r/min,离心1"min,弃滤液;12"000"r/min,离心2~3"min,将离心柱晾干,再转移至新的1.5"mL的离心管内,开盖放置1~2"min,使无水乙醇完全挥发,再悬空滴加30~60"μL TE缓冲液,室温静置3"min后,12"000"r/min,离心1"min,将液体样品放入-20"℃的冰柜内保存。
(2)使用酚/氯仿抽提法提取DNA。该方法具体操作过程如下。取50"μL样品和100"μL"细胞裂解液于0.2"mL的薄壁管中,做好标记。将薄壁管放入PCR仪内中加热30"min,加入700"μL"DNA提取液(酚∶氯仿∶异戊醇=25∶24∶1),颠倒充分混匀,分别将薄壁管中的液体吸到离心柱内,1"000"r/min,离心1"min,弃滤液。加500"μL"95%无水乙醇溶液,1"000"r/min,离心1"min(重复2次),弃滤液后离心2"min,分别将离心柱放置在新的薄壁管上,开盖室温放置2"min,加50"μL"TE缓冲液,离心2"min,丢弃吸附柱,将液体样品放入-20"℃的冰柜内保存。
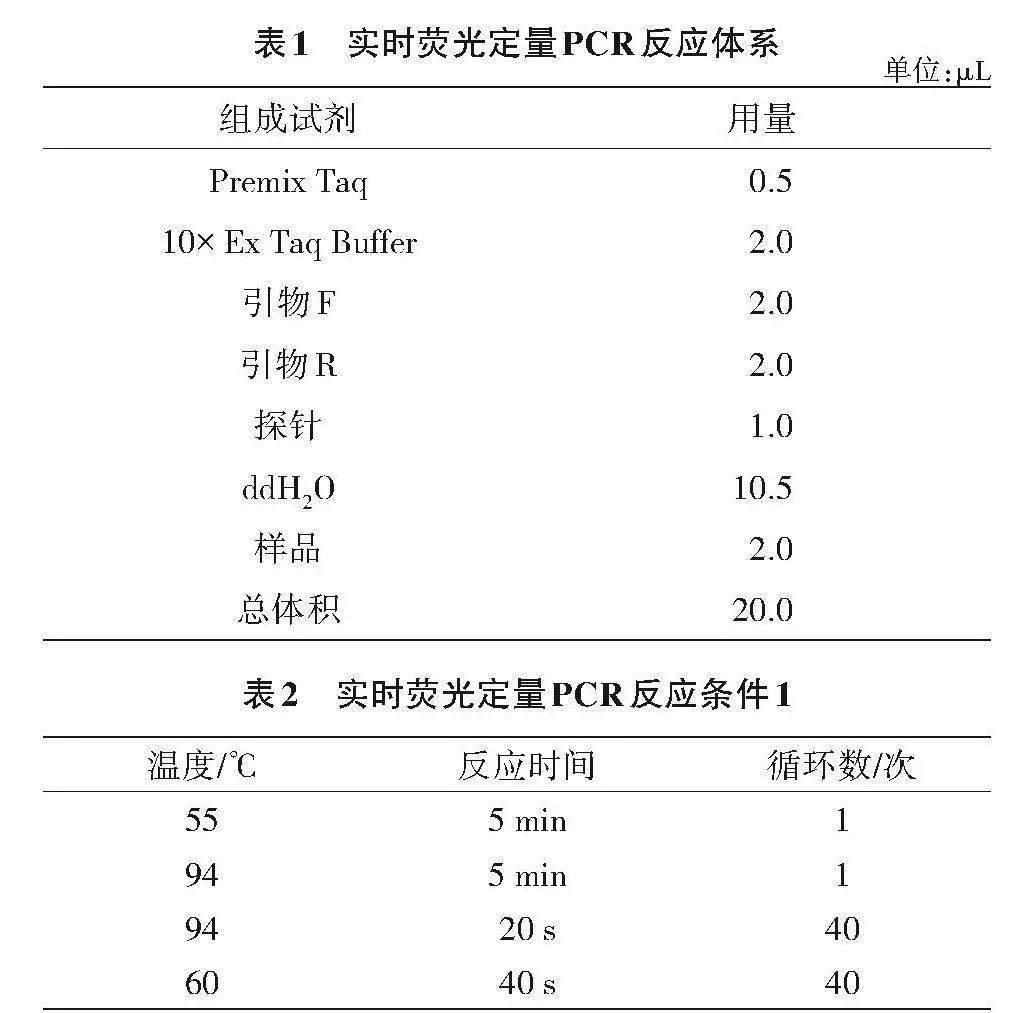
1.2.2 不同浓度的细胞裂解液提取DNA 在提取DNA时的细胞裂解步骤中分别用3种不同浓度的细胞裂解液对病原体组织进行裂解,分别是50%,75%和90%,裂解时间均为15"min,其余步骤按提取试剂盒的方法操作。PCR反应体系如表1所示,反应程序如表2所示。
1.2.3 不同裂解时间提取DNA 设置3个裂解时间分别为15、30和45"min,裂解液浓度保持不变,均为90%,其余步骤按提取试剂盒的方法操作。
1.2.4 引物设计和反应条件 根据NCBI公布的EHP基因组信息,使用Primer 5软件设计EHP核酸序列引物,由广州生工技术公司合成。该反应总体系20 μL,由Premix Taq(DNA Polymerase、Buffer和dNTP Mixture的2倍浓度的混合物)、10× Ex Taq Buffer、EHP引物(EHP-F:5’-AGTAACTATGCCGACCA;EHP-R:AATTAAGCAGCACAATCC-3’)、TaqMan探针(5’-TCCTGGTAGTGTCCTTCCGT-3’)、ddH2O和模板DNA组成。具体用量如表1所示,实时荧光定量PCR反应条件如表2所示。
1.2.5 不同循环次数检测DNA 按水生动物病原体试剂盒方法提取的病原体核酸分别采用两种不同的反应程序进行实时荧光定量PCR反应,程序1循环40次(表2),程序2循环50次(表3),探针的标记荧光基团选择FAM;淬灭基团选择None。
1.3 测定指标和方法
PCR反应程序运行结束后,在程序分析中获得样品检测的CT值。CT值是检测出EHP病原所对应的循环数。CT值越小,说明所检测的病原EHP的含量越高。
1.4 数据分析
使用Excel软件对数据进行归纳整理。
2 结果与分析
2.1 提取方式选择
用酚/氯仿抽提法和试剂盒法对病原体的核酸提取后进行PCR检测,结果如表4所示。酚/氯仿抽提法提取的DNA出现CT值检测不出的情况,结果显示阴性;用试剂盒法提取的DNA,可以稳定地检测出CT值。因此,在实际试验中需选择合适的提取试剂盒,来提高DNA获得率,以提高EHP的检出率。
2.2 检测条件优化
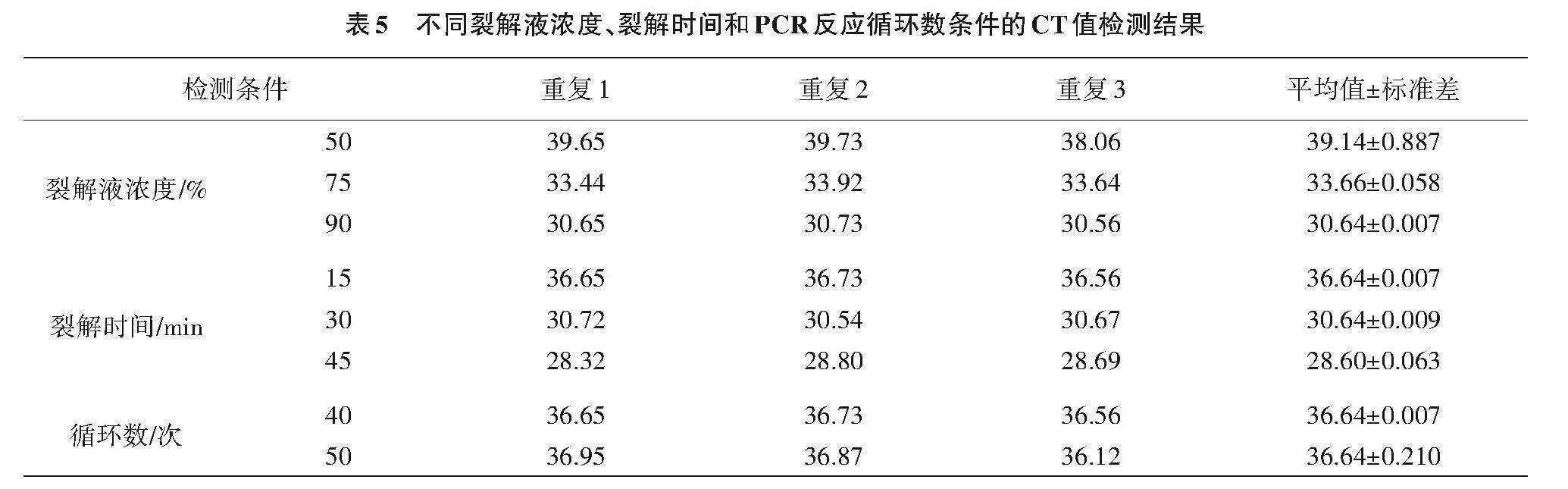
2.2.1 不同的裂解浓度 由表5可知,不同浓度的细胞裂解液(50%、75%和90%)裂解组织,进行PCR检测,得到的CT值具有一定差距。50%组的平均CT值最高,为39.14;75%组平均CT值33.66;90%组的平均CT值最低,为30.64。说明90%浓度的细胞裂解液提取的DNA质量较好,检出的EHP含量较高。
2.2.2 不同的裂解时间 由表5可知,对病原体组织进行同一浓度细胞裂解液但不同裂解时间(15、30和45"min)处理,进行PCR检测,得出的CT值有所不同。15"min组的平均CT值最高,为36.64;30"min组的平均CT值30.64,45"min组的平均CT值最低,为28.60。结果表明,适当延长时间可提高EHP的检测率。实际试验中考虑时间效率问题,可选择裂解时间30"min。
2.2.3 不同的循环次数 由表5可知,循环次数在40时,平均CT值36.64;当循环次数增加到50次,平均CT值36.64。两者平均CT值相同,说明循环40次时足以检测出EHP。
3 结论和讨论
虾肝肠胞虫病是一种由鞭毛体寄生于肝胰腺的原虫病,是水产养殖中一种常见的传染性疾病[10]。EHP的感染不仅导致虾类的生长缓慢,也对水产品的品质和经济效益产生影响[11]。因此,准确地检测出EHP的感染状况对虾肝肠胞虫病的防治工作具有重要意义。刘宝彬等[12]研究表明,TaqMan实时荧光定量PCR是常用的EHP检测方法,相较于普通PCR,能够同时实现定性和定量的分析,且整个检测时间可控制在2"h内,具有较好的时效性。适合水产种苗生产基地每天大量的样品检测。
目前,在对虾种苗培育基地质量检测实验室中,EHP的检测步骤主要有以下几个方面。(1)采集样本:从虾苗体内或周围环境中采集可能携带EHP病原的样本,如虾苗的体液、组织、粪便和水样等。(2)样品处理:将采集到的样本进行处理,如消毒、过滤和离心等,以提高样品的检测灵敏度和准确性。(3)分离纯化:将样品分离出可能存在的病原生物,进行纯化处理,以便进一步鉴定和检测。(4)鉴定检测:对分离纯化后的病原生物进行鉴定和检测,如显微镜观察、生化试验和分子生物学检测等,以确定病原类型和数量。(5)结果分析:根据鉴定和检测结果,分析可能存在的病害为害和风险,并制订相应的防治措施。魏俊利等[13]通过使用商品化海洋动物DNA提取试剂盒,酚/氯仿抽提等方法对EHP进行基因组DNA提取,研究发现,海洋动物DNA提取试剂盒提取的EHP基因组浓度高于氯仿抽提法。与本研究得出的结果一致。刘珍等[9]建立的实时荧光定量PCR检测EHP的方法,通过优化PCR反应条件,表明qPCR扩增效果最好的退火温度为60"℃。雷燕等[6]通过优化PCR扩增条件,建立了快速检测凡纳滨对虾EHP的PCR方法。但是,在检测样本的准备过程中,还存在许多需进一步优化的步骤。
本研究采用酚/氯仿抽提法和水生动物病原体核酸提取试剂盒对病虾组织进行DNA的提取,将提取的DNA进行TaqMan实时荧光定量PCR检测。结果表明,商业化水生动物病原体核酸提取试剂盒法比酚氯仿抽提法更适用于虾苗培育基地生产过程中对虾苗病原检测时DNA的提取。本研究在试剂盒提取DNA的条件下,通过不同浓度的细胞裂解液,不同裂解时间和不同循环次数,对检测流程进行优化,以提高DNA提取质量,提升EHP检测准确度、灵敏度和稳定性。综上,优化后的方案为采用水生动物病原体核酸提取试剂盒对病原组织核酸进行提取,裂解液浓度90%,裂解时间30"min,PCR检测条件的循环次数控制在40次。本方案在不增加成本的基础上,进一步提高了EHP检测精确度和灵敏度,为对虾种苗公司培育高质量苗种提供参考。
参考文献
[1] TOURTIP S,WONGTRIPOP S,STENTIFORD G D,et al. Enterocytozoon hepatopenaei sp. nov. (Microsporida:Enterocytozoonidae),a parasite of the black tiger shrimp Penaeus monodon (Decapoda:Penaeidae):fine structure and phylogenetic relationships[J]. Journal of invertebrate pathology,2009,102(1):21-29.
[2] 江海仪,李婉莹,高焕. 虾肝肠胞虫研究进展[J]. 水产养殖,2023,44(7):31-35.
[3] 崔玮琪,冯晓,宋瑞强,等. 滨州地区凡纳滨对虾苗种虾肝肠胞虫病的调查和分析[J]. 河北渔业,2023(3):14-16.
[4] 李楠英,房文红,王元,等. 虾苗场3种重要病原同步定量PCR检测技术的建立[J]. 海洋渔业,2020,42(3):375-384.
[5] 李英瑕,徐婷婷,刘爽,等. 虾肝肠胞虫(EHP)现场快速高灵敏度检测试剂盒的性能评价研究[J]. 渔业科学进展,2022,43(4):218-225.
[6] 雷燕,肖洋,张会军,等. 凡纳滨对虾肠道上皮细胞微胞子虫PCR检测方法的建立与应用[J]. 广东海洋大学学报,2016,36(4):50-54.
[7] 骆云慧,石坚,方磊,等. 虾肝肠胞虫TaqMan实时荧光定量PCR检测方法的建立及应用[J]. 中国兽医科学,2016,46(7):847-852.
[8] 张娜,谢艳辉,陈进会,等. 虾肝肠胞虫Taqman荧光PCR方法的建立与应用[J]. 中国动物检疫,2017,34(10):98-103.
[9] 刘珍,张庆利,万晓媛,等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测[J]. 渔业科学进展,2016,37(2):119-126.
[10] 吴玉娇. 虾肝肠胞虫感染对虾肝胰腺的特征分析及对宿主脂肪酸代谢的影响[D]. 重庆:西南大学,2023.
[11] 李浩澜,沈辉,顾伟,等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)的研究进展[J]. 水产学杂志,2022,35(3):98-107.
[12] 刘宝彬,杨冰,吕秀旺,等. 凡纳滨对虾(Litopenaeus vannamei)传染性皮下及造血组织坏死病毒(IHHNV)及虾肝肠胞虫(EHP)的荧光定量PCR检测[J]. 渔业科学进展,2017,38(2):158-166.
[13] 魏俊利,孙妍,陈浩楠,等. 虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)基因组不同提取方法的比较[J]. 水产研究,2023(1):23-30.
(责任编辑:胡立萍)

