黄精根状茎无菌快繁体系建立
摘要" 为进一步完善黄精无菌快繁技术体系提供技术基础。本试验以选育的七叶黄精根状茎作为外植体材料,测定不同消毒处理的根茎污染率、死亡率和不同浓度6-BA(6-Benzylminopurine)与NAA(1-Naphthalic acid)组合对其茎段腋芽的萌芽率影响,探索该植物根状茎无菌快繁体系的建立。结果表明,以超声波清洗机消毒15"min的处理效果最好,污染率和死亡率分别为20%和17%;恒温振荡器消毒15"min的污染率和死亡率分别为27%和37%,最佳消毒时间15"min;以MS为基本培养基,采用C12-Y组合(2.0"mg/L 6-BA+0.5"mg/L NAA)处理有芽茎段的效果最好,其平均萌芽率达76.67%,无芽茎段的平均萌芽率达56.67%。
关键词" 黄精;根状茎;无菌快繁体系;消毒处理
中图分类号" S567"""""" 文献标识码" A"""""" 文章编号" 1007-7731(2024)22-0097-04
DOI号" 10.16377/j.cnki.issn1007-7731.2024.22.021
基金项目 辽宁省教育厅2021年度科学研究经费项目“黄精品种选育与优质高产栽培示范”(LJKZ1218)。
作者简介 程贵兰(1977—),女,河北廊坊人,硕士,副教授,从事种苗快繁研究。
通信作者 高涵(1982—),女,辽宁营口人,硕士,讲师,从事食品检测及功能性食品开发;蔡智军(1976—),男,内蒙古赤峰人,教授,从事功能性食品研究。
收稿日期 2024-09-08
Establishment of aseptic rapid propagation system for the rhizomes of Polygonatum sibiricum
CHENG Guilan""" WANG Ya’nan""" ZHAO Zhihan""" GAO Han""" CAI Zhijun""" JIA Qingxian
(Liaoning Agricultural Vocational and Technical College, Yingkou 115009, China)
Abstract" To provide a technical basis for further improving the aseptic rapid propagation technology system of Polygonatum sibiricum. The seven leaf Polygonatum sibiricum rhizomes were selected as explant materials, the root and stem contamination rate and mortality rate of different disinfection treatments, as well as the germination rate of axillary buds in stem segments treated with different concentrations of 6-BA (6-Benzylminopurine) and NAA (1-Naphthalic acid) combinations were measured, a aseptic rapid propagation system had been established for the rhizomes of this plant. The results showed that the treatment effect was best when disinfected with an ultrasonic cleaning machine for 15"minutes, with a contamination rate of 20% and a mortality rate of 17%; The contamination rate and mortality rate of the constant temperature oscillator after 15"minutes of disinfection were 27% and 37%, respectively, and the optimal disinfection time was 15"minutes; MS was used as the basic medium, the C12-Y combination (2.0"mg/L 6-BA+0.5"mg/L NAA) showed the best treatment effect on stem segments with buds, with an average germination rate of 76.67% and an average germination rate of 56.67% for stem segments without buds.
Keywords" Polygonatum sibiricum; rhizome; aseptic rapid propagation system; disinfection treatment
黄精(Polygonatum sibiricum Redouté)为百合科多年生草本植物,以根茎入药,是一味常用的补阴药,应用历史悠久。《中华人民共和国药典》[1](2020版)收载了3种植物来源的黄精,分别是滇黄精(Polygonatum kingianum Collett amp; Hemsl.)、黄精和多花黄精(Polygonatum cyrtonema Hua),均以干燥根茎入药,因其根茎形状不同,分别称为大黄精、鸡头黄精和姜形黄精[2]。据《中国植物志》[3]记载,滇黄精主产云南、四川和贵州等地;黄精主产黑龙江、吉林、辽宁、河北、山西、陕西和内蒙古等地,多花黄精主产四川、贵州、湖南、湖北、河南(西、南部)和江西等地。
黄精根状茎呈圆柱状,结节处膨大,节间一端粗、一端细,较粗的一端有短分枝,该根状茎类型所制成的药材为鸡头黄精。其茎高50~90"cm,轮生叶,每轮4~6枚,条状披针形,先端拳卷或弯曲成钩。钟子龙等[4]研究多花黄精根茎萌发新芽及生长习性,表明该植物可选择3年生的根茎切成种块进行苗木繁育。王海洋等[5]研究滇黄精离体快繁体系建立及优化,表明该植物根状茎诱导分化的最适培养基配方为1/2 MS(Murashige and skoog)+6-BA(6-Benzylminopurine)2.0"mg/L+2,4-D(2,4-Dichlorophenoxyacetic acid)0.2"mg/L+蔗糖30"g/L+琼脂5.5"g/L。研究团队于2019年在辽宁营口、抚顺等地开展黄精品种资源收集,通过野外定点鉴定和试验地人工栽培等方法,选育出若干株七叶轮生的黄精,并于2022年开花结实。本试验以选育的七叶黄精根状茎作为外植体材料,测定不同消毒处理的根茎污染率、死亡率以及不同浓度6-BA与NAA(1-Naphthylacetic acid)组合对其茎段腋芽的萌芽率的影响,探索七叶黄精根状茎无菌体系的建立,为进一步完善七叶黄精无菌快繁技术体系提供技术基础。
1 材料和方法
1.1 试验材料
试验材料取自辽宁农业职业技术学院黄精种植基地,选取3年生生长健壮且无病虫害的七叶黄精根状茎。6-BA、NAA均购于北京酷莱博生物科技有限公司。
1.2 试验设计
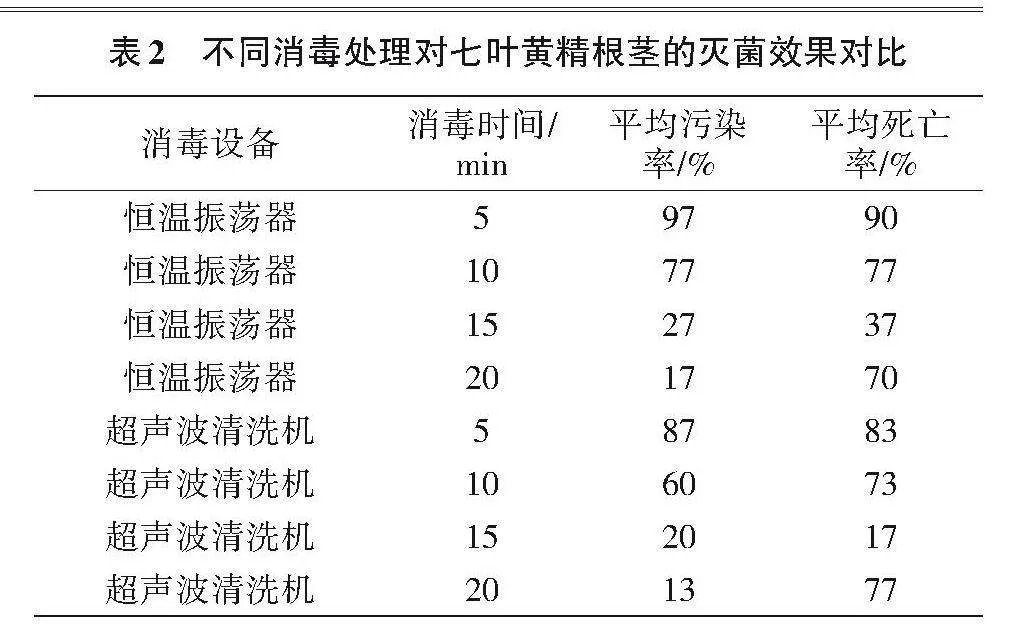
1.2.1 不同消毒处理对七叶黄精根茎灭菌效果的影响 将预处理后的植物材料放入装有2.5%次氯酸钠溶液的试管中,分别放置在恒温振荡器(型号ZD-85)和超声波清洗机(型号KQ-500DM)中处理5、10、15和20"min,比较不同消毒设备和消毒时间对其灭菌效果的影响。每瓶接种1个外植体,每个处理10瓶,重复3次。
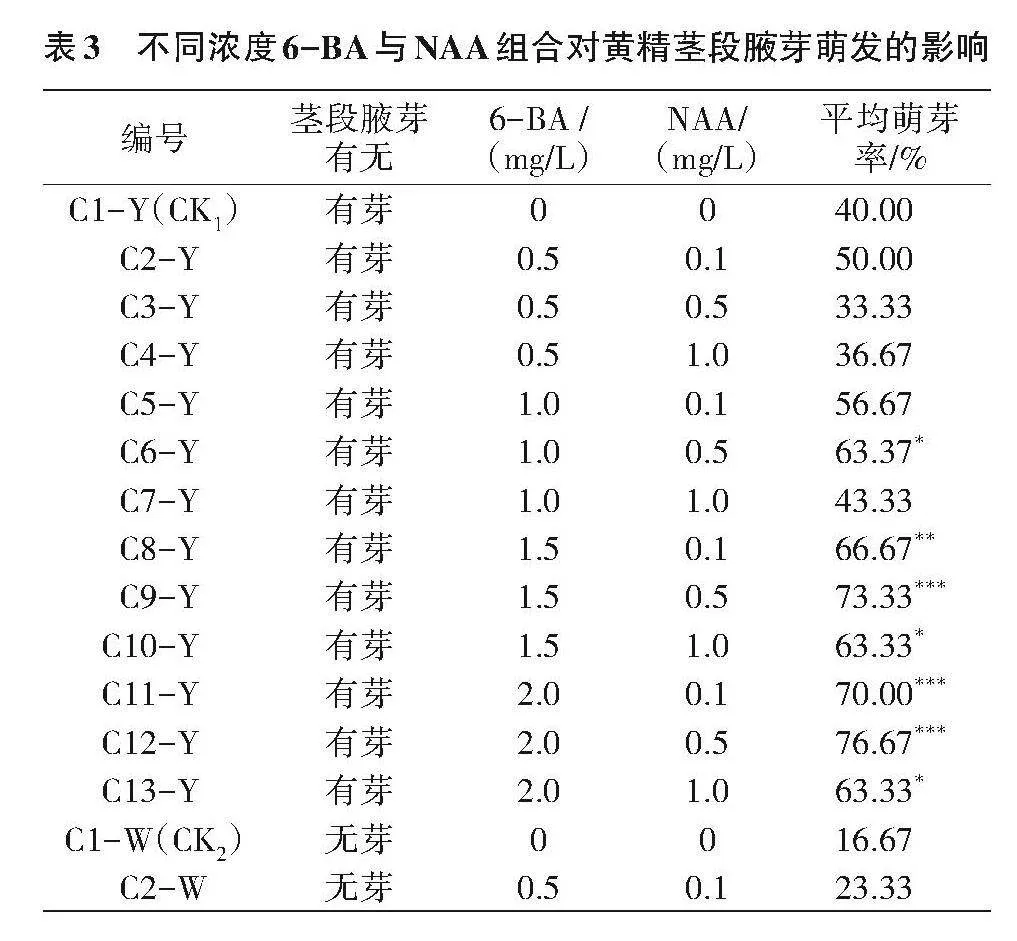
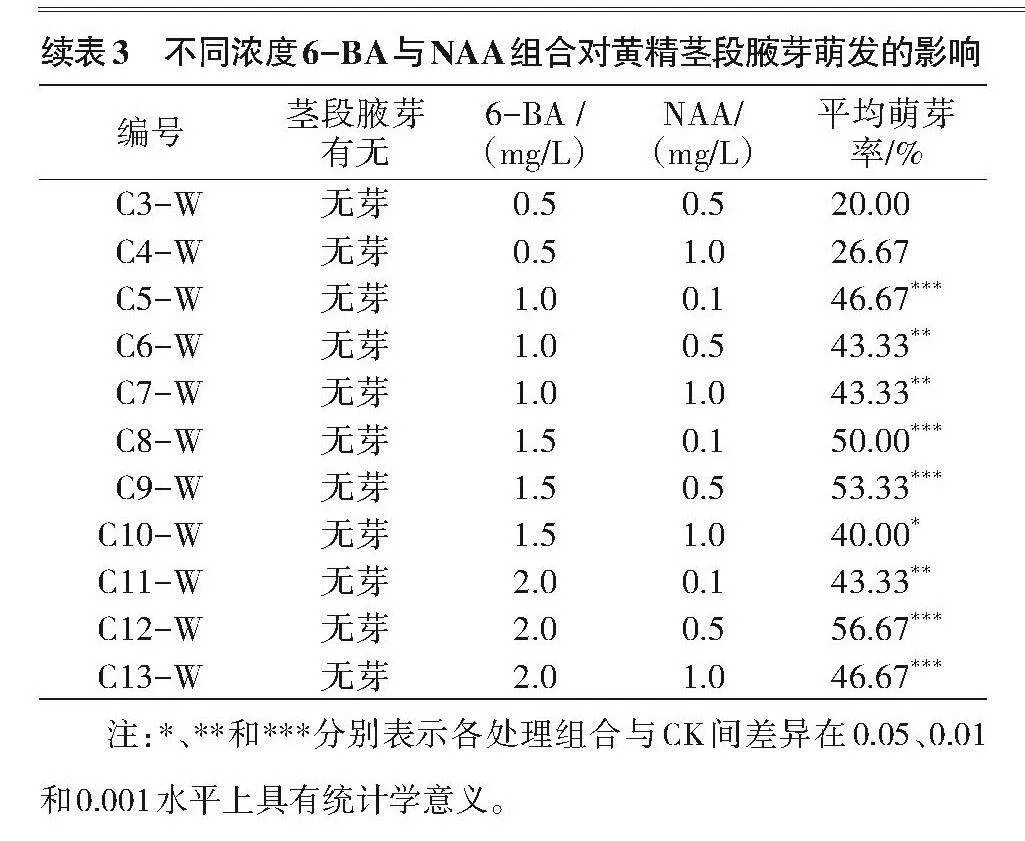
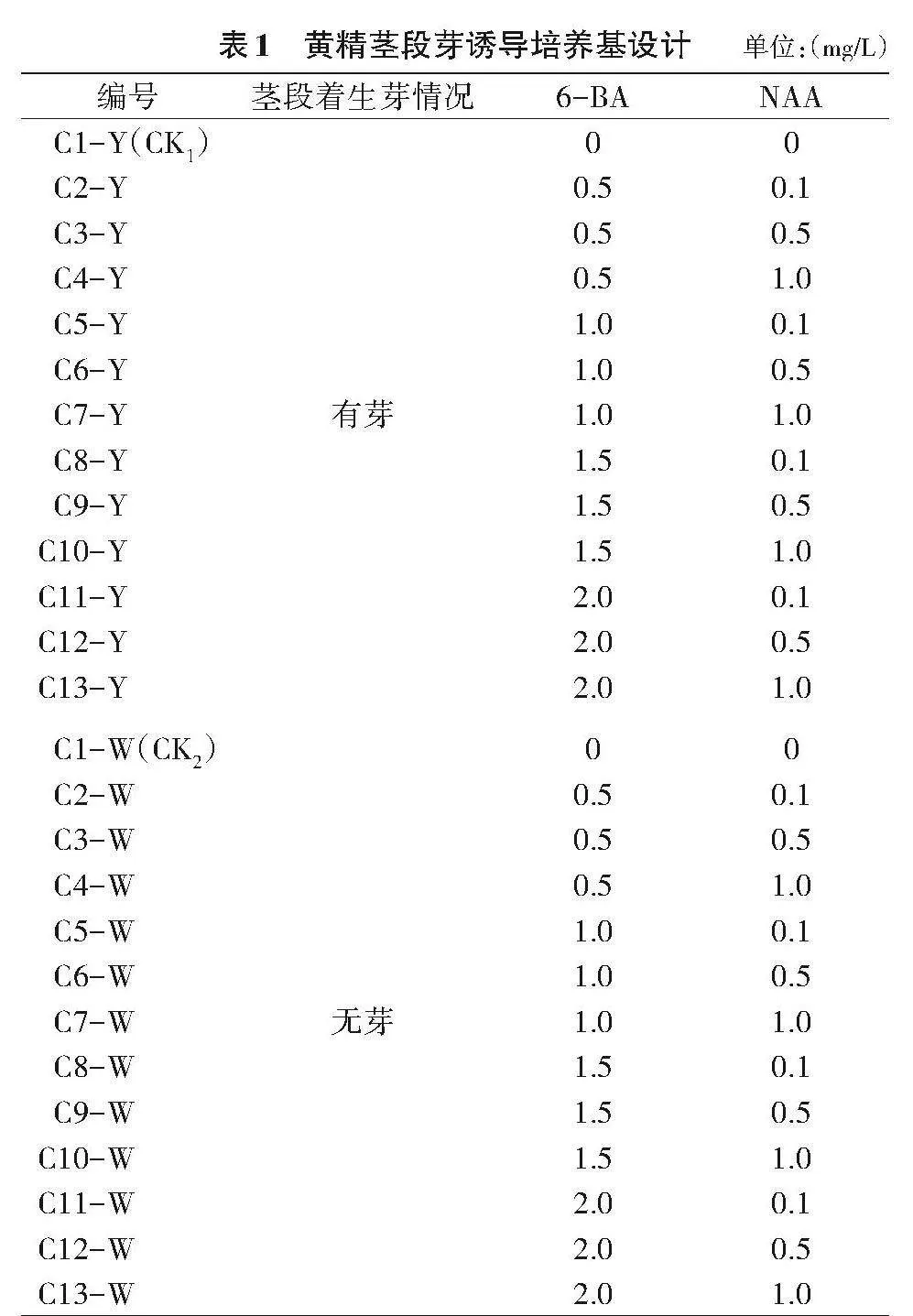
1.2.2 不同浓度生长调节剂6-BA与NAA组合对七叶黄精茎段腋芽萌发的影响 该植物根状茎分有芽和无芽两种类型,获得无菌材料后,比较其有芽和无芽根状茎在13个浓度组合培养基上的腋芽萌发情况,每瓶接种1个外植体,每个处理10瓶,重复3次。培养基设计见表1。
1.3 试验方法
1.3.1 根状茎预处理 将挖取的根状茎清洗干净,选择生长健壮的白色或乳白色且无病斑的根状茎,去除茎节处着生的须根,用75%乙醇棉球将试验材料外表面擦拭干净,将其切成3~5"cm茎段,置于流水下冲洗12"h。
1.3.2 外植体接种前灭菌处理 将冲洗后的根状茎茎段置于超净工作台上,节的上下端各保留1.0~1.5"cm,最终茎段长度在2~3"cm;将处理好的试验材料放入无菌小试管中(规格30"mm×80"mm),每个小试管中放2个外植体,用75%乙醇消毒30"s,将75%乙醇倒掉后再加入2.5%的次氯酸钠溶液,溶液体积为试管容量的2/3,以保证外植体被完全浸没,并加盖密封;10个/捆,分别放入恒温振荡器(设定温度25"℃、40 Hz)和超声波清洗机(设定温度25"℃、80 r/min)清洗5、10、15和20"min。
1.3.3 接种与过渡培养 消毒后,取出试管中的茎段,用无菌水漂洗3次,然后置于无菌滤纸上吸干其表面水分,置于无菌培养皿,将其切割成大小1"cm、节上保留1/3、节下保留2/3的短茎段,避免伤及芽,然后将其接种于添加30"g/L蔗糖、7"g/L琼脂和pH 5.5~6.0 的MS培养基中进行过渡培养,每瓶接种1个外植体。置于25"℃暗环境下培养2"d,再转入光照强度2 000 lx条件下培养,光周期12 L∶12 D,10"d后测定其污染率和死亡率。
1.3.4 不定芽的诱导培养 将经过过渡培养的有芽和无芽茎段分别转接于各芽诱导培养基中,每个处理10瓶,每瓶接种1个单芽段,重复3次。置于25"℃、光照强度2 000 lx条件下培养,光周期12 L∶12 D。
1.4 观测指标和方法
1.4.1 无菌材料污染率与死亡率 灭菌效果指标污染率和死亡率计算如式(1)~(2)。
污染率(%)=污染外植体数/接种外植体数×100
(1)
死亡率(%)=死亡外植体数/接种外植体数×100
(2)
1.4.2 不定芽诱导萌芽率 根状茎在培养基上培养40"d后观察腋芽萌发情况,有芽茎段以出现腋芽、无芽茎段以芽眼处有圆突状萌芽点长出视为萌发。萌芽率计算如式(3)。
萌芽率(%)=萌芽外植体数/接种外植体数×100
(3)
1.5 数据处理
使用GraphPad Prism 5 软件进行数据处理。
2 结果与分析
2.1 不同消毒处理对根茎灭菌效果的影响
由表2可知,随处理时间的延长,两种消毒设备处理下的污染率均呈递减趋势。采用恒温振荡器处理20"min的平均污染率(17%)低于处理15"min (27%),其平均死亡率较处理15"min高33百分点;采用超声波清洗机处理15"min的平均污染率(20%)高于处理20"min (13%),其平均死亡率较处理20"min低60百分点;采用超声波清洗机处理15"min的平均污染率和平均死亡率较采用恒温振荡器处理15"min分别低7和20百分点。综合来看,采用超声波清洗机处理15"min对七叶黄精根茎灭菌效果较好。
2.2 不同浓度6-BA与NAA组合对茎段腋芽萌发的影响
由表3可知,外植体有芽茎段的平均萌芽率普遍高于无芽茎段,随着6-BA浓度的提高,平均萌芽率呈递增趋势,尤以C12-Y组合(2.0"mg/L 6-BA+0.5"mg/L NAA)有芽茎段的平均萌芽率最高,为76.67%,较CK1提升36.67百分点,与除C11-Y、C9-Y外组合差异存在统计学意义(Plt;0.001),无芽茎段的平均萌芽率56.67%;C9-Y组合(1.5"mg/L 6-BA+0.5"mg/L NAA)有芽茎段的平均萌芽率73.33%,无芽茎段的平均萌芽率53.33%,与对照组(CK1和CK2)差异存在统计学意义(Plt;0.001);C8-Y组合(1.5"mg/L 6-BA+0.1"mg/L NAA)有芽茎段的平均萌芽率也较高,为66.67%,与CK1差异具有统计学意义(Plt;0.01),无芽茎段的平均萌芽率50.00%,与CK2差异存在统计学意义(Plt;0.001)。综合来看,使用有芽茎段对黄精茎段腋芽萌发效果较好,以C12-Y组合(2.0"mg/L 6-BA+0.5"mg/L NAA)处理的效果最好,对平均萌芽率提升有明显的促进作用。
3 结论与讨论
七叶黄精的根状茎长期生长在泥土中,附着较多的微生物,因此其根状茎的消毒程度与无菌体系密切相关。本研究对七叶黄精根状茎预处理后,分别用75%乙醇和2.5%的次氯酸钠溶液消毒,采用恒温振荡器和超声波清洗机消毒15"min效果最佳,采用超声波清洗机的消毒效果最好,污染率为20%,这与刘红美等[6]分别采用75%乙醇和2.5%次氯酸钠溶液消毒3次,每次5"min的多次短时灭菌法,消毒效果较好的结论相似。周新华等[7]用75%乙醇对多花黄精根状茎进行表面灭菌30"s,再用0.1%氯化汞灭菌10"min,其外植体材料无菌保存率达73.2%。本研究发现,使用同一消毒设备消毒不同时间对根茎外植体污染率和死亡率产生较大影响,当消毒时间过长,污染率降低的同时死亡率也升高,可能是因为消毒时间过长对外植体材料造成损伤,这与党裳霓等[8]研究结果基本一致;而消毒时间过短导致污染率和死亡率均较高,可能是因为黄精中多糖、氨基酸等营养成分促使杂菌迅速扩增。
黄精腋芽的萌发情况与生长调节剂种类、使用浓度及不同生长调节剂之间的组合配比有关。本研究以MS为培养基,通过研究6-BA和NAA的浓度配比对七叶黄精腋芽萌发的影响,发现6-BA和NAA浓度在0.5~2.0"mg/L组合配比均能诱导有芽、无芽茎段不定芽萌发,以2.0"mg/L 6-BA+0.5"mg/L NAA的效果最好,与农艳丰等[9]以MS为培养基,2.0"mg/L 6-BA+0.2"mg/L NAA+0.5"mg/L 2,4-D组合诱导滇黄精根茎芽点萌芽率达62.9%的结果相似。刘红美等[6]以MS培养基添加0.2"mg/L 2,4-D与2.0"mg/L 6-BA 诱导出不定芽,说明2.0"mg/L 6-BA有利于黄精不定芽的萌发;牟小翎等[10]研究发现,以MS为培养基,添加4.0"mg/L 6-BA对泰山野生黄精不定芽的诱导效果较佳,说明单一激素也能诱导黄精根状茎不产生定芽;孙俊威等[11]以MS为培养基,添加1.0"mg/L ZT(Zeatin)与0.2"mg/L NAA多花黄精根状茎不定诱导率为87.9%,说明其他激素对黄精根茎不定芽诱导也有较好的效果。
综上,以超声波清洗机消毒15"min的处理效果最好,污染率和死亡率分别为20%和17%;恒温振荡器消毒15"min的污染率和死亡率分别为27%和37%,最佳消毒时间为15"min。以MS为培养基,采用C12-Y组合(2.0"mg/L 6-BA+0.5"mg/L NAA)处理有芽茎段的效果最好,其平均萌芽率达76.67%,无芽茎段的平均萌芽率达56.67%。
参考文献
[1] 国家药典委员会. 中华人民共和国药典 一部[M]. 北京:中国医药科技出版社,2020.
[2] 徐睿,程铭恩,彭华胜. 黄精的品质评价及其 “辨状论质” 考[J]. 中成药,2023,45(4):1241-1245.
[3] 中国科学院中国植物志编辑委员会. 中国植物志-第七卷[M]. 北京:科学出版社,1978.
[4] 钟子龙,张小辉,王洪根,等. 多花黄精根茎萌发新芽及生长习性研究[J]. 浙江林业科技,2024,44(2):63-67.
[5] 王海洋,龙飞,沈伟祥,等. 滇黄精离体快繁体系建立及优化[J]. 黑龙江农业科学,2022(5):85-90.
[6] 刘红美,方小波,夏开德,等. 多花黄精组织培养快繁技术的研究[J]. 种子,2010,29(12):13-17.
[7] 周新华,曾满生,肖智勇,等. 多花黄精嫩茎与根茎芽离体培养技术[J]. 经济林研究,2014,32(4):68-72.
[8] 党裳霓,刘影,高润梅. 穿龙薯蓣茎段组培体系的建立[J]. 种子,2020,39(12):1-6.
[9] 农艳丰,李健,吴永振. 滇黄精不同外植体无菌体系的建立[J]. 安徽农学通报,2018,24(22):21-23,86.
[10] 牟小翎,张利民,杨圣祥,等. 泰山野生黄精的组培快繁技术研究[J]. 山东农业科学,2010,42(1):12-13,17.
[11] 孙骏威,赵进,周荣鑫. 不同植物生长调节剂对多花黄精组织培养的效果[J]. 贵州农业科学,2017,45(3):97-100.
(责任编辑:吴思文)

