盐度驯化对许氏平鲉钠钾ATP酶活性及鳃中AQP3基因表达量的影响


摘要" 为探究盐度驯化对许氏平鲉钠钾ATP酶(NKA)活性及鳃中AQP3基因表达量的影响,将140尾该鱼分为急性盐度驯化和慢性盐度驯化两部分试验。急性盐度驯化将其放入盐度为32、27、24、21、18、15、12和9的试验组中进行盐度胁迫,取鳃、肠及肾组织样测定NKA活性;慢性盐度驯化将其放入盐度为32、25、20、15、10和5的试验组中进行盐度胁迫,取鳃组织样测定AQP3的表达量。急性盐度驯化结果表明,除对照组外,鳃中NKA活性均明显高于肠和肾中NKA的活性(Plt;0.05),各个盐度组中肠和肾中NKA的活性差异无统计学意义(Pgt;0.05)。慢性盐度驯化结果显示,在盐度胁迫达到4"h时,AQP3的表达量在25‰和20‰组出现峰值,随着盐度下降,表达量也随之下降;96"h时25‰组AQP3表达量逐渐恢复,而20‰组表达量仍为峰值,而后随盐度下降逐渐下降。综上,许氏平鲉可通过NKA和AQP3调节机体的渗透压平衡。
关键词" 许氏平鲉;盐度胁迫;Na+,K+-ATPase;AQP3基因
中图分类号" S965.399"""""" 文献标识码" A"""""" 文章编号" 1007-7731(2024)22-0036-07
DOI号" 10.16377/j.cnki.issn1007-7731.2024.22.009
基金项目 辽宁省教育厅高等学校基本科研项目(JYTZD2023038)。
作者简介 化文原(1997—),男,河南周口人,硕士研究生,从事水产养殖生物繁育研究。
通信作者 陈岩(1976—),男,吉林人,博士,讲师,从事鱼类生物学研究。
收稿日期 2024-04-15
Effects of salinity acclimation on Na+,K+-ATPase activity and AQP3"gene expression in gill of Sebastes schlegelii
HUA Wenyuan""" YOU Yuzhuo""" ZHANG Yaming""" SUN Rongzhen""" DING Ye""" ZHANG Yunuo WANG Wei""" CHEN Yan
(Key Laboratory of Applied Biology and Aquaculture of Northern Fishes in Liaoning Province, Dalian Ocean University, Dalian 116023, China)
Abstract" To investigate the effects of salinity acclimation on NKA (Na+,K+-ATPase) activity and gill AQP3"gene expression of 140 Sebastes schlegelii.The experiment was divided into two parts: acute salinity acclimation and chronic salinity acclimation. They were subjected to salinity stress in experimental groups with acute salinity of 32, 27, 24, 21, 18, 15, 12"and 9. NKA activity in gill, intestine and kidney were measured. In chronic salinity acclimation, it was placed in experimental groups with salinities of 32, 25, 20, 15, 10"and 5 for salinity stress, and the expression of AQP3 in the gill was measured. The results of acute salinity acclimation showed that NKA activity in gill was significantly higher than that in intestine and kidney except control group (Plt;0.05), there was no statistical significance in NKA activity in midintestine and kidney in all salinity groups (Pgt;0.05). The results of chronic salinity acclimation showed that AQP3 expression peaked in 25‰ and 20‰ groups when salinity stress reached 4"h, and decreased with the decrease of salinity. At 96"h, the expression of AQP3 in the 25‰ group gradually recovered, while the expression of AQP3 in the 20‰ group was still at its peak, and then gradually decreased with the decrease of salinity. In conclusion, the Sebastes schlegelii could regulate the osmolality of the body through NKA and AQP3.
Keywords" Sebastes schlegelii; salinity stress; Na+,K+-ATPase; AQP3"gene
许氏平鲉(Sebastes schlegelii)隶属脊索动物门(Chordata)、硬骨鱼纲(Osteichyes)鲉形目(Scorpaeniformes)鲉科(Scorpaenidae)平鲉属(Sebastes),是重要的近海经济鱼类之一。该鱼喜栖息在岩礁地带的淤泥质底层,无长距离洄游习性;小型个体多分布于沿海,大型个体则常栖息在海水颜色较暗、流速较急等地。目前对于许氏平鲉的研究主要在基础生物学[1-3],消化及组织化学[4],环境胁迫[5-6]和营养需求[7-8]等方面。
杨宇晴等[9]研究表明,鳃中三磷酸腺苷(Adenosine triphosphate,ATP)酶、离子浓度与血浆渗透压是评价鱼体渗透压调节的重要指标,在维持机体渗透调节平衡与内环境稳定上起主要作用。钠钾ATP酶(Na+, K+-ATPase,NKA)是进行渗透调节重要的蛋白酶之一,在渗透压调节过程中NKA通过泵出Na+吸收K+,形成细胞内外电位势,启动二级膜蛋白运输及离子通道,以维持体内稳定的渗透压。陈利琼等[10]综述了水通道蛋白3(Aquaporins 3,AQP3)的研究进展,表明水通道蛋白AQPs是一类特异性转运水的蛋白家族,能明显增加细胞膜对于水的通透性,参与水的分泌、吸收以及细胞内外平衡调节等过程。AQP3是水通道蛋白家族成员之一,对水和甘油等小分子物质具有通透性[11]。Sato等[12]研究表明,暴露在亚硝酸盐中的平鲷(Rhabdosargus sarba)AQP3的表达在鳃中无变化,但在肾中表达量明显下降,NKA活性有一定增加,另外HSP70/90活性增加。
本试验选取许氏平鲉作为研究对象,研究其在不同盐度变化下的适应性、相应渗透压调节的关键酶的活性变化以及相关基因的表达调控,为海水鱼淡化养殖的盐度驯化提供参考。
1 材料与方法
1.1 试验动物
许氏平鲉采自大连市旅顺口区附近海域,打捞后经过打氧充气直接从码头运回大连海洋大学辽宁省北方鱼类应用生物学及增养殖重点实验室进行暂养,实验室养殖水体环境温度为(24±0.5)℃,溶氧gt;5"mg/L,pH 7.9~8.3,光照300~1 000 lx,氨氮lt;0.1"mg/L,亚硝酸盐lt;0.01"mg/L。在实验室条件下暂养7"d,暂养期间每天上午8:00投喂一次,饲料投喂量为鱼体体重的2%~3%,每日换50%水,用吸管吸出未消化的残饵及粪便,保证养殖水体清洁。试验用水经消毒、过滤、沉淀并充分曝气后使用。低盐度海水由充分曝气后的自来水(盐度为0)和沙滤海水(盐度为32)调配而成。换水前1"d将水调整至所需的盐度并充分曝气备用。在试验期间保证饲养环境下的水温以及光照符合许氏平鲉的正常生长,对其生命力不造成影响。经暂养后选取140尾生长状态良好健康的许氏平鲉进行试验,鱼体质量(94.32±6.41)g,体长(19.13±1.32)cm。
1.2 试验设计
试验开始前进行急性盐度驯化条件下许氏平鮋的半致死浓度的测定[13]。基于半致死浓度,本试验共分为两部分进行。一部分为急性盐度驯化试验,另一部分为慢性盐度驯化试验,两部分试验在各自独立的环境下进行,互不干扰。在急性盐度驯化试验中,取80尾暂养的许氏平鲉,将其随机分成8组,每组10尾鱼,饲养在盐度不同的水槽中,其中1组为海水对照组(盐度为32),试验盐度设8个梯度,分别为32、27、24、21、18、15、12和9,并取样。在慢性盐度驯化试验中,取60尾暂养的许氏平鲉,将其随机分成6组,每组10尾鱼,分别饲养在6个水槽中,其中1组为海水对照组(盐度为32);慢性盐度驯化梯度为32、25、20、15、10和5,慢性盐度驯化每天每个试验组降低1‰到试验设置的盐度,降低至所需梯度后取样并进行相关指标的测定。
驯化结束后,每个平行选取3尾,分别于4、12、24、48和96"h取样。急性盐度驯化取样时,使用丁香酚麻醉,解剖工作在0"℃环境下完成;快速取其鳃、肠及肾组织,用生理盐水洗涤,放入冻存管中,在液氮中进行速冻,然后放入-80"℃冰箱保存。慢性盐度驯化只取其鳃组织,使用PBS缓冲液洗涤,置于核糖核酸(RNA)组织保存液中,放入-80"℃冰箱保存。以供日后提取总RNA使用。
1.3 测定指标和方法
1.3.1 NKA活性测定 取样后的组织经过生理盐水洗涤后,除去血液,使用滤纸拭干,称重,放入玻璃匀浆器内,按重量(g)∶体积(mL)为1∶9的比例,加入9倍体积的生理盐水,在冰浴条件下进行匀浆。将制成的10%匀浆液1 000 r/min离心5"min后,取上清液,一部分用于蛋白浓度测定,一部分用于酶活性检测。蛋白浓度检测试剂盒和NKA活性测定试剂盒均由由南京建成生物工程研究所提供。NKA活性的定义为每小时每毫克组织蛋白的组织中ATP酶分解1 μmol无机磷的量为一个ATP酶活力单位。涉及的计算公式如式(1)~(2)。
待测样本蛋白浓度=[(测定OD-对照OD)÷(标准OD-空白OD)]×标准品浓度×稀释倍数"""""" (1)
组织酶活力=[(测定OD-对照OD)÷(标准OD-空白OD)]×标准品浓度×6×7.8÷待测样本蛋白浓度""" (2)
1.3.2 RNA提取和荧光定量PCR 组织总RNA用天根生化科技有限公司提供的RNA提取试剂盒(DP431)提取,用凝胶电泳检测RNA的完整性,用NanoDrop 2000测定其浓度和质量。完整性较好的RNA用天根生化科技有限公司提供的RNA反转录试剂盒(KR116-02)进行cDNA合成,合成产物稀释后放入–80"℃冰箱保存备用。
根据Genbank中鱼类AQP3的基因序列,利用DNAMAN软件进行多序列比较,用Primer 5.0软件设计许氏平鲉PCR引物,进行PCR扩增,然后进行胶回收,测序,分析得到许氏平鲉AQP3的基因序列,设计其荧光定量PCR引物。引物由上海英俊公司合成,选取β-actin作为内参,引物具体序列如表1所示。
先进行常规PCR反应,以确保引物可以扩增出目的条带,然后再进行荧光定量PCR反应。常规PCR反应条件:95"℃预变性4"min;35个循环:95"℃变性15~30"s,55~65"℃退火15~30"s,72"℃延伸30"s;循环结束后72"℃延伸5~10"min。荧光定量PCR条件:95"℃预变性2~5"min;40个循环:95"℃变性15~30"s,60"℃退火15~30"s,72"℃延伸30"s。
1.4 数据处理
所有数据均以3个平行组数据的平均值±标准差(Means±SD)表示,采用SPSS 19.0软件进行单因素方差分析(One-way ANOVA),用Duncan多重比较进行组间差异分析。
2 结果与分析
2.1 半致死浓度
在本实验室之前的研究基础上可知[13],许氏平鲉在4~30的盐度内生存良好,当盐度降至3(包括3)以下时开始出现死亡,在盐度为0的条件下,6"h内试验鱼全部死亡。当盐度为3时,96"h内不同时间的半致死盐度见表2。表明本试验设置的盐度对其生长较安全。
2.2 鳃、肠及肾中NKA活性
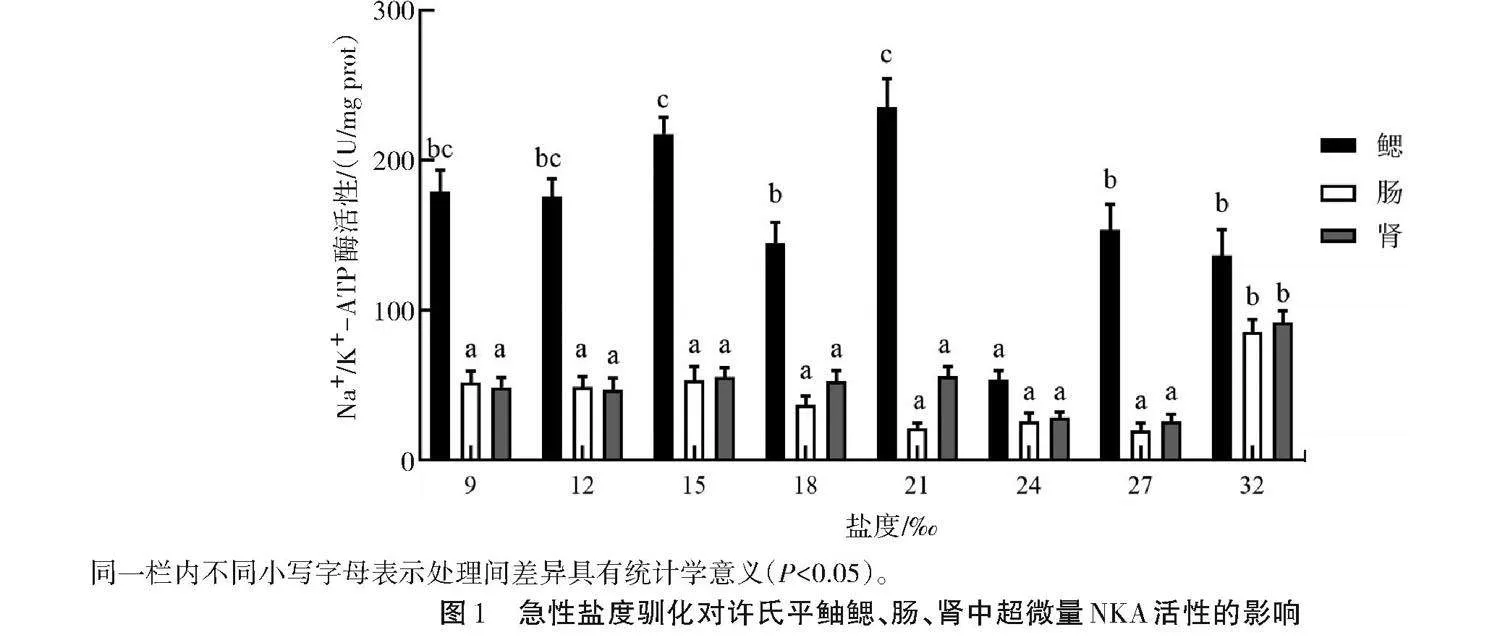
如图1所示,各处理盐度组肠和肾中NKA的活性差异无统计学意义(Pgt;0.05),但明显低于对照组(盐度32)(Plt;0.05);肠和肾中的NKA活性不高,均低于鳃中NKA活性。鳃中NKA活性总体趋势为随着盐度的降低先略微升高再降低,然后又升高后趋于稳定,在盐度为21时出现峰值。表明急性盐度驯化中,相比较于肠和肾,鳃中NKA活性变化较大。鳃是盐度驯化发挥作用的主要器官之一,随着盐度的降低,鳃中NKA活性不断发生变化,盐度21是鳃能主动适应且自身不受损伤的盐度。
同一栏内不同小写字母表示处理间差异具有统计学意义(Plt;0.05)。
2.3 总RNA质量
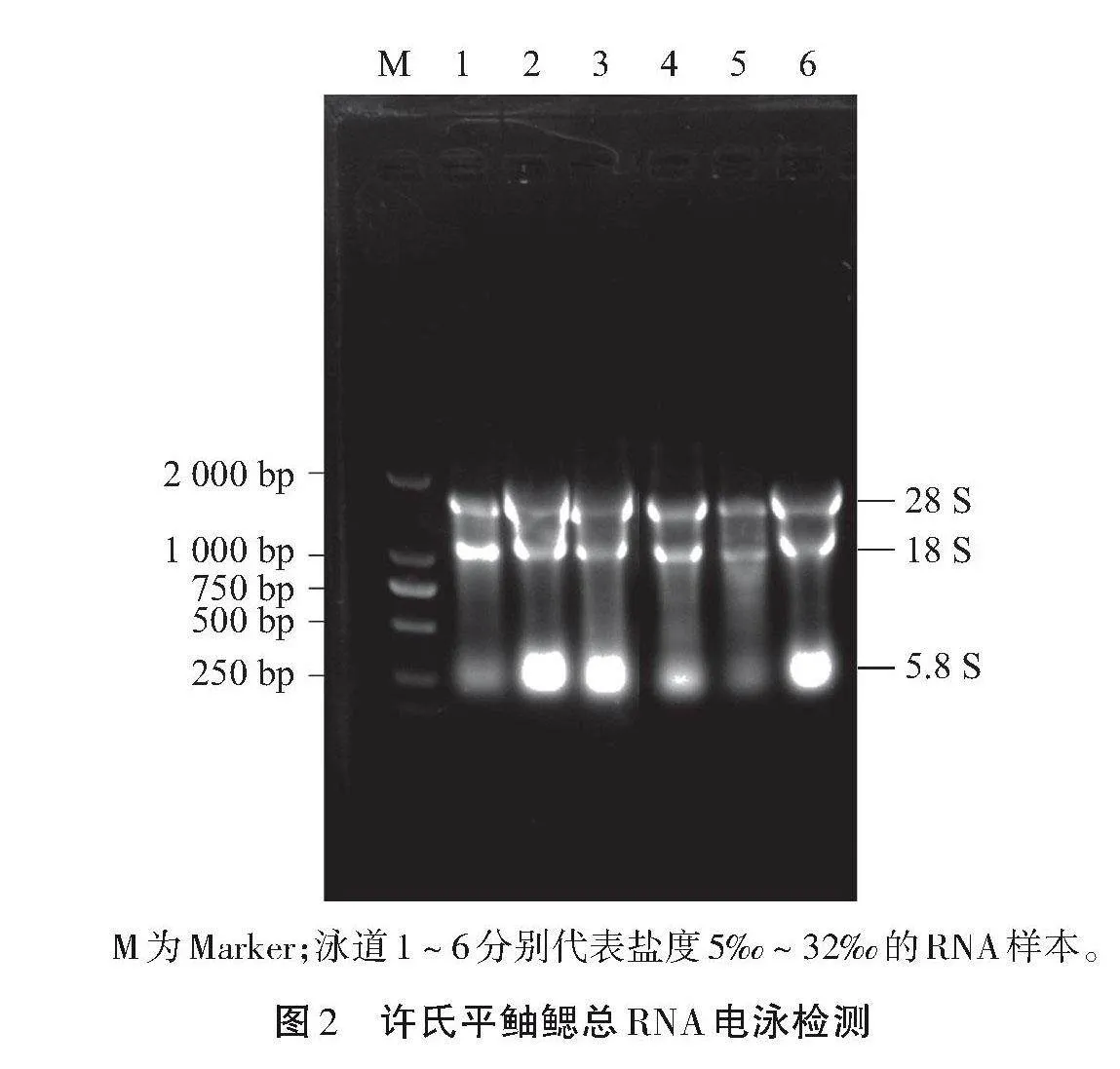
提取的许氏平鲉鳃组织中的总RNA用琼脂糖凝胶电泳对其大小和完整性进行检测,结果如图2所示,电泳结果可见28S、18S和5.8S三条清晰的电泳带,用紫外分光光度计测其纯度,其A260/A280在1.9~2.1,说明其总RNA纯度较高,可以直接作为反转录的模板。
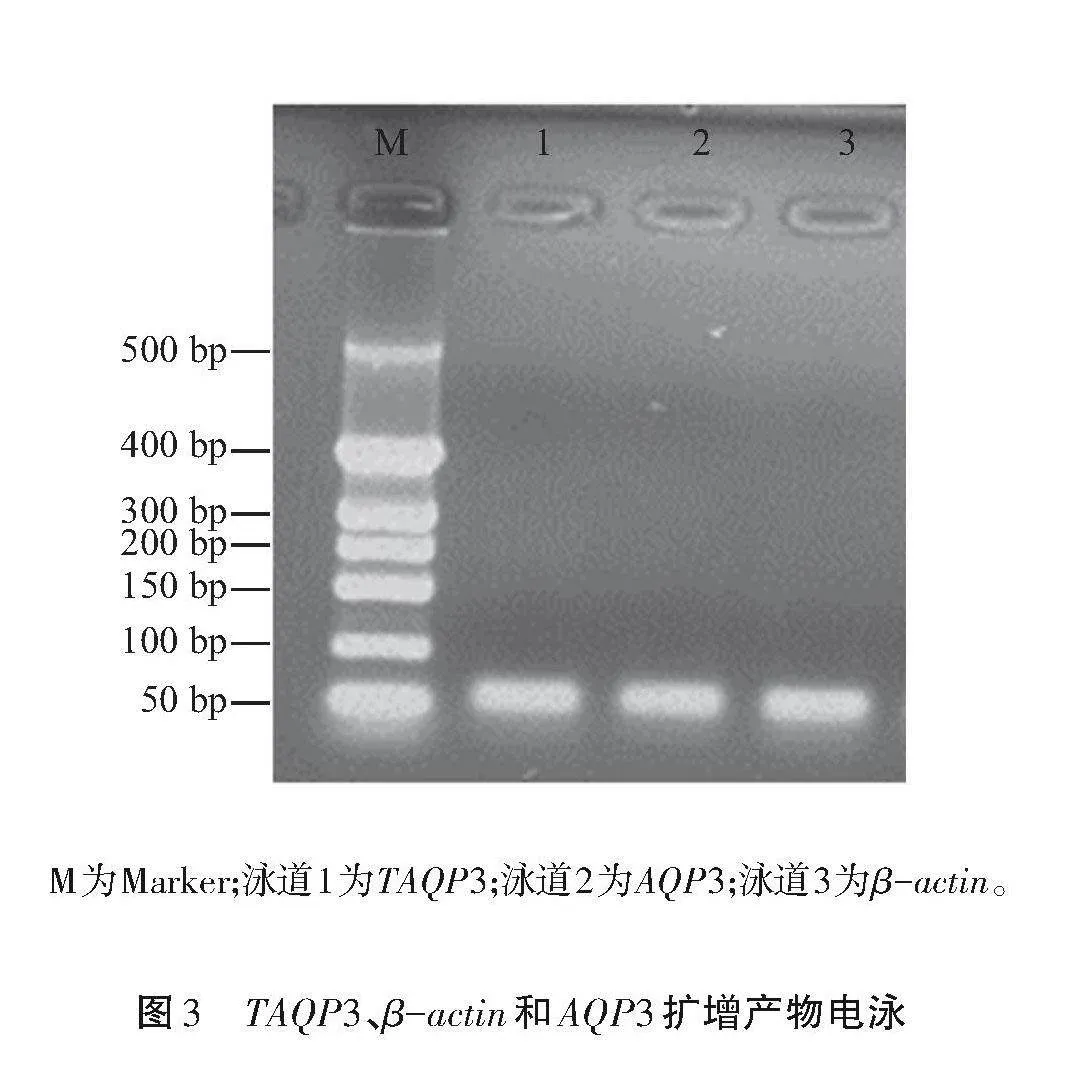
如图3所示,3个引物的电泳条带单一,清晰,无引物二聚体,说明TAQP3、β-actin和AQP3引物特异性良好,可用于后续荧光定量PCR。
M为Marker;泳道1~6分别代表盐度5~32的RNA样本。
M为Marker;泳道1为TAQP3;泳道2为AQP3;泳道3为β-actin。
2.4 AQP3表达量
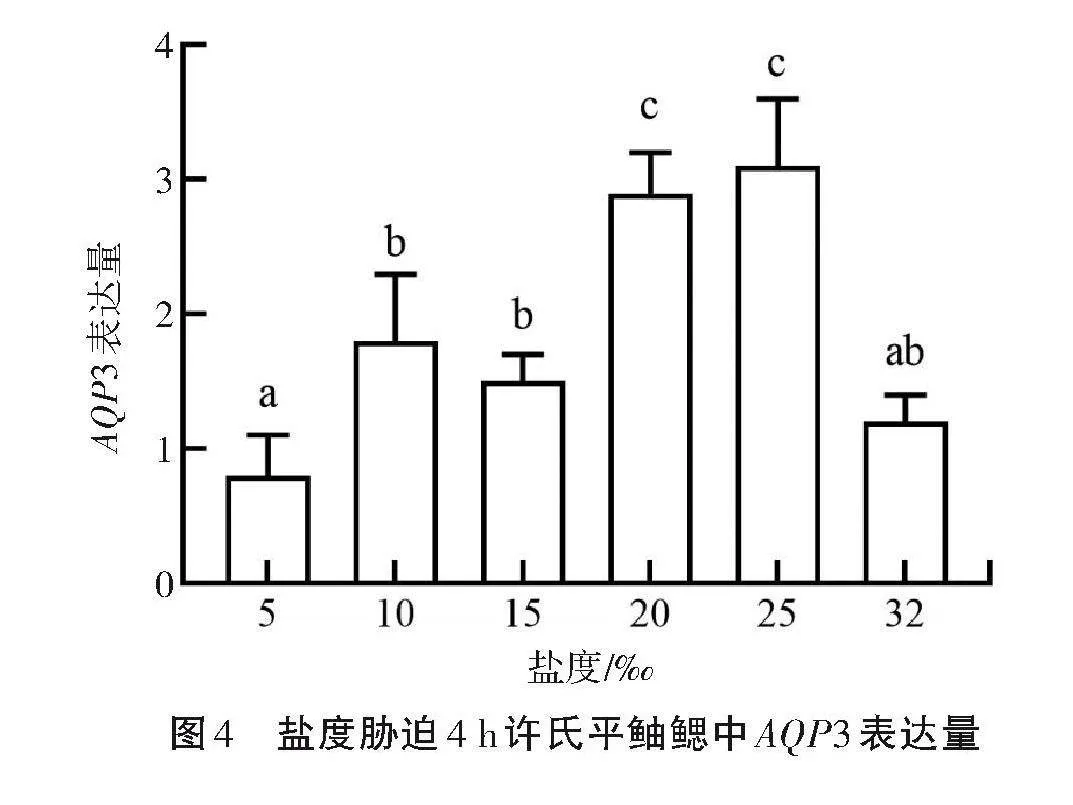
2.4.1 盐度胁迫4"h 如图4所示,在盐度下降的过程中,盐度胁迫达到4"h时,AQP3的表达量在25和20盐度时较高,分别是2.612和2.582,之后随着盐度的下降,表达量也随之下降,最后恢复至对照组水平。表明在短时间内当盐度在一定范围内降低时,其AQP3表达量升高,有利于促进水分排出,维持体内渗透压平衡;在盐度较低的环境中,鳃上皮对水的通透性高,大量水分进入鱼体内,鳃上皮细胞AQP3可将由细胞顶端进入的水从基底侧排出,有利于自身渗透压的调节。因此,增加AQP3的表达量能促进水分的排出,可防止上皮细胞膨胀破裂,维持体内渗透平衡。
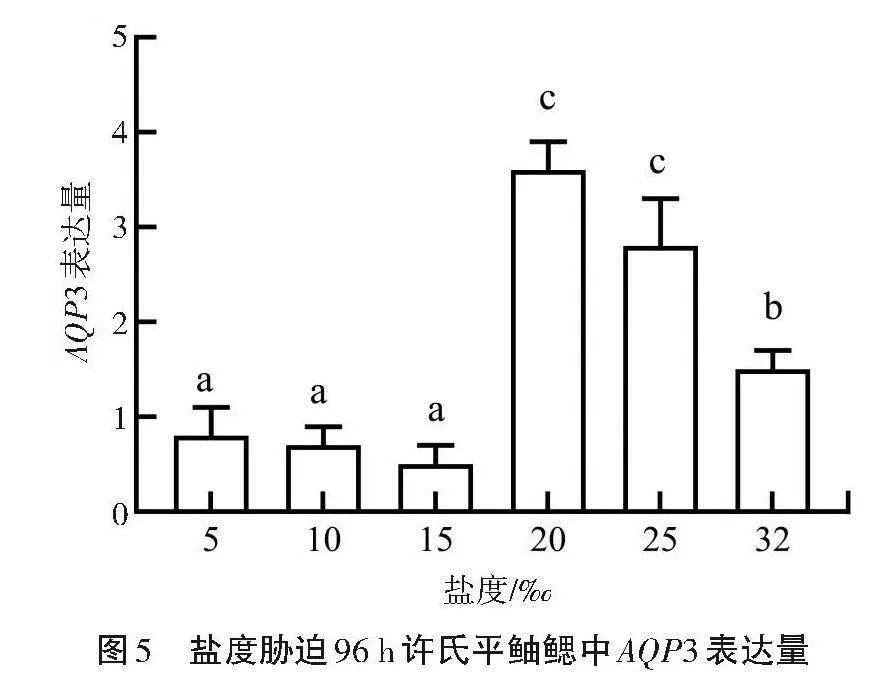
2.4.2 盐度胁迫96"h 如图5所示,当盐度胁迫时间达到96"h时,与4"h盐度胁迫相比,25盐度组的AQP3基因表达量有所下降,而20盐度组的基因表达量升高至3.276,仍为峰值。随着盐度的下降,基因表达量骤减至对照组以下水平,然后趋于稳定。表明鳃作为与水环境直接接触的渗透调节器官,当水环境盐度发生变化时,最先响应盐度胁迫进行渗透调节,以维持鱼体渗透压稳定。盐度在一定范围内变化时,许氏平鲉可经过自身调节维持渗透压平衡。当水环境盐度剧烈变化时,渗透压调节失衡,鱼体开始出现严重损伤。
3 结论与讨论
3.1 急性盐度驯化对不同组织NKA活性的影响
鱼类可从环境中摄取或从自身排出多余的离子来适应环境中盐度的变化,从而维持整个机体内环境稳定,NKA是发挥离子调节作用的主要活性酶之一[14]。近几年有较多学者研究鱼类急性盐度驯化下NKA活性的变化,如褐牙鲆(Paralichthys olivaceus)[15]、军曹鱼(Rachycentron canadum)[16]和条石鲷(Oplegnathus fasciatus)等,以上研究表明,外界环境盐度的变化会对NKA活性产生明显影响。本试验发现鳃中NKA的活性高于肠和肾,这表明NKA主要分布在鳃上,此结果与Evans等[17]研究结果一致。Cutler等[18]和Kim等[19]研究指出,NKA在肠和肾中的活性不高,可能是因为其有关基因表达量在这两种组织中不高,导致其调节功能有限。
Shui等[20]和Jensen等[21]研究表明,当鱼体的环境盐度剧烈变化后,鱼鳃中的NKA的活性随着盐度的变化呈现“U”形的变化趋势,即在对照组和低盐度组的NKA活性高于中间梯度组。同样的趋势在褐牙鲆[15]的实验中也有所体现,可能是鱼体内存在一个等渗点,使鱼类的鳃中NKA活性有一个最低值,鱼体不需要过多的NKA来进行自身的离子调节[22-23]。蒲春霞[24]研究表明,NKA也可进行水的调节,因此在低盐度下NKA的活性上升可能是参与组织排水的调节过程[25]。本试验中,许氏平鲉鳃中低盐度组NKA活性高于对照组的原因可能是因为过低的盐度刺激NKA使其活性增加,进而调节渗透压,使鱼体的渗透压保持在正常水平。成智丽等[13]研究了盐度驯化下许氏平鲉血清生化指标及渗透压的变化,发现盐度在9~32的梯度内,血清中的渗透压无明显差异,可能是NKA的调节机制,使许氏平鲉体内渗透压在处于盐度驯化的时期依然保持稳定水平。不同鱼种对盐度变化的离子调节机制不尽相同,其离子调节机制比较复杂[26],关于鳃与肠和肾等器官进行联合离子调节有待进一步研究。
3.2 慢性盐度驯化对鳃中AQP3基因表达量的影响
盐度会影响鳃、肾脏和消化道(主要渗透调节器官)中水通道蛋白的表达水平。目前关于硬骨鱼AQP3基因的研究较多,其中欧洲鳗鲡(Anguilla anguilla)[18]、莫桑比克罗非鱼(Oreochromis mossambicus)[11]和加拿大底鳉鱼(fundulus heteroclitus)[27]等已经有AQP3 cDNA序列被成功克隆,并研究其结构和功能。甘远迪等[28]使用实时荧光定量PCR技术检测不同盐度胁迫下萨罗罗非鱼(Sarotherodon melanotheron)各组织中AQP3"mRNA的表达量,结果显示AQP3在各个组织中均有一定的表达,其中皮肤、鳃和肌肉组织的表达量明显高于其他组织。相似的结果在Tse等[29]研究中也有体现。在其他广盐性鱼类中,AQP3也被证实大量存在于氯细胞中[30]。AQP3现已在许多不同的硬骨鱼物种中被鉴定出来,基因组数据库中还提供了更多鱼类该基因的DNA序列信息。在硬骨鱼鳃中,AQP3在氯细胞中表达,在一些物种中,还存在于其他上皮细胞中,具有防止细胞脱水等功能[31]。本试验通过对许氏平鲉进行盐度胁迫,发现鳃组织中AQP3基因的表达量随着盐度的降低出现变化,当盐度下降时,该基因的表达量上升,这一结果与甘远迪等[28]和Giffard-Mena等[32]研究结果基本一致。原因可能是当鳃组织直接接触到低渗环境的海水时,鱼类会面临渗透梯度较大而产生的高通量水分子流的风险,通过增加AQP3的表达量可以促进水分的排出,防止细胞膨胀破裂,以维持体内渗透压的平衡[33-34]。
通过对比不同盐度胁迫时间AQP3表达量的差异,发现与胁迫4"h相比,96"h时盐度为25的该基因表达量有所恢复。表明在此盐度水平下,许氏平鲉在进行了短暂的离子调节之后体内渗透压逐渐恢复了正常水平。张金生等[25]在大菱鲆(Scophthalmus maximus)水通道蛋白AQP1和AQP3以及离子通道蛋白对低盐胁迫的响应研究中发现,AQP3表达量随时间呈现先升后降的趋势。本研究中当盐度降低到20,胁迫时间从4"h到96"h时,AQP3表达量增加,可能是96"h不足以使体内渗透压调节至正常水平,故在96"h后仍在继续进行渗透调节。张金生等[25]研究发现,更低的盐度需要更长的时间,更多的基因表达量来进行机体渗透调节。An等[35]在有关黑鲷(Acanthopagrus schlegeli)的AQP1研究中指出,低渗环境能促进其鳃和肾的水通道蛋白调节,而肠的水通道蛋白调节不明显。本研究发现,在盐度低于20的胁迫下,AQP3基因表达量均不高,可能是因为盐度过低,导致了一定程度的盐度调节失衡,渗透压调节机制受到抑制;但鳃上NKA的活性一直明显高于对照组,表明机体的渗透压调节仍在继续,但主要排水的部位可能转移到肠或肾等器官。
综上,本试验研究了盐度驯化对许氏平鲉NKA活性及鳃中AQP3基因表达量的影响,发现许氏平鲉主要通过鳃来进行盐度驯化下的渗透压调节,鳃中该基因表达量呈现先增加后降低最后趋于平缓趋势,不同的盐度驯化水平决定整个进程的长短;许氏平鲉可通过NKA活性和AQP表达量调节机体的渗透压平衡。
参考文献
[1] 张波,孙耀,郭学武,等. 黑鲪的最大摄食率与温度和体重的关系[J]. 海洋水产研究,1999,20(2):82-85.
[2] 孙耀,张波,唐启升. 摄食水平和饵料种类对黑鲪能量收支的影响[J]. 海洋水产研究,2001,22(2):32-37.
[3] 井爱国,张秀梅,李文涛. 花鲈、许氏平鲉游泳能力的初步实验研究[J]. 中国海洋大学学报(自然科学版),2005,35(6):95-98.
[4] 冯晓燕,郑家声,王梅林. 许氏平鲉消化道的组织化学研究[J]. 青岛海洋大学学报(自然科学版),2003,33(3):399-404.
[5] 洪磊,张秀梅. 环境胁迫对许氏平鮋和花鲈血糖、血沉降的影响[J]. 中国水产科学,2005,(4):414-418.
[6] 王晓杰,张秀梅,李文涛. 盐度胁迫对许氏平鲉血液免疫酶活力的影响[J]. 海洋水产研究,2005,26(6):17-21.
[7] 冯东岳,刘云,唐学玺. 许氏平鲉人工配合饲料投喂试验[J]. 齐鲁渔业,2003,20(11):4-5.
[8] 严全根,解绶启,雷武,等. 许氏平鲉幼鱼的赖氨酸需求量[J]. 水生生物学报,2006,30(4):459-465.
[9] 杨宇晴,余德光,谢骏,等. 急性盐度胁迫对斜带石斑鱼Na+/K+-ATP酶及血清应激指标的影响[J]. 热带海洋学报,2010,29(4):160-164.
[10] 陈利琼,朱雪琼. 水通道蛋白3的研究进展[J]. 医学研究杂志,2012,41(6):8-10.
[11] WATANABE S,KANEKO T,AIDA K. Aquaporin-3 expressed in the basolateral membrane of gill chloride cells in Mozambique Tilapia Oreochromis mossambicus adapted to freshwater and seawater[J]. Journal of experimental biology,2005,208(14):2673-2682.
[12] SATO S,FUJITA N,TSURUO T. Modulation of Akt kinase activity by binding to Hsp90[J]. Proceedings of the national academy of sciences of the United States of America,2000,97(20):10832-10837.
[13] 成智丽,孙鹏飞,罗珺,等. 盐度驯化下许氏平鲉血清生化指标及渗透压的变化[J]. 水产科学,2021,40(3):310-317.
[14] 罗鸣钟,关瑞章,靳恒. 盐度对花鳗鲡(Anguilla marmorata)和太平洋双色鳗鲡(A. bicolor pacifica)幼鳗鳃丝及肾脏Na+/K+-ATP酶活力的影响[J]. 海洋与湖沼,2013,44(3):807-813.
[15] 潘鲁青,唐贤明,刘泓宇,等. 盐度对褐牙鲆(Paralichthys olivaceus)幼鱼血浆渗透压和鳃丝Na+-K+-ATPase活力的影响[J]. 海洋与湖沼,2006,37(1):1-6.
[16] 徐力文,刘广锋,王瑞旋,等. 急性盐度胁迫对军曹鱼稚鱼渗透压调节的影响[J]. 应用生态学报,2007,18(7):1596-1600.
[17] EVANS D H,PIERMARINI P M,CHOE K P. The multifunctional fish gill:dominant site of gas exchange,osmoregulation,acid-base regulation,and excretion of nitrogenous waste[J]. Physiological reviews,2005,85(1):97-177.
[18] CUTLER C P,CRAMB G. Branchial expression of an aquaporin 3 (AQP3) homologue is downregulated in the European eelAnguilla anguilla following seawater acclimation[J]. Journal of experimental biology,2002,205(17):2643-2651.
[19] KIM Y K,WATANABE S,KANEKO T,et al. Expression of aquaporins 3,8"and 10 in the intestines of freshwater and seawater-acclimated Japanese eels Anguilla japonica[J]. Fisheries science,2010,76(4):695-702.
[20] SHUI C,SHI Y H,HUA X M,et al. Serum osmolality and ions,and gill Na+/K+-ATPase of spottedtail goby Synechogobius ommaturus (R.) in response to acute salinity changes[J]. Aquaculture and fisheries,2018,3(2):79-83.
[21] JENSEN M K,MADSEN S S,KRISTIANSEN K. Osmoregulation and salinity effects on the expression and activity of Na+,K+-ATPase in the gills of European sea bass,Dicentrarchus labrax (L.)[J]. The journal of experimental zoology,1998,282(3):290-300.
[22] HWANG P P,SUN C M,WU S M. Changes of plasma osmolality,chloride concentration and gill Na-K-ATPase activity in tilapia Oreochromis mossambicus during seawater acclimation[J]. Marine biology,1989,100(3):295-299.
[23] MADSEN S S,LARSEN B K,JENSEN F B. Effects of freshwater to seawater transfer on osmoregulation,acid-base balance and respiration in river migrating whitefish (Coregonus lavaretus)[J]. Journal of comparative physiology B,1996,166(2):101-109.
[24] 蒲春霞. 水通道蛋白研究进展[J]. 成都大学学报(自然科学版),2010,29(2):104-106.
[25] 张金生,刘志峰,马爱军,等. 大菱鲆水通道蛋白(AQP1、AQP3)以及离子通道蛋白(CFTR、NHE1)对低盐胁迫的响应[J]. 渔业科学进展,2020,41(4):41-49.
[26] 冉凤霞,金文杰,黄屾,等. 盐度变化对鱼类影响的研究进展[J]. 西北农林科技大学学报(自然科学版),2020,48(8):10-18.
[27] JUNG D,SATO J D,SHAW J R,et al. Expression of aquaporin 3 in gills of the Atlantic killifish (Fundulus heteroclitus):effects of seawater acclimation[J]. Comparative biochemistry and physiology part A:molecular amp; integrative physiology,2012,161(3):320-326.
[28] 甘远迪,赵金良,JEERAWAT T,等. 萨罗罗非鱼AQP3 cDNA序列克隆及盐度胁迫下组织表达特征[J]. 动物学杂志,2014,49(4):560-569.
[29] TSE W K F,AU D W T,WONG C K C. Characterization of ion channel and transporter mRNA expressions in isolated gill chloride and pavement cells of seawater acclimating eels[J]. Biochemical and biophysical research communications,2006,346(4):1181-1190.
[30] LIGNOT J H,CUTLER C P,HAZON N,et al. Immunolocalisation of aquaporin 3 in the gill and the gastrointestinal tract of the European eel Anguilla anguilla(L.)[J]. Journal of experimental biology,2002,205(17):2653-2663.
[31] CUTLER C P,MARTINEZ A S,CRAMB G. The role of aquaporin 3 in teleost fish[J]. Comparative biochemistry and physiology part A:molecular amp; integrative physiology,2007,148(1):82-91.
[32] GIFFARD-MENA I,BOULO V,AUJOULAT F,et al. Aquaporin molecular characterization in the sea-bass (Dicentrarchus labrax):the effect of salinity on AQP1"and AQP3 expression[J]. Comparative biochemistry and physiology part A:molecular amp; integrative physiology,2007,148(2):430-444.
[33] WANG M Y,YANG J,XU P,et al. Molecular cloning and expression analysis of aquaporin-1 from the Coilia nasus under high-salinity conditions[J]. Journal of fishery sciences of China,2017,24(3):449.
[34] CUTLER C P,CRAMB G. Water transport and aquaporin expression in fish[M]//Molecular biology and physiology of water and solute transport. boston,MA:springer US,2000.
[35] AN K W,KIM N N,CHOI C Y. Cloning and expression of aquaporin 1"and arginine vasotocin receptor mRNA from the black porgy,Acanthopagrus schlegeli:effect of freshwater acclimation[J]. Fish physiology and biochemistry,2008,34(2):185-194.
(责任编辑:胡立萍)

