人参酚酸类自毒物质降解菌的筛选鉴定及生防研究



摘要:随着人参种植年限的增加,土壤中自毒物质的积累会导致连作障碍的发生,极大地影响人参种植业的健康发展。生物降解土壤中自毒物质是缓解连作障碍的有效途径。以酚酸类自毒物质为筛选指标,从人参根际土壤中分离、筛选酚酸类自毒物质降解细菌,结合16S rRNA基因测序及生理生化试验对降解菌株进行分类鉴定,采用紫外分光光度法测定其降解能力,并进一步采用单因素试验对其培养条件进行优化,利用降解菌对酚酸胁迫下的人参种子进行生防研究。结果表明,从人参根际土壤中分离出10株自毒物质降解菌,以假单胞菌属(Pseudomonas)为主。初步降解试验显示菌株S1对水杨酸的降解率最高,达65.32%,经鉴定该菌株为伯克霍尔德属(Burkholderia)细菌。单因素试验结果表明,以硝酸钙作为氮源,培养温度30 ℃,500 mg·L−1自毒物质下,菌株S1的降解率达88.58%,较优化前明显提升。生防试验结果表明,菌株S1可缓解水杨酸对人参种子生长的抑制作用,促生效率达12.56%。综上所述,从土壤中分离出可降解水杨酸的伯克霍尔德属菌株S1具有较好的生防效果,对于解决连作障碍问题具有潜在生防应用价值。
关键词:酚酸降解菌;自毒物质;人参;连作障碍;条件优化
doi:10.13304/j.nykjdb.2023.0651
中图分类号:S47 文献标志码:A 文章编号:1008‑0864(2024)07‑0147‑09
五加科多年生植物人参(Panax ginseng C. A.Meyer)属名贵中药材,具有极高的药用和经济价值[1‑2]。人参在种植过程中存在严重的连作障碍现象,采收后10~20年内不能再次栽种,否则会出现烧须、烂根、病害多发、产量降低等,严重制约人参产业的可持续发展。导致连作障碍的原因主要是土壤理化性质的改变、土壤微生物群落结构失衡和自毒物质的积累,其中自毒物质被视为连作障碍的主要诱因[3]。人参在生长过程中,枯枝残叶和根系分泌产生的自毒物质极易在土壤中积累,并产生化感作用,从而抑制种子萌发、破坏根系或其他分生组织,影响植物、土壤和微生物之间的相互作用,导致植物产生连作障碍[4‑5]。李自博[6]从人参根际土壤中共收集鉴定出水杨酸、没食子酸、苯甲酸、3-苯基丙酸和肉桂酸5种酚酸物质,被证明是人参连作障碍中根系分泌的主要化感物质,其中水杨酸含量最高,为0.519 mmol·L−1。He等[7]从西洋参土壤中分离出9种酚酸类化合物,土壤中约含1 200 mg·kg−1酚酸物质。本课题组前期在林下连作种植参根际土壤中检测出苯甲酸、阿魏酸、水杨酸、香草酸、丁香酸、肉桂酸、对羟基苯甲酸、没食子酸共8种酚酸类自毒物质[8]。
目前,解决连作障碍的主要防治手段是化学防治,依靠农药进行土壤消毒。该方法存在化学药剂毒性高、残留超标等问题,严重影响生态环境安全[9]。因此,生物防治成了解决连作障碍的突破点。国内对于药用植物自毒物质降解的研究主要集中在三七上,向维等[10]从三七根际土壤中成功分离出8株自毒物质降解细菌,其中编号SC3 的寡养单胞菌属菌株具有消除连作土壤中皂苷类自毒物质的潜力;王罗涛等[11]发现,蒙氏假单胞菌PM-41 既能有效降解三七皂苷类自毒物质,又能有效拮抗三七锈腐病菌毁灭柱孢菌。在其他作物如花生(Arachis hypogaea L.)[12]、番茄(Solanum lycopersicum L.)[12]等中也发现有降解菌。毛宁等[14]发现了4 株对对羟基苯甲酸有明显降解作用的放线菌,可有效降低草莓的死亡率和发病率。肖蓉等[15]发现,绿针假单胞菌(Pseudomonas chlororaphis)能有效缓解羟基苯甲酸对黄瓜生长的抑制作用。但目前筛选得到的具有降解人参自毒物质功能菌的数量有限,且对于降解水杨酸等在土壤中积累含量较多的酚酸类自毒物质的降解菌研究还不够透彻,其菌种资源有待进一步开发。
本研究根据前期试验结果[8],以土壤中检测到的苯甲酸、阿魏酸、水杨酸、香草酸、丁香酸、肉桂酸、对羟基苯甲酸、没食子酸8种酚酸类自毒物质作为研究目标,以人参连作土壤为材料,筛选具有降解能力的微生物菌株,确定降解菌的系统分类学地位,并优化高效降解菌的培养条件,考察自毒物质对人参种子的抑制作用及其高效降解菌的解毒能力,为绿色菌肥的研发应用提供新的思路。
1 材料与方法
1.1 试验材料
1.1.1 土壤
供试土壤采自吉林省临江市蚂蚁河乡三棚湖村(41°51′02.80\"N,127°6′21.81\"E,海拔833 m),采用五点采样法,所选区域去表层10 cm土后,采集人参根际土并混匀。
1.1.2 供试种子
供试的人参种子购买于辽宁省沈阳市长白山参乡产地,品种为长白山人参。选取颗粒饱满、大小一致、无机械损伤的种粒备用。
1.1.3 主要试剂和仪器
水杨酸、阿魏酸、香草酸、丁香酸、肉桂酸、没食子酸、邻苯二甲酸、对羟基苯甲酸、琼脂粉购自上海麦克林生化科技有限公司。CaCl2、K2HPO4、(NH4)2SO4、NaH2PO4、MgSO4·7H2O购自广东光华科技股份有限公司。生理生化试剂盒及草酸铵结晶紫染液、草酸铵、卢戈氏碘液、沙黄复染液、对二甲基氨基苯甲醛、体积分数为95%酒精、浓盐酸、甲基红、质量浓度为40%的KOH 溶液、体积分数为6%的α‑奈酚酒精溶液、对氨基苯磺酸、α‑萘胺、乙酸购自杭州微生物试剂有限公司。试验所需培养基及其配方如表1所示。
主要仪器包括ZHJH-C1106B 型超净工作台(上海智城分析仪器制造有限公司)、G154DP型全自动立式高压灭菌锅[致微(厦门)仪器有限公司]、SP-1920紫外可见分光光度计(上海光谱仪器有限公司)、RE-2000B 旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 试验方法
1.2.1 降解菌分离筛选及分子鉴定
分别称取3个采样点各10 g土壤样品混合,加入90 mL无菌水,置于恒温摇床(220 r·min−1,28 ℃)振荡过夜。分别在100、500和1 000 mg·L−1 酚酸作为单一碳源的筛选培养基中加入5 mL 土壤悬液,28 ℃、220 r·min−1 摇床培养3 d,连续培养3 个周期共9 d,接种量为2%。富集培养的菌液进行梯度稀释(10−3、10−4、10−5),涂布于筛选培养基(酚酸物质1 000 mg·L−1)固体平板上,在分离筛选过程中设置空白组对照。挑选在以酚酸作为单一碳源的培养基上生长,而在其他培养条件相同却无酚酸的培养基上不生长的菌株,初步确定为具有降解能力的降解菌株。反复划线以得到菌株纯培养物,纯化后的单菌落收集于30%甘油中,置于−20 ℃冰箱保存。
形态学观察:将降解菌株在LB培养基上划线,28 ℃下培养24 h,观察记录菌落形态、颜色及透明度等特征。降解菌株的生理生化反应测定参照《常见细菌系统鉴定手册》[16]和《伯杰细菌鉴定手册》[17]。
基因测序:超净台收集单菌落于1.5 mL离心管中,然后加入100 μL 10% 的Chelex-100 溶液,提取DNA。以基因组DNA 为模板,使用引物27F和1492R扩增16S rRNA基因片段。使用通用引物Eu-27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和Eu-1492R(5’-GGTTACCTTGTTACGACTT-3’)分别扩增细菌16S rRNA基因序列。PCR体系50 μL,包含 DNA模板2 μL、2×Taq Mastr Mix 25 μL、上下游引物各1 μL、ddH2O 21 μL。PCR程序: 95 ℃预变性4 min;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,32个循环;72 ℃充分延伸2 min,于4 ℃保存。PCR产物经琼脂糖凝胶电泳检测后,送至生工生物工程(上海)股份有限公司进行测序。将测序结果在EzBioCloud(https://www.ezbiocloud.net/)进行序列比对。用MEGA 6.0中的neighbor-joining算法(自展数为1 000)构建系统进化树。
1.2.2 降解菌降解能力测定
采用紫外分光光度计测定降解率,设置0~640 mg·L−1 酚酸等梯度含量,以酚酸含量为横坐标、吸光度值为纵坐标绘制标准曲线。种子液在摇床(28 ℃,220 r·min−1)培养3 d后,放入50 mL离心管10 000 r·min−1离心10 min,弃上清收集菌体,用无菌水重悬至OD600=1.0。按重悬液2%的体积接种到筛选培养基(酚酸含量为1 000 mg·L−1)中摇床(28 ℃, 220 r·min−1)培养3 d。将发酵液装入分液漏斗中,用二氯甲烷按照1∶2比例萃取3次,收集有机液相于旋蒸瓶中,在旋转蒸发仪(30 ℃,80 r·min−1)上进行旋蒸浓缩后,将浓缩物转移至样品瓶内,用75%无水乙醇定容于5 mL。采用紫外分光光度仪测定,根据标准曲线得出剩余酚酸物质的量,按公式(1)计算降解率(degradation rate,DR)。
DR =( D - M/D) ×100% (1)
式中,D 为经标准曲线计算得出对照组剩余酚酸物质的质量;M 为经标准曲线计算得出试验组剩余酚酸物质的质量。
1.2.3 单因素试验
选取温度、酚酸含量、氮源3种因素进行单因素试验,其他培养条件不变。温度单因素试验中将温度分别设置为25、30、35、40 ℃;酚酸含量单因素试验中将化感物质初始含量分别设置为100、500、1 000、1 500、2 000 mg·L−1;氮源单因素试验中将氮源分别设置为磷酸二氢钠(NaH2PO4)、硝酸钾(KNO3)、硫酸铵[(NH4)2SO4]、氯化铵(NH4Cl)、硝酸钙[(Ca(NO3)2]。降解率的测定方法同1.2.2。
1.2.4 种子萌发试验
分别选用无菌水(CK)、250 mg·L−1 水杨酸溶液(SA250)、2.5 mg·L−1 水杨酸溶液(SA2.5)、0.025 mg·L−1 水杨酸溶液(SA0.025)、降解菌液(SA250+S1)处理人参种子,处理液用量均为4 mL,共计5种处理。其中降解菌液处理为降解菌和250 mg·L−1 水杨酸(1∶3)的混合液4 mL。混合液中的降解菌为前期筛选得到,经液体摇床发酵(1.2.3优化后的发酵条件)培养3 d后,去除上清液,采用去离子水稀释至OD600=1,即成降解菌液。
培养皿法: 在9 cm 玻璃培养皿的底部铺2层滤纸,将滤纸片用无菌水浸透固定,高压蒸汽灭菌(121 ℃、10 min)。选取颗粒饱满、大小均一的裂口人参种子,用4%的次氯酸钠消毒5 min,再用无菌水反复冲洗数次后移至超净工作台,每个培养皿放入10粒人参种子和4 mL处理液,每组设置2组重复。
种子萌发形态指标测定: 放入种子记作第1天,之后每天观察生长情况。于第7天统计并测量记录各处理种子的生长情况。种子平铺于透明硬塑料膜上,用游标卡尺准确测量胚根长度和胚轴长度,并计算化感作用效应指数(responseindex,RI)[18]。当Tgt;C 时,采用公式(3)计算RI;当T
胚根(胚轴)生长值=7 d后的胚根(胚轴)长-刚种植的胚根长(胚轴)长(2)
RI = 1 - C/T(3)
RI = T/C- 1 (4)
式中,C 为空白组生长值,T 为处理组生长值;当RIgt;0时,表现为促进作用;当RIlt;0时,表现为抑制作用;绝对值的大小表示自毒作用强度。
1.3 数据处理
采用Excel 2018软件进行试验数据的整理;采用SPSS对数据进行方差分析及最小显著差异性检验。
2 结果与分析
2.1 降解菌分离筛选结果
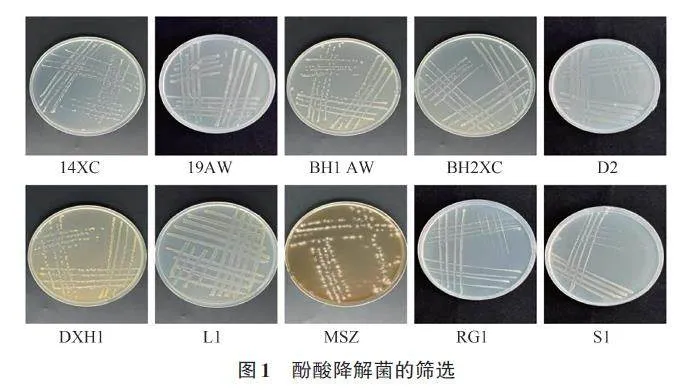
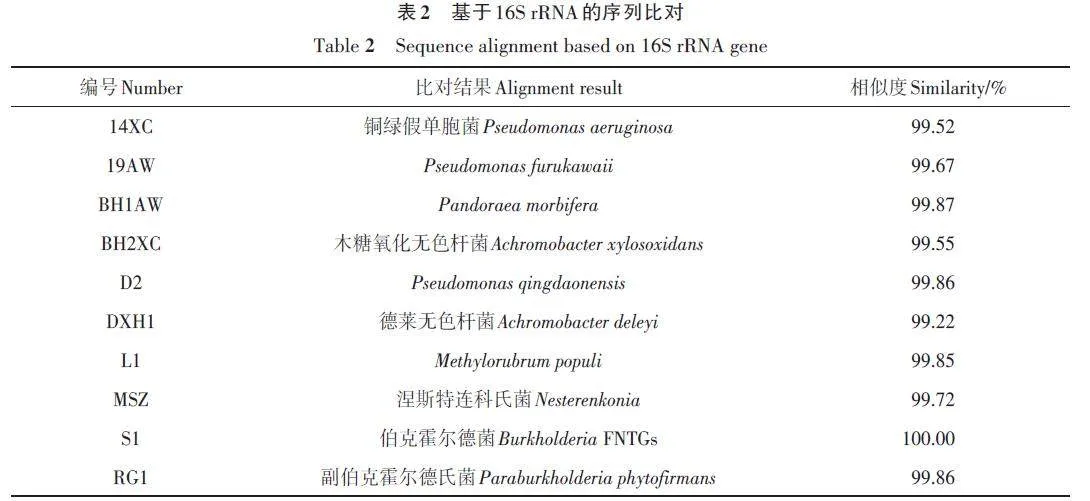
以水杨酸、阿魏酸、香草酸、丁香酸、肉桂酸、没食子酸、邻苯二甲酸、对羟基苯甲酸为单一碳源,从土壤样品中共分离得到10株细菌,包含1株放线菌。各菌株的外观形态如图1所示。MSZ为放线菌,呈白纤毛球状;其余均为细菌,颜色大都为黄白色,表面光滑,粘稠状。14XC、BH2XC在香草酸筛选培养基上生长;19AW、BH1AW在阿魏酸筛选培养基上生长;D2在对羟基苯甲酸筛选培养基上生长;DXH1在丁香酸筛选培养基上生长;L1在邻苯二甲酸筛选培养基上生长;RG1在肉桂酸筛选培养基上生长;S1在水杨酸筛选培养基上生长;放线菌MSZ 在没食子酸筛选培养基上生长。基于16SrRNA序列比对结果如表2所示。S1与伯克霍尔德菌(Burkholderia FNTGs)的相似度达100%。
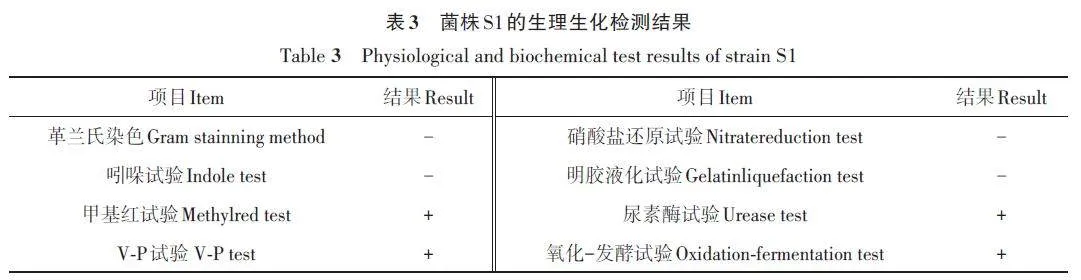
降解能力测定结果(表3)表明,S1为高效降解水杨酸菌株。对S1 进行形态学观察发现,其在筛选培养基上的生长状况良好,具有粘度、外观呈圆形有闪光;革兰氏染色结果为阴性;甲基红试验、V-P 试验、氧化−发酵试验、尿素酶试验反应呈阳性;革兰氏染色、吲哚试验、硝酸盐还原试验、明胶液化试验反应呈阴性。
以降解菌株S1的DNA为模板,利用细菌16SrRNA 基因通用引物进行PCR 扩增,其产物为1 120 bp 的基因片段。将其通过EzBioCloud 和NCBI进行比对,结果(图2)显示,降解菌株S1与伯克霍尔德菌(Burkholderia FNTGs)处于同一分支,最大相似度为99%,结合菌株形态学特征和生理生化检测,将菌株S1鉴定为伯克霍尔德菌属。
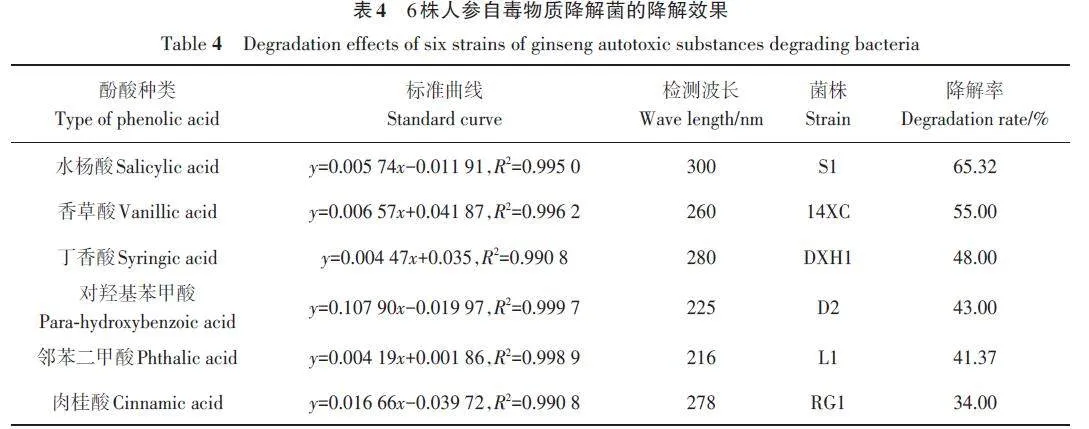
2.2 降解能力测定结果
经摇床发酵,通过标准曲线分别计算菌株S1对酚酸类物质的降解能力,结果(表4)表明,有6株表现出较好的降解能力,其中菌株S1对水杨酸的降解效果最强,平均降解率达65.32%。由于人参连作土壤中水杨酸的含量较高[3],而S1对水杨酸的降解能力最优,因此选取菌株S1进行后续应用研究。
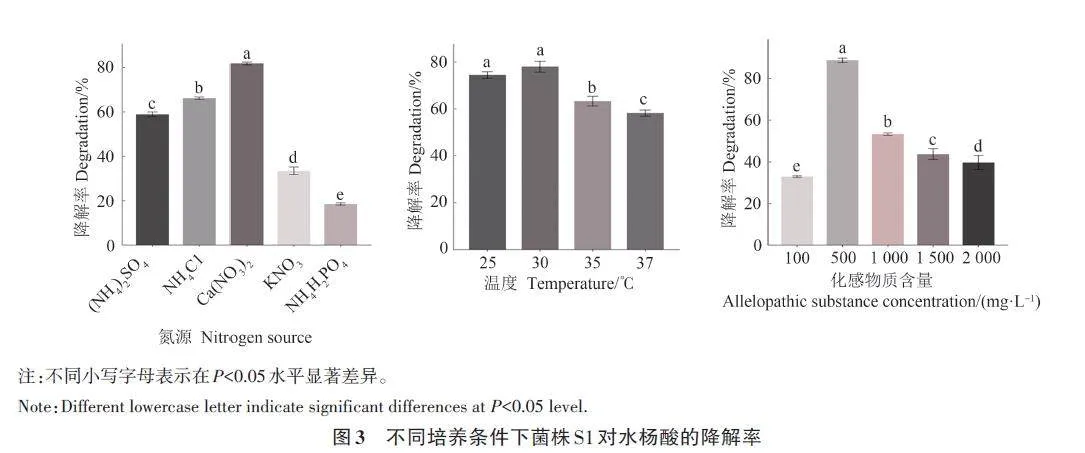
2.3 菌株S1 培养条件的优化
考察在以水杨酸为单一碳源的筛选培养基中,不同氮源。培养温度和自毒物质含量对菌株S1降解水杨酸的影响。结果表明,不同因素对降解率影响存在显著差异。不同氮源培养条件下,硝酸钙[Ca(NO3)2]的效果最好,菌株S1对水杨酸的降解率达到81.4%(图3),显著高于其他氮源。菌株S1对培养温度具有良好的耐受性,在25~30 ℃之间,对水杨酸的降解率均大于60%,降解效果显著优于其他温度,最高达78.7%(图4);当温度高于30 ℃时,降解效果逐渐降低。在化感物质含量为500 mg·L−1时,菌株S1的降解率达88.58%,显著高于其他处理(图5)。各因素降解率峰值均在设置的培养条件范围内,说明单因素试验条件设置合理。
2.4 菌株S1 对人参种子萌发的影响
由图4和表5可知,对照组种子的胚根长度平均为53.42 mm。0.025和2.500 mg·L−1水杨酸处理对人参种子胚根的抑制作用较弱,而250.000 mg·L−1水杨酸处理的胚根长度显著低于对照组。RI代表自毒物质对种子的化感作用程度。在水杨酸处理下,胚根长度的RI均为负值,表明水杨酸对人参种子胚根的生长具有一定的抑制作用,且在高水平处理下抑制作用最强。经菌株S1处理后,人参种子的胚根长度平均为60.13 mm,较对照组增加6.71 mm,促生效果达12.56%,且RI为正值(0.154),说明菌株S1不仅缓解了水杨酸对胚根生长的抑制作用,同时对人参种子的胚根发育具有一定促生作用。
对照组种子的胚轴长度平均为27.95 mm。水杨酸处理下人参种子的胚轴长度显著小于对照,且水杨酸对人参种子胚轴生长的抑制作用随质量浓度的升高而逐渐增强。菌株S1降解液能在一定程度上缓解水杨酸对人参种子胚轴生长的抑制作用,但其胚轴长度仍显著小于对照,而胚根长度与对照组无差异显著,说明胚根对水杨酸的耐受性较胚轴强;胚轴长度的RI为负值,说明在S1降解液处理中还有一定的水杨酸残留,或是某些代谢产物仍具有自毒性,致使胚轴生长受到抑制。
3 讨论
筛选及应用自毒物质降解菌是有效解决连作障碍的措施之一,对抗重茬病害的防治技术和人参产业的健康发展都具有一定的推动作用。本研究在人参连作土壤中发现了10株可降解不同酚酸物质的降解菌,主要以假单胞菌属为主。研究表明,假单胞菌属对植物根际自毒物质的降解能力较强,具有促生、固氮和生物防治等功能特性[19]。为了减少试验因素的影响,明确降解菌对于特定酚酸的降解效率,本研究选取具有高效降解水杨酸能力的菌株S1 进行生防研究,根据形态、生理生化特征、系统发育树分析,菌株S1鉴定为伯克霍尔德菌属。研究表明,该菌属最早在腐烂的洋葱表面中分离,该属多种菌株都具有生物修复和植物促生功能[20]。许玉[21]和Han等[22]研究发现,该菌属的菌株可诱导植物的生长、细胞壁修复酶、植物防御和抗逆、营养物质摄取与积累等代谢途径。但对于伯克霍尔德菌属降解自毒物质的研究还鲜有报道。
本研究对菌株S1的培养条件进行了优化,在培养温度为30 ℃、氮源为硝酸钙、初始水杨酸含量为500 mg·L−1时降解率达到88.58%,较优化前提高23.26%。田间连作土壤中自毒物质具有积累效应,随着栽培时间的增长根际土中自毒物质的种类和含量均呈现增多趋势[23]。因此,提升菌种的降解能力尤为重要。本研究单因素试验的酚酸含量设置高于土壤,后续还会进一步考察该菌株对酚酸混合物的降解以及与其他微生物的协同作用。
水杨酸即邻羟基苯甲酸,其芳香环上带有活性羧基,是抑制种子萌发、降低根系活力的主要原因[24]。本研究表明,菌株S1能缓解水杨酸对人参种子的生长胁迫,对胚根促生效率达12.56%。推测S1降解水杨酸的代谢过程与李敏等[25]研究的微生物降解苯甲酸类酚酸的过程可能一致,既微生物生理代谢过程中首先将苯酚羟基化形成邻苯二酚,再经过邻位裂解或间位裂解将苯环开环,降解为低碳化合物或者通过三羧酸循环降解为二氧化碳和水。在自然界中,植物根际分泌的酚酸自毒物质会迅速吸附到矿物质和有机质的表面,降低其有效性,使植物不能充分利用土壤中的营养元素,从而限制植物生长[26]。微生物能降解自毒物质,促进土壤中有机碳矿化,进而为植物及土壤微生物的生长提供养分[27]。因此,利用降解菌株S1作为微生物菌剂进行连作障碍防治,对于解决连作障碍问题具有潜在生防应用价值,为缓解连作障碍的生物有机菌剂研制及完善人参土壤管理技术体系提供了理论依据。
参考文献
[1] 张益恺,初赛君,董亚南,等.简述长白山人参在大健康产业中的应用[J].人参研究,2023,35(1):34-37.
[2] 孙仁爽,赵敏婧,隋艳艳,等.人参药材抗氧化活性的研究[J].人参研究,2023,35(3):28-31.
[3] BLOK W J, BOLLEN G J. The role of autotoxins from rootresidues of the previous crop in the replant disease ofAsparagus [J]. Netherlands J. Plant Pathol., 1993, 99(3):29-40.
[4] BENNETT J A, KLIRONOMOS J. Mechanisms of plant-soilfeedback: interactions among biotic and abiotic drivers [J].New Phytol., 2018, 222(1):91-96.
[5] 周亭亭,战宇,李琼,等.人参属药用植物化感物质种类及其作用机制研究进展[J/OL].特产研究,2023:1-6 [2023-07-20].https://doi.org/10.16720/j.cnki.tcyj.2023.072.
ZHOU T T, ZHAN Y, LI Q, et al .. Research progress on thetypes and mechanism of allelochemicals in ginseng medicinalplant [J/OL]. Spec. Res., 2023: 1-6 [2023-07-20]. https://doi.org/10.16720/j.cnki.tcyj.2023.072.
[6] 李自博.人参根系自毒物质在连作障碍中的化感作用及其缓解途径研究[D].沈阳:沈阳农业大学,2018.
LI Z B. Allelopathy of autotoxic compounds and mitigationmethod for ginseng continuous cropping obstacle [D].Shenyang: Shenyang Agricultural University, 2018.
[7] HE C N, GAO W W, YANG J X, et al .. Identification ofautotoxic compounds from fibrous roots of Panaxquinquefolium L. [J]. Plant Soil, 2009, 318(1/2):63-72.
[8] 陈福慧,谢勇俊,贾清文,等.林下连作种植参根际土壤可培养微生物区系及细菌群落对酚酸类化感物质的响应[J].广西科学,2023,30(3):468-477.
CHEN F H, XIE Y J, JIA Q W, et al .. Response of culturablemicroflora and bacterial community to phenolic allelochemicain rhizosphere soil of continuous cropping Panax ginseng C. A.Meyer under forest [J]. Guangxi Sci., 2023, 30(3):468-477.
[9] 刘莹,孙文松,李玲,等. 人参连作障碍及防治措施研究进展[J].园艺与种苗,2020,40(7):26-29.
LIU Y, SUN W S, LI L, et al .. Research progress onconsecutive monoculture problems and control measures ofPanax ginseng [J]. Hortic. Seed, 2020, 40(7):26-29.
[10] 向维,韦小兰,曹科鑫,等.三七皂苷类自毒物质降解细菌分离及其降解特性[J].广西植物,2023,43(7):1173-1181.
XIANG W, WEI X L, CAO K X, et al .. Isolation andcharacterization of autotoxic saponins-degrading bacterialstrains from Panax notoginseng [J]. Guihaia, 2023, 43(7):1173-1181.
[11] 王罗涛,杨冬英,邓琳梅,等.三七根际土壤中皂苷类自毒物质降解拮抗细菌的分离筛选[J].南方农业学报,2020,51(2):305-312.
WANG L T, YANG D Y, DENG L M, et al .. Isolation andscreening of antagonistic autotoxin-degrading bacteria inPanax notoginseng (Burk.) F. H. Chen rhizosphere soil [J]. J.South Agric., 2020, 51(2):305-312.
[12] 赵亚慧,华雪洁,杜海岩,等.花生化感物质降解菌和抗连作拮抗菌复合菌剂应用效果的研究[J].土壤通报,2016,47(3):599-604.
ZHAO Y H, HUA X J, DU H Y, et al .. Research on theapplication effect of compound bacterium agent forallelochemicals degradation bacteria and antagonistic bacteriaresistance to continuous cropping [J]. Chin. J. Soil Sci., 2016,47(3):599-604.
[13] 张娜.微生物菌剂对设施番茄连作障碍的防治效果[J].蔬菜,2022(11):29-31.
ZHANG N. Effects of microbial inoculants on control ofcontinuous cropping obstacles of facilities tomato [J].Vegetables, 2022(11):29-31.
[14] 毛宁,薛泉宏,唐明,等.放线菌对对羟基苯甲酸的降解作用及草莓生长的影响[J]. 中国农业科技导报,2010,12(5):103-108.
MAO N, XUE Q H, TANG M, et al .. Degradation of parahydroxybenzoicacid by actinom yces and its effects onstrawberry growth [J]. J. Agric. Sci. Technol., 2010, 12(5):103-108.
[15] 肖蓉,邓舒,赵菁,等.自毒物质对羟基苯甲酸降解细菌ZH2的分离与应用[J].农学学报,2021,11(7):84-91.
XIAO R, DENG S, ZHAO J, et al .. An autotoxicity phydroxybenzoicacid-degrading strain ZH2: isolation andapplication [J]. J. Agron., 2021, 11(7):84-91.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:66-127.
[17] GIBBONS N E, BUCHANAN R E. 伯杰细菌鉴定手册[M].北京:科学出版社,1984:446-450.
[18] BRUCE-WILLIAMSON G, RICHARDSON D R. Bioassays forallelopathy: measuring treatment responses with independentcontrols [J]. J. Chem. Ecol., 1988, 14 (1):181-187.
[19] 崔丙健,崔二苹,刘春成,等.土壤改良剂对再生水滴灌根际土壤菌群多样性及病原菌和抗生素抗性基因丰度的影响[J].环境科学,2022,43(10):4765-4778.
CUI B J, CUI E P, LIU C C, et al .. Effects of soil amendmentson the bacterial diversity and abundances of pathogens andantibiotic resistance genes in rhizosphere soil under dripirrigation with reclaimed water [J]. Environ. Sci., 2022, 43(10):4765-4778.
[20] WANG X Q, CHEN D X, WANG J, et al .. Cloning and analysisof genes controlling antibacterial activities of Burkholderiapyrrocinia strain Lyc2 [J]. Curr. Microbiol., 2019, 76: 1003-1009.
[21] 许玉.Tsukamurella tyrosinosolvens P9、Burkholderia pyrrociniaP10与花生互作机制的比较研究[D].贵阳:贵州大学,2022.
XU Y. Comparative study on the interaction mechanism betweenTsukamurella tyrosinosolvens P9, Burkholderia pyrrocinia P10 andpeanut [D]. Guiyang: Guizhou University, 2022.
[22] HAN L, ZHANG H, XU Y, et al .. Biological characteristicsand salt-tolerant plant growth-promoting effects of an ACCdeaminase-producing Burkholderia pyrrocinia strain isolatedfrom the tea rhizosphere [J]. Arch. Microbiol., 2021, 203:2279-2290.
[23] 王鹏飞.丹参自毒物质的鉴定及其在腐解液和根际土中的含量分析[D].泰安:山东农业大学,2021.
WANG P F. Identification of autotoxic substances from Salviamiltiorrhiza and analysis of their contents in decomposedsolution and rhizosphere soil [D]. Tai’ an: ShandongAgricultural University, 2021.
[24] 张博洋,陈彦宏,栗锦鹏,等.自毒物质降解菌缓解药用植物连作障碍的作用及机制研究进展[J]. 中国野生植物资源,2023,42(11):7-14.
ZHANG B Y, CHEN Y H, LI J P, et al .. Research progress onthe role and mechanisms of autotoxicity-degrading bacteria inalleviating continuous cropping obstacles of medicinal plants[J]. Chin. Wild Plant Res., 2023, 42(11):7-14.
[25] 李敏,张丽叶,张艳江,等.酚酸类自毒物质微生物降解转化研究进展[J].生态毒理学报,2019,14(3):72-78.
LI M, ZHANG L Y, ZHANG Y J, et al .. Review on themicrobial biodegradation and metabolism of autotoxic phenolicacids [J]. Asian J. Ecotoxicol., 2019, 14(3):72-78.
[26] PEETERS C, ZLOSNIK J E A, SPILKER T, et al ..Burkholderia pseudomultivorans sp. nov., a novel Burkholderiacepacia complex species from human respiratory samples andthe rhizosphere [J]. Syst. Appl. Microbiol., 2013, 36(7):483-489.
[27] WILHELM R C,DERITO C M,SHAPLEIGH J P, et al .. Phenolicacid-degrading Paraburkholderia prime decomposition in forestsoil [J/OL]. Cold Spring Harbor Lab., 2020, 9: 317347 [2023-07-20]. https://doi.org/10.1101/2020.09.28.317347.
基金项目:广西壮族自治区科技重大专项(桂科AA18242026);广西壮族自治区科技计划项目(桂科AB21196019)。

