连作烟草根系分泌物鉴定及潜在化感物质的筛选研究





摘要:为探索长期连作状态下烟草根系分泌物内含有的化感物质组成成分,设置石英砂栽培和连作土壤栽培2种烟草培养处理,对2种烟草不同生长时期的根系分泌物进行提取,利用超高效液相色谱串联质谱(ultra-highperformance liquid chromatography tandem mass spectrometry, UHPLC-MS/MS)对提取的根系分泌物进行分析,通过数据库比对、差异分析和时间聚类分析等方法筛选连作烟草根系分泌物中潜在的化感物质。结果表明,共筛选出11类潜在化感物质,分别为生物碱、萜类、胺类、有机酸、苯酸及其衍生物、脂肪酸、酚类、氨基酸和多肽、香豆素、肉桂酸及其衍生物和其他。生物碱、萜类、胺类和有机酸4类化合物相对含量占所有化合物的73.3%。L-烟碱、熊果酸、β-氨基丙腈、5-羟基吲哚乙酸、早熟素Ⅱ、单乙基己基邻苯二甲酸、己内酰胺、姜酚、L-乳酸、邻苯二甲酸二乙酯和2,3-二氢-3,5-二羟基-2-氧代-3-吲哚乙酸甲酯是连作烟草根系分泌物中相对含量较高的潜在化感物质。研究结果为烟草根系化感物质的化感作用研究及缓解烟草连作障碍方法研究提供理论基础。
关键词:烟草;根系分泌物;化感物质;化感作用;连作障碍;UHPLC-MS/MS
doi:10.13304/j.nykjdb.2023.0034
中图分类号:S181;S572 文献标志码:A 文章编号:1008‑0864(2024)07‑0136‑11
在烟草的生长过程中,其根系会不断向根际周围释放大量的化合物,这些化合物被称为根系分泌物[1‑2]。根系分泌物是植物与土壤环境进行物质和能量交换及信息传递的重要载体,例如植物根系之间的相互作用、根系与微生物的相互作用等[3‑4]。植物根系分泌物是化感物质的重要来源,产生的化感物质会抑制植物种子萌发,扰乱植物的生长过程,在农田系统中化感物质会直接或间接影响相邻的同种作物或下茬作物的生长发育[5‑6]。化感作用被认为是供体植物释放的具有生物活性的化学物质与受体植物之间产生相互化学作用的过程[7]。有研究表明,烟草根系分泌物中的邻苯二甲酸酯,在含量大于0.5 mmol·L-1时对烟草种子萌发和幼苗生长表现出抑制作用[8]。
过度耕种所引发的连作障碍会造成烟田不同程度的土壤养分耗竭、生物多样性下降、土壤酸化或盐碱化、烟草生长发育减缓等问题[8-10]。研究表明,长期单一作物种植会降低土壤中氮、磷和钾等养分含量,导致植物吸收养分不平衡[11]以及化感自毒物质在土壤中不断累积,加剧了连作下土传病害的发生[12‑13]。长期连续种植棉花,其根系分泌物在土壤中大量累积,改变根际微生态环境,增加病虫害[14]的发生。王劲松等[15]研究发现,长期连作的高粱根系分泌物组成单一,会导致根际微生物的代谢活性、群落功能和多样性下降。
已有研究表明,根系分泌物作为化感物质的重要输出源之一,是探索作物补植问题的重要因素[2,16]。连作障碍的发生会对植物的生理活动造成影响,因此,本研究在理想生长环境以及长期连作土壤2种生长条件下,对长期连作条件下烟草根系分泌物中的潜在化感物质成分进行筛选分析,以期为长期连作烟草根系分泌物中化感物质的研究和生态应用提供研究依据。
1 材料与方法
1.1 试验材料
本研究选用的烟草品种为‘云烟87’,从连作5 年以上烟田随机采集土壤,土壤类型为壤土。土壤样品经自然风干、混合和过筛,去除多余植物根茎、石子等,进行后续盆栽试验。试验使用的塑料花盆上口直径34 cm、内口直径31 cm、高25 cm。试验所用Hoagland营养液组分如下:KNO3 0.506 g·L-1,Ca(NO3)2 1.181 g·L-1,MgSO4·7H2O 0.493 g·L-1,KH2PO4 0.14 g·L-1,H3BO3 0.028 g·L-1,MnCl2·4H2O0.020 g·L-1,ZnSO4·7H2O 0.023 g·L-1,CuSO4·5H2O0.08 g·L-1,Na2MoO4·2H2O 0.010 g·L-1, EDTA-Fe6.51 g·L-1。
1.2 试验设计
1.2.1 烟草培养
试验设置砂培和土培2种烟草盆栽试验。烟草种子经消毒、浸种后,使用烟草漂浮育苗方法进行育苗,待幼苗长至5叶1心时,选取长势一致的烟草幼苗进行移栽,烟草移栽后共培养60 d。烟草砂培所用石英砂用10%(体积分数)盐酸进行浸泡消毒,使用蒸馏水冲洗至pH稳定后,每个塑料花盆装入12.5 kg石英砂;烟草土培使用连作5年以上烟田土壤,每个塑料花盆装入12.5 kg土壤。每种培养方式分别移栽30 株烟草幼苗,共60株;在移栽后30、45、60 d每种培养方式随机选取6株烟草,收集烟草根系分泌物,共收集36个根系分泌物样品(砂培:S30、S45、S60;土培:T30、T45、T60)。每隔1 d浇Hoagland营养液200 mL。
1.2.2 烟草根系分泌物的收集
烟草根系分泌物选择土壤-水培法进行收集[17-19]。将长势良好的烟草植株从土壤和石英砂中取出,尽量避免对根部的损伤,保持根的完整。用去离子水缓缓洗去根部附着的土壤和石英砂颗粒,将冲洗干净的烟株置于去离子水中浸泡10 min,然后将烟株置于1 L去离子水中(淹没完整的根部),在25 ℃恒温恒湿的人工气候箱中培养24 h。将烟株取出后,根系分泌物提取液用0.22 μm水系滤膜过滤,将过滤后的溶液进行真空冷冻干燥。称取5 mg样品粉末,加入500 μL甲醇提取液(含同位素标记内标混合物),35 Hz 研磨4 min,超声冰水浴5 min,-40 ℃静置1 h,在4 ℃、12 000 r·min-1条件下离心15 min,取上清液进行超高效液相色谱串联质谱(ultra-high performance liquid chromatographytandem mass spectrometry,UHPLC-MS/MS)上机检测。
1.2.3 UHPLC-MS/MS 上机检测条件
烟草根系分泌物使用Vanquish(Thermo Fisher Scientific)超高效液相色谱仪上机检测,通过Wasters ACQUITY UPLCHSS T3(2.1 mm×100.0 mm,18 μm)液相色谱柱进行色谱分离。液相色谱A 相为水相,含5 mmol·L-1 乙酸铵和5 mmol·L-1 乙酸,B相为乙腈。样品盘温度4 ℃ ,进样体积2 μL。Orbitrap Exploris 120质谱仪在Xcalibur软件控制下进行一级、二级质谱数据采集,参数如下:Sheath gas flow rate: 50 Arb, Aux gas flow rate: 15Arb, Capillary temperature: 320 ℃, Full ms resolution:60 000, MS/MS resolution: 15 000, Collision energy:10/30/60 in NCE mode, Spray Voltage: 3.8 kV(positive)或-3.4 kV (negative)。
1.3 数据分析
原始数据经Proteo Wizard软件转成mzXML格式后,使用R语言进行峰识别、峰提取、峰对齐等处理,然后进行数据预处理,保留样品中大于80%的化合物,对缺失值进行模拟填补(最小值1/2),利用内标进行归一化。得到的原始数据矩阵使用Biotree DB(Version 2.1)自建二级质谱数据库匹配进行物质注释。化合物数据使用SIMCA软件进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法(orthogonal partial least squaresdiscrminantanalysis,OPLS-DA)建模。使用R 语言(Version 4.2.1)中table函数统计各分类的化合物数量,并使用Origin 2022b软件绘制分泌物分类饼图。使用R语言ggplot2函数绘制差异根系分泌物火山图,使用mfuzz函数对不同时期连作烟草根系分泌物进行时间序列聚类分析。鉴定出的化合物丰度均使用内标归一化为0到1之间的范围。
2 结果与分析
2.1 烟草根系分泌物成分鉴定
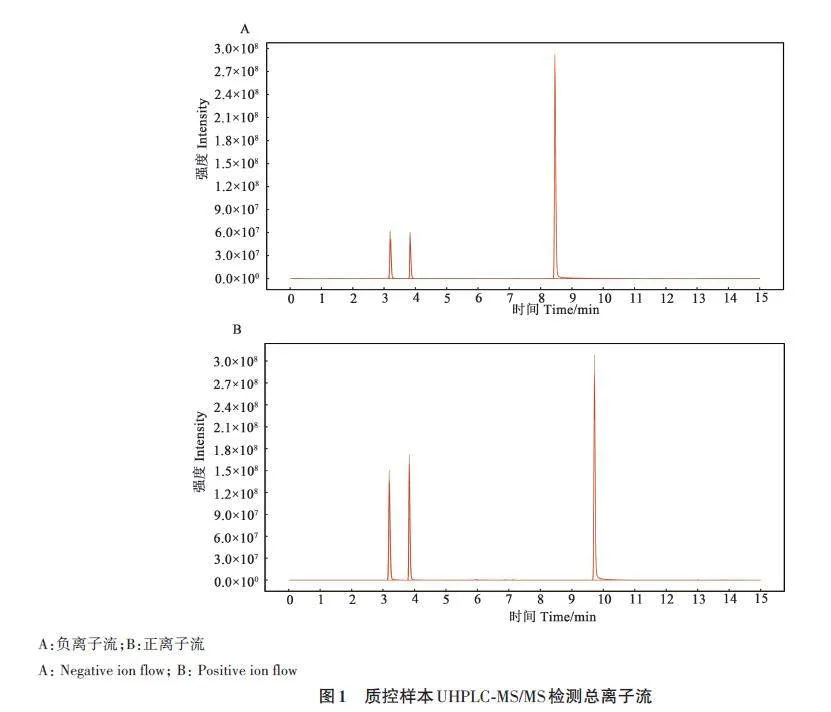
从正、负2 种离子模式质控样本(qualitycontrol,QC)的总离子流可以看出,在本研究的检测条件下,峰形及分布良好,表明超高效液相色谱串联质谱(UHPLC-MS/MS)检测所获得的数据可靠(图1)。保留每组样品中非零值,且匹配度80%以上的代谢物,阳离子模式下共获得890种代谢物,负离子模式下共鉴定出344种代谢物。
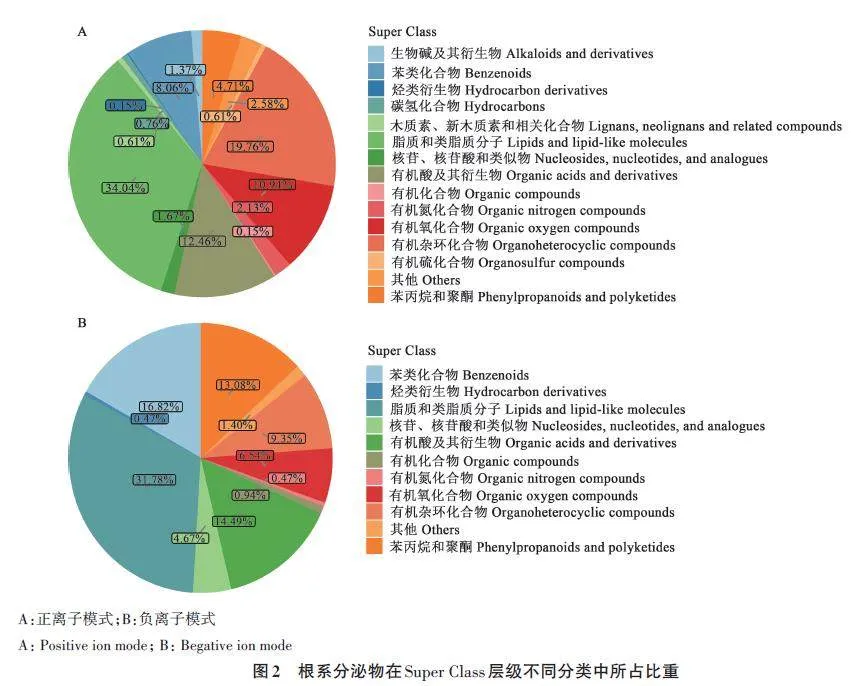
对根系分泌物在Super Class 层级上进行分类,正离子模式鉴定的根系分泌物在Super Class层级上被分为14类,其中,脂质和类脂质分子中包含的化合物种类最多,所占比重为34.04%,其次是有机杂环化合物、有机酸及其衍生物和有机氧化合物,所占比重分别为19.76%、12.46% 和10.94%(图2A)。负离子模式鉴定的根系分泌物在Super Class层级上被分为10类,其中,脂质和类脂质分子中包含的化合物种类最多,所占比重为31.78%,其次是苯类化合物、有机酸及其衍生物、苯丙烷和聚酮类化合物,所占比重分别为16.82%、14.49%和13.08%(图2B)。
2.2 不同培养方式烟草根系分泌物的差异分析
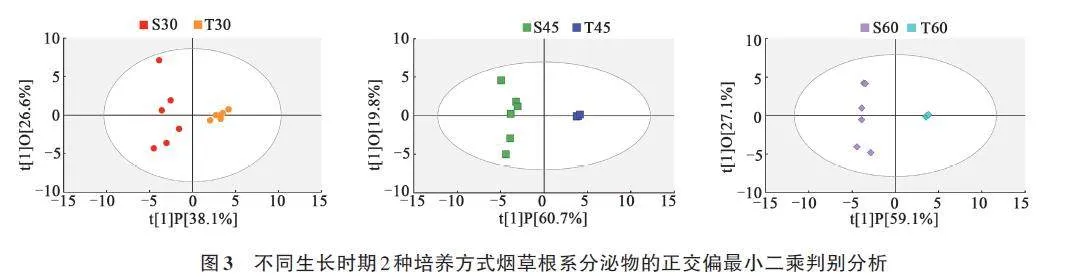
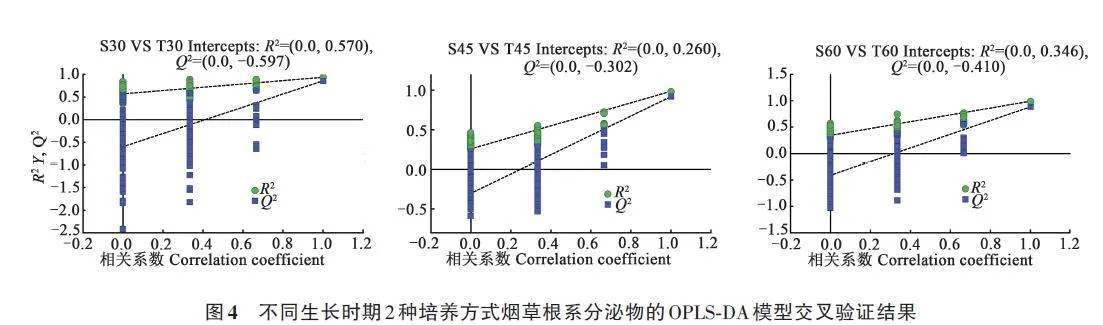
为筛选出2种培养方式烟草根系主要的差异分泌物,对不同时期根系分泌物样本数据进行正交偏最小二乘法判别分析(OPLS-DA),可以实现2种培养方式的烟草根系分泌物样品的有效区分(图3),本次分析中的R2gt;0.5,模型预测指数Q2gt;0.5,模型拟合结果良好[18]。之后对构建的OPLS-DA模型进行置换检验(n=200),如图4所示,各模型Q2回归线与Y 轴交点小于零,表明构建模型没有过拟合,认为模型结果准确有效,可以用于不同时期2种培养方式的烟草根系分泌物鉴别分析。
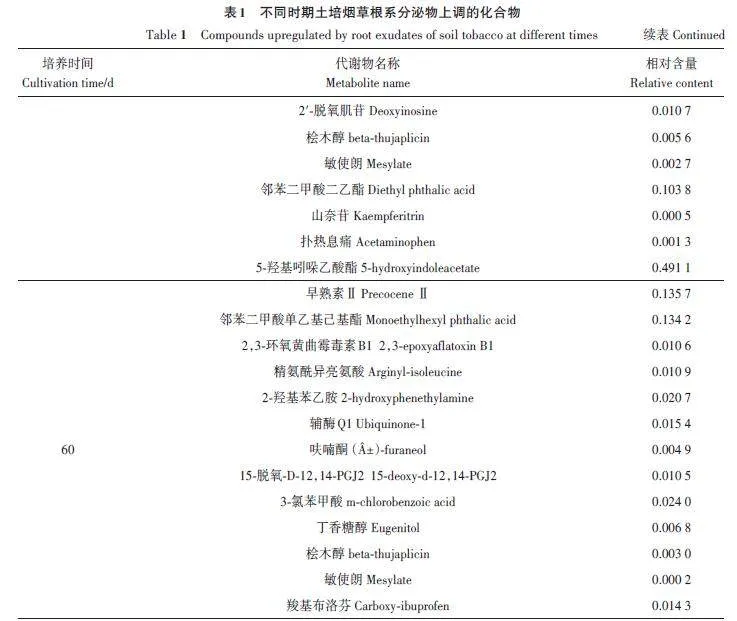
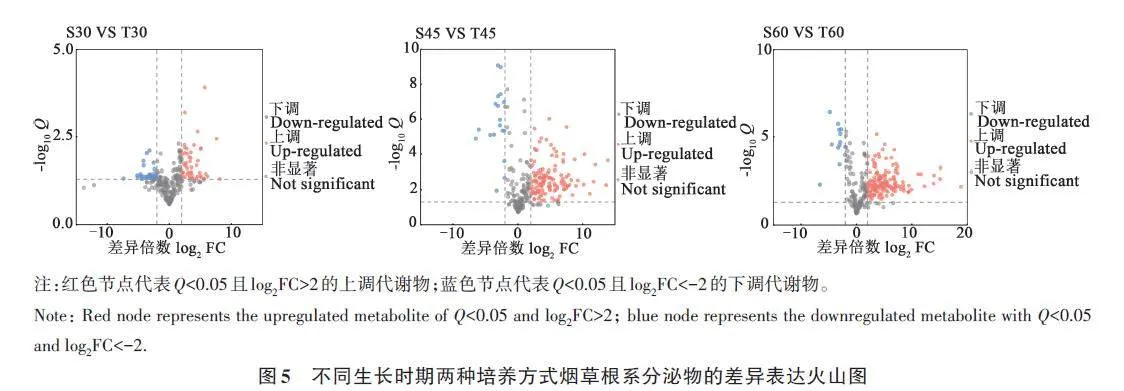
经过对数据进行差异分析,发现2种培养方式的烟草在不同时期根系中表现出了差异代谢,根据OPLS-DA模型计算各代谢物的VIP值,筛选出各时期VIPgt;1,Qlt;0.05且|log2FC|gt;2的差异代谢物(图5)。砂培组与土培组相比,在烟草移栽后30 d时,筛选出32种上调代谢物和27种下调代谢物;在烟草移栽后45 d时,筛选出121种上调代谢物和18种下调代谢物;在烟草移栽后60 d时,筛选出148种上调代谢物和13种下调代谢物。根据不同时间烟草根系差异代谢物,筛选出与砂培烟草相比土培烟草根系代谢物上调的代谢物(表1)。
2.3 土培烟草根系分泌物时间序列分析
为了研究差异代谢物在烟草生长不同时期中的相对含量变化趋势,并筛选生长过程中重要的根系分泌物,将所有分组比较中按照筛选标准鉴定得到的全部差异代谢物的相对含量进行Z 分(z-score)标准化,之后应用模糊C-均值法对3个时期的烟草根系分泌物进行聚类分析。结果显示,共观察到8个不同的时间模式簇(Cluster),代表不同变化趋势的根系分泌物(图6),在烟草生长期的第30~60天时,簇1、4和6表示先下调后上调的代谢物,簇2表示先上调后下调的代谢物,簇3、5和7表示持续下调的代谢物,簇8表示持续上调的代谢物。根据聚类结果,筛选同类簇中membershipgt;0.5 的重要代谢物,共106 种代谢物。
2.4 轮作烟草根系分泌物潜在化感物质筛选
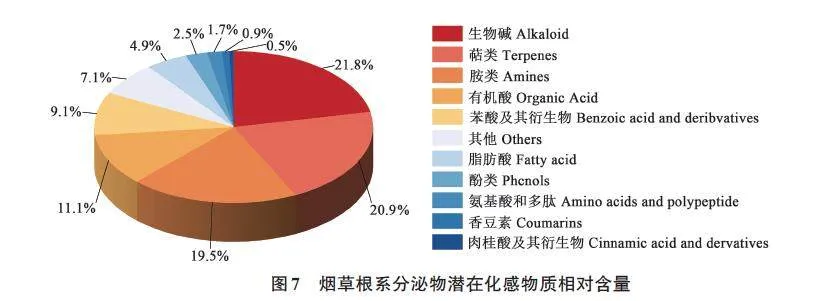
依据已有对植物化感物质的分类[19-22],对筛选出的根系分泌物进行分类,并选择相对含量大于0.005的化合物。由图7可知,筛选出的潜在化感物质共分属11大类,分别是生物碱、萜类、胺类、有机酸、苯酸及其衍生物、脂肪酸、酚类、氨基酸和多肽、香豆素、肉桂酸及其衍生物和其他。其中,生物碱、萜类、胺类和有机酸4类化感物质占所有潜在化感物质的73.3%。由表2可知,在44种潜在化感物质种相对含量大于0.03的物质分属于苯酸及其衍生物、萜类、有机酸、生物碱、胺类、酚类和其他7 种,分别是L-烟碱、熊果酸、β-氨基丙腈、5-羟基吲哚乙酸、早熟素Ⅱ、单乙基己基邻苯二甲酸、己内酰胺、姜酚、L-乳酸、邻苯二甲酸二乙酯和2,3-二氢-3,5-二羟基-2-氧代-3-吲哚乙酸甲酯。
3 讨论
烟草化感物质对烟株的自毒作用是一种特殊的种内竞争,它会造成竞争个体之间的生存适应能力下降,导致连作障碍的发生[23]。有研究表明,长期连作会影响土壤中化感物质的组成和含量,连作年限越长差异越大[15,24‑25]。于会泳等[26]研究发现,烟草根系分泌物中包含的有机酸、酰胺类、酯类、甘油和烟碱是可能导致烟草连作障碍的化感物质。对叔丁基苯甲酸、对羟基苯甲酸等化感物质通过抑制氮循环,降低土壤中的营养物质含量,对作物的生长产生影响。种子的萌发和植物幼苗的生长可以用来评估化感物质对植物自毒作用的情况[27‑28]。Deng 等[29]研究发现,烟草根系分泌物中邻苯二甲酸酯对烟草种子和幼苗生长有显著的自毒作用。根系分泌物中熊果酸对糖胶树以及绿兰种子和幼苗生长有抑制作用[30‑31]。
根系分泌物中的化感物质与根际微生物群落之间存在着相互作用,化感物质对根际群落的组成和结构有显著影响[32]。如玉米根系分泌物中的抗生素二萜类化合物有助于根际微生物的组装[33],酚酸类物质会导致土壤根际真菌群落结构改变,增加群落中病原菌负荷,导致土传病害增加[34‑35]。白羽祥等[36]研究发现,根系分泌物中的酚酸类物质在低水平时对烟草黑茎病菌有促进作用。刘艳霞等[37]研究表明,烟草根系分泌物提取物能促进根际微生物中的病原菌生长,抑制拮抗菌生长,病原菌对分泌物中的苯甲酸和3-苯丙酸利用率高于拮抗菌,这是造成连作烟草青枯病频发的重要原因之一。
本研究通过对非连作和连作2种烟草的根系分泌物进行比较分析,共筛选出44种潜在化感物质,分属生物碱、萜类、胺类、有机酸、苯酸及其衍生物、脂肪酸、酚类、氨基酸和多肽、香豆素、肉桂酸及衍生物和其他11大类。潜在化感物质组分中含量较高(gt;0.03)的11种化合物分别是L-烟碱、熊果酸、β-氨基丙腈、5-羟基吲哚乙酸、早熟素Ⅱ、单乙基己基邻苯二甲酸、己内酰胺、姜酚、L-乳酸、邻苯二甲酸二乙酯和2,3-二氢-3,5-二羟基-2-氧代-3-吲哚乙酸甲酯。对连作烟草根系分泌物中的化感物质研究可以为化感作用以及缓解烟草连作障碍方法研究提供理论基础,所筛选化感物质的化感效应还需进一步研究。
参 考 文 献
[1] BAIS H P, WEIR T L, PERRY L G, et al .. The role of rootexudates in rhizosphere interactions with plants and otherorganisms [J]. Annu. Rev. Plant Biol., 2006, 57(1): 233-266.
[2] 刘帅,黄坤,陈乐,等.烟草根系分泌物及其化感作用研究进展[J].亚热带农业研究,2018,14(1):61-65.
LIU S, HUANG K , CHEN L , et al .. Research progress ontobacco root exudates and their allelopathy [J]. Subtrop. Agric.Res., 2018,14(1):61-65.
[3] VIVES-PERIS V, DE OLLAS C, GOMEZ-CADENAS A, et al ..Root exudates: from plant to rhizosphere and beyond [J]. PlantCell Rep., 2020, 39(1): 3-17
[4] 蔡莹,于晓菲.植物根系分泌物的生态效应研究[J].环境生态学,2022,4(9):9-16.
CAI Y, YU X F. Study on the ecological effects of plant rootexudates [J]. Environ. Ecol., 2022,4(9):9-16.
[5] MILLER D A. Allelopathy in forage crop systems [J]. Agron. J.,1996, 88(6): 854-859.
[6] XING Y, ZHANG L H, SHI C P, et al .. The extraction,isolation and identification of exudates from the roots ofFlaveria bidentis [J]. J. Integr. Agric., 2014, 13(1): 105-114.
[7] KATO-NOGUCHI H. Allelopathy and allelochemicals ofimperata cylindrica as an invasive plant species [J/OL]. Plants,2022, 11(19): 2551 [2022-12-20]. https: doi.org/10.3390/plants11192551.
[8] DENG J J, ZHANG S X, HU J W, et al .. Toxic effects ofphthalate esters in tobacco root exudates on seed germinationand seedling growth [J]. Pedosphere, 2017, 27(6): 1073-1082.
[9] 时鹏,张继光,王正旭,等.烟草连作障碍的症状机理及防治措施[J].安徽农业科学,2011,39(1):120-122,124.
SHI P, ZHANG J G, WANG Z X, et al .. Symptoms, mechanismand controlling measures of tobacco continuous croppingobstacles [J]. J. Anhui Agric. Sci., 2011,39(1):120-122,124.
[10] APARICIO V, COSTA J L. Soil quality indicators undercontinuous cropping systems in the Argentinean Pampas [J].Soil Tillage Res., 2007, 96(1-2): 155-165.
[11] 晋艳,杨宇虹,段玉琪,等.烤烟轮作、连作对烟叶产量质量的影响[J].西南农业学报, 2004,17(增刊1):267-271.
JIN Y, YANG Y H, DUAN Y Q, et al .. Effect of rotationalcropping and continuous cropping on yield and quality of fluecuredtobacco [J]. Southwest China J. Agric. Sci., 2004, 17(S1):267-271.
[12] WANG J, TIAN T, WANG H, et al .. Chitosan-coatedcompound fertilizer application and crop rotation alleviatecontinuous cotton cropping obstacles by modulating rootexudates [J/OL]. Rhizosphere, 2022, 23:100581 [2022-12-20].https://doi.org/10.1016/j.rhisph.2022.100581.
[13] TAN Y, CUI Y, LI H, et al .. Rhizospheric soil and rootendogenous fungal diversity and composition in response tocontinuous Panax notoginseng cropping practices [J]. Microbiol.Res., 2017, 194: 10-19.
[14] LI W, KNOPS J J M H, ZUO X, et al .. Carbon and nitrogencycling are resistant to fire in nutrient-poor grassland [J]. Soil Sci. Soc. Am. J., 2014, 78(3): 825-831.
[15] 王劲松,樊芳芳,郭珺,等.不同作物轮作对连作高粱生长及其根际土壤环境的影响[J].应用生态学报,2016,27(7):2283-2291.
WANG J S, FAN F F, GUO J, et al .. Effect of different croprotations on growth of continuous cropping sorghum and itsrhizosphere soil micro-environment [J]. Chin. J. Appl. Ecol.,2016, 27(7): 2283-2291.
[16] ASADUZZAMAN M, ASAO T. Autotoxicity in beans and theirallelochemicals [J]. Sci. Hortic., 2012, 134: 26-31.
[17] CANARINI A, MERCHANT A, DIJKSTRA F A. Droughteffects on Helianthus annuus and glycine max metabolites:from phloem to root exudates [J]. Rhizosphere, 2016, 2: 85-97.
[18] YUN J, CUI C, ZHANG S, et al .. Use of headspace GC/MScombined with chemometric analysis to identify the geographicorigins of black tea [J/OL]. Food Chem., 2021, 360(11): 130033[2022-12-20]. https://doi.org/10.1016/j.foodchem.2021.130033.
[19] 孙颖,李江,雷小林,等.胡颓子根系分泌物中潜在化感物质分析[J].中南林业科技大学学报,2020,40(3):8-12, 52.
SUN Y, LI J, LEI X L, et al .. Analysis of potentialallelochemicals in root exudation of Elaeagnus pungens [J]. J.Cent. South Univ. For. Technol., 2020,40(3):8-12, 52.
[20] KONG C H, XUAN T D, KHANH T D, et al.. Allelochemicals andsignaling chemicals in plants [J/OL]. Molecules, 2019, 24(15): 2737[2022-12-20]. https://doi.org/10.3390/molecules24152737.
[21] YANG R Y, MEI L X, TANG J J, et al .. Allelopathic effects ofinvasive Solidago canadensis L. on germination and growth ofnative Chinese plant species [J]. Allelopathy J., 2007, 19(1):241-248.
[22] 师小平,陈银萍,闫志强,等.植物化感作用研究进展[J].生物技术通报,2020,36(6):215-222.
SHI X P, CHEN Y P, YAN Z Q, et al .. Research progress onplant allelopathy [J]. Biotechnol. Bull., 2020,36(6):215-222.
[23] JIAJUN D, ZHANG Y L, JIWEI H U, et al .. Autotoxicity ofphthalate esters in tobacco root exudates: effects on seedgermination and seedling growth [J]. Pedosphere, 2017, 27(6):1073-1082.
[24] 孙敬国,王昌军,孙光伟,等.连作年限对植烟根际土壤化感物质积累的影响——以湖北黄棕壤烟田为例[J].土壤,2021,53(1):148-153.
SUN J G, WANG C J, SUN G W, et al .. Effect of tobaccocontinuous cropping on allelochemicals accumulation inrhizosphere soil—a case study of yellow brown soil of Hubei[J]. Soil, 2021, 53(1): 148-153.
[25] 刘苹,赵海军,唐朝辉,等.连作对不同抗性花生品种根系分泌物和土壤中化感物质含量的影响[J].中国油料作物学报,2015,37(4):467-474.
LIU P, ZHAO H J, TANG C H, et al .. Effects of continuouscropping on root exudates of different resistance peanut (Arachishypogaea L.) varieties and allelochemicals content in soil [J]. Chin.J. Oil Crop Sci., 2015, 37(4): 467-474.
[26] 于会泳,申国明,高欣欣.烟草根系分泌物的GC-MS检测[J].中国烟草学报,2013,19(4):64-72.
YU H Y, SHEN G M, GAO X X. Determination of tobacco rootexudates by GC-MS [J]. Acta Tab. Sin., 2013, 19(4): 64-72.
[27] LARA-NÚÑEZ A, SÁNCHEZ-NIETO S, LUISA ANAYA A, et al..Phytotoxic effects of Sicyos deppei (Cucurbitaceae) in germinatingtomato seeds [J]. Physiol. Plant., 2009, 136(2): 180-192.
[28] ASAO T, HASEGAWA K, SUEDA Y, et al.. Autotoxicity of rootexudates from taro [J]. Sci. Hortic., 2003, 97(3-4): 389-396.
[29] DENG J J, ZHANG Y L, HU J W, et al .. Autotoxicity ofphthalate esters in tobacco root exudates: effects on seedgermination and seedling growth [J]. Pedosphere, 2017, 27(6):1073-1082.
[30] WANG C M, CHEN H T, LI T C, et al .. The role of pentacyclictriterpenoids in the allelopathic effects of Alstonia scholaris [J].J. Chem. Ecol., 2014, 40(1): 90-98.
[31] SELVI B, KADAMBAN D. Allelopathic effect of ursolic acidon growth and physiology of green gram cultivar KM-2 [J]. Int.J. Plant Sci. (Muzaffarnagar), 2009, 4(2): 578-581.
[32] SCHANDRY N, BECKER C. Allelopathic plants: models forstudying plant-interkingdom interactions [J]. Trends Plant Sci.,2020, 25(2): 176-185.
[33] MURPHY K M, EDWARDS J, LOUIE K B, et al .. Bioactivediterpenoids impact the composition of the root-associatedmicrobiome in maize (Zea mays) [J]. Sci. Rep., 2021, 11(1):1-13.
[34] LI Z, FU J, ZHOU R, et al .. Effects of phenolic acids fromginseng rhizosphere on soil fungi structure, richness anddiversity in consecutive monoculturing of ginseng [J]. Saudi J.Biol. Sci., 2018, 25(8): 1788-1794.
[35] 李庆凯,刘苹,赵海军,等.玉米根系分泌物对连作花生土壤酚酸类物质化感作用的影响[J]. 中国农业科技导报,2020,22(3):119-130 .
LI Q K, LIU P, ZHAO H J, et al .. Effects of maize rootexudates on allelopathy of phenolic acids in soil of continuouscropping peanut [J]. J. Agric. Sci. Technol., 2020, 22(3):119-130.
[36] 白羽祥,朱媛,杨焕文,等.烟草酚酸和有机酸对黑胫病菌生长的影响[J].西南农业学报,2017,30(6):1364-1368.
BAI Y X, ZHU Y, YANG H W, et al .. Effect of phenolic andorganic acid on growth of Phytophora parasitica var. nicotiana [J].Southwest China J. Agric. Sci., 2017, 30(6): 1364-1368.
[37] 刘艳霞,李想,蔡刘体,等.烟草根系分泌物酚酸类物质的鉴定及其对根际微生物的影响[J].植物营养与肥料学报,2016,22(2):418-428.
LIU Y X, LI X, CAI L T, et al .. Identification of phenolic acidsin tobacco root exudates and their role in the growth ofrhizosphere microorganisms [J]. J. Plant Nutr. Fert., 2016, 22(2):418-428.
基金项目:湖南省烟草公司长沙市公司项目20-22A07);湖南省教育厅资助科研项目(20A230);湖南省高新技术产业科技创新引领计划项目(2020NK2005)。

