油茶根腐病根际土壤、根系内真菌群落结构和多样性分析


摘要:为明确患根腐病的油茶在不同病情等级下根系和根际土壤内真菌群落组成、多样性、功能特征及与环境因子的关系,以德宏州梁河县的油茶为研究对象,利用高通量测序技术对5个病情等级的油茶根系及根际土壤内真菌的转录间隔区(internal transcribed spacer,ITS)序列进行测序。结果表明,染病油茶根系及根际土壤内的真菌群落多样性(Shannon指数)降低,根系中真菌总OTUs(operational taxonomic units)、特有OTUs和丰富度(Chao1指数)呈先增加后减少的趋势;根际土壤中染病油茶真菌群落的均匀度和丰富度上升。门水平上,子囊菌门(Ascomycota)和担子菌门(Basidiomycota)为根系及根际土壤中共同的优势菌门,球囊菌门(Glomeromycota)和被孢囊门(Mortierellomycota)在根系中丰度表现为逐级递减的趋势。属水平上,患病后油茶根系内树状孢属(Dendrosporium)、暗双胞属(Cordana)、Matsushimamyces、无柄盘菌属(Pezicula)、黑孢盘属(Melanconium)的丰度明显上升。油茶林下土壤真菌群落结构的主要影响因子为速效钾、有机质、pH、速效磷,真菌群落与环境因子联合分析结果表明,部分有益菌和磷含量呈正相关,部分病原菌和钾含量呈负相关。FUNGuild 功能分析表明,油茶根系及根际土壤中真菌以腐生型为主,健康油茶中共生营养型真菌丰度最高,染病后逐渐降低;从Ⅱ级病害以后的油茶根系内植物病原功能群开始成为优势功能群。综上所述,油茶患病后真菌的多样性减少,根系内部分有益真菌丰度减少,植物病原菌和腐生菌增加,丛枝菌根真菌的定殖在调节油茶病健关系中发挥着重要的作用。针对德宏州梁河县的油茶基地,需要多施钾肥和磷肥,减少氮肥的施用,可提高部分有益菌的丰度,降低病原菌的丰度,从而减轻油茶根腐病的发生。
关键词:油茶根腐病;真菌多样性;群落结构;土壤理化性质;FUNGuild功能
doi:10.13304/j.nykjdb.2022.1006
中图分类号:S763.7;S476 文献标志码:A 文章编号:1008‑0864(2024)07‑0121‑15
油茶(Camellia oleifera)泛指山茶科(Theacea)山茶属(Camellia)中种子含油率较高且有利用价值的一类木本食用油料植物[1]。油茶籽富含不饱和脂肪酸,是健康型高级食用植物油,也是我国食用油的重要组成部分,被誉为“东方橄榄油”[2]。油茶在中国已有2 300年的栽植历史,截至2020年,我国实有油茶林面积445.1 万hm2,预计2030 年将达到618.67万hm2[3]。油茶的种植区域主要在长江流域及其以南地区[4],云南省德宏州是油茶主要种植区域之一,但近年来多处油茶林频发炭疽病、根腐病和灰斑病等病害,致使油茶品质和产量下降,一定程度上影响了德宏州油茶产业的发展。
植物内生菌是植物微生态系统的重要组成,有增强植株抗病虫害等生态功能[5];根际土壤中的微生物能够转化土壤养分,参与有机质的分解来维持土壤的健康[6]。微生物群落的组成受到环境因子和气候的影响,植物根系会向土壤中释放化合物招募不同的微生物,从而吸引更多有益的微生物,同时微生物能向植物提供更复杂的反馈[7]。作为土壤微生物中的重要组成,真菌比细菌更加敏感,它对植物摄取营养物质、促进生长发育、提高宿主植物抗病性以及维持根际微生态系统平衡等起重要调节作用[8]。土壤真菌多样性及群落结构是评价生态系统是否健康稳定的重要指标。因此,研究根系及根际土壤真菌有助于了解该区域植株及土壤的健康情况并提出针对性意见。
油茶根腐病是危害德宏州油茶林较严重的一种病害,油茶受到病原菌侵染后,根部初期症状表现为褐色或黑褐色,后期症状表现为表皮腐烂脱落,严重时症状延伸到根茎交界处。地上部分植株表现为叶片黄化脱落,植株矮小,严重时整株枯死,严重影响油茶果的产量,损害经济效益。因此,亟需对油茶林生长环境进行探究,明确土壤微生物对油茶生长和病害的影响。本研究以德宏州油茶林为对象,利用Illumina MiSeq高通量测序技术对不同发病程度油茶的根系及根际土壤真菌群落结构及多样性进行检测,并分析真菌功能多样性以及根际土壤真菌与环境理化因子的相关性,以期为开发有益的油茶根际微生物资源、调控土壤环境因子和预防油茶病害提供科学依据。
1 材料与方法
1.1 研究区概况
采样地位于德宏州梁河县九保乡丙界村(24°48’59” N、98°19’40” E),海拔1 451 m,属南亚热带季风气候,年均气温18.3 ℃,年均降水量1 396.2 mm。本研究选择的油茶林占地44.4 hm2,是白花油茶示范基地,具有一定的代表性。经课题组前期分离回接试验鉴定,本次油茶根腐病的主要病原为镰刀菌属的尖孢镰刀菌(Fusariumoxysporum)。
1.2 样品采集
研究对象为10年生的白花油茶,品种为‘德林油B1’。根据油茶地上部分发病情况进行取样对象选择,共分为5个病害等级,每个等级选择长势相近的6株油茶,共选取30棵油茶树。每棵树之间距离大于20 m。去除表面枯叶及杂质,在距离主干约30~50 cm的4个方向,将油茶的根系拔出,抖落并收集须根土壤样品,充分混匀,为根际土壤样品(S);抖落土壤后的二级侧根,为根系样品(R)。
根据油茶根系发病程度设为5个处理,每个处理分别对应1个病情等级。0级:根部健康无症状;Ⅰ级:主根基部轻微褐变,侧根正常;Ⅱ级:主根部分褐变,侧根轻微褐变;Ⅲ级:主根及侧根褐变,侧根脱落;Ⅳ级:根部变黑腐烂,侧根脱落,整株枯死[9]。取6份同一病害等级下的不同油茶植株的根系及根际土壤,充分混合为1个样本,最终0、Ⅰ、Ⅱ、Ⅲ、Ⅳ级下根际土壤分别命名为HS0、DS1、DS2、DS3、DS4,根系分别命名为HR0、DR1、DR2、DR3、DR4。将样本用干冰保存运回实验室,根系样品表面消毒流程为:75%乙醇1 min,无菌水冲洗1次,用有效氯5%(质量体积分数)的次氯酸钠溶液表面消毒5 min,无菌水冲洗3次。吸取100 μL最后一遍清洗的无菌水涂布于PDA培养基观察是否有菌落生长,依此判断表面消毒是否彻底[10]。土壤以200目筛网过筛,分为2份,1份用于分子试验,1份用于理化性质测定。
1.3 土壤理化性质测定
采用电位法测定土壤pH;采用重铬酸钾容量法测定土壤有机质(organic matter,OM)含量;采用高锰酸钾-还原性铁法测定全氮(total nitrogen,TN)含量;采用氢氧化钠熔融法测定全钾(totalpotassium,TK)含量;采用氢氧化钠熔融-钼锑抗比色法测定全磷(total phosphorus,TP)含量;采用紫外分光光度法测定硝态氮(nitrate nitrogen,NO-3-N)含量;采用蒸馏后滴定法测定铵态氮(ammoniumnitrogen,NH+4-N)含量;采用醋酸铵-火焰光度计法测定速效钾(available potassium,AK)含量;采用钼锑抗比色法测定测定速效磷(availablephosphorus,AP)含量[11]。每个样品重复3次。
1.4 土壤真菌总DNA 提取及高通量测序
将采集的土壤、根系样品进行微生物DNA的提取。采用E.Z.N.A Mag-Bind soil DNA Kit提取试剂盒(OMEGA)提取总DNA。用琼脂糖凝胶检测DNA 完整性,用Qubit定量测定样本含量。以土壤和根系作为模板,用ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’) 扩增真菌内转录间隔区(internal transcribed spacer,ITS)中长度约250 bp的ITS1区段。PCR 反应为30 μL体系:15 μL 2×Hieff® Robust PCR Master Mix、1 μL Bar-PCR primerF、1 μL Primer R、10~20 ng PCR产物、9~12 μL H2O补足30 μL。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5个循环;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,20个循环;72 ℃延伸5 min。PCR产物用于构建微生物多样性测序文库,送至生物工程(上海)股份有限公司使用Illumina Miseq高通量测序平台进行测序。
1.5 测序数据生物信息学及统计分析
利用Cutadapt(version1.18)、PEAR (version 0.9.8)、PRINSEQ(version 0.20.4)等软件对Illumina Miseq测序获得的序列进行质控和过滤,得到各样本的高质量序列。利用Usearch 软件(version11.0.667),按照97% 相似性对非重复序列进行OTUs(operational taxonomic units)聚类,在聚类过程中去除嵌合体,得到OTUs的代表序列。采用RDP classifier 贝叶斯算法(version 2.12)对97% 相似度水平的OTUs代表序列进行分类学分析,并在门、纲、目、科、属、种水平统计各个样品的菌落组成,绘制不同分类水平真菌类群的相对丰度图。利用Mothur(version1.43.0)软件计算各样本的Chao1 指数、Ace 指数、Shannon 指数、Simpson 指数,分析样本真菌的Alpha 多样性。利用R 的gplots package绘制不同分类的相对丰度热图。采用冗余分析(redundancy analysis, RDA)进行环境因子与微生物群落分布的关联分析。基于共生、腐生和病理3种营养型来划分[12]真菌的生态功能类群。运用FUNGuild 数据库对5组根系样品和5组根际土壤样品真菌群落进行功能预测,置信水平选用highly probable 和probable。应用Excel2010 对各分类单元数据进行统计,使用Word2010进行表格制作,使用SPSS进行差异显著性分析,运用Duncan法(Plt;0.05)进行单因素方差分析。
2 结果与分析
2.1 油茶植被土壤理化性质分析
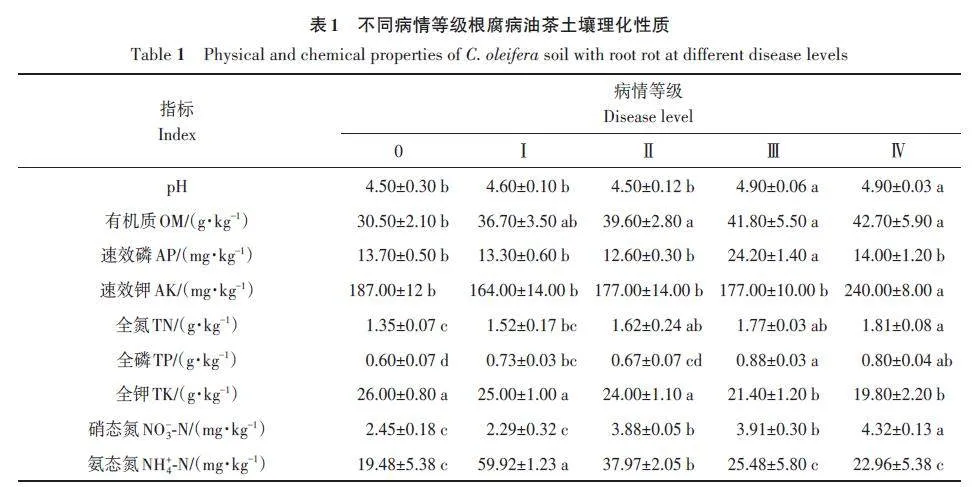
由表1 可知,油茶土壤为酸性土壤,pH 在4.50~4.90。土壤中有机质和全氮含量随着油茶病害等级的上升呈现出逐级递增的趋势,病害等级为0级的油茶土壤的有机质和全氮含量最低,患病后升高;全钾含量随着油茶病害等级的上升呈现出逐级递减的趋势,病害等级为0级的油茶土壤的全钾含量最高,患病后降低。
2.2 不同病害等级油茶根系及根际土壤内真菌的α 多样性分析
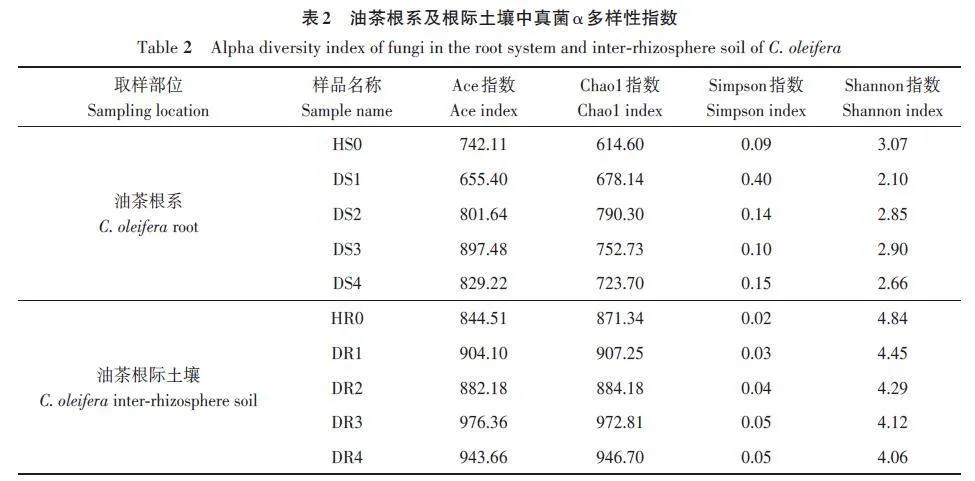
Alpha 多样性分析结果如表2 所示,在根系中,0 级油茶真菌的Shannon 指数(3.07)最高,Simpson指数(0.09)最低,表明健康油茶根系中真菌的多样性最高,患病后真菌多样性下降;而丰富度指数(Chao1指数)则是随着病害等级的增加,呈现先增加后减少的趋势,Ⅱ级油茶根系中真菌的丰富度(790.30)最高。
根际土壤中,油茶真菌的Shannon 指数随病害等级的升高而降低,Simpson指数随病害的升高而升高,说明油茶根际土壤中真菌的多样性随病害的加重而降低;同时,0级油茶根际土壤中真菌的Chao1指数(871.34)和Ace指数(844.51)最低,感病后的油茶根际土壤中真菌的Chao1指数和Ace指数均有不同程度的升高,说明感病后真菌的物种丰富度上升。
2.3 不同病害等级油茶土壤及根系样品细菌的OTUs 分类
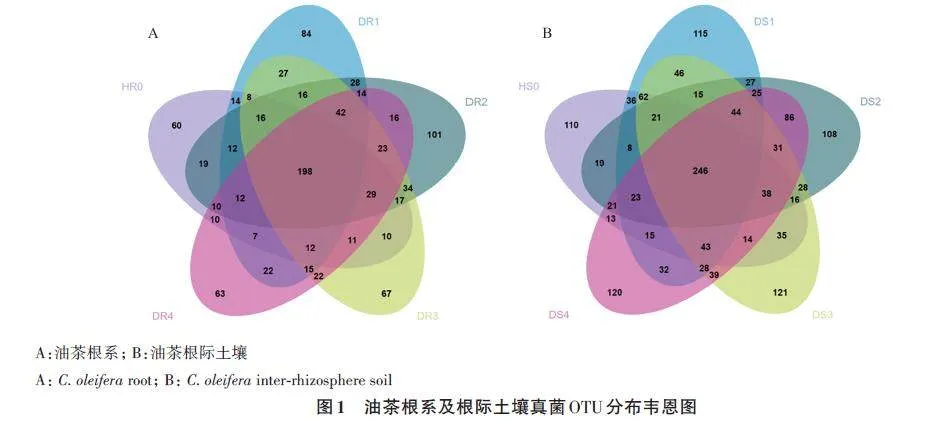
对5个油茶根系样本真菌进行测序,共获得高质量质控序列297 212条,平均长度243.06 bp,序列聚类共获得1 019个OTUs,5个病情等级共有OTUs 198个,占比19.43%。随着病害等级的增加,油茶根系中的真菌总OTUs数呈现出先增加后减少的趋势。就特有OTUs 而言,健康油茶(HR0)特有OTUs 60个(5.89%),Ⅰ级油茶(DR1)特有OTUs 84 个(8.24%),Ⅱ级油茶(DR2)特有OTUs 101个(9.91%),Ⅲ级油茶(DR3)特有OTUs67 个(6.58%),Ⅳ级油茶(DR4)特有OTUs 63 个(6.18%),表明特有OTUs随病情等级增加也呈现出先增后减的趋势,其中Ⅱ级油茶特有的OTUs数最多(图1A)。
对5个油茶根际土壤样品进行测序,共获得高质量质控序列284 441条,平均长度248.94 bp,序列聚类共获得1 585个OTUs,5个病情等级共有OTUs 246 个,占比15.52%;健康油茶(HS0)根际土壤中的总OTUs数最少,患病后总OTUs数量增加, DS3 样本中的总OTUs 数最多,占比52.18%。此外,0 级油茶(HS0)特有OTUs 110 个(6.94%),Ⅰ 级油茶(DS1)特有OTUs 115 个(7.26%),Ⅱ 级油茶(DS2)特有OTUs 108 个(6.81%),Ⅲ 级油茶(DS3)特有OTUs 121 个(7.63%),Ⅳ 级油茶(DS4)特有OTUs 120 个(7.57%)。由此可以看出,油茶患病后总OTUs数增加,但与病害等级无关;而特有OTUs数与油茶的患病情况无明显关系(图1B)。
2.4 不同病害等级油茶根系及根际土壤的真菌物种组成
在门分类水平上对每组样品的根系真菌相对丰度分布进行分析并绘制优势物种相对丰度(gt;1%)柱形图(图2A),不同根系样本中各门的相对丰度不同,子囊菌门(Ascomycota, 69.10%~93.26%)、担子菌门(Basidiomycota,3.13%~23.28%)和球囊菌门(Glomeromycota,2.24%~6.25%)在病害等级为0、Ⅰ和Ⅱ级的油茶根系样本中为优势菌门(丰度前3);子囊菌门(90.01%~95.25%)、未明确地位的真菌(unclassified_fungi,3.14%~8.27%)和担子菌门(1.24%~1.35%)在病害等级为Ⅲ和Ⅳ级的油茶根系样本中为优势菌门。其中,子囊菌门相对丰度表现为HR0DR2gt;DR1gt;DR3gt;DR4,健康油茶根系中担子菌门的相对丰度最高,患病后该类群相对丰度下降,Ⅳ级时相对丰度降至最低;此外,球囊菌门和被孢霉门(Mortierellomycota)的相对丰度都表现为HR0gt;DR1gt;DR2gt;DR3gt;DR4,呈现逐级递减的趋势,健康根样中相对丰度最高,Ⅳ级根样中相对丰度最低。
如图2B所示,健康根际土壤样本与患病油茶样本中各门的相对丰度不同,子囊菌门(Ascomycota,61.06%)、担子菌门(Basidiomycota,23.60%)和球囊菌门(Glomeromycota,4.59%)在健康油茶根际土壤样本中为优势菌门(丰度前3);子囊菌门(61.06%~74.84%)、担子菌门(5.08%~23.60%)和被孢霉门(Mortierellomycota,2.48%~20.72%)在病害等级Ⅰ、Ⅱ、Ⅲ和Ⅳ级的油茶根际土壤样本中为优势菌门。其中,子囊菌门相对丰度表现为HS0DS1gt;DS3gt;DS2gt;DS4,健康油茶根际土壤中担子菌门的相对丰度最高,患病后该类群相对丰度不同程度地下降,Ⅳ级相对丰度降至最低;被孢霉门相对丰度表现为DS3gt;DS2gt;DS4gt;HS0gt;DS1,该类群在根际土壤中与病害的发生无明显变化规律;球囊菌门相对丰度表现为HS0gt;DS2gt;DS1gt;DS3gt;DS4,健康油茶根际土壤中该类群的相对丰度最高,患病后相对丰度不同程度地下降,在Ⅳ级油茶中相对丰度降至最低。
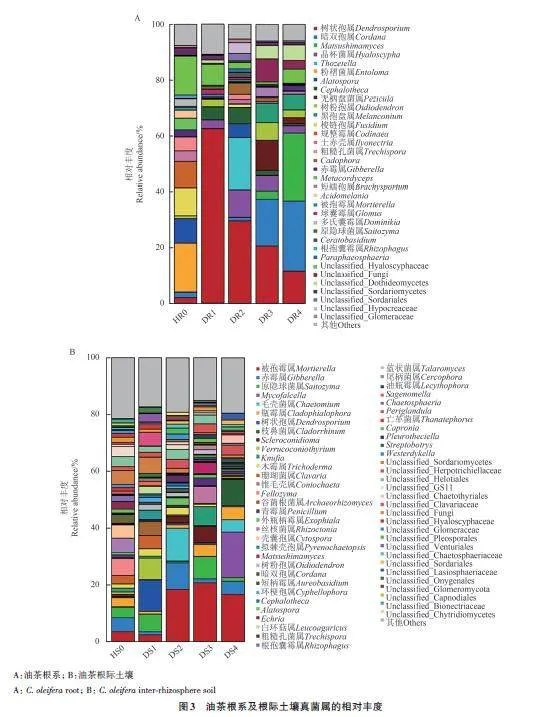
从属水平上分析(图3A),0级油茶根系内真菌的优势属( 相对丰度gt;5%)为粉褶菌属(Entoloma,17.53%)、unclassified_Hyaloscyphaceae(13.93%)、梭链孢属(Fusidium,10.01%)、规整霉属(Codinaea,9.54%)和Alatospora(8.65%)。Ⅰ级油茶根系内真菌的优势属为树状孢属(Dendrosporium,62.47%)和unclassified_Hyaloscyphaceae(7.48%)。Ⅱ 级油茶根系内真菌的优势属为树状孢属(29.59%) 、Thozetella (18.78%) 、晶杯菌属(Hyaloscypha,9.80%)和Cephalotheca(5.77%)。Ⅲ级油茶根系内真菌的优势属为树状孢属(20.65%)、暗双胞属(Cordana,16.67%)、无柄盘菌属(Pezicula,10.79%)、unclassified_fungi(8.27%)、黑孢盘属(Melanconium, 6.91%)和树粉孢属(Oidiodendron,6.34%)。Ⅳ级油茶根系内真菌的优势属为暗双胞属(25.08%)、Matsushimamyces(24.42%)、树状孢属(11.61%)、黑孢盘属(5.63%)、unclassified_Dothideomycetes(5.57%)和unclassified_Hyaloscyphaceae(5.03%)。各样本间的物种相对丰度差异较大,粉褶菌属、Alatospora、梭链孢属、规整霉属和unclassified_Hyaloscyphaceae 在健康油茶根系内占比最大, 在油茶患根腐病后,树状孢属、暗双胞属、Matsushimamyces、无柄盘菌属、黑孢盘属、unclassified_fungi 和unclassified_Dothideomycetes 的相对丰度明显增加。
根际土壤内(图3B),0级油茶真菌的优势属为Fellozyma(5.91%)。Ⅰ级油茶根际土壤内真菌的优势属为树状孢属(Dendrosporium,11.07%)、Verrucoconiothyrium (7.54%) 、原隐球菌属(Saitozyma,6.17%)和unclassified_Sordariomycetes(5.72%)。Ⅱ级油茶根际土壤内真菌的优势属为被孢霉属(Mortierella,18.42%)、毛壳菌属(Chaetomium,11.52%)和赤霉属(Gibberella,9.35%)。Ⅲ级油茶根际土壤内真菌的优势属为被孢霉属(20.68%)、原隐球菌属(7.86%)、Knufia(6.73%) 、锥毛壳属(Coniochaeta,6.05%) 和Scleroconidioma(5.77%)。Ⅳ级油茶根际土壤内真菌的优势属为被孢霉属(16.67%)、Mycofalcella(15.98%)和枝鼻菌属(Cladorrhinum,9.16%)。各样本间的物种相对丰度差异较大,患病情况较严重的3个等级下(Ⅱ、Ⅲ和Ⅳ级),被孢霉属的相对丰度明显多于患病情况较轻(0和Ⅰ级)的油茶。此外,发病情况最严重的油茶根际土壤中Mycofalcella 和枝鼻菌属的相对丰度最高,且明显多于其他病害等级下的;而在健康油茶根际土壤中Fellozyma的相对丰度最高,且明显多于其他病害等级。
2.5 不同病情等级下油茶根系及根际土壤中真菌β 多样性分析
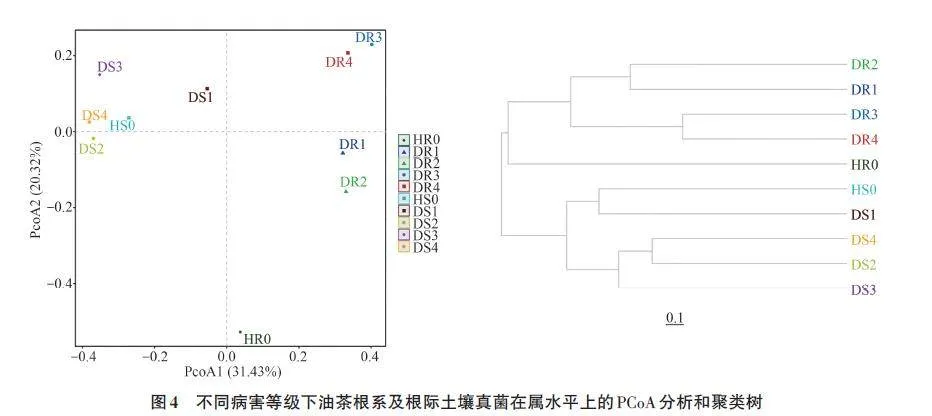
在属分类单元水平上,采用unweighted-unifrac算法对样本进行分析(图4)。PCoA(principalco-ordinates analysis)分析结果显示,PCoA1 轴解释了关系值的31.43%,PCoA2轴解释了关系值的20.32%,二者累计贡献率为51.75%。根系样品和根际土壤样品在PCoA1上分开,此外,健康油茶根系内的真菌组成与患病油茶的有明显差异。
聚类树显示,健康油茶根系内真菌群落组成处于独立的分支,与患病油茶的根内及根际土壤真菌组成存在较大差异;在患病油茶中,病害等级为Ⅰ级和Ⅱ级的真菌群落组成相似,病害等级为Ⅲ级和Ⅳ级的真菌群落组成相似。根际土壤中,健康油茶和Ⅰ级油茶的真菌群落组成相似,Ⅱ、Ⅲ和Ⅳ级油茶的真菌群落组成相似。由此说明,健康油茶患病后,无论是根系还是根际土壤内的真菌群落都存在过渡过程,真菌结构随病害程度的加重逐渐发生变化。
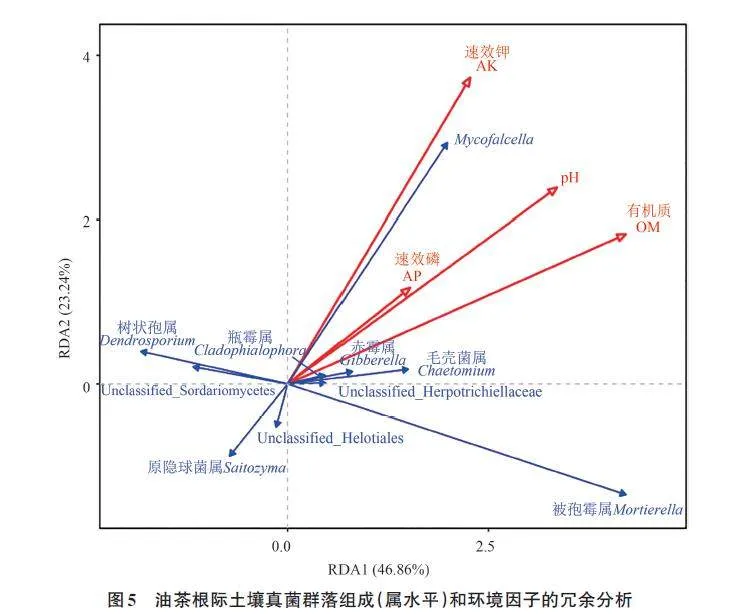
2.6 环境因子对油茶根系及根际土壤真菌群落组成的影响
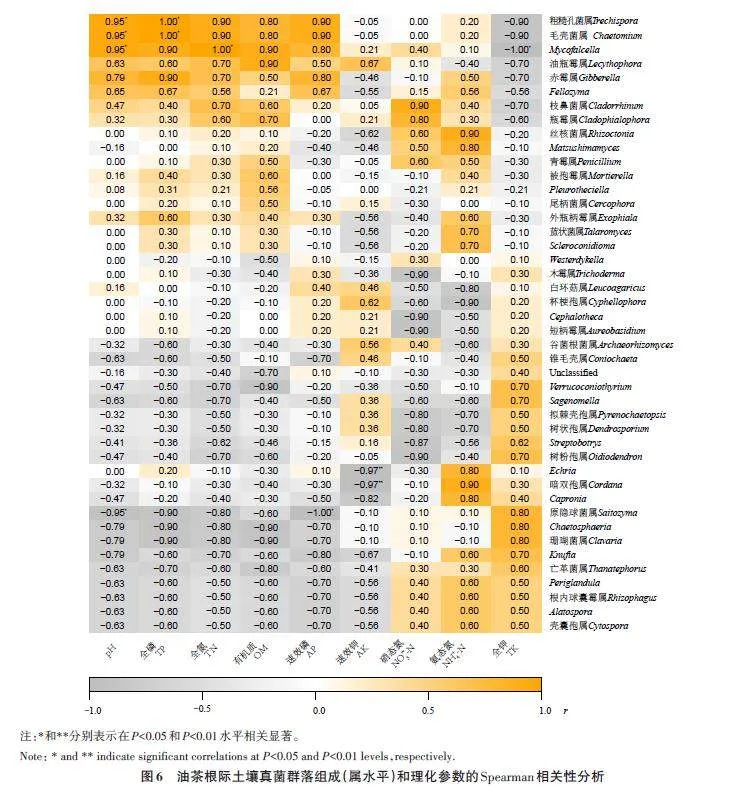
通过方差膨胀因子分析,去掉多重共线性较强的因子,将剩余因子用于冗余分析(redundancyanalysis,RDA)。将油茶根际土壤真菌群落丰度前10(属水平)以及4种环境因子进行RDA分析,结果显示(图5),第1、第2 轴的解释率分别为46.86%和23.24%,累计总解释率达70.10%,表明该结果较好地反映了对真菌群落的影响,从大到小依次为:速效钾gt;有机质gt;pHgt;速效磷。选取丰度gt;1%的属水平下根际土壤真菌,相关性类型为spearman,显著性P 值为0.05,对油茶根际土壤真菌群落组成与土壤理化性质相关性做热图分析(图6)发现,原隐球菌属(Saitozyma)与速效磷(AP)呈显著负相关(Plt;0.05),与pH 呈显著负相关(Plt;0.05);Mycofalcella 与pH和全氮(TN)呈显著正相关(Plt;0.05),与全钾(TK)呈显著负相关(Plt;0.05);毛壳菌属(Chaetomium)与pH和全磷(TP)呈显著正相关(Plt;0.05);暗双孢属(Cordana)与速效钾(AK)呈极显著负相关(Plt;0.01);Echria 与速效钾呈极显著负相关(Plt;0.01);粗糙孔菌属(Trechispora)与pH和全磷呈显著正相关(Plt;0.05)。
2.7 根系和根际土壤真菌群落的功能多样性特征
运用FUNGuild数据库对5组根系样品和5组根际土壤样品真菌群落进行真菌功能预测分析,得到真菌营养型在不同样本中的相对丰度信息(图7A、B),样本中的真菌类群主要为病理营养型、腐生营养型、共生营养型、病理-腐生营养型等营养类型。其中,根系内腐生营养型、病理-腐生营养型和共生营养型的相对丰度较高;根际土壤内腐生营养型、腐生-共生营养型和共生营养型的相对丰度较高。
5个根系样本和5个根际土壤样本预测得到的生态共位群相对丰度如图7C、D所示(选择丰度gt;1%)。根系中,HR0的优势菌群(丰度gt;10%)包括丛枝菌根功能群(arbuscular mycorrhizal,39.95%)和木腐功能群(wood saprotroph,31.45%);DR1的优势菌群包括未定腐生功能群(undefinedsaprotroph,52.74%)、外生菌根-未定腐生功能群(ectomycorrhizal-undefined saprotroph,14.12%)和丛枝菌根功能群(arbuscular mycorrhizal,12.60%);DR2的优势菌群包括植物病原-木腐功能群(plant saprotroph-wood saprotroph,41.05%)和未定腐生功能群(undefined saprotroph,31.38%);DR3 和DR4 的优势菌群都为未定腐生功能群(undefined saprotroph,19.98%和22.23%)、植物病原- 植物腐生功能群(plant pathogen-plantsaprotroph,25.74% 和11.21%)、内生-植物病原-植物腐生功能群(endophyte-plant pathogen-plantsaprotroph,16.47%和29.30%)、藻类寄生-苔藓寄生-真菌寄生-未定腐生功能群(algal parasitebryophyteparasite-fungal parasite-undefined saprotroph,19.33%和14.66%)和外生菌根-未定腐生功能群(ectomycorrhizal-undefined saprotroph,13.92% 和12.98%)。根际土壤中,HS0的优势菌群(相对丰度gt;10%)包括未定腐生功能群(undefinedsaprotroph,19.95%)、内生-植物病原-木腐功能群(endophyte-plant pathogen-wood saprotroph,16.19%) 和丛枝菌根功能群(arbuscularmycorrhizal,13.83%);DS1的优势菌群包括未定腐生功能群(undefined saprotroph,25.60%)和动物病原-植物病原-未定腐生功能群(animal pathogenplantpathogen-undefined saprotroph,23.20%);DS2的优势菌群包括未定腐生功能群(undefinedsaprotroph,18.99%);DS3的优势菌群包括未定腐生功能群(undefined saprotroph,26.74%%)和动物病原- 真菌寄生- 未定腐生功能群(animalpathogen-fungal parasite-undefined saprotroph,12.66%);DS4 的优势菌群包括未定腐生功能群(undefined saprotroph,28.59%)和内生-凋落物腐生-土壤腐生-未定腐生功能群(endophyte-littersaprotroph-soil saprotroph-undefined saprotroph,20.05%)。可以看出,随着病害等级的增加,植物病原菌和腐生菌增加,而丛枝菌根真菌的定殖可能在调节油茶病健关系中发挥着重要作用。
3 讨论
真菌是土壤生态系统的重要组成部分,是凋落物降解、养分周转循环等多种生态系统过程或功能的核心介导及驱动者[13]。本研究采用高通量测序技术对德宏州油茶5个发病等级下根系及根际土壤中的真菌进行测定,了解真菌多样性、组成及功能的差异。根系内,真菌总OTUs数、特有的OTUs 数以及丰富度指数(Chao1 指数)随病害等级的上升呈先增加后减少的变化趋势,推测是由于油茶根部防御机制被破坏,原有内生菌的结构比例失衡,使得其他的病原及腐生微生物更容易侵入,导致根系中的微生物种类逐渐增多,到病级为Ⅱ级时最多,根系腐烂程度继续加重后,腐生微生物成为优势类群,此消彼长,部分微生物类群消失,导致种类逐渐减少,因而呈现出先增加后减少的趋势。研究还发现,健康油茶根系内真菌的多样性指数(Shannon 指数)最高,不同病害等级油茶根系内真菌多样性发生了不同程度的下降,这与戴瑞卿等[14]的研究结果一致。根际土壤中,多样性指数(Shannon指数)随发病程度的加重呈逐级递减趋势,说明病害越严重,根际土壤内真菌的多样性越低,这与李婷婷等[15]的研究结果一致,病原菌的入侵能降低土壤微生物的多样性,可能是因为患根腐病油茶根际土壤中病原菌丰度增加,占据了更多的生态位,抑制了其他真菌的生存,导致真菌多样性降低;同时,土壤内患病油茶真菌群落的丰富度指数(Chao1指数)和均匀度指数(Ace指数)较健康油茶有不同程度上升,这与向立刚等[16]的研究结果一致,可能是因为患病后油茶防御能力降低,吸引了更多外界环境中的真菌侵入植株。
罗鑫等[17]在贵州7个地区油茶土壤样品中共获得634个OTUs,隶属于9门、32纲、73目、141科和213属,优势门为担子菌门和子囊菌门,与本研究结果一致。本研究发现,德宏州油茶根区内有丰富的真菌类群,根系内真菌共划分为1 019个OTUs,根际土壤内真菌共划分为1 585个OTUs。子囊菌门有大量的腐生真菌[18],油茶患病后根系内和根际土壤中子囊菌门的相对丰度增加。担子菌门在健康油茶根系及根际土壤中的相对丰度最高,该类群可与植物共生形成菌根,有利于植物生长发育[19]。本研究还发现,油茶根系内的球囊菌门和被孢霉门丰度与病害呈负相关,球囊菌门包含许多丛枝菌根(AM)真菌,AM 真菌能够与植物根系形成互惠共生体,可提高植物的抗逆性[20];被孢霉门是很多植物的内生菌,可帮助植物抵御病原的侵染,能够促进植物生长[21],它们的定殖能减轻油茶根腐病的发生。
从属水平上看,根系内,油茶患根腐病后树状孢属、暗双孢属、无柄盘菌属和黑孢盘菌属的相对丰度明显上升,成为不同病害等级下的优势菌群。研究发现,香蕉暗双孢菌(Cordana musae)会引起香蕉叶斑病的发生[22],该类群在本研究中发病严重的油茶根系内相对丰度明显增高,其对油茶的致病性需进一步研究。无柄盘菌属是植物的内生真菌,同时也是一种植物的病原菌。Kehr[23]曾报道,无柄盘菌属真菌(Pezicula cinnamomea)会导致红栎树干上发生溃疡病,因此该类群可能会引起油茶根系的腐烂。黑盘孢属会引起胡桃科和桦木科等植物的枝枯病,甚至导致植株死亡[24]。本研究发现,在根腐病严重的油茶根系中有大量该类群的存在,对于其是否为根腐病的的病原菌还需进一步研究。根际土壤中,患病油茶被孢霉属和枝鼻菌属的相对丰度升高。被孢霉属是一种分解纤维素能力极强的属,能够很好地抵抗根腐病[25]。枝鼻菌属也是一类有益真菌,可改善关键的土壤理化因子[26]。根际土壤中这类有益菌群的相对丰度在患病后升高,可能是因为油茶在受到病原菌侵染后,根系产生分泌物,招募有益菌群。研究发现,赤霉属在根系及根际土壤样品中均有分布,赤霉属为镰刀菌属(Fusarium)的有性阶段,它是油茶根腐病的主要病原,该类群的相对丰度与病害等级之间无明显规律性,可能是因为赤霉属内的病原真菌并非都是致病的病原菌,因此相对丰度的变化不一定与病害等级相关。
组间β多样性分析发现,根系样本和土壤样本中真菌群落存在差异,而根系真菌来源于土壤[27],说明根系招募土壤真菌具有选择性,这与根系分泌物或者生长发育过程相关,且健康油茶根系内真菌群落组成明显区别于其他几组患病的,说明患病会改变根系内真菌群落结构。本研究还发现,无论是根系内还是根际土壤内,相邻病害等级间的真菌群落都有相似性,说明真菌群落的变化都存在一个逐渐过渡过程。
油茶喜好酸性土壤,本研究所测土壤pH 在4.5~4.9,属于酸性土壤。植物病害发生与土壤理化特性的改变有关[28]。本研究发现,有机质和全氮随着病害等级的上升逐级升高。陈海念[29]研究发现,土壤理化因子中有机质含量高会加剧烟株青枯病的发生,与本研究结果相似。有研究指出,施用氮肥过多作物发病率会更高、病害程度会加重[30]。全钾含量随着油茶病害等级的上升逐级递减,土壤中的钾可诱导植物根系分泌相关物质来抑制病原菌的生长,从而减轻植物病害的发生[31]。本研究发现,速效钾、有机质、pH和速效磷是影响根际土壤真菌群落组成的主要因子,这与罗鑫等[17]的研究结果部分相似,说明这些土壤因子对于5个样本根际土壤真菌的群落组成和丰度起着重要作用。相关性分析发现,原隐球菌属与速效磷呈显著正相关,与pH呈显著负相关;Mycofalcell与pH和全氮呈正相关,与全钾呈正相关;毛壳菌属与pH和全磷呈正相关,暗双孢属和Echria 与速效钾呈极显著负相关,粗糙孔菌属与pH和全磷呈正相关。由此表明,针对德宏州梁河县的油茶基地,需要多施钾肥和磷肥,少施氮肥,可提高部分有益菌的相对丰度,降低病原菌的相对丰度,从而减轻油茶根腐病的发生。
FUNGuild功能预测结果显示,油茶种植基地土壤真菌功能类群中腐生营养型真菌比例最大,其次为病理-腐生营养真菌,共生营养型真菌比例排名第3,与患病油茶相比,健康油茶中共生营养型真菌比例最高。共生型营养真菌与病原菌之间存在拮抗关系,能够抑制病原的生长,从而保护寄主、减轻病原菌侵染带来的危害[32]。从功能分组上可以看出,健康油茶根系及根际土壤中丛枝菌根功能群的相对丰度比患病油茶高,说明油茶根区有丰富的丛枝菌根真菌,丛枝菌根真菌通常与植物根系建立菌根共生体,减少植物病害的发生、促进植物生长[33]。从Ⅱ级病害以后的油茶根系内植物病原功能群开始成为优势功能群,说明从这一阶段开始,有大量的病原菌对油茶根系进行了侵染导致油茶病害发生加重。综上,油茶患病后,根系和根际土壤真菌多样性下降,部分有益真菌丰度下降,植物病原菌和腐生菌增加。本研究获得的真菌群落组成、多样性特征、优势类群、环境因子以及功能特征的分析结果具有一定的实践意义,为预防植物病害及土壤真菌资源的开发利用提供了理论依据。
参 考 文 献
[1] 陈永忠,邓绍宏,陈隆升,等.油茶产业发展新论[J].南京林业大学学报(自然科学版),2020,44(1):1-10.
CHEN Y Z, DENG S H, CHEN L S, et al .. A new view on thedevelopment of oil tea Camellia industry [J]. J. Nanjing For.Univ. (Nat. Sci.),2020,44(1):1-10.
[2] 中华人民共和国国家统计局.中国统计年鉴2019[M].北京:中国统计出版社,2019:1-1017.
National Bureau of Statistics of the People’s Republic ofChina. China Statistical Yearbook 2019 [M]. Beijing: ChinaStatistics Press,2019:1-1017.
[3] 栾淑丽,任红艳,施润和,等.中国油茶种植适宜性评价及产能提升建议[J].中国农业资源与区划,2021,42(10):39-47.
LUAN S L, REN H Y, SHI R H, et al .. Evaluation on thesuitabilily of Camellia oleifera planting and suggestions forproductivity im provement in China [J]. Chin. J. Agric. Res.Reg. Plan., 2021,42(10):39-47.
[4] 范筱元,杜娟,周晓亮,等.中国油茶生产区比较优势分析与影响因素研究[J].中国油脂,2023,48(12):9-19,39.
FAN X Y, DU J, ZHOU X L, et al .. Comparative advantageanalysis and influencing factors of Camellia oleifera productionareas in China [J]. China Oils Fats, 2023,48(12):9-19,39.
[5] 沙月霞.嗜碱假单胞菌Ej2浸种对盐胁迫下水稻根系内生菌群落结构的影响[J].微生物学报,2022,62(5):1919-1935.
SHA Y X. Effects of soaking seeds with Pseudomonasalcaliphila Ej2 on endophytic community of rice roots under salt stress [J]. Acta Microbiol. Sin., 2022,62(5):1919-1935.
[6] ACOSTA-MARTINEZ V, BUROW G, ZOBECK T M, et al ..Soil microbial communities and function in alternative systemsto continuous cotton [J]. Soil Sci. Soc. Am. J., 2010,74(4):1181-1192.
[7] 郭璞,邢鹏杰,宋佳,等.蒙古栎根系与根区土壤真菌群落组成及与环境因子的关系[J].菌物研究,2022,20(3):173-182.
GUO P, XING P J, SONG J, et al .. Fungal community in rootsand the root zone of Quercus mongolica and the correlationswith the environmental factors [J]. J. Fungal Res., 2022,20(3):173-182.
[8] POWELL J R, RILLIG M C. Biodiversity of arbuscularmycorrhizal fungi and ecosystem function [J]. New Phytol.,2018, 220(4):1059-1075.
[9] 方中达.植病研究方法[M]. 北京:中国农业出版社,1988: 8-10.
[10] 崔明秦,张东华,闫晓慧,等.油茶炭疽菌侵染对油茶叶片内生细菌群落结构的影响[J].中国生物防治学报,2022,38(4):911-919.
CUI M Q, ZHANG D H, YAN X H, et al .. Effects ofColletotrichum sp. infection on encdophytic bacterialcommunity in leaves of Camellia oleifera [J]. Chin. J. Biol.Control, 2022,38(4):911-919.
[11] 杨娅琳,吴峰婧琳,陈健鑫,等.油茶根腐病与丛枝菌根真菌群落的相关性分析[J].西南农业学报,2023,36(11):2426-2436.
YANG Y L,WU F J L,CHEN J X, et al..Correlation betweenroot rot of Camellia oleifera and arbuscular mycorrhizal fungi[J]. Southwest China J. Agric. Sci., 2023,36(11):2426-2436.
[12] 张健,徐明,陈进,等.黔中不同地区马尾松林土壤真菌群落分布特征[J].东北林业大学学报,2022,50(10):84-89.
ZHANG J, XU M, CHEN J, et al .. Distribution characteristicsof soil fungal community in Pinus massoniana forest amongdifferent areas in the central Guizhou [J]. J. Northeast For.Univ. , 2022,50(10):84-89.
[13] YAO F, YANG S, WANG Z R, et al .. Microbial taxadistribution is associated with ecological trophic cascadesalong an elevation gradient [J/OL]. Front. Microbiol.,2017,8:2071 [2022-10-18]. https://doi.org/10.3389/fmicb.2017.02071.
[14] 戴瑞卿,赖宝春,曾天宝,等.健康与患根腐病草莓根际、非根际与根内真菌群落多样性研究[J]. 现代农业科技,2021(24):29-33,39.
DAI R Q, LAI B C, ZENG T B, et al .. Fungal communitydiversity in rhizosphere, non-rhizosphere and root tissue ofhealthy and root rot strawberry [J]. Mod. Agric. Sci. Technol.,2021(24):29-33,39.
[15] 李婷婷,邓旭辉,李若尘,等.番茄青枯病发生对土壤真菌群落多样性的影响[J].生物技术通报,2022,38(10):195-203.
LI T T, DENG X H, LI R C, et al .. Effects of Ralstoniasolanacearum infection on soil fungal community diversity [J].Biotechnol. Bull., 2022,38(10):195-203.
[16] 向立刚,郭华,周浩,等.健康与感染青枯病烟株根际土壤与茎秆真菌群落结构与多样性[J].植物保护,2020,46(1):189-196,228.
XIANG L G, GUO H, ZHOU H, et al .. Fungal communitystructure and diversity of the rhizosphere soil and stems ofhealthy and diseased tobacco plants infected with bacterial wilt [J].Plant Prot.,2020,46(1):189-196,228.
[17] 罗鑫,吴跃开,张念念,等.油茶根际土壤真菌群落组成及多样性分析[J].中国农业科技导报,2023,25(2):199-210.
LUO X, WU Y K, ZHANG N N, et al .. Composition anddiversity of fungal community in rhizosphere soil of Camelliaoleifera [J]. J. Agric. Sci. Technol., 2023,25(2):199-210.
[18] 邓娇娇, 周永斌, 殷有, 等. 辽东山区两种针叶人工林土壤真菌群落结构特征[J]. 北京林业大学学报, 2019, 41(9):130-138.
DENG J J, ZHOU Y B, YIN Y, et al .. Characteristics of soilfungal community structure at two coniferous plantations inmountainous region of eastern Liaoning province, northeasternChina [J]. J. Beijing For. Univ., 2019, 41(9): 130-138.
[19] MIGUEL R M, JOSE G M V, MEIKE P. Diversity of fungi insoils with different degrees of degradation in Germany andPanama [J]. Mycobiology, 2020, 48(1):20-28.
[20] NADIMI M, BEAUDET D, FORGET L, et al .. GroupⅠintronmediatedtrans-splicing in mitochondria of Gigaspora rosea anda robust phylogenetic affiliation of arbuscular mycorrhizal fungiwith Mortierellales [J]. Mol. Biol. Evol.,2012,29:2199-2210.
[21] 宁琪,陈林,李芳,等.被孢霉对土壤养分有效性和秸秆降解的影响[J].土壤学报,2022,59(1):206-217.
NING Q, CHEN L, LI F, et al .. Effects of Mortierella onnutrient availability and straw decomposition in soil [J]. ActaPedol. Sin., 2022,59(1):206-217.
[22] 林善海,黄思良,岑贞陆,等.香蕉真菌性叶斑病病原种群结构季节性变化研究[J]. 南方农业学报,2011,42(10):1212-1216.
LIN S H, HUANG S L, CEN Z L, et al .. Seasonal variation inpopulation structure of banana mycotic leaf spot pathogen [J].J. Southern Agric., 2011,42(10):1212-1216.
[23] KEHR R D. Pezicula canker of Quercus rubra L. caused byPezicula cinnamomea (DC.) Sacc. I. symptoms and pathogenesis [J].Eur. J. For. Path.,1991,21(4),218-233.
[24] 杜卓. 中国广义黑盘孢属的分类和系统学研究[D].北京:北京林业大学,2018.
DU Z. Phylogeny and taxonomy of Melanconium sensu lato inChina [D]. Beijing: Beijing Forestry University, 2018.
[25] 乔沙沙,周永娜,柴宝峰,等.关帝山森林土壤真菌群落结构与遗传多样性特征[J].环境科学,2017,38(6):2502-2512.
QIAO S S, ZHOU Y N, CHAI B F, et al .. Characteristics offungi community structure and genetic diversity of forests inGuandi mountains [J]. Environ. Sci., 2017,38(6):2502-2512.
[26] 乔策策. 木霉生物有机肥提升作物产量的微生物生态学机理研究[D].南京: 南京农业大学, 2019.
QIAO C C. Microbial ecological mechanism of bio-organicfertilizer of Mycobacterium xylinum to enhance crop yield [D].Nanjing: Nanjing Agricultural University,2019.
[27] BAI B, LIU W D, QIU X Y, et al .. The root microbiome:community assembly and its contributions to plant fitness [J]. J.Integr. Plant Biol., 2022,64(2):230-243.
[28] 孙战,王圣洁,杨锦昌,等.木麻黄根区土壤理化特性及酶活性与青枯病发生关联分析[J].生态环境学报,2022,31(1):70-78.
SUN Z, WANG S J, YANG J C, et al ..Correlation analysis ofthe occurrence of bacterial wilt and physicochemical propertiesand enzyme activity of root-zone soil of Casuarina spp. [J].Ecol. Environ., 2022,31(1): 70-78.
[29] 陈海念. 植烟土壤土传病害区土壤微生物生态特征变化及其影响因素分析[D]. 贵阳:贵州大学,2020.
CHEN H N.The changes of micro bial community in tobaccosoil infected with soil-borne disease and its influenecingfactors [D]. Guiyang: Guizhou University,2020.
[30] 段旺军,杨铁钊,戴亚,等.植物氮素营养与病害发生关系研究进展[J].西北植物学报,2011,31(10):2139-2146.
DUAN W J, YANG T Z, DAI Y, et al .. Advances in therelationships between nitrogen nutrition and diseasedevelopment in plant species [J]. Acta Bot. Bor-Occid. Sin.,2011,31(10):2139-2146.
[31] 方宇,白涛,刘冬梅,等.烟草黑胫病植株根际土壤真菌群落多样性及结构分析[J].西南农业学报,2022,35(4):822-830.
FANG Y, BAI T, LIU D M, et al .. Diversity and structure of thefungal community in rhizosphere soil of tobacco plants withblack shank disease [J]. Southwest China J. Agric. Sci., 2022,35(4): 822-830.
[32] FREW A, POWELL J R, GLAUSER G, et al .. Mycorrhizalfungi enhance nutrient uptake but disarm defences in plantroots, promoting plant-parasitic nematode populations [J]. SoilBiol. Biochem., 2018, 126: 123-132
[33] 黄咏明,蒋迎春,王志静,等.丛枝菌根真菌对植物根腐病的抑制效应及其机制[J].应用生态学报,2021,32(5):1890-1902.
HUANG Y M, JIANG Y C, WANG Z J, et al .. The suppressioneffect and mechanism of arbuscular mycorrhizal fungi againstplant root rot [J]. J. Appl. Ecol.,2021,32(5):1890-1902.
基金项目:国家重点研发计划项目(2019YFD1002002);国家自然科学基金项目(31860208)。

