SMAD2、SMAD3 和SMAD4 基因在小尾寒羊卵巢活动中的功能分析

摘要:为探究SMAD 基因家族重要成员SMAD2、SMAD3 和SMAD4 基因在小尾寒羊繁殖活动中的生物学功能,利用生物信息学技术对SMAD2、SMAD3 和SMAD4 基因的蛋白理化性质、亲疏水性和亚细胞定位进行分析,并对其二级结构、蛋白互作进行预测及GO(gene ontology)和KEGG(kyoto encyclopedia of genes and genomes)的富集分析;然后以小尾寒羊为研究对象,通过免疫组织化学染色(immunohistochemistry,IHC)确定SMAD2、SMAD3和SMAD4蛋白在卵巢组织中的表达,利用实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)和蛋白免疫印迹(western blot,WB)方法测定SMAD2、SMAD3 和SMAD4 基因mRNA及其编码蛋白在不同生理阶段卵巢组织和不同直径卵泡中表达水平。结果显示,SMAD2、SMAD3和SMAD4蛋白为亲水性蛋白,理论等电点分别为6.67、6.73和6.50,在不同生理阶段卵巢组织中的阳性表达主要位于卵母细胞、卵泡膜细胞和颗粒细胞,且二级结构中α螺旋和无规则卷曲的占比较高,其蛋白与FOXH1、ACVR1B、SMAD1、TGFβR1、TGFβR2、ZFYVE9、SKI、SKIL、TGIF1 和ENSOARP0000001869 蛋白存在互作关系。SMAD2、SMAD3 和SMAD4 基因在TGF-β受体信号通路、TGF-β受体结合、TGF-β激活受体活性中发挥生物学功能,且在TGF-β信号通路富集。SMAD2和SMAD4蛋白在撤栓后42 h卵巢组织中的表达量显著高于撤栓后18 h,其mRNA表达趋势及其编码蛋白表达趋势总体一致;而SMAD3 基因mRNA及其编码蛋白的表达量在不同生理阶段卵巢组织中差异不显著。SMAD3 基因mRNA及其编码蛋白在中卵泡中的表达量显著高于大卵泡;SMAD2 和SMAD4 基因表达量在不同直径卵泡中差异不显著。综上所述,SMAD2、SMAD3 和SMAD4 基因在小尾寒羊卵巢周期性活动中的生物学功能存在差异,SMAD2 和SMAD4 基因参与小尾寒羊发情初期至排卵前的卵巢生理变化,但不参与卵泡发育;而SMAD3 参与卵泡发育。以上研究结果为进一步探索SMAD 基因家族在小尾寒羊卵巢活动中的分子机理提供理论参考。
关键词:小尾寒羊;卵巢;卵泡;SMAD2;SMAD3;SMAD4
doi:10.13304/j.nykjdb.2022.1118
中图分类号:S826;Q786 文献标志码:A 文章编号:1008‑0864(2024)07‑0069‑11
小尾寒羊是中国乃至世界闻名的肉裘兼用型绵羊品种,具有早熟、多羔、生长快、体格大、产肉多、裘皮好、遗传性稳定及适应性强等优点,被国家认定为名畜良种,从而引起了国内外养羊业的广泛关注,其最早分布于河北、河南、山东、安徽和江苏,现已推广至全国近20 个省(自治区、直辖市),在养羊业生产中呈现出迅猛发展势头[1]。绵羊繁殖力受遗传背景、饲养条件、营养水平等多种因素的调控,其中排卵数对母羊的产羔数具有直接影响,同时排卵数和产羔数也是衡量母羊繁殖力最重要的2个指标[2]。卵巢作为雌性哺乳动物性腺,具有产生卵子、分泌雌激素和孕酮的功能,决定着雌性的第二性征。卵泡是卵巢基本功能单位,分布于卵巢皮质部,由卵母细胞(oocyte)、颗粒细胞(granular cells,GCs)和卵泡膜细胞(thecalcells,TCs)组成,为卵母细胞的发育和成熟提供微环境,不同大小代表不同发育阶段。因此,研究小尾寒羊卵巢中卵泡的生长发育过程有助于挖掘小尾寒羊高繁殖力性状的遗传机制,为其他绵羊品种提供理论参考。
1995 年,Sekelsky 等[3]在果蝇中首次鉴定出SMAD蛋白家族。SMAD蛋白可以分为3类,受体调节的SMAD 蛋白(R-SMAD)、公共SMAD 蛋白(CoSMAD、SMAD4) 和抑制性SMAD 蛋白(SMAD6/7)。R-SMAD 蛋白中包含SMAD2/3,其作为TGF-β/SMAD 信号途径中的核转录调控因子,磷酸化能够促进TGF- β 信号传递[4‑5];公共SMAD 蛋白中的SMAD4 作为TGF-β 信号传导中的中心介质,不仅可以与SMAD3发挥协同作用,还可以与SMAD2发挥协同作用以介导TGF-β信号传导[6‑7]。有关SMAD2、SMAD3 和SMAD4 基因在不同品种、不同组织及不同细胞类型中的生物学功能报道较多。廖火城等[8]发现,敲低SMAD2基因表达与过表达SMAD7 基因能降低大鼠心肌纤维化。Liu等[9]发现,过表达SMAD3 基因可调控肌生长抑制素(myostatin,MSTN),从而抑制绵羊成肌细胞肌源性分化。张秉芬等[10]发现,抑制TGF-β/SMAD3信号通路激活会对大鼠肺纤维化产生保护作用。范李静等[11]发现,下调SMAD4 基因表达会抑制TGF-β1诱导的人子宫内膜间质细胞(human endometrial stromal cell,hESC)增殖和纤维化。此外,关于SMAD2、SMAD3 和SMAD4 基因与生殖活动相关的研究报道也越来越多。在TGF-β/SMAD 信号通路中,SMAD 作为下游信号分子通过自分泌/旁分泌途径发出信号,调控颗粒细胞增殖和卵母细胞生长,影响着卵巢发育[12];SMAD 信号分子还可以调节雄激素和雌激素的形成,从而介导 BMP4 的作用[13]。2000 年,在人卵母细胞中也检测到SMAD2 和SMAD3 基因的表达[14]。在牛早期胚胎发生过程中SMAD3 基因是关键影响基因,并且卵泡抑素(follistatin,FS)要依赖于SMAD2/3信号共同转导,才能够发挥出特异性促胚胎发育的作用[15]。Gueripel等[16]研究显示,促卵泡素(follicle-stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH)能够增加TGF-BMP 通路相关基因表达量,其中SMAD4 基因起桥梁作用。Pangas 等[17]在小鼠卵巢中发现,干扰SMAD4 基因会破坏卵巢颗粒细胞中的信号传导,导致颗粒细胞过早黄体化,最终导致卵巢过早衰竭,繁殖力降低,从而出现产仔数显著减少和超排后卵子数量减少的现象;被活化的SMAD2蛋白也可作为底物,与SMAD4形成聚合体,进而转入细胞核,启动基因转录,调节目的基因表达,促进小型有腔卵泡的早熟,促进卵泡的释放[18]。综上所述,SMAD 基因家族参与哺乳动物繁殖活动,特别是在雌性动物繁殖活动中的生物学功能仍然是目前研究的热点;然而有关SMAD 基因在小尾寒羊卵巢周期性活动中的研究报道还较少。
基于以上研究背景,本研究欲利用生物信息学分析SMAD2、SMAD3和SMAD4蛋白,然后采集同期发情后的雌性小尾寒羊不同生理阶段的卵巢组织,通过免疫组织化学确定SMAD2/3/4蛋白在卵巢组织中的阳性表达,并利用RT-qPCR 和Western blot 方法测定SMAD2、SMAD3 和SMAD4基因及其编码蛋白在小尾寒羊卵巢组织中的表达水平;同时在屠宰场随机采集小尾寒羊卵巢,分离出不同直径的卵泡,利用相同方法测定SMAD2、SMAD3 和SMAD4 基因在不同发育阶段卵泡中的表达水平,初探SMAD2、SMAD3和SMAD4 基因在小尾寒羊卵巢周期性活动中的生物学功能,挖掘小尾寒羊高繁殖力潜在的遗传机理,为深入研究SMAD 基因家族在小尾寒羊繁殖活动中的调控机理提供理论参考。
1 材料与方法
1.1 试验羊只处理及样品采集
1.1.1 试验羊只的处理及卵巢样品的采集
试验羊只来自甘肃省临夏市兴华牧业养殖场,选取饲养和管理条件一致,2~3岁健康纯种雌性小尾寒羊8只,在其阴道放置孕酮阴道栓(300 mg孕酮,新西兰Bioniche Animal Health Pty 公司)处理12 d,实施同期发情。在孕酮栓塞撤除后的18和42 h各屠宰4只母羊,解剖分离出两侧卵巢,然后用磷酸盐缓冲盐水(phosphate buffer saline,PBS)冲洗。将分离出的左侧卵巢放置于冻存管投于液氮中冷冻保存,右侧卵巢放置于4%多聚甲醛溶液中,用于后续试验。
1.1.2 卵泡样品的采集
在临夏市康泰屠宰场采集小尾寒羊母羊卵巢,使用剪刀、镊子等器械分离出卵泡,用游标卡尺测量卵泡直径。参考Jing等[19] 方法,将获得的卵泡分为小卵泡(直径≤2 mm)、中卵泡(3.5 mm≤直径≤4.5 mm)和大卵泡(直径≥6 mm)。将测量后的卵泡置于冻存管于液氮中冷冻保存,用于后续试验。
1.2 试验方法
1.2.1 生物信息学分析
从NCBI 网站GenBank数据库获取SMAD2(XP_027816688.1)、SMAD3(XP_042108005.1)和SMAD4(XP_027816484)的蛋白序列。利用ExPASy-ProtParam tool在线工具对编码的蛋白质进行理化性质分析;利用ProtScale在线工具分析SMAD 蛋白的亲疏水性;参考Chou等[20]的方法进行亚细胞定位分析;通过在线网站SOPMA预测SMAD蛋白的二级结构;最后,利用在线网站STRING预测SMAD蛋白的互作及GO(gene ontology)和KEGG(kyoto encyclopediaof genes and genomes)富集分析。
1.2.2 免疫印迹(western blot)分析
用RIPA 组织裂解液(G2002,Servicebio)提取卵巢组织和卵泡的蛋白,根据BCA蛋白定量试剂盒(PC0020,索莱宝)进行蛋白定量。用30 μL 5×上样缓冲液(G2013,Servicebio)与120 μL 蛋白样本混合于200 μL的离心管中,于PCR仪上98 ℃煮沸5 min后,迅速插入冰上,冰浴5 min;重复3 次,置于−80 ℃备用。于−80 ℃中取出变性蛋白样品,于PCR 仪上95 ℃变性3 min,每孔上样30 μg,以GAPDH(YM3215,ImmunoWay)为内参,12%的十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecylsulfate polyacryl-amide gelelectrophoresis,SDS-PAG)进行电泳,转膜。转膜后,取PVDF膜(RVH00010,Millipore)置于用脱脂奶粉(D8340,索莱宝公司)配置的5% 脱脂奶封闭液中,室温摇1.5 h;将PVDF膜按照目的蛋白所处位置裁成长条,分别将其置于用5%脱脂奶封闭液配置的一抗稀释液中,4 ℃慢摇,孵育过夜。用1×TBS和0.1% Tween-20(T8220,索莱宝公司)配置TBST洗膜,室温5×6 min 摇洗。加入山羊抗IgG(1∶6000)(RS0002,ImmunoWay),室温1 h;TBST 洗膜,室温5×6 min摇洗。用 ECL 发光液(G2020-2,Servicebio)显影曝光,并观察试验结果。
1.2.3 总RNA提取及cDNA合成
将卵巢组织和卵泡在RNA isolater里匀浆或在液氮里研碎,按照RNA isolater Total RNA Extraction Reagent 试剂盒(R401-01,诺唯赞)使用说明提取卵巢组织和卵泡的总RNA。
使用Evo M-MLV RT Mix Kit with gDNAClean for qPCR试剂盒(AG11728,艾科瑞)去除卵巢组织和卵泡总RNA 中的DNA 后,反转录合成cDNA,具体操作步骤参照试剂盒使用说明书。获得的cDNA产物于−80 ℃保存备用。
1.2.4 引物设计与合成
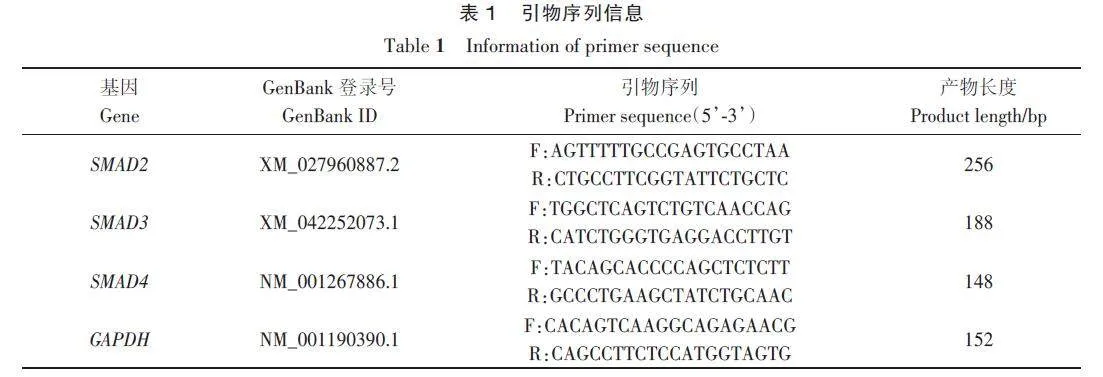
从GenBank数据库中检索绵羊SMAD2(XM_027960887.2)、SMAD3(XM_042252073.1)、SMAD4 基因(NM_001267886.1)和内参GAPDH 基因(NM_001190390.1)的mRNA序列,利用Primer Premier 3.0 软件设计引物(表1),并进行BLAST检测后,将引物序列信息发送至杨凌天润奥科生物科技有限公司进行引物合成。
1.2.5 实时荧光定量 PCR(RT-qPCR)技术
采用实时荧光定量PCR 仪(Thermo Fisher,USA)检测卵巢组织和卵泡中SMAD2/3/4 mRNA的表达水平,以GAPDH 为内参。PCR 体系包括10 μL 2×SYBR® Green PremixPro Taq HS qPCR Kit(AG11720,艾科瑞),上、下游引物各0.4 μL,7.2 μLddH2O,2 μL cDNA, 3次重复。PCR程序为95 ℃3 min;95 ℃ 10 s,60 ℃ 30s,72 ℃ 30 s, 40 个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。按照梁维炜等[21]方法对RT-qPCR结果进行计算。
1.3 数据分析
使用Image J 软件统计Western blot 结果,使用GraphPad Prism8.0软件对数据进行独立样本t检验和单因素方差分析。
2 结果与分析
2.1 SMAD2、SMAD3 和SMAD4 蛋白的理化性质
ExPASy-ProtParam tool 在线工具分析发现,SMAD2、SMAD3 和SMAD4 蛋白分子式分别为C2 168H3 368N602O649S22、C2 133H3 298N594O626S25和C2 675 H4 140-N764O802S23,原子总数为6 809、6 676和8 404,氨基酸数量为437、425和553,蛋白的相对分子质量为48 955.56、48 080.75 和60 572.32 kDa,理论等电点为6.67、6.73 和6.50,脂肪族指数为75.58、74.52 和76.06,平均亲水性指数为− 0.437、−0.447 和−0.389,不稳定指数(Ⅱ)为54.84、53.26和50.95。
2.2 SMAD2、SMAD3 和SMAD4 蛋白的亲疏水性
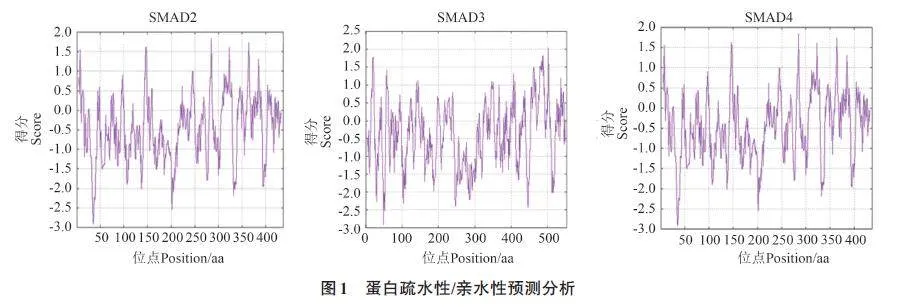
由图1可知,高峰值(正值)区域表示疏水,而负值的“ 低谷”区域为亲水区域,总体来看,SMAD2、SMAD3 和SMAD4 蛋白的亲水性氨基酸明显多于疏水性氨基酸,均属于亲水性蛋白。
2.3 SMAD2、SMAD3 和SMAD4 蛋白的亚细胞定位
亚细胞定位分析发现,SMAD2蛋白主要分布在细胞膜和细胞核;MAD3蛋白主要分布在细胞膜、细胞质和细胞核;SMAD4蛋白主要分布在细胞质和细胞核。
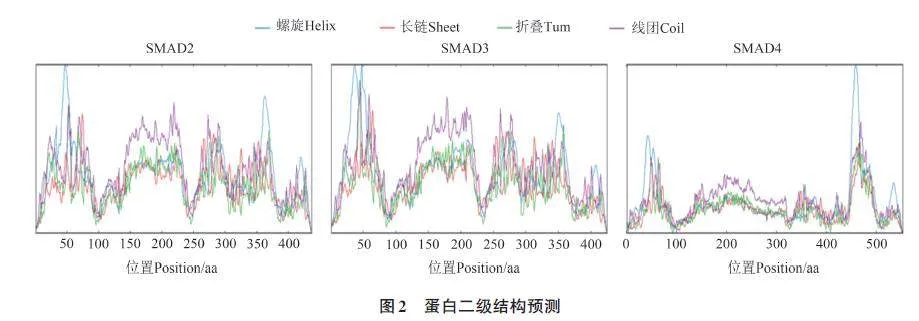
2.4 SMAD2、SMAD3 和SMAD4 蛋白的二级结构
通过在线网站SOPMA 对SMAD2、SMAD3和SMAD4蛋白的二级结构进行预测,结果(图2)表明,SMAD2、SMAD3 和SMAD4 蛋白中α 螺旋(alpha helix)的占比分别为24.03%、23.53% 和24.41%,有105、100 和135 个氨基酸;延伸链(extended strand)的占比分别为16.93%、18.12%和15.55%,有74、77和86个氨基酸;β-折叠结构(beta turn) 的占比分别为3.89%、3.76%和6.69%,有17、16和37个氨基酸;无规线团(random coil)的占比分别为55.15%、54.59%和53.35%,有241、232和295个氨基酸。
2.5 SMAD2、SMAD3 和SMAD4 蛋白互作的GO 和KEGG 富集分析
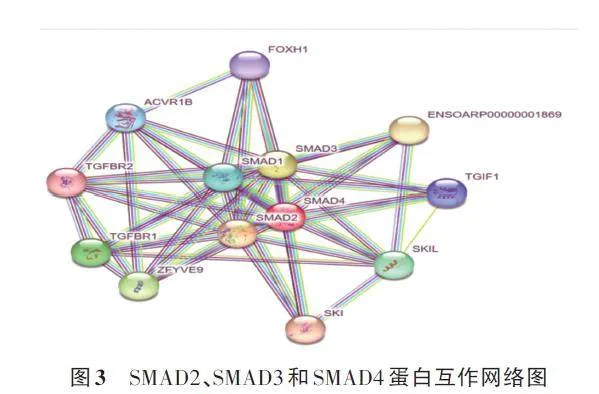
由图3可知,与 SMAD2、SMAD3和SMAD4蛋白互作的蛋白共有10个(FOXH1、ACVR1B、SMAD1、TGFβR1、TGFβR2、ZFYVE9、SKI、SKIL、TGIF1、ENSOARP0000001869),存在52条互作关系。
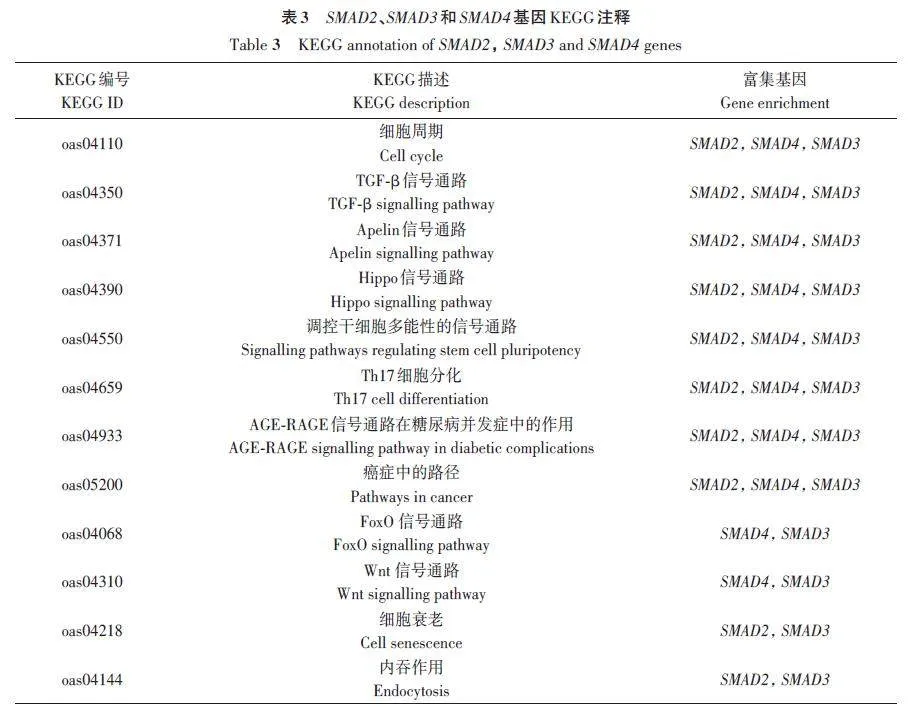
SMAD2、SMAD3 和SMAD4 基因的GO 的功能条目主要有TGF-β受体信号通路(GO∶0007179)、TGF-β受体结合(GO∶0005160)、TGF-β激活受体活性(GO∶0005024)(表2),在KEGG富集分析发现SMAD2、SMAD3 和SMAD4 基因主要富集于TGF-β信号通路、Apelin信号通路、Hippo信号通路等信号通路(表3)。这些都可能与卵巢发育有关。
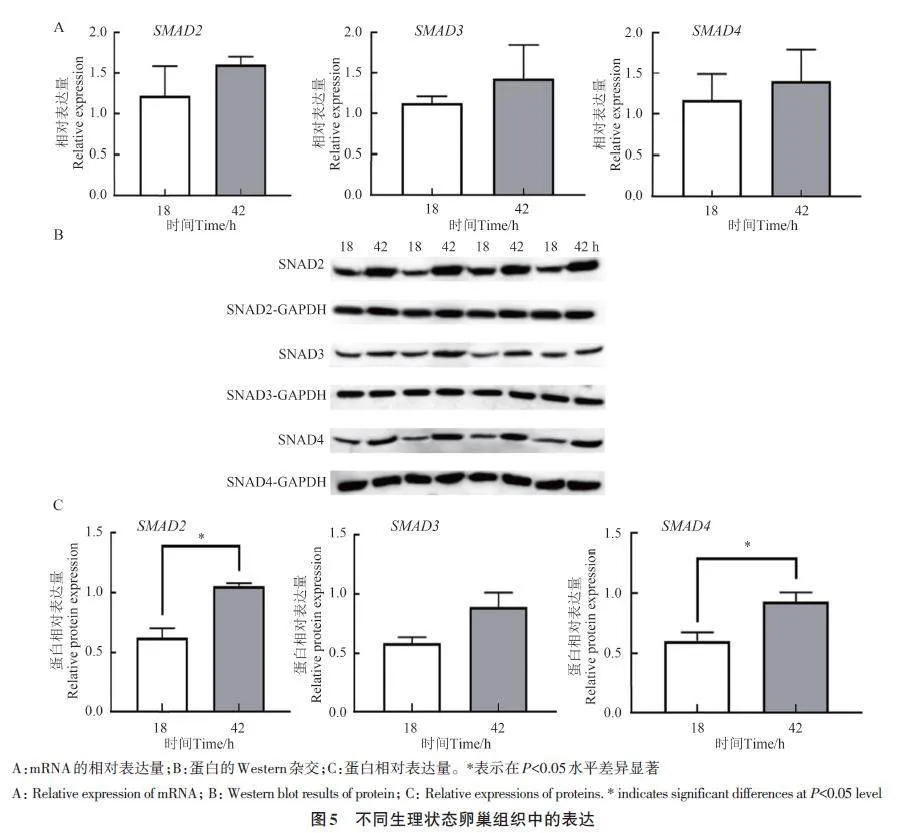
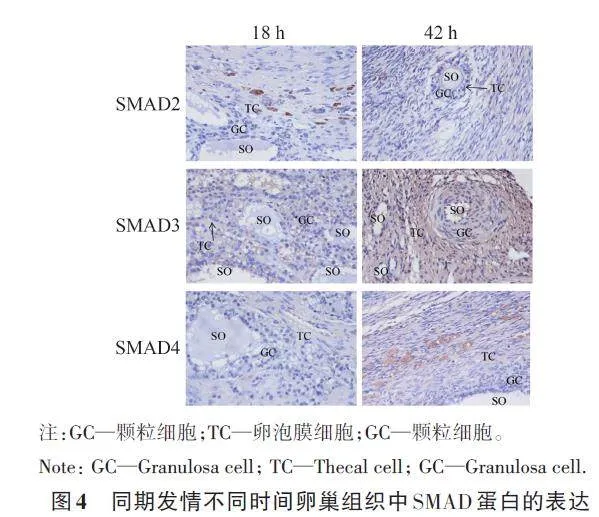
2.6 SMAD2、SMAD3 和SMAD4 蛋白在不同生理状态卵巢组织中的阳性表达
免疫组织化学试验结果如图4 所示。SMAD2、SMAD3和SMAD4蛋白在撤栓后18和42 h的卵巢组织中均有阳性表达;且主要位于卵母细胞、卵泡膜细胞、颗粒细胞。
2.7 SMAD2、SMAD3 和SMAD4 基因在不同生理状态卵巢组织中的表达
采用RT-qPCR 和Western blot技术检测撤栓后18 和42 h 的卵巢组织中SMAD2、SMAD3 和SMAD4 基因mRNA及其编码蛋白表达水平,结果(图5)表明,在撤栓后18和42 h的卵巢组织中均能检测到SMAD2、SMAD3 和SMAD4 基因与蛋白的表达,且在撤栓后42 h卵巢组织中mRNA及其编码蛋白的表达量均高于18 h,其中,SMAD2 和SMAD4蛋白在撤栓后42 h卵巢组织中的表达量显著高于18 h,而mRNA表达差异不显著;SMAD3基因及其编码蛋白在撤栓后18和42 h间差异均不显著。
2.8 SMAD2、SMAD3 和SMAD4 基因在不同直径卵泡中的表达
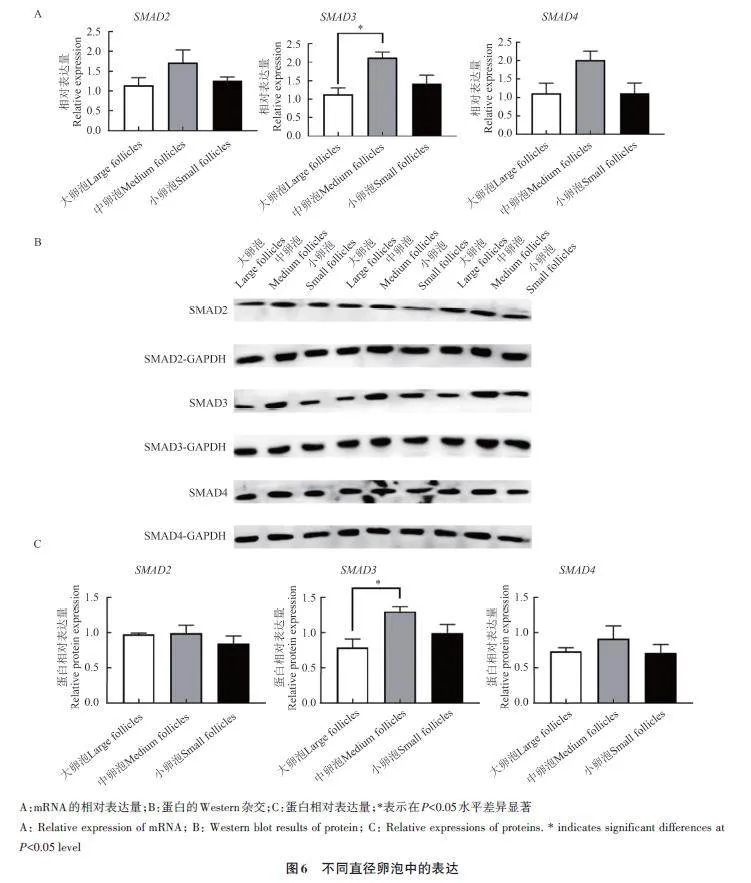
采用RT-qPCR 和Western blot技术检测不同直径卵泡中SMAD2、SMAD3 和SMAD4 基因mRNA及其编码蛋白的表达水平,结果(图6)表明,SMAD2、SMAD3 和SMAD4 基因及其蛋白在大、中、小卵泡中均表达。其中SMAD3 基因mRNA 及其编码蛋白在中卵泡的表达量显著高于大卵泡,然而大卵泡与小卵泡、中卵泡与小卵泡间差异不显著。SMAD2 和SMAD4 基因及其蛋白在不同直径卵泡中表达量差异均不显著。
3 讨论
TGF-β超家族信号通路对卵泡发育、卵母细胞生长以及颗粒细胞增殖发挥重要作用。SMAD2、SMAD3 和SMAD4 基因是SMAD 基因家族参与哺乳动物TGF-β信号传导的重要成员,但其在绵羊卵巢周期性活动中的生物学功能尚不明确。本研究利用生物信息分析发现,SMAD2、SMAD3 和SMAD4 蛋白均为亲水性蛋白,理论等电点为6.67、6.73和6.50,可以与某些带有电荷的基团结合,从而发挥其生物学功能;亚细胞定位分析显示,SMAD2、SMAD3 和SMAD4 蛋白在细胞膜、细胞质和细胞核中发挥生物学作用,且二级结构中α螺旋和无规卷曲的占比较高;与FOXH1、ACVR1B、SMAD1、TGFβR1、TGFβR2、ZFYVE9、SKI、SKIL、TGIF1和ENSOARP0000001869蛋白存在52条互作关系;GO分析表明,SMAD2、SMAD3和SMAD4 基因在TGF-β受体信号通路、TGF-β受体结合、TGF-β激活受体活性中发挥生物学功能,KEGG 富集分析发现,SMAD2、SMAD3 和SMAD4基因在TGF-β信号通路富集,而TGF-β信号通路在卵巢中发挥着重要作用,因此,推测SMAD2、SMAD3 和SMAD4 基因与卵巢的周期性变化有关。
汤继顺[22]研究表明,实施同期发情后的小尾寒羊在撤栓后18 h开始发情,在36 h时发情率达到90%以上,在48 h时发情率达到100%;撤栓后48~52 h 卵母细胞排出。为了进一步验证SMAD2、SMAD3 和SMAD4 基因在卵巢中的功能,本研究分别采集撤栓后18和42 h的卵巢组织,采用免疫组织化学法发现,在卵母细胞、卵泡膜细胞、颗粒细胞中均有SMAD2、SMAD3和SMAD4蛋白的阳性表达;RT-qPCR和WB也检测到SMAD2、SMAD3 和SMAD4 基因mRNA及其编码蛋白在卵巢组织中表达,且SMAD2、SMAD3 和SMAD4 基因mRNA及其编码蛋白在42 h卵巢中的表达量高于18 h,其中SMAD2 和SMAD4 蛋白表达量差异显著。盖玉强等[23]研究表明,敖汉细毛羊在发情期中SMAD4 基因mRNA表达量显著高于发情前期;He等[24]研究发现,SMAD2 基因在黄鳗卵巢发育过程中表达,且表达量持续增加,在卵黄形成早期达到峰值;苗竹林等[25]发现,随着大鼠卵巢的发育,SMAD4 基因的表达量也逐渐增加;与本研究结果一致,即SMAD2 和SMAD4 基因参与小尾寒羊发情初期至排卵这一过程中卵巢的生理变化。
雌性绵羊的卵母细胞进入减数分裂后一直被阻断在第一次减数分裂前期的双线期,直到发情时,才在垂体促性腺激素的调节下重新恢复减数分裂。与此同时,卵巢上的卵泡快速发育,随着卵泡的不断增大,雌激素分泌增多,从而引起性欲;在此期间,只有少数卵泡会变成优势卵泡破裂排卵,大多数卵泡会发生闭锁;排卵后雌激素显著减少,孕酮(progesterone,P4)快速增加,导致停止发情[26]。郑健[27]研究发现,在湖羊垂体上调控SMAD2基因表达能够影响垂体细胞的激素分泌,调节卵巢卵泡发生和排卵。李碧筠等[28]发现,抑制山羊卵巢中SMAD2 基因表达,会抑制TGF-β/SMAD信号通路的传导,从而抑制雌二醇(estradiol,E2)分泌,促进孕酮的合成。Nomura等[29]发现,在人卵巢中SMAD2 基因可通过调控CYP19A1的表达,影响雌激素分泌。Yu等[30]在小鼠中研究发现,SMAD4 基因是LH刺激ERK1/2激活和排卵相关基因表达所必需的,敲除SMAD4基因会阻断LH诱导的卵丘扩张和卵泡破裂,还会降低Nppc 和Npr2 的表达,使其维持卵母细胞减数分裂停滞的作用减弱。绝经过渡期大鼠卵巢功能衰退与SMAD2基因表达下调密切相关,颗粒细胞中SMAD4 基因的表达下调也是其部分原因[31‑32]。基于以上研究,推测SMAD2和SMAD4 基因能够通过调控雌激素、孕激素分泌和阻断LH的诱导作用来调控小尾寒羊发情初期至排卵前卵巢的生理变化。卵泡的发育及卵母细胞的成熟和排卵是雌性动物发情周期的关键。伴随着动物发情,卵巢中的卵泡也不断发育至成熟,SMAD2 和SMAD4 基因是否能够参与卵泡发育的优势化过程,还需进一步验证。
分离并采集不同直径的卵泡,检测大、中、小卵泡中SMAD2、SMAD3 和SMAD4 基因mRNA及其编码蛋白的表达水平,结果发现,SMAD3 基因mRNA及其编码蛋白在中卵泡中的表达量显著高于大卵泡,在大卵泡与小卵泡、中卵泡与小卵泡间无显著差异;SMAD2 和SMAD4 基因mRNA及其编码蛋白在不同直径的卵泡中的表达量均无显著差异。综上所述,SMAD2 和SMAD4 基因参与小尾寒羊发情过程中卵巢的生理变化,但不参与卵泡发育;而SMAD3 基因参与卵泡发育。研究表明,SMAD3 基因是合成卵泡刺激素(follicle-stimulatinghormone,FSH)的必需基因[33]。Li 等[34] 发现,SMAD3 基因在大鼠不同阶段卵泡中差异表达,过表达SMAD3 基因会促进雌激素的产生和增殖,抑制颗粒细胞的凋亡,调节卵泡的发育与闭锁。Gry等[35]发现,人SMAD3 基因在卵泡生长开始就参与了卵泡发育。Li等[36]发现,敲除SMAD3 基因会导致雌鼠的卵泡发育受阻,最终导致卵泡闭锁、生殖能力显著下降。Zhou 等[37] 发现,内含子microRNAlet-7可降低猪卵巢颗粒细胞中SMAD3蛋白磷酸化水平来促进颗粒细胞凋亡和卵泡闭锁。本研究结果也表明,SMAD3 基因在卵泡发育过程中起重要调控作用;然而该基因是否能够通过调控小尾寒羊卵巢颗粒细胞增殖或凋亡来影响卵泡发育,还需要进一步研究。综上所述,SMAD2、SMAD3 和SMAD4 基因在小尾寒羊卵巢周期性活动中的生物学功能存在差异,SMAD2 和SMAD4 基因参与小尾寒羊发情初期至排卵前的卵巢生理变化,但不参与卵泡发育; SMAD3 基因参与卵泡发育。
参考文献
[1] 国家畜禽遗传资源委员会.中国畜禽遗传资源志:羊志[M].北京:中国农业出版社,2011.
[2] JUENGEL J L, FRENCH M C, QUIRKE L D, et al ..Reproduction differential expression of cart in ewes with differingovulation rates [J]. Soc. Study Fert., 2017, 153(4):471-479.
[3] SEKELSKY J J, NEWFELD S J, RAFTERY L A, et al ..Genetic characterization and cloning of mothers against dpp, agene required for decapentaplegic function in Drosophilamelanogaster [J/OL]. Genetics, 1995, 139(3): 1347 [2022-11-20]. https://doi.org/10.1007/BF01435010.
[4] 严晓华,章隽宇,陈晔光.抑制性Smad蛋白对TGF-β超家族信号转导的调控及其生理意义[J].细胞生物学杂志,2009,31(2):4-13.
YAN X H, ZHANG J Y, CHEN Y G. Regulation of TGF- βsuperfamily signaling by inhibitory Smad [J]. Chin. J. CellBiol., 2009,31(2):4-13.
[5] MULSANT P, LECERF F, FABRE S, et al .. Mutation in bonemorp-hogenetic protein receptor-IB is associated with increasedovulation rate in Booroola Merino ewes [J]. Proc. Natl. Acad.Sci. USA, 2001, 98:5104-5109.
[6] ZHANG Y, MUSCI T, DERYNCK R. The tumor suppressorSmad4/DPC 4 as a central mediator of Smad function [J].Current Biol. Cb, 1997, 7(4):270-276.
[7] MING Z, LOPA M, CHU X D. The role of TGF- β/SMAD4signaling in cancer [J]. Int. J. Biol. Sci., 2018, 14(2):111-123.
[8] 廖火城,刘勇,周彬,等.四逆汤对异丙肾上腺素诱导的大鼠心肌纤维化Smad2和Smad7的影响[J].中国中西医结合杂志,2012,32(7):934-938.
LIAO H C, LIU Y, ZHOU B, et al .. Effects of Sin decoction onthe expressions of Smad2 and Smad7 in isoproterenol inducedmyocardial fibrosis rats [J]. Chin. J. Integrative Med., 2012, 32(7):934-938.
[9] LIU C, LI W, ZHANG X, et al .. The critical role of myostatinin differentiation of sheep myoblasts [J]. Bioch. Biophy. Res.Comm., 2012, 422(3):381-386.
[10] 张秉芬,周胜红,王哲.延龄草皂苷通过抑制TGF-β/Smad3与Wnt/β-catenin信号通路改善大鼠肺纤维化[J].山东大学学报(医学版),2022,60(8):23-29.
ZHANG B F, ZHOU S H, WANG Z. Trillium saponinsameliorates pulmonary fibrosis in rats by inhibiting TGF- β/Smad3 and Wnt/β-catenin signaling pathways [J]. J. ShandongUniv. (Health Sci.), 2022, 60(8):23-29.
[11] 范李静,张苗,郑瑛红,等.miR-34a-5p靶向Smad4抑制子宫内膜纤维化的机制研究[J]. 现代妇产科进展,2022,31(9):678-682.
FAN L J, ZHANG M, ZHENG Y H, et al .. Inhibitory effect ofmiR-34a-5p on fibrosis of endometrial by down-regulatingSmad4 [J]. Prog. Obstet. Gynecol., 2022, 31(9):678-682.
[12] 王雪,张景萍,郭丽丽,等.TGF-β/SMAD信号通路在哺乳动物卵巢发育调控中的作用研究进展[J].中国畜牧杂志,2023,59(3):61-69.
WANG X, ZHANG J P, GUO L L, et al .. Research progress onthe regulation of TGF-β/Smad signaling pathway in mammalianovarian development [J]. Chin. J. Anim. Sci., 2023, 59(3):61-69.
[13] LIU Y, DU S Y, DING M, et al .. The BMP4-Smad signalingpathway regulates hyperandrogenism development in a femalemouse model [J]. J. Biol. Chem., 2017, 292(28):11740-11750.
[14] OSTERLUND C. TGFbeta receptor types Ⅰ and Ⅱ and thesubstrate proteins Smad 2 and 3 are present in human oocytes[J/OL]. Mol. Human Reprod., 2000, 6(6): 498 [2022-11-20].https://doi.org/10.1093/molehr/6.6.498.
[15] ZHANG K, RAJPUT S K, LEE K B, et al .. Evidencesupporting a role for smad2/3 in bovine early embryonicdevelopment: potential implications for embryotropic actions offollistatin [J/OL]. Biol. Reprod., 2015, 86: 130278 [2022-11-20]. https://doi.org/10.1095/biolreprod.115.130278.
[16] GUERIPEL X, BENAHMED M, GOUGEON A. Sequentialgonadotropin treatment of immature mice leads to amplificationof transforming growth factor β action, via upregulation ofreceptor-type1, Smad2 and 4, and downregulation of Smad6 [J].Biol. Reprod., 2004, 70(3):640-648.
[17] PANGAS S A, LI X, ROBERTSON E J, et al ..Prematureluteinization and cumulus cell defects in ovar-ianspecificSmad4 knockout mice [J]. Mol. Endocrinol., 2006,20(6):1406-1422,.
[18] FINDIAY J K, DRUMMOND A E, DYSON M, et al .. Productionand actions of inhibin and activin during folliculogenesisin the rat [J]. Mol. Cell Endocr-inol., 2001, 180(1-2):139-144.
[19] JING J, JIANG X, CHEN J, et al .. Notch signaling pathwaypromotes the development of ovine ovarian follicular granulosacells [J]. Anim. Reprod. Sci., 2017, 181(1):69-78.
[20] CHOU K C, SHEN H B. A new method for predicting thesubcellular localization of eukaryotic proteins with both singleand multiple sites: Euk-mPLoc 2.0 [J/OL]. PloS One, 2010,5(4): e9931[2022-11-20].https://doi.org/10.1371/journal.pone.0009931.
[21] 梁维炜,李明娜,罗玉柱,等.性成熟期辽宁绒山羊与子午岭黑山羊睾丸发育比较[J].畜牧兽医学报,2021,52(12):3461-3470.
LIANG W W, LI M N, LUO Y Z, et al .. Comparation of thetestes development between Liaoning cashmere goat andZiwuling blackgoat at swxual matreity [J]. J. Anim. Husb.Vet. Med., 2021, 52(12):3461-3470.
[22] 汤继顺.利用转录组测序和蛋白质组学分析筛选绵羊多羔候选基因的研究[D].北京:中国农业科学院,2019.
TANG J S. Study on screening polytocous candidate genes insheep based on transcriptome sequencing and proteomics analysis[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019.
[23] 盖玉强,杜宝霞,马龙,等.不同发情时期Smad4 基因在绵羊卵巢中表达规律的研究[J].吉林畜牧兽医,2020,41(10):1-2,4.
[24] HE Z, DENG F, XIONG S, et al .. Expression and regulation ofSmad2 by gonadotropins in the protogynous hermaphroditicricefield eel (Monopterus albus) [J/OL]. Fish Physiol. Biochem.,2020, 4: 9 [2022-11-20]. https://doi. org/10.1007/s10695-020-00778-9.
[25] 苗竹林,王自能,章韵,等.Smad4蛋白及mRNA在卵巢不同发育阶段的表达[J].中国病理生理杂志,2005,21(5):1009-1013.
MIAO Z L, WANG Z N, ZHANG Y, et al .. Expression of Smad4protein and mRNA in different developmental stages of the ratovary [J]. Chin. J. Pathophysiol., 2005, 21(5):1009-1013.
[26] 刘利杰.山羊卵母细胞减数分裂机制的初步研究[D].杨凌:西北农林科技大学,2008.
LIU L J. The study on the regulation of meiotic of goat oocyte[D]. Yangling: Northwest A amp; F University, 2008.
[27] 郑健.高低繁湖羊垂体差异表达lncRNA/mRNA筛选及候选基因SMAD2 的相关研究[D].南京:南京农业大学,2019.
ZHENG J. Pituitary transcriptomic study reveals the differentialregulation of incRNAs/mRNAs related to prolificacy in sheep andstudy on the candidate gene SMAD2 [D]. Nanjing: NanjingAgricultural University, 2019.
[28] 李碧筠,黄思艺,王钰锟,等.SMAD7 对山羊卵泡颗粒细胞增殖、凋亡的影响[J].畜牧兽医学报,2022,53(8):2548-2557.
LI B J, HUANG S Y, WANG Y K, et al .. Effect of SMAD7 onproliferation and apoptosis of goat follicular granulosa cells [J].J. Anim. Husb. Vet. Med., 2022, 53(8):2548-2557.
[29] NOMURA M, SAKAMOTO R, MORINAGAH, et al .. Activinstimulates CYP19A gene expression in human ovarian granulosacell-like KGN cells via the SMAD2 signaling pathway [J].Biochem. Biophys. Res. Comm., 2013, 436(3):443-448.
[30] YU C, ZHANG Y L, FAN H Y. Selective Smad4 knockout inovarian preovulatory follicles results in multiple defects inovulation [J]. Mol. Endocrinol., 2013, 27(6):966-978.
[31] 张娟.Smad2、Smad3及Smad7蛋白在绝经过渡期大鼠卵巢中的表达及意义[D].张家口:河北北方学院,2017.
ZHANG J. The expression and significance of Smad protein inthe ovary of the rat during menopausal transition [D].Zhangjiakou: Hebei North College, 2017.
[32] 袁丽娟,任君旭,姬宏宇,等.转化生长因子-β和Smad4在绝经过渡期大鼠卵巢颗粒细胞中的表达[J].解剖学报, 2018,49(1):108-112.
YUAN L J, REN J X, JI H Y, et al .. Expression of transforminggrowth factor- β and Smad4 in ovarian granulosa cells inmenopausal transitional rat [J]. J. Anatomy, 2018, 49(1):108-112.
[33] LI Y, SCHANG G, BOEHM U, et al .. SMAD3 regulates folliclestimulatinghormone synthesis by pituitary gonadotrope cells invivo [J]. J. Biol. Chem., 2017, 292(6):2301-2314.
[34] LI Y, JIN Y, LIU Y, et al .. SMAD3 regulates the diversefunctions of rat granulosa cells relating to the FSHR/PKAsignaling pathway [J/OL]. Reproduction, 2013, 146(2): 0325[2022-11-20]. https://doi.org/10.1530/rep-12-0325.
[35] GRY K S, KASPER A, ALEXANDRO C C, et al .. Expressionof TGF-beta superfamily growth factors, their receptors, theassociated SMADs and antagonists in five isolated sizematchedpopulations of pre-antral follicles from normal humanovaries [J]. Mol. Human Reprod., 2014, 20(4):293-308.
[36] LI Q L, PANGAS S A, JORGEZ C J, et al .. Redundant roles ofSMAD2 and SMAD3 in ovarian granulosa cells in vivo [J]. Mol.Cell Biol., 2008, 28(23):7001-7011.
[37] ZHOU J L, LIU J Y, PAN Z X, et al .. The let-7g microRNApromotes follicular granulosa cell apoptosis by targetingtransforming growth factor- β type 1 receptor [J]. Mol. CellularEndocrinol., 2015, 409(7):103-112.
基金项目:国家自然基金项目(31960664);甘肃农业大学学科团队项目(GAU-XKTD-2022-21);甘肃省自然基金项目(21JR7RA809);甘肃省基础研究创新群体项目(22JR5RA829);兰州市科技计划项目(2021-1-162)。

