老山芹层积前后种子差异代谢物分析



摘要:为深入探索老山芹种子休眠机理,以老山芹层积前后种子为研究对象,采用气相色谱-飞行时间质谱联用技术 (gas chromatography-time of flight mass spectrometry,GC-TOF/MS)对其非层积种子(non-lamellarizedseeds, NS)和层积后达到发芽状态种子(germination seeds, GS)的差异代谢物进行分析。结果表明,共检测到995种代谢产物,NS和GS的代谢物存在明显分离,差异代谢物有126种,其中极显著差异代谢物75种,包括35种上调,40种下调。对极显著差异代谢物所在代谢通路分析表明,涉及10条关键代谢通路。和弦图分析表明,差异代谢物中脂质类化合物(含类脂分子)与苯类化合物呈极显著正相关;苯丙烷类化合物(含聚酮类化合物)与有机氧类化合物呈极显著负相关。以上研究结果为探索老山芹种子成熟后萌发提供了代谢组学理论基础,为更好地研究老山芹种子后成熟及休眠机制提供了依据和支撑。
关键词:老山芹;GC-TOF/MS;代谢组学;层积;差异代谢物
doi:10.13304/j.nykjdb.2023.0183
中图分类号:S567.23+9 文献标志码:A 文章编号:1008‑0864(2024)07‑0037‑13
老山芹(Heracleum moellendorffii Hance)为多年生宿根草本植物,学名东北牛防风,又名大叶芹、土当归等,多生长于我国东北、西南及华中地区的阴湿、腐殖质多的河岸或杂草林中[1],富含氨基酸、黄酮类化合物等,对于治疗风湿、高血糖和血脂、腰膝疼痛、癌症等有积极的辅助作用。老山芹叶基部肥大,可入菜,因膳食纤维丰富、活性成分多而深受大众喜爱。然而受自然条件及种子休眠等因素影响,老山芹种子的发芽率极低,出苗也不整齐,只依靠自然采收远远满足不了市场需求。
杨慧洁等[2]发现,老山芹出苗不整齐的主要原因是种子存在休眠。层积可以有效打破种子休眠,降低脱落酸等抑制物质的含量,增加赤霉素、细胞分裂素等含量,从而提高种子的萌发率。李富恒等[3]以5年生老山芹种子为材料,通过4种变温层积处理发现,采用“暖温-低温-暖温”层积的方法在形态学上更有利于老山芹种子后熟,而且低温是处理的关键。可见,低温层积对于解除老山芹种子休眠有积极作用。目前,关于老山芹种子休眠的研究多集中在化学成分[4]、栽培技术[1]、食用药用[1]、蛋白质组学[5]、形态学[6]等方面,而对层积过程中老山芹种子代谢物的变化及其调控途径鲜有报道。生物体内每时每刻都在各种因素调控作用下发生代谢变化。代谢组学可通过高通量技术定性、定量环境因素引起的细胞、组织、器官中小分子代谢物[7‑8],是从分子水平进行系统研究的重要方式之一。种子萌发不仅与大分子化学成分、种子形态结构、蛋白质等相关,还与小分子物质相关。因此,研究层积条件下种子代谢组学具有重要意义。
本研究利用4 ℃恒温层积处理老山芹种子,通过气相色谱-飞行时间质谱 (gas chromatographytime-of-flight mass spectrometry,GC-TOF/MS)鉴定种子的代谢物,采用正交偏最小二乘方判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)获得OPLS-DA 模型,并用交叉验证法检验模型质量;采用 OPLS-DA模型结合t检验寻找差异性代谢物。利用KEGG(Kyoto encyclopedia ofgenes and genomes)方法分析层积过程中老山芹种子的关键代谢通路,研究影响老山芹种子萌发的关键代谢物质及可能控制后熟到萌发阶段的关键通路,为老山芹后熟及休眠机制、种子萌发、育苗技术的研究奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 种子材料
以7年生老山芹植株收获的种子为试验材料,由东北农业大学生命科学学院提供。种子采收后自然阴干备用。
1.1.2 试剂
试验试剂包括75% 乙醇、提取液(甲醇与水体积比为3∶1)、核糖醇、甲氧胺盐试剂(甲氧胺盐酸盐溶于吡啶,20 mg·mL−1)、含有1%(体积分数)TMCS (trimethylchlorosilane)的双三甲基硅基三氟乙酰胺(bis-trifluoroacetamide,BSTFA)、纯水(ddH2O)等。
1.1.3 仪器
GC-TOF/MS 分析使用仪器为气相色谱仪系统(7890A型 美国安捷伦)和Pegasus HT飞行时间质谱仪(美国力可)。
1.2 试验方法
1.2.1 种子层积处理
选取大小均一、籽粒饱满的种子,用75%乙醇灭菌30 s,再以蒸馏水清洗干净后浸泡6 h。将处理好的种子和干净的湿润沙子按2∶3(体积比)的比例混匀并搅拌,放入塑料盒(长、宽和高分别为19、13和11 cm)中,并在盖子上打孔透气;然后将种子转移到4 ℃进行层积处理。在4 ℃层积处理过程中,每隔2 d通过解剖镜观察种胚结构及胚发育情况,同时各取10 g非层积种子(non-stratified seeds,NS)和层积后达到发芽状态的种子(germinated seeds,GS),用滤纸吸干水分,于液氮速冻后置于−80 ℃冰箱保存,用于代谢组分析(n=6,n 为每个取样点所取重复样品数)。
1.2.2 样品代谢物提取
种子总代谢物利用甲氧铵盐和BSTA法[9]提取。
1.2.3 样品检测
样品分析检测参照雷锋杰[10]方法,具体GC-TOF/MS仪器参数如表1所示。
1.2.4 数据处理
参照雷锋杰[10]的分析方法,使用ChromaTOF 软件(V 4.3x,LECO)以及LECOFiehnRtx5数据库对质谱数据进行分析,包括峰提取、峰面积积分、峰对齐等;利用SIMCA 软件(V14.1,Sartorius Stedim Data Analytics AB,Umea,Sweden)对数据进行对数转换加中心化格式化处理[11],然后进行主成分分析(principal componentanalysis,PCA),观察不同时间样品原始数据的总体分布和整个分析过程的稳定性。通过OPLS-DA对结果进一步分析,获取更加可靠的组间差异代谢物与试验组的相关程度信息[11]。使用SIMCA软件采用7次循环交互验证及随机多次改变分类变量排列顺序检验的方法验证模型。采用OPLSDA模型,设定筛选条件为VIP(variable importancein the projection)值gt;1且Plt;0.05,并将筛选结果制成火山图。利用circos. par 函数设置参数,chordDiagram 函数绘制和弦图。由于老山芹没有测序,因此通过搜索KEGGPathway数据库查找同一科植物胡萝卜的代谢通路,并将差异代谢物在KEGG通路图上标记,再通过对差异代谢物所在通路综合分析,筛选与代谢物差异相关性最高的关键通路,并将结果绘制成气泡图进行分析。
2 结果与分析
2.1 GC-TOF/MS 分析
通过GC-TOF/MS 对老山芹样品进行鉴定和分析,得到总离子色谱图(total ion current,TIC)如图1所示。2组的总离子色谱图整齐,均未观察到漂移,保留时间集中在6~32 min,重现性好,表明所用GC-TOF/MS仪器具有良好的重复性和稳定性。NS和GS样本的主要色谱峰构成相似,但色谱峰数目存在差异。共检测到995种代谢产物,经预处理后保留971种。通过与质谱数据库匹配初步鉴定出315 种代谢物,包括18 种有机酸,33种氨基酸、肽及其配体,19种脂肪酸及其共轭物,12种糖醇、糖酸及其他衍生物等。
2.2 老山芹不同层积时期代谢物PCA 和OPLSDA分析
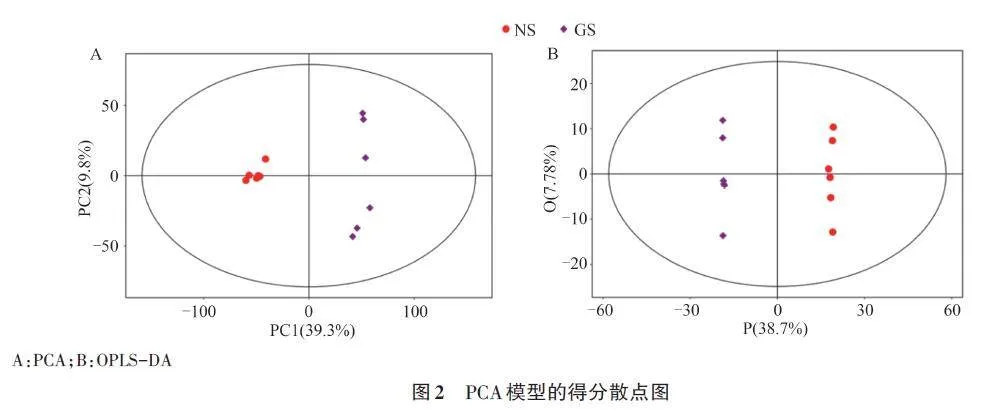
为探究萌发机理,采用SIMCA软件对后熟时期的代谢物进行PCA和OPLS-DA回归模型分析,如图2和3所示。PCA得分图中所有样本均在95%的置信区间内,且NS聚为一类,GS聚为另一类,在第1主成分(PC1)轴完全分离,第2主成分(PC2)轴分离趋势较小。NS和GS间代谢物差异较大,而相同处理下不同重复间化合物组成较一致(图2A)。
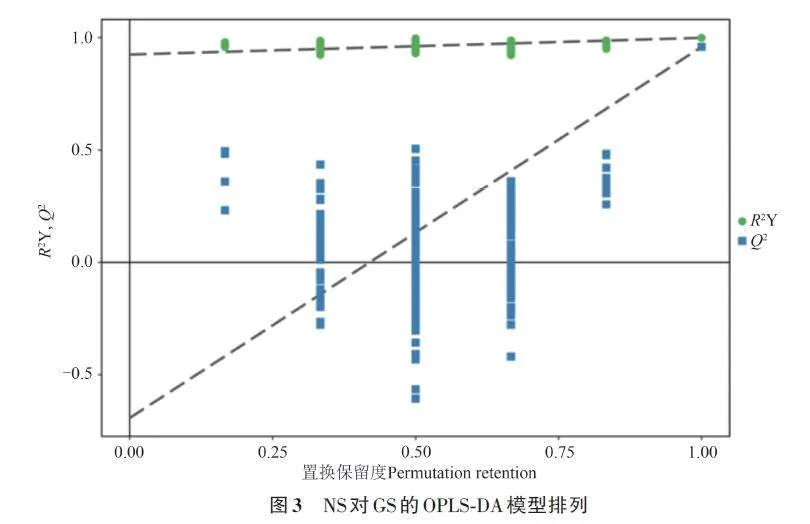
利用OPLS-DA法过滤不相关的正交变量,使得到的信息更可靠。从图2B可以看出,2组样本区分非常显著,且样本均处于95%置信区间内,说明模型具有较好的稳健性。为了使判别效果及主成分的得分图更加明显,随机改变分类变量的排列顺序,使分类信息主要集中在1个主成分中,利用200 次置换后建立OPLS-DA 模型。由图3可知,随机模型的R2的截距和Q2的截距分别为0.92和-0.69,表明模型的稳健性较好,不存在过拟合,可靠性较强。
2.3 不同层积时期显著性差异代谢物分析
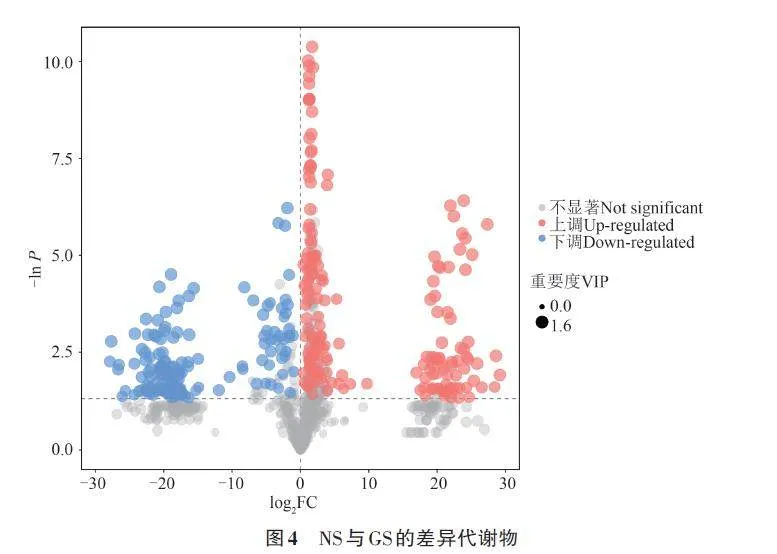
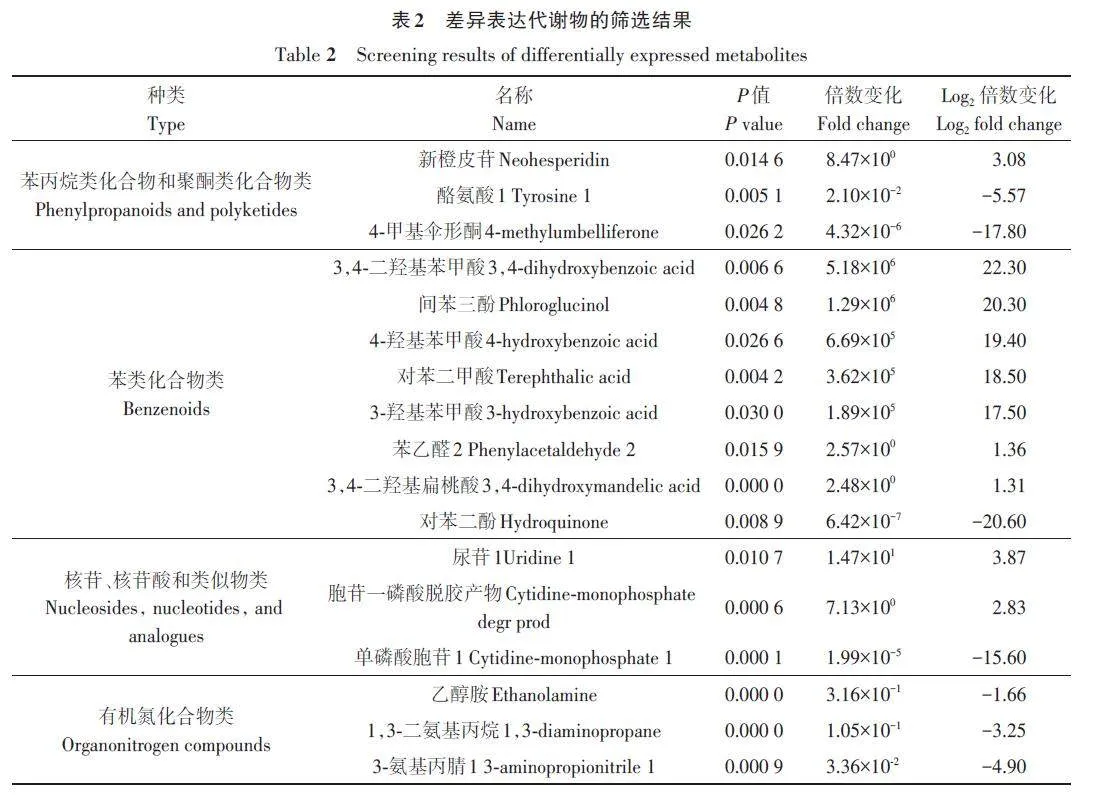
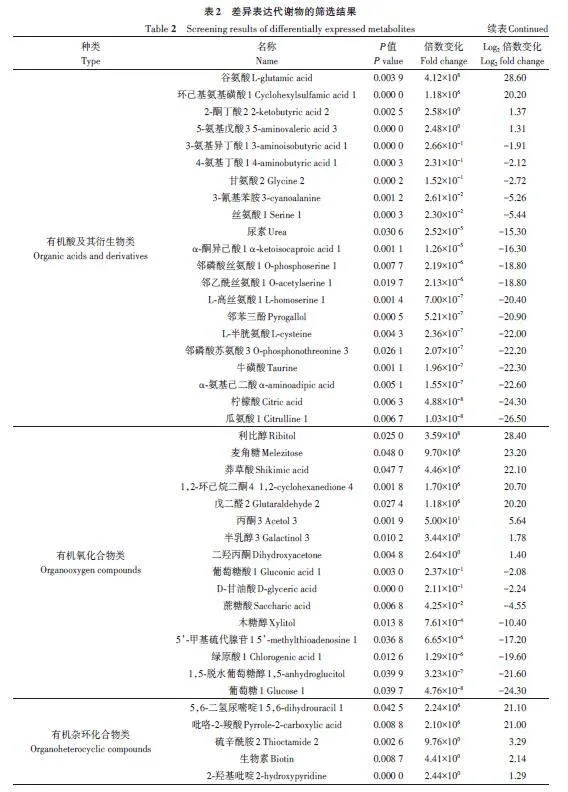
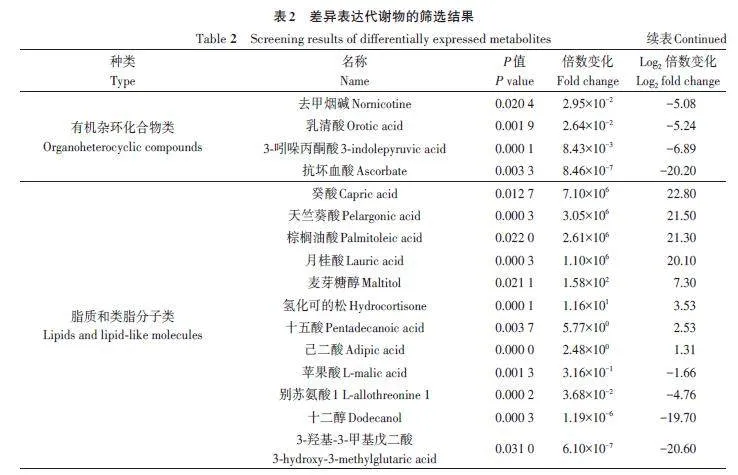
由图4可知,在NS和GS间共获得349种差异代谢物,排除unknown及analyte代谢物,有126种代谢物存在显著差异,其中有57 种显著上调,69种显著下调。为进一步确定与层积相关的候选生物标志物,参照吴菲菲等[12]的方法筛选到有明确注释且差异极显著的差异代谢物75种,其中上调的有35种,下调的有40种(表2)。
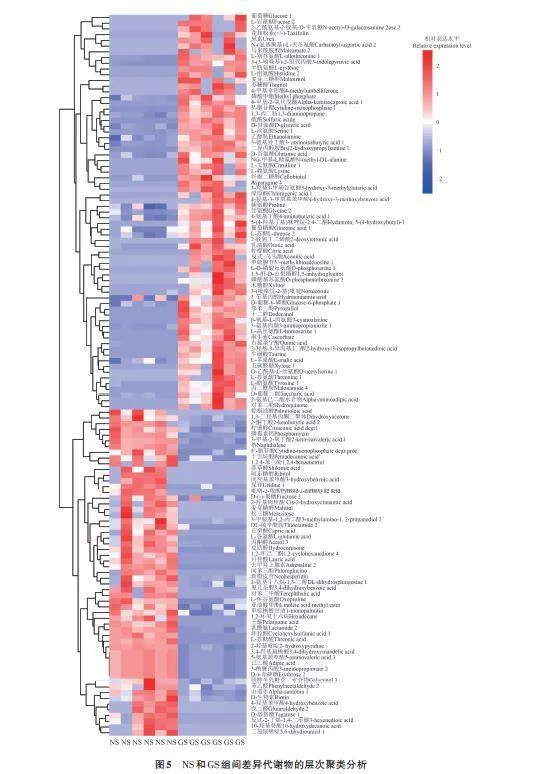
2.4 不同层积时期差异代谢物层次聚类分析
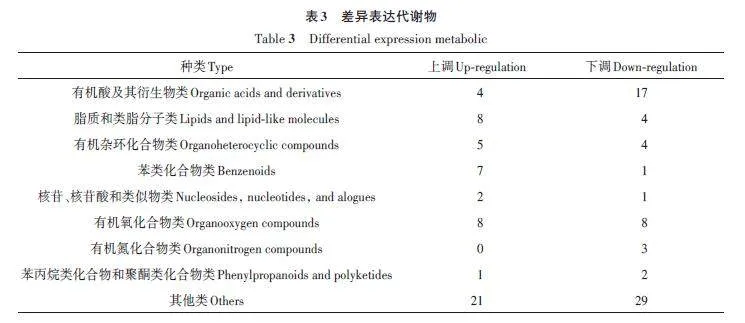
为了解差异代谢物的相关性,采用Lee 等[13]的方法对差异代谢物进行聚类,结果(图5)表明,NS与GS代谢物差异较大。与NS相比,GS的一些代谢物被上调,另一些代谢物被下调,其中上调的较多。由表3可知,共计125种差异代谢物,其中有56种上调,69种下调;涉及有机酸及其衍生物类、有机氧化合物类、苯丙烷类化合物和聚酮类化合物类多为下调,而脂质和类脂分子类、有机氮化合物类、有机杂环化合物类、核苷和核苷酸及其衍生物类、苯类化合物多为上调。
2.5 差异代谢物的和弦分析
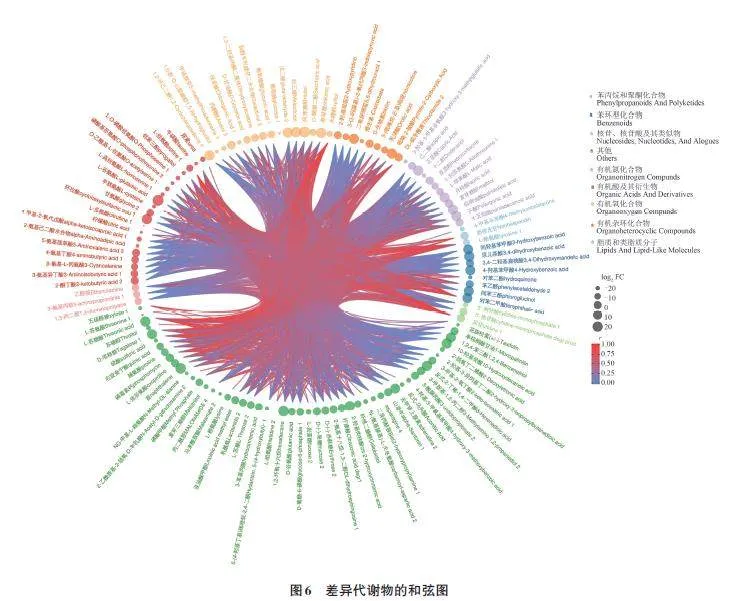
为了更好地展示差异代谢物的相关性,对代谢物进行和弦分析,如图6所示。图形呈近圆形,图外围数据节点围绕在圆周围辐射分布,连接带的首尾如果宽度相同,则表示单向流量;宽度不同则表示双向流量[14‑15]。差异代谢物包括有机酸及其衍生物类、有机氧化合物类、脂质和类脂分子类、有机杂环化合物类、苯类化合物类、核苷和核苷酸及类似物类、有机氮化合物类、苯丙烷类化合物、聚酮类化合物类、其他类。选取| Log2FC|gt;20的数据节点,有苯类化合物类2种,分别为3,4-二羟基苯甲酸、间苯三酚;脂质和类脂分子类3种,分别为癸酸、天竺葵酸、棕榈油酸;有机酸及其衍生物类2种,分别为谷氨酸、环己基氨基磺酸1;有机氧化合物类5种,分别为利比醇、麦角糖、莽草酸、1,2-环己烷二酮4、戊二醛2;有机杂环化合物类2种,分别为5,6-二氢尿嘧啶1、吡咯-2-羧酸;其他类6种,分别为萘、肾上腺素2、苏氨酸、3-己烯二酸、10-羟基癸酸、1,2,4-苯三醇。不同类代谢物在代谢通路中的相互转化与调控。脂质和类脂分子类(紫色)与苯类化合物类(蓝色)呈极显著正相关;苯丙烷类化合物类(浅蓝色)与有机氧化合物类(浅黄色)呈极显著负相关。
2.6 生物标志物的代谢通路分析
生物体中的代谢反应依赖于基因和蛋白质的调控。全面分析代谢和调控通路,有利于了解代谢系统的变化规律[16]。采用京都基因与KEGG通路数据库(http://www.kegg.jp/kegg/pathway.html)结合Metabolite Mapping 拟合差异代谢物,通过KEGG注释分析找到所有差异代谢物所参与的通路,进一步对代谢差异物进行代谢通路分析和筛选,找到与代谢物差异相关性最高的关键通路[17]。结果表明,NS和GS有36条途径差异显著,如图7所示。根据-lnPgt;1且impact scoregt;0,最终筛选出10 条关键通路,分别是嘧啶代谢(pyrimidinemetabolism)、氰氨基酸代谢(cyanoamino acidmetabolism)、硫代谢(sulfur metabolism)、甘氨酸/丝氨酸/苏氨酸代谢(glycine/serine/threoninemetabolism) 、赖氨酸生物合成(lysinebiosynthesis)、半胱氨酸和蛋氨酸代谢(cysteineand methionine metabolism)、β - 丙氨酸代谢(β-alanine metabolism) 、谷胱甘肽代谢(glutathione metabolism)、牛磺酸和次牛磺酸代谢(taurine and hypotaurine metabolism)、磷酸戊糖途径(pentose phosphate pathway)。
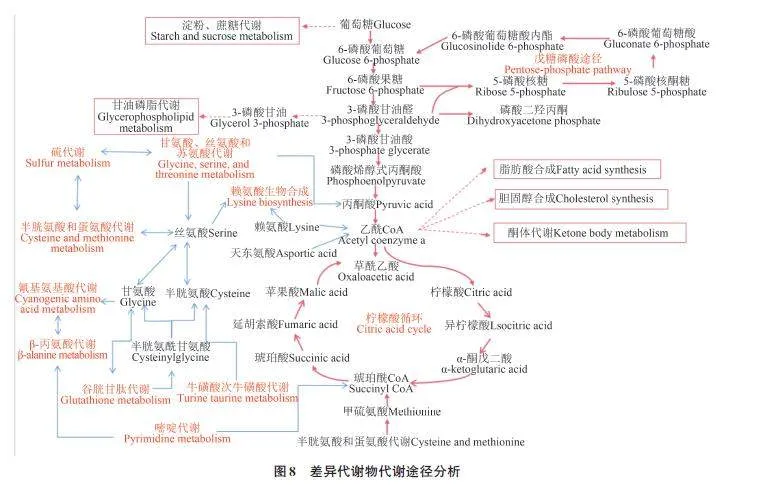
2.7 差异代谢物的代谢途径分析
代谢通路对于研究生物细胞内物质的代谢和生理过程有重要作用[18]。利用KEGG对差异代谢物所在通路进行检索和调控互作网络分析,结果(图8)表明,筛选出的10条关键代谢通路中主要参与代谢通路的为甘氨酸、半胱氨酸、丝氨酸、赖氨酸、丙氨酸、谷氨酸、天冬氨酸、6-磷酸葡萄糖酸内酯、葡萄糖酸、葡萄糖、果糖、3-磷酸甘油醛、柠檬酸、α-酮戊二酸和琥珀酸等。在种子发育过程中,淀粉、糖类和脂肪提供原料、构建骨架、提供能量,使种胚继续发育至成熟;蔗糖、可溶性糖和还原糖参与呼吸过程,提供生长发育的原料和能量,在一系列酶的作用下水解成葡萄糖和果糖。葡萄糖经过糖酵解途径生成6-磷酸葡萄糖,再经酶的作用生成丙酮酸。丙酮酸能转化为乙酰CoA,从而进入三羧酸循环。乙酰CoA合成后可以参加的途径很多,如可以合成胆固醇或者脂肪酸,可以进行酮体代谢,可以进入三羧酸循环生成众多酸,其中部分酸参与氨基酸代谢。3-磷酸甘油醛能生成3-磷酸甘油,之后进入甘油磷脂代谢途径。半胱氨酸是谷胱甘肽代谢、牛磺酸次牛磺酸代谢、甘氨酸丝氨酸和苏氨酸代谢通路中的共有化合物,连接多个代谢途径;其他的还有甘氨酸、丝氨酸、谷氨酸、天冬氨酸等。磷酸戊糖途径的核糖可参与嘌呤代谢,继续进入糖酵解或者三羧酸循环,提供核酸合成的原料与还原力。氰基氨基酸代谢、硫代谢、甘氨酸/丝氨酸/苏氨酸代谢、牛磺酸和次牛磺酸代谢、半胱氨酸和蛋氨酸代谢、谷胱甘肽代谢等这些途径均相互联系,说明这些代谢物可能通过甘氨酸、谷胱甘肽、半胱氨酸等相互转化。
3 讨论
本研究共检测到种子层积代谢产物995个,预处理后保留971个,经过匹配得到差异代谢物315个。通过NS与GS的比较,有125种代谢物存在显著差异,说明NS与GS的代谢物存在显著差异。进一步筛选出75种差异代谢物,有35种上调,40种下调。代谢通路分析得到老山芹种子NS和GS差异相关性最高的代谢通路有36条,筛选出其中10条关键代谢通路,分别为嘧啶代谢、氰基氨基酸代谢、硫代谢、甘氨酸/丝氨酸/苏氨酸代谢、β-丙氨酸代谢、牛磺酸和次牛磺酸代谢、赖氨酸生物合成、半胱氨酸和蛋氨酸代谢、谷胱甘肽代谢、磷酸戊糖途径,这些通路为老山芹种子低温发育提供了能量和代谢原料。
老山芹种子的休眠是由于种子存在后熟特性,是由种胚尚未发育完全和内源性抑制物质等因素共同引起的综合性休眠[3]。通过层积处理,创造合适的种子萌发环境,促进种胚发育和贮藏物质的转化,使种子完成后熟,即能使种子的休眠有效解除。刘舒娅[19]研究表明,磷酸戊糖途径在老山芹种子发育中占主导地位。本研究也筛选到了磷酸戊糖途径可能影响老山芹种子休眠。种胚在发育后期呼吸作用增强,随着种胚进一步生长分化,种子呼吸转变为磷酸戊糖途径,种子休眠得到解除[20]。研究表明,嘌呤代谢和嘧啶代谢参与种子的萌发过程[21],嘌呤核苷酸和嘧啶核苷酸可参与休眠种子核酸的合成、糖类代谢、脂质代谢和一些蛋白质前身的合成。甘氨酸、亮氨酸、异亮氨酸、丝氨酸、高丝氨酸等各类氨基酸在生物体受到外界胁迫时,可以互相转化或者生成其他次级代谢产物,进行代谢平衡的调控。本研究发现,嘧啶代谢及甘氨酸、丝氨酸等各类氨基酸代谢在老山芹打破休眠中发挥重要作用。郝林华等[22‑23]对小麦、黄瓜幼苗的培育表明,牛磺酸可促进幼苗生长,稳定细胞膜,但未见其在种子萌发时的具体作用。而本研究筛选到牛磺酸在打破种子休眠中发挥重要作用,推测可能是牛磺酸参与了蛋氨酸或半胱氨酸生成的谷胱甘肽代谢,具体原因有待进一步研究。张彩峡等[24]研究表明,氰基氨基酸代谢在多花黑麦草的抗旱性中发挥重要作用;祝山等[25]研究表明,氰基氨基酸代谢、磷酸戊糖等途径上的差异表达基因与细胞壁上多糖的降解有关;王一衡等[26] 分析了大白菜中与花发育相关的miRNAs 靶基因,氰基氨基酸代谢通路上富集基因显著。氰基氨基酸代谢与丙氨酸代谢、精氨酸代谢、硒化合物代谢等多个代谢途径相联系,它们之间的物质流动使得氰基氨基酸代谢在整个代谢网络中具有重要作用。本研究也发现,氰基氨基酸代谢一定程度上影响种子萌发。牛磺酸和次牛磺酸代谢、硫代谢、谷胱甘肽代谢和氰基氨基酸代谢对休眠种子的作用还有待进一步研究。
参考文献
[1] 刘继德,谭玉琴.老山芹人工栽培及食用方法[J].中国农学通报,1997,13(2):46-47.
[2] 杨慧洁,高箭,王铁.山芹菜生物学特性的调查研究[J].人参研究,2000(2):19-20.
[3] 李富恒,张雪霞,赵恒田,等.四种变温层积对老山芹种子胚发育及生理特性的影响[J].东北农业大学学报,2018,49(5):33-44.
LI F H, ZHANG X X, ZHAO H T, et al .. Effect of four variabletemperature stratifications on the embryo development andphysiological characteristics of Heracleum moellendorffiiHance seed [J]. J. Northeast Agric. Univ., 2018, 49(5):33-44.
[4] 韩和璧,杨博航,曾勇,等.老山芹化学成分研究与开发利用进展[J].粮食与油脂,2022(6):24-29.
[5] 李富恒,张晓雯,张永芳,等.不同发育阶段老山芹种子多组学联合分析[J].东北农业大学学报,2021,52(10):32-46.
LI F H, ZHANG X W, ZHANG Y F, et al .. Integration analysison multiple omics of Heracleum moellendorffii Hance seeds atdifferent developmental stages [J]. J. Northeast Agric. Univ.,2021, 52(10):32-46.
[6] 李富恒,刘增兵,崔巍金琦,等.老山芹生长发育规律及主要性状相关性分析[J]. 东北农业大学学报,2017,48(1 ):15-22,32.
LI F H, LIU Z B, CUI-WEI J Q, et al .. Growth anddevelopment rule and correlation analysis of main characters ofHeracleum moellendorffii Hance [J]. J. Northeast Agric. Univ.,2017, 48(1):15-22,32.
[7] HALL R, BEALE M, FIEHN O, et al .. Plant metabolomics: themissing link in functional genomics strategies [J]. Plant Cell,2002, 14(7):1437-1440.
[8] NICHOLSON J K, CONNELLY J, LINDON J C, et al ..Metabonomics: a platform for studying drug toxicity and genefunction [J]. Nat. Rev. Drug Discov., 2002, 1(2):153-161.
[9] 杨军,宋硕林,JOSE C P,等.代谢组学及其应用[J].生物工程学报,2005,21(1):1-5.
YANG J, SONG S L, JOSE C P, et al .. Metabonomics and itsapplications [J]. Chin. J. Biotech., 2005, 21(1):1-5.
[10] 雷锋杰.人参细菌性软腐病菌对人参三萜皂苷类物质的趋化响应及其致病机制研究[D].沈阳:沈阳农业大学,2018.
LEI F J. Chemotaxis response of ginseng bacterial soft rotpathogen to three terpenoid saponins from Panax ginseng andits pathogenic mechanism [D]. Shenyang: Shenyang AgriculturalUniversity, 2018.
[11] SUSANN E, WIKLUN D, ERI K, et al .. Visualization of GC/TOF-MS-based metabolomics data for identification ofbiochemically interesting compounds using OPLS class models [J].Anal. Chem., 2008, 80(1):115-122.
[12] 吴菲菲,程楚杭,陈廷,等.热带糙海参雌、雄亲参的差异代谢物和差异代谢通路研究[J]..渔业科学进展,2021,42(3):55-67.
WU F F, CHENG C H, CHEN T, et al .. Study on sexdifferential metabolites and metabolic pathway of parentaltropical sea cucumbers Holothuria scabra [J]. Progress Fish.Sci., 2021, 42(3):55-67.
[13] LEE A, WILLCOX B. Minkowski generalizations of ward’smethod in hierarchical clustering [J]. J. Classification, 2014,31(2):194-218.
[14] REINKE S N, GALINDO-PRIETO B, SKOTARE T, et al ..OnPLS-based multi-block data integration: a multivariateapproach to interrogating biological interactions in Asthma [J].Anal. Chem., 2018, 90(22):13400-13408.
[15] STACEY N R, BEATRIZ G P, TOMAS S, et al.. OnPLS-basedmulti-block data integration: a multivariate approach tointerrogating biological interactions in Asthma [J]. Anal.Chem., 2018,90(22):13400-13408.
[16] 薛佳艺.口腔鳞状细胞癌患者的唾液代谢组学研究[D].青岛:青岛大学,2018.
XUE J Y. Saliva metabolomics study of parients with oralsquamous cell [D]. Qingdao: Qingdao University, 2018.[17] XIA J G, SINELNIKOV I V, HAN B, et al .. MetaboAnalyst3.0—making metabolomics more meaningful [J]. Nucl. AcidsRes., 2015, 43(1):251-257.
[18] PICART-ARMADA S, FERNÁNDEZ-ALBERT F, VINAIXAM, et al.. FELLA: an R package to enrich metabolomics data [J/OL].BMC Bioinform., 2018, 19(1):538 [2023-02-20]. https://doi.org/10.1186/s12859-018-2487-5.
[19] 刘舒娅.东北牛防风(Heracleum moellendorffii Hance)种胚发育及种子休眠的研究[D].哈尔滨:东北农业大学,2018.
LIU S Y. Research on embryo development and seed dormancyof Heracleum moellendorffii Hance [D]. Haibin: NortheastAgricultural University, 2018.
[20] 赵永华,杨世林,刘惠卿,等.西洋参种子休眠解除与磷酸戊糖途径关系的研究[J].中草药,2001,32(3):259-261.
ZHAO Y H, YANG S L, LIU H Q, et al .. Relationship betweenphosphopentose pathway and seed dormancy releasing ofPanax quinquef olius [J]. Chin. Trad. Herbal Drugs, 2001,32(3):259-261.
[21] SAUX M, PONNAIAH M, LANGLADE N, et al .. Amultiscaleapproach reveals regulatory players of water stress responses inseeds during germination [J]. Plant Cell Environ., 2020, 43(5):1300-1313.
[22] 郝林华,何培青,柳春燕,等.牛磺酸对小麦幼苗生长的生理效应[J].植物生理与分子生物学学报,2004,30(5):595-598.
HAO L H, HE P Q, LIU C Y, et al .. Physiological effects oftaurine on the growth of wheat (Triticum aestivum L.) seedlings [J].Physiol. Mol. Biol. Plants, 2004, 30(5):595-598.
[23] 郝林华,陈靠山,李光友.牛磺酸对黄瓜幼苗生长和生理特性的影响[J]. 上海交通大学学报(农业科学版),2005,23(1):10-14.
HAO L H, CHEN K S, LI G Y. Effects of taurine on the growthand physiological properties of cucumber (Cucumis sativus L.)seedlings [J]. J. Shanghai Jiaotong Univ. (Agric. Sci.), 2005,23(1):10-14.
[24] 张彩峡,吴洪新,毕玉芬.多花黑麦草抗旱代谢通路挖掘[J].草业科学,2020,37(8):1528-1536.
ZHANG C X, WU H X, BI Y F. Mining metabolic pathways indrought tolerance of Lolium multiflorum [J]. Pratac. Sci., 2020,37(8):1528-1536.
[25] 祝山,王一波,李建宇,等.基于转录组探究PacC介导的苹果黑腐皮壳菌致病机制[J].农业生物技术学报, 2020, 28(12):2130-2140.
ZHU S, WANG Y B, LI J Y, et al .. Exploring PacC mediatedpathogenic mechanism of Valsa mali based on transcriptome [J]. J.Agric. Biotech., 2020, 28(12):2130-2140.
[26] 王一衡,黄胜楠,刘志勇,等.大白菜倍性变异引起花发育变化的microRNA调控机制研究[J].沈阳农业大学学报,2018,49(5):529-536.
WANG Y H, HUANG S N, LIU Z Y, et al .. Mechanism of floraldevelopment variation resulted from ploidy changes regulatedby microRNA in Chinese cabbage [J]. J. Shenyang Agric.Univ., 2018, 49(5):529-536.
基金项目:国家自然科学基金项目(31801872);山西省高等学校科技创新计划项目(2022L459); 山西大同大学人文社科项目(2022YGZX005);大同市科技攻关项目(2020044) ;大同大学产学研项目(2020CXZ14)。

