种子生物引发处理研究进展
摘要:近几十年来,微生物接种剂在可持续农业和生态系统恢复领域的使用激增,这种增长很大程度上归因于对植物和微生物相互作用的研究的进步、农作物绿色防控的社会需求以及生态系统管理中对可持续战略的需求。种子生物引发是近几年来比较热门的,用于提高种子活力及抗性的一种种子处理技术。采用种子生物引发技术可以促进种子萌发、提高萌发整齐度、提高幼苗抗性、改善营养状况等,从而达到抗病增产的目的。对种子生物引发在不同作物中的应用效果进行了归纳总结,同时对今后的发展趋势作出了分析,以期为种子生物引发技术的发展和推广应用及绿色高效生产栽培技术的创建奠定基础。
关键词:种子生物引发;微生物;可持续农业;木霉菌;荧光假单胞菌
Study on Development of Seed Bio-Priming Treatment
GU Anping1,LU Xiaoling1,LI Yunchuan2
(1Nujiang Lisu Autonomous Prefecture Agricultural Technology Extension Center,Nujiang 673299,Yunnan;
2Hexi Township People’s Government,Nujiang 671403,Yunnan)
种子是农业的“芯片”,紧扣国家粮食安全,关系老百姓的饭碗。高质量的种子能大幅减少农业生产投入并有效提高生产效率。为了让种子在田间最大限度地发挥自然潜力,人们开发了多样化的种子增强技术,其中种子引发技术由于其环保、高效和低成本等优势,受到种子研究者的广泛关注。
1973年Heydecker等[1]首次提出种子引发概念,指通过可控条件(慢速定量吸水、逐步回干等)对种子进行不引起损伤的播前预处理技术。前人对种子萌发的生物学机制进行了研究并提出种子引发技术,该技术目的是促进种子发芽、缩短萌发时间、提高幼苗的抗性、改善其营养状况。种子引发主要通过对渗透、温度、气体以及激素等的调节来提高幼苗抗逆性,对植物有多种促进作用。一是打破休眠,激活水解酶和参与储备物质的酶;二是调节多种胁迫响应途径的基因表达和蛋白质丰度,增强对干旱、盐度、低温、重金属及纳米颗粒胁迫的耐受性[2];三是改变活性氧的积累,种子引发主要通过影响前体蛋白和抗氧化蛋白的基因表达和酶活性来促进活性氧的积累[3];四是促进早期生长和提高根系探土面积,无论采用包衣还是丸粒化等种子增强技术,都能观察到预处理种子的发芽速度加快。
种子引发方法主要有水引发、滚筒引发、渗透引发、固体基质引发、激素引发、化学引发、生物引发和膜引发等[4],每种技术都有一定的优势和局限性,选择哪种特定的方法取决于植物种类、种子属性和引发的目的。用于种子引发的引发剂可包括纯水、多种合成化合物、盐、细菌悬浮液、激素和天然代谢物等。近年来种子引发提高作物产量的研究主要集中在微量元素引发(铁、锌、砷和钙等)、烟源化合物苷引发、水合静电、磁场引发、等离子体引发、纳米粒子引发、激素处理等方面,采用生物引发的报道较少。这些方法均有助于提高种子活力、发芽整齐度、幼苗活力,以及抵御非生物胁迫的能力,其中生物引发方法具有提高植物对生物胁迫抗性的额外优势,因此受到越来越多研究者的关注。
1 种子生物引发
1.1 种子生物引发概述 生物引发是目前流行的一种种子处理方法,指用特定浓度的有益微生物对种子进行一段时间的预处理,随后脱水回到初始状态的过程。这一过程使微生物附着在种皮上形成生物膜并与胚根建立早期关系,从而形成抵御外部威胁的第一道防线,有效减少许多种传和土传病害对种子萌发的不利影响,使种子发芽更快、更同步。同时在种子吸胀过程中部分微生物能够有机会被吸收到种子中,一些用作生物引发剂的细菌能够在根际繁殖,进而对作物生长发育起到长远的促进作用。相较于普通的引发方式,生物引发种子处理结合了生物(用保护性生物接种种子)和生理(种子水合)成分,可改善种子的生理、分子和抗逆功能,提高对非生物和生物胁迫的系统抗性[5-6]。
1.2 引发试剂类型
1.2.1 微生物引发剂 有益微生物(细菌和真菌)可直接添加到种子水合过程中,或者通过成膜剂包裹到种子上,这些微生物可以自由繁殖并在种子表面形成保护层,防止病原菌的侵害,并在播种后促进幼苗的生长和抗逆性。生物引发剂中最常用的微生物包括绿色木霉、哈茨木霉、荧光假单胞菌、枯草芽孢杆菌、固氮菌、放射农杆菌、灰绿链霉菌和沙雷
氏菌。
1.2.2 微生物代谢物 部分微生物产生的代谢产物有助于打破种子休眠,促进胚乳分解和胚细胞分裂,从而提高种子的萌发率和整齐率,还有部分微生物代谢产物如铁载体、抗生素,可以抑制土壤中的植物病原体,并通过诱导防御反应抑制植物疾病。Alzandi等[7]利用荧光假单胞菌代谢产物作为生物引发剂诱导番茄植株对枯萎病的系统抗性,结果发现用荧光假单胞菌代谢物引发的种子茉莉酸含量、多种抗氧化酶的活性显著高于对照,与细胞壁结合的过氧化物酶(POX)和苯丙氨酸解氨酶(PAL)活性显著增加,有助于细胞壁木质化,使其更坚固,不能被病原体穿透。也有研究表明,荧光假单胞菌通过次生代谢物拮抗病原菌和诱导寄主植物抗性基因表达两方面的作用机制来防控果斑病,最高保护率为62.25%[8],与其他生物制剂相比,荧光素对种子的营养和繁殖性能有明显改善。
1.2.3 复合生物引发剂 在实际应用中,为了获得更好的效果,往往会将多种生物引发剂或者多种引发方式联合使用。例如,可以将有益微生物与植物激素或抗真菌物质结合使用,以同时提高种子的抗逆性和萌发率。前人研究证明,与单一微生物处理相比,微生物联合体的应用可使宿主生长更快。Singh等[9]采用抗坏血酸、棘孢木霉BHU P-1和苍白杆菌BHU PB-1对番茄种子进行生物引发,发现与用番茄尖镰孢菌(FOL)进行单独处理相比,联合引发处理的植物中苯丙烷途径(木质素沉积)更为活跃;抗坏血酸和拮抗微生物处理的组合在10d内显著降低番茄植株的发病率至28%,降低了50个百分点。防御基因的转录表达分析证实,与水引发种子处理植物相比,在96h时,用抗坏血酸和苍白杆菌联合进行种子引发的处理中,苯胺裂解酶(2.1倍)、几丁质酶(0.92倍)、发病机制相关蛋白(1.58倍)和脂氧合酶(0.72倍)上调。据报道,番茄种子经哈茨木霉和荧光假单胞菌的无菌过滤液等体积混合引发有利于提高种子活力、促进植株生长、增加植株体内的保护酶活性,从而提高番茄植株的低温耐受性[10]。
需要注意的是,不同类型的种子生物引发剂具有不同的作用机制和效果,因此在选择使用时需要根据具体作物和栽培条件进行综合考虑。同时,为了确保生物引发剂的安全性和有效性,建议在使用前进行充分的试验和评估。
2 种子生理生化变化
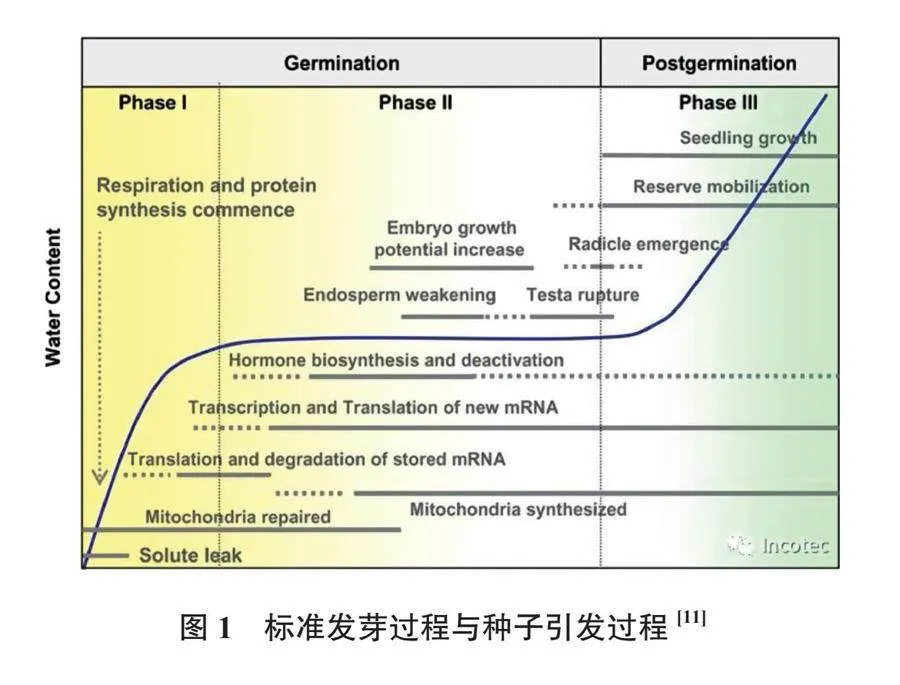
种子引发使种子在发芽的初始阶段经历第1个生化过程。如图1,曲线对应标准发芽过程:种子在第1阶段于合适的温度和湿度下吸收水分,在第2阶段生化过程被激活,并最终在第3阶段开始发芽(根和下胚轴从种子中长出)。常用的引发技术是“给水控制引发”,原理是调节第2阶段,使种子可以更加快速和整齐地发芽、提高种子在逆境下的发芽率、打破休眠、防止再次休眠、起到春化作用以及对种子进行修复。也就是说,种子在经历萌发第2阶段的一部分时被取出,然后缓慢干燥,该过程涉及将种子推进到发芽过程的相同阶段,当播种时,一旦田地条件(温度和湿度)适宜,第3阶段就可以继续,发芽会在更短的时间内发生,且出苗更均匀。
图1 标准发芽过程与种子引发过程[11]
种子引发技术采用物理、化学或生物处理来提高种子质量,将种子保持在萌发的第2阶段而不完全发芽,在这个过程中,种子内部会发生一系列的生理生化变化,包括诱导生化、分子和细胞反应,促进细胞修复机制,如DNA修复和过氧化物清除,这些机制是由核酸和蛋白质的合成、三磷酸腺苷(ATP)的产生等介导的,一旦代谢被激活,涉及的酶会产生联合作用,淀粉、脂肪和蛋白质等大型储存物质通过氧化呼吸转化为糖,使其可被运输和利用。Forti
等[12]的研究显示,水引发和生物引发改善了苜蓿种子的发芽率和生长发育,在分子水平上表现为与DNA损伤修复有关的基因OGG1(8-氧代鸟嘌呤DNA糖基化酶)和FPG(甲酰胺嘧啶-DNA糖基化酶)上调,这表明种子引发处理有助于修复DNA损伤,有助于胚胎细胞重新开始细胞周期发育和DNA复制;在引发2h和4h时,参与抗氧化反应的抗坏血酸过氧化物酶(APX)和超氧化物歧化酶(SOD)基因在水引发种子中上调,且APX和SOD基因的表达更多地受到生物引发处理(4h水引发和芽孢杆菌BP1菌株组合)的影响。据推测,引发过程会激发氧化应激,从而产生活性氧,过氧化氢酶和超氧化物歧化酶的水平在引发过程中增加,是响应这种应激而合成的,可以保护细胞免受因自然发生的脂质过氧化而导致的膜损伤[13]。Hussain等[14]研究发现,生物引发种子含有高水平的抗氧化酶,如过氧化氢酶、超氧化物歧化酶、过氧化物酶、谷胱甘肽还原酶、抗坏血酸等,有助于细胞防御系统的激活。
在水引发的基础上,种子生物引发涉及将有益或有效微生物引入种子和根际环境,其生理生化表现机制具体包括:(1)溶解或调动土壤大分子和矿物质营养元素,增加氮的固定,为植物提供养分。(2)诱导产生植物激素。前人研究表明,采用里氏木霉ID11D引发处理种子可通过分泌激素或类激素代谢产物(主要是生长素前体吲哚乙酸或吲哚-3-乙醇)来诱导植物减少H2O2的含量并促使可溶性蛋白和脯氨酸含量增加[15]。(3)通过影响植物激素水平、诱导抗氧化酶产量增加、激活应激反应基因和促进代谢调整提高植物对抗高盐、干旱、重金属毒性和高温应激的能力。例如,在玉米和小麦中施用哈茨木霉已被证明可以提高耐盐度和耐旱性,并刺激生理和形态生长参数。研究表明,利用解淀粉芽孢杆菌对水稻种子进行生物引发,可通过产生生长素、脱落酸以及调节盐胁迫条件下几种基因的表达和生物合成来提高水稻对盐分的耐受性并促进生长[16]。
在Pehlivan等[15]的研究中,里氏木霉ID11D生物引发后,在50mmol/L和100mmol/L的盐胁迫下玉米的根干重分别增加了39.82%和33.33%。(4)通过抑制植物病原体和其他有害微生物来影响植物健康。有益微生物通过竞争根际内的养分和生态位或产生拮抗物质(如氰化氢、铁载体、抗生素和抗菌代谢物)和溶解酶(如几丁质酶、葡聚糖酶和蛋白酶),激活防御相关酶,并诱导植物对广谱根和叶部病原体的系统抗性[17-18]。
3 生物引发的影响因素
3.1 引发剂 活性 引发剂的活性直接影响其引发效果。相关研究表明,微生物活性在种子早期发育阶段中(例如发芽和初始幼苗生长)至关重要[19]。活性高的引发剂能够更好地与种子天然微生物群落争夺种子表面的空间,增加繁殖速度。微生物菌剂的浓度 生物引发剂的浓度直接影响其引发效果。浓度过低,种子表面无法形成有效的生物膜,导致微生物繁殖系数低、在种子上的定殖效率差等问题;浓度过高的引发剂可能对种子有毒害作用,根据前人的研究结果,一般认为微生物浓度在106~108cfu/mL引发效果较好。Singh等[9]分别测试了4个浓度的棘孢木霉BHU P-1和苍白杆菌BHU PB-1,结果显示棘孢木霉BHU P-1孢子剂量1×107cfu/mL对种子发芽最有效,发芽率最高(91.67%),苍白杆菌 BHU PB-1细胞浓度1×108cfu/mL对引发最有效,发芽率最高(98.33%)。柳旭等[20]研究发现,用菌株BCR5处理扁穗雀麦老化种子的最优方法为时间72h、菌浓度1×107cfu/mL。渗透势 通过有效控制渗透势,使种子适度水合而不发生可见的萌发,是液体引发和生物引发处理的关键。渗透势过低引起吸胀伤害,过高则影响种子水合作用,渗透势参数因作物种类不同而有所差异。
3.2 引发时间和条件
3.2.1 时间 引发时间的长短对种子的萌发效果有显著影响。过短的引发时间可能无法充分激活种子的生理机制,而过长的引发时间则可能导致种子老化或受到吸胀损害。一般情况下,引发时间随微生物种类、菌浓度、溶液渗透势以及植物种类而变化。研究表明,引发时间会对抗氧化酶活性和活性氧产生影响,比如用300µg/mL大蒜水提取物引发茄子种子4h有积极影响,但长时间暴露在相同浓度下会抑制种子发芽过程,并诱导幼苗发生氧化应激,导致丙二醛含量升高[21]。据报道,种子生物引发可提高青兰种子的萌发、幼苗生长和精油产量,分别用多粘类芽孢杆菌(Bacillus polymixa)和圆褐固氮菌(Azotobacter chroococcum)进行种子引发,第13天时,用2类菌种接种10min、20min处理的种子发芽率分别为21.4%和11.6%、10.2%和1.8%,此时对照种子才开始发芽[22]。曲正[23]在油菜种子生物引发试验中发现,随着引发时间的增加,幼苗携带SsHADV-1(生防因子)的比率增加,引发时间为12h时幼苗携带率最高,为83.33%,显著高于引发4h和8h。
3.2.2 温度 温度是影响种子萌发的重要因素之一。适宜的温度能够加快种子的新陈代谢速率,促进种子的萌发和生长,大多数种子在15~25℃引发效果较好。生物引发处理中,还需要结合生物菌剂适宜的繁殖温度适当调节,过高的温度可能导致种子膜系统和呼吸能力等被破坏,进而导致发芽速度降低,抑制幼苗生长和发育,降低对不利环境条件的耐受性,增加异常幼苗的比例[24];而过低的温度则可能抑制种子的生理生化反应,并且不利于微生物存活。研究证明,随着引发温度的增加,油菜幼苗携带SsHADV-1的比率不断减少,引发温度为20℃时幼苗SsHADV-1检出率可达75.0%,显著高于引发温度为26℃的检出率,但与23℃引发相比没有显著性差异[23]。
3.2.3 湿度 湿度对种子的吸水速率和萌发过程有重要影响。适宜的湿度条件能够满足种子萌发所需的水分,促进种子的正常萌发,保证种子生物引发的最终效果。
3.3 种子质量和一致性
3.3.1 作物种类和品种 不同作物、不同品种对生物引发剂的响应程度不同。一般认为淀粉含量高的种子吸水能力相较于蛋白质含量高的种子弱,高蛋白质和高油的亲水性有助于种子吸收水分,在温湿度高的情况下,种子生化反应速率加快,种子更容易产生吸胀损伤和劣变[25]。在大豆品种加速老化试验中,在42℃高温、95%高湿的双重胁迫下,细菌处理在品种Atlas中的作用主要是积极的,而在品种Teona中的作用则相反,表明大豆品种Atlas与Teona对细菌处理的反应不同[19]。采用1×107cfu/mL
哈茨木霉孢子液预处理增加了玉米在低温胁迫下的生理参数和出苗率,提高了根和叶的过氧化氢酶活性,不耐寒品种KSC703的根和叶的过氧化氢酶活性高于不耐寒品种AR68[26]。因此,在选择生物引发剂时需要根据种子的品种特性进行选择和调整。
3.3.2 种子一致性 种皮的性质和种子的大小是影响引发效果的物理限制因素,与较大的种子相比,较小的种子携带的引发剂较少,形状一致且大小均匀的种子批,更有助于引发处理时提高出苗一致性的效果。
3.3.3 种子活力 高活力种子在引发后处于更高级的生理阶段,几乎处于第3阶段,引发过程控制不好种子更容易变质。当低活力种子引发时,需要一定时间来修复代谢损伤,然后才能发芽,引发处理的效果会比较明显。
3.4 引发后回干和贮藏 为了实现引发处理的最大潜力,需要严格控制前面讨论的所有因素。在引发处理后,为了种子的商业应用,回干以及随后的种子贮藏成为该技术的关键组成部分。水分含量的增加可能导致种子呼吸速率增加,从而产生热量,其保质期也随之缩短。为了便于应用,种子应在引发处理后缓慢回干到一定的湿度水平,以供播种前的贮藏。同时,贮藏的环境应干净干燥,储存时间不宜过久,不恰当的贮藏条件和持续时间可能会改变引发效果。
综上所述,种子生物引发的影响因素是多方面的,需要在实践中根据具体情况进行综合考虑和调整。通过合理选择生物引发剂、优化引发条件、控制贮藏的条件等措施可以有效提高种子生物引发的最终效果和在生产上的应用。
4 种子生物引发的作用效果
目前,生物技术工具正被用于补充传统的作物生产管理,其中将有益微生物和植物的相互作用整合到农作物生产计划中是提高产量的可持续解决方案。生物接种剂中使用的有益微生物可分为植物生长促进微生物(PGPM)或生物防治剂(BCA)[27]。PGPM大多分离于土壤、植物根际土壤,少部分为植物内生菌。根据其作用机制,还可分为固氮剂、磷酸盐增溶剂、植物刺激剂、植物抗性诱导剂和植物病原体拮抗剂等[28]。如今,生物引发技术已在玉米、小麦、大豆、豌豆、茄子、番茄、红花和向日葵等多种作物中显示出积极效果,显著提高了种子发芽率、幼苗活力、植株生长量和产量,用生物引发处理的种子培育出的幼苗通常更健壮,更能抵抗生物胁迫。此外,许多使用各种生物制剂进行生物引发的实例已显示出对多种病原体,如镰刀菌、黄萎病、炭疽菌、丝核菌和菌核菌的积极影响,一些生长繁殖快、抗逆性强的菌株,如土壤杆菌(Agrobacterium)、哈茨木霉(Trichoderma harzianum)和芽孢杆菌(Bacillus)、荧光假单胞菌(Pseudomonas fluorescens)是目前微生物制剂的研究热点。
4.1 细菌生物制剂在种子生物引发中的应用 有益细菌有两种类型,一种是共生联合的细菌,另一种是存在于植物根区附近的自由生活细菌。从根际分离参与作物生产的细菌被称为植物生长促进根际细菌(PGPR),这些有益细菌在农作物生产中得到了广泛应用。在过去的几十年中,人们已鉴定出多种PGPR属,包括固氮菌属、芽孢杆菌属、节杆菌属、假单胞菌属、肠杆菌属、链霉菌属、伯克霍尔德氏菌属、克雷伯氏菌属和沙雷氏菌属等,并且有研究表明,它们作为生物肥料和生物防治剂可提高不同作物的生长状况和产量[29-31]。其中,荧光假单胞菌繁殖速度快,在植物根部适应性强,具有抑菌广谱性,被广泛应用在各种农业生产中,已成为近年来研究最多、最具价值的生防菌[32]。通过种子生物引发接种PGPR表现出协同效应,其主要作用是提高种子发芽均匀性,提高养分利用率,通过诱导防御相关蛋白、植物激素、抗氧化剂、多酚等的生物合成来提高植物免疫力[33],从而促进植物的生长发育。
据报道,用芽孢杆菌、假单胞菌和微杆菌等内生细菌和根际细菌对小麦种子进行生物引发,可通过增强种子发芽、幼苗活力和鲜重来改善植物生长。Miljakovi等[19]利用大豆慢生根瘤菌(Bradyrhizobium japonicum)和巨大芽孢杆菌(Bacillus megaterium)对大豆进行生物引发,芽孢杆菌处理的发芽率比对照提高3.5%、根长增加8.9%、地上部干重增加18.9%、幼苗活力指数提高12.5%,大豆慢生根瘤菌引发处理后,发芽势提高3.4%、芽长增长8.2%;与对照相比,两种细菌的联合处理效果最好,幼苗活力指数提高48.5%,芽干重增加9.3%,异常幼苗减少2.8%,根干重的最高增幅
为70.2%。用PGPR联合体(圆褐固氮菌Azotobacter chroococcum和生脂固氮螺菌Azospirillum lipoferum)进行种子生物引发显著提高了大麦的干物质积累、千粒重(容重)、收获指数、生物产量和籽粒产量[34]。
在某些情况下,即使在盐胁迫下,种子引发也能通过提高α-淀粉酶活性来调节其生理生化状态。研究显示,在室内适宜条件下,解淀粉芽孢杆菌SNMB1引发处理种子能够提高玉米种子活力,显著提高种子的SOD活性及吸胀48h的α-淀粉酶活性,增幅分别为53.66%和41.84%;在盐胁迫下,该处理也显著提高了吸胀后期种子的α-淀粉酶活性,幼苗生长第7、14天的根系表面积分别增加了32.46%、9.68%,比水引发分别增加44.72%、8.48%;在禾谷镰刀菌侵染胁迫下,SNMB1处理的种子受禾谷镰刀菌侵染伤害最小,幼苗地上部干重分别比水引发和无处理增加了16.48%和12.30%[35]。在增强植物抗逆性方面,据报道,铜绿假单胞菌PAR对氟胁迫下番茄植物的种子萌发、根长、茎高、相对含水量、叶面积等性状有显著影响,在铜绿假单胞菌PAR处理的植株中,叶绿素含量增加,丙二醛水平降低,表明光合效率提高,氧化胁迫减轻;在10ml/L、
20ml/L、40ml/L和80ml/L的NaF胁迫条件下,脯氨酸含量比对照提高了209.25%~302.47%,可溶性糖含量比对照提高了141.12%~218.87%;同时,该菌株改变了过氧化氢酶、抗坏血酸、谷胱甘肽还原酶等抗氧化酶活性,以上均有助于提高幼苗的抗逆性[36]。
此外,种子生物引发处理具有修复老化种子的能力,有研究表明,植物根际促生菌BCR5与扁穗雀麦老化种子引发处理可降低丙二醛含量,一定程度上恢复种子活力,提高老化种子的发芽率,并促进胚根和胚芽的伸长[20]。
4.2 真菌生物制剂在种子生物引发中的应用 广泛的生防真菌、促生长真菌通过与植物的相互作用而对植物生长起到促进作用,或是增强植物抵抗生物和非生物胁迫的能力,其中木霉属(Trichoderma)是最常用的生防真菌,因为木霉菌对环境的适应性强,菌丝生长速度较快,能有效与病原菌竞争空间和养分,对植物病原菌(主要是真菌和线虫)具有明显的拮抗作用。木霉属通常寄生在根表皮、外皮层和根际,是潜在的植物共生菌,也是重要的生物防治剂,且具有促生长、强拮抗力、高产多种酶和生态修复等作用,广泛应用于农业、工业和生态环境领
域[37],据报道,全球市场上大部分生物农药都是基于木霉配方。
木霉属真菌对作物有多方面的促进作用,一是对病害防治有明显效果,如从鱼腥草根际土壤中分离到的钩状木霉菌菌株ZQ202104的菌丝体、小分子代谢产物及挥发性成分对辣椒炭疽菌和薏苡黑粉菌均具有抑制作用,特别是对薏苡黑粉菌的生长抑制效果明显[38],将哈茨木霉INAT11应用于种子能够降低黄萎病菌和禾谷镰孢病的发生率[39],并且哈茨木霉不但能有效防治菜豆炭疽病、棉花苗期立枯病,还有促进棉花、菜豆生长发育的作用[40]。二是对连作障碍有修复效果,生物炭与棘孢木霉(Trichoderma asperellum)均对连作障碍的修复有一定作用,有研究表明生物炭与棘孢木霉协同通过提高黄瓜初花期茎粗、株高、土壤速效钾养分和盛果期土壤蔗糖酶活性以及黄瓜根腐病的防治效果来修复黄瓜的连作障碍[41]。三是促使生物量不同程度地增加,如利用哈茨木霉分生孢子拌施处理拟南芥和烟草种子后植株均出现不同程度生物量的增加[42]。四是提高生长参数,采用绿色木霉和丛枝菌根真菌处理洋葱后不仅能提高洋葱的鲜重、干重、根长、茎长和叶面积等生长参数,还能提高洋葱叶片的叶绿素、类胡萝卜素和总色素含量[43]。五是降低逆境胁迫的危害,利用哈茨木霉(Trichoderma harzianum)AK20G菌株作为生物防治剂,接种后可有效降低低温、高盐胁迫等不利影响,还能够促进光合作用和生长速率[44]。六是激活防御系统,哈茨木霉在十字花科植物根部定植和诱导系统防御中起着关键作用,十字花科植物中Thkel1的过度表达通过诱导茉莉酸介导的系统防御来改善对病原体的反应,通过调节黑芥子酶活性促进根部定植,从而提高植物生产力[45]。有研究表明,用哈茨木霉进行种子引发可触发接种霜霉病病原体的葡萄树的防御反应,最高防病率可在第4天达82.9%;同时,防御酶(即苯丙氨酸氨裂解酶、过氧化物酶和1,3-葡聚糖酶)的活性上调,木质素、胼胝质和过氧化氢的积累在接种后12h开始增加,并在接种后24h达到最高[46]。
5 总结与展望
健康和高活力的种子是现代农业的基础。尽管使用化学试剂进行种子处理是一种低剂量的农药使用,但如今的种植者正在考虑如何在减少合成化学产品投入的同时减轻对环境的污染。因此,开发高效、低成本、环境友好且可持续的方法来改善田间和温室条件下种子的健康和性能是很有必要的。有益微生物可以改善植物的健康和生产力,对环境的影响较小,其功效在很大程度上取决于应用技术。种子生物引发利用有益微生物来处理种子,在改善种子的生理功能方面表现出巨大的潜力,同时有可能提供一种安全、无污染和环保的疾病控制方式,此外,生物引发介导的分子和代谢重编程赋予植物抗逆性,改善植物健康、养分利用效率和田间生长,从而为持续提高作物产量提供一种创新的作物保护工具。
尽管生物引发在农业系统中有着光明的前景,但其在商业化和农民利用等方面仍处于起步阶段。种子生物引发可以将有益微生物输送到土壤和根际环境系统,使其定植于作物的新生根系,这也是一种将细菌应用于小种子作物的有效方法。然而,在种子处理和储存期间保持种子表面的大量微生物是保留种子生物引发效果的主要限制条件,这关系着在商业化条件下微生物的升级和生产过程中保持产品的稳定性、有效性和质量。因此,实际应用中需要更好地了解微生物、种子和配方成分之间的相互作用,以开发功能性微生物接种剂。
新型种子处理技术的研究是作物保护市场中发展最快的领域之一,许多相关研究单位已基于长效保质期、有效微生物菌株、胁迫下的稳定性、应用于种子的简便性和生产经济性等因素,对各种作物品种的生物引发的功效性、可靠性和实用性进行有价值的改进。拜耳、先正达、巴斯夫、科迪华等全球大型种子、农资公司正在大力研发生物防治剂作为种子处理剂,这些产品也可为防止特定病原体提供相应的解决方案。尽管种子生物处理剂目前还无法取代化学种子处理剂,但其兼具保护环境、保护植物和促进植物生长等多重优势,随着全球对农产品安全的重视和对有机作物需求的增加,这些产品可能比化学产品在保护作物方面还具有生态优势,在减少化肥、农药对环境的污染和降低农业生产对环境的负面影响方面具有很大的潜力。
参考文献
[1] Heydecker W,Higgins J,Gulliver R L.Accelerated germination by osmotic seed treatment.Nature,1973,246:42-44
[2] Lukasz W,Katarzyna L,Szymon K.Molecular processes induced in primed seeds—increasing the potential to stabilize crop yields under drought conditions.Journal of Plant Physiology,2016,203:116-126
[3] Boucelha L,Djebbar R,Abrous-Belbachir O.Vigna unguiculata seed priming is related to redox status of plumule,radicle and cotyledons.Functional Plant Biology,2019,46(6):584-594
[4]闵丹丹,范燕,郭正刚.紫花苜蓿种子水引发条件的优化.草业科学,2016,33(4):669-673
[5] Bruisson S,Zufferey M,L’Haridon F,Trutmann E,Anand A,Dutartre A,De Vrieze M,Weisskopf L.Endophytes and epiphytes from the grapevine leaf microbiome as potential biocontrol agents against phytopathogens.Frontiers in Microbiology,2019,10:2726
[6] Compant S,Samad A,Faist H,Sessitsch A.A review on the plant microbiome:Ecology,functions,and emerging trends in microbial application.Journal of Advanced Research,2019,19:29-37
[7] Alzandi A A,Naguib D M.Pseudomonas fluorescens metabolites as biopriming agent for systemic resistance induction in tomato against Fusarium wilt.Rhizosphere,2019,11:100168
[8]汪心玉,芦钰,邱艳红.荧光假单胞菌2P24防控瓜类果斑病机制初探.中国生物防治学报,2023,39(3):575-584
[9] Singh P,Singh J,Ray S,Rajput R S,Vaishnav A,Singh R K,Singh H B.Seed biopriming with antagonistic microbes and ascorbic acid induce resistance in tomato against Fusarium wilt.Microbiological Research,2020,237:126482
[10]李亚波,张文健,何丽萍.不同生物引发条件对番茄冷胁迫下种子活力和幼苗生理特性的影响.南方农业学报,2024,55(2):531-539
[11] Incotec盈可泰.神秘的引发技术.(2017-05-22)[2024-07-26].https://mp.weixin.qq.com/s/ZKaTCR13AVnVTx7Hca8K2A
[12] Forti C,Shankar A,Singh A,Balestrazzi A,Prasad V,Macovei A.Hydropriming and biopriming improve Medicago truncatula seed germination and upregulate DNA repair and antioxidant genes.Genes,2020,11(3):242
[13] Varier A,Vari A K,Dadlani M.The subcellular basis of seed priming.Current Science,2010,25:450-456
[14] Hussain S,Hussain S,Khaliq A,Ali S,Khan I.Physiological,biochemical,and molecular aspects of seed priming//Hasanuzzaman M,Fotopoulos V.Priming and pretreatment of seeds and seedlings.Singapore:Springer,2019,43-62
[15] Pehlivan N,Yesilyurt A M,Durmus N,Karaoglu S A.Trichoderma lixii ID11D seed biopriming mitigates dose dependent salt toxicity in maize.Acta Physiologiae Plantarum,2017,39(3):1-12
[16] Shahzad R,Khan A L,Bilal S,Waqas M,Kang S M,Lee I J.Inoculation of abscisic acid-producing endophytic bacteria enhances salinity stress tolerance in Oryza sativa.Environmental and Experimental Botany,2017,136:68-77
[17] Berg G,Köberl M,Rybakova D,Müller H,Grosch R,Smalla K.Plant microbial diversity is suggested as the key to future biocontrol and health trends.FEMS Microbiology Ecology,2017,93(5):fix050
[18] Meena M,Swapnil P,Divyanshu K,Kumar S,Harish,Tripathi Y N,Zehra A,Marwal A,Upadhyay R S.PGPR-mediated induction of systemic resistance and physiochemical alterations in plants against the pathogens:current perspectives.Journal of Basic Microbiology,2020,60(10):828-861
[19] Miljakovi D,Marinkovi J,Tamindži G,Dordevi V,Tintor B,Miloševi D,Ignjatov M,Nikoli Z.Bio-priming of soybean with Bradyrhizobium japonicum and Bacillus megaterium:Strategy to improve seed germination and the initial seedling growth.Plants,2022,11(15):1927
[20]柳旭,周文楠,陈钊,赵恬,刘倩,高娅妮,崔健,王佺珍.根际促生菌对扁穗雀麦老化种子萌发和幼苗生长的影响.黑龙江畜牧兽医,2018(11):24-31
[21] Ali M,Hayat S,Ahmad H,Ghani M I,Amin B,Atif M J,Cheng Z.Priming of Solanum melongena L.seeds enhances germination,alters antioxidant enzymes,modulates ROS,and improves early seedling growth:indicating aqueous garlic extract as seed-priming bio-stimulant for eggplant production.Applied Sciences,2019,9(11):2203
[22] Bidabadi S S,Mehralian M.Seed bio-priming to improve germination,seedling growth and essential oil yield of Dracocephalum kotschyi Boiss,an endangered medicinal plant in Iran.Gesunde Pflanzen,2020,72:17-27
[23]曲正.核盘菌弱毒株DT-8生物引发油菜种子技术研发及其促进油菜抗病机理.武汉:华中农业大学,2020
[24] Flores P,Poggi D,Gariglio N,Catraro M.Accelerated test to assess vigor of Juglans nigra seeds.International Journal of Fruit Science,2020,20(2):221-232
[25] Shelar V R,Shaikh R S,Nikam A S.Soybean seed quality during storage:a review.Agricultural Reviews,2008,29(2):125-131
[26] Afrouz M,Sayyed R Z,Fazeli-Nasab B,Piri R.Almalki W,Fitriatin B N.Seed bio-priming with beneficial Trichoderma harzianum alleviates cold stress in maize.Peer Journal,2023,11:e15644
[27] Lugtenberg B,Kamilova F.Plant-growth-promoting rhizobacteria.Annual Review of Microbiology,2009,63:541-556
[28] Parnell J J,Berka R,Young H A,Sturino J M,Kang Y,Barnhart D M,DiLeo M V.From the lab to the farm:an industrial perspective of plant beneficial microorganisms.Frontiers in Plant Science,2016,7:1110
[29] Islam F,Yasmeen T,Ali Q,Ali S,Arif M S,Hussain S,Rizvi H.Influence of Pseudomonas aeruginosa as PGPR on oxidative stress tolerance in wheat under Zn stress.Ecotoxicology and Environmental Safety,2014,104:285-293
[30] Paulucci N S,Gallarato L A,Reguera Y B,Vicario J C,Cesari A B,de Lema M B,Dardanelli M S.Arachis hypogaea PGPR isolated from Argentine soil modifies its lipids components in response to temperature and salinity.Microbiological Research,2015,173:1-9
[31] Younesi O,Moradi A.Effects of plant growth-promoting rhizobacterium(PGPR)and arbuscular mycorrhizal fungus(AMF)on antioxidant enzyme activities in salt-stressed bean(Phaseolus vulgaris L.).Agriculture(pol’nohospodárstvo),2014,60(1):10-21
[32]刘佳莉,方芳,史煦涵.2株盐碱地燕麦根际促生菌的筛选及其促生作用研究.草业学报,2013,22(2):132-139
[33] Kumar S,Arutselvan R,Greeshma K,Bodhankar S,Akash A U,Prasad V S,Nehela Y,Singh U B,Bhupenchandra I,Sen A,Rajput L S.Unraveling the seed bio-priming contours for managing plant health.Journal of Plant Growth Regulation.https://doi.org/10.1007/s00344-024-11277-z
[34] Mirshekari B,Hokmalipour S S,Sharifi R S,Farahvash F,Ebadi-khazine-gadim A.Effect of seed biopriming with plant growth promoting rhizobacteria(PGPR)on yield and dry matter accumulation of spring barley(Hordeum vulgare L.)at various levels of nitrogen and phosphorus fertilizers.Journal of Food,Agriculture amp; Environment,2012,10:314-320
[35]沙欣尧.解淀粉芽孢杆菌引发处理种子对玉米农艺与产量性状的影响.泰安:山东农业大学,2023
[36] Singh A,Patani A,Patel M,Vyas S,Verma R K,Amari A,Osman H,Rathod L,Elboughdiri N,Yadav V K,Sahoo D K,Chundawat R S,Patel A.Tomato seed bio-priming with Pseudomonas aeruginosa strain PAR:a study on plant growth parameters under sodium fluoride stress.Frontiers in Microbiology,2024,14:1330071
[37]侯怡婷,杨静雅,韩丽,赵爽,赵丽,贺学礼.河北安国药用植物根区土壤木霉物种多样性.菌物研究,2020,18(3):162-173
[38]郑传奇,令狐美林,舒忠泽.钩状木霉的分离鉴定及对辣椒炭疽菌和薏苡黑粉菌的抑菌活性.南方农业学报,2023,54(7):2050-2059
[39] Ferrigo D,Mondin M,Ladurner E,Fiorentini F,Causin R,Raiola A.Effect of seed biopriming with Trichoderma harzianum strain INAT11 on Fusarium ear rot and Gibberella ear rot diseases.Biological Control,2020,147:104286
[40]蒋继志,梁廷银,王怀远,王兴哲.致病疫霉拮抗菌荧光假单胞菌的筛选及离体防病作用.河北农业大学学报,2013,36(3):72-76
[41]金鸽.生物炭与棘孢木霉协同对黄瓜连作障碍修复效果研究.秦皇岛:河北科技师范学院,2024
[42]温瑞成,蔡静波,李芮,程志强,张建峰,董浩.平菇菌糠培养哈茨木霉对植物生长的促进作用.东北林业大学学报,2018,46(7):67-72
[43] Metwally R A,Al-Amri S M.Individual and interactive role of Trichoderma viride and arbuscular mycorrhizal fungi on growth and pigment content of onion plants.Letters in Applied Microbiology,2020,70(2):79-86
[44] Ghorbanpour A,Salimi A,Ghanbary M A T,Pirdashti H,Dehestani A.The effect of Trichoderma harzianum in mitigating low temperature stress in tomato(Solanum lycopersicum L.)plants.Scientia Horticulturae,2018,230:134-141
[45] Poveda J,Hermosa R,Monte E,Nicolás C.The Trichoderma harzianum Kelch protein ThKEL 1 plays a key role in root colonization and the induction of systemic sefense in Brassicaceae plants.Frontiers in Plant Science,2019,10:1478
[46] Kamble,M V,Joshi S M,Hadimani S,Jogaiah S.Bio-priming with rhizosphere Trichoderma harzianum elicit protection against grapevine downy mildew disease by triggering histopathological and biochemical defense responses.Rhizosphere,2021,19:100398
(收稿日期:2024-07-26)

