趋化因子CCL19 诱导巨噬细胞M1 极化对小鼠慢性胰腺炎的促进作用及其机制

[摘 要] 目的:探讨趋化因子C-C基序配体19(CCL19) 诱导巨噬细胞M1极化对小鼠慢性胰腺炎的促进作用,并阐明其相关机制。方法:选取10只雄性C57BL/6N小鼠,提取小鼠胰腺腺泡细胞和腹腔巨噬细胞,构建巨噬细胞-腺泡细胞共培养体系,共培养体系细胞分为对照组、模型组和小干扰RNA CCL19 (si-CCL19) 组,显微镜下观察各组腺泡细胞形态表现。随机选取40 只小鼠,分为正常组和慢性胰腺炎组,每组20 只。HE 染色观察2 组小鼠胰腺组织病理形态表现,免疫荧光染色法观察2 组小鼠胰腺组织中角质蛋白19 (CK19)、淀粉酶、M1 型巨噬细胞相关标志物诱导型一氧化氮合酶(iNOS) 和F4/80 表达情况及各组共培养体系细胞中腺泡细胞形态表现及CK19 和淀粉酶表达情况,酶联免疫吸附试验(ELISA) 法检测2 组小鼠血清和各组共培养体系细胞中肿瘤坏死因子α (TNF-α)、白细胞介素(IL)-6 和IL-1β 水平, 免疫组织化学法观察2 组小鼠胰腺组织中CCL19 蛋白表达情况,Western blotting 法检测2 组小鼠胰腺组织和各组共培养体系细胞中CCL19 蛋白和关键蛋白核因子κB(NF- κB) 信号通路相关蛋白P65、磷酸化P65 (p-P65)、κB 抑制物激酶α/β (IKKα/β)、磷酸化IKKα/β(p-IKKα/β)、IκBα和磷酸化IκBα(p-IκBα) 表达水平。结果:HE染色,正常组小鼠胰腺组织腺泡细胞的紧密排列;与正常组比较,慢性胰腺炎组小鼠胰腺组织腺泡细胞产生了明显的空泡化,即腺泡细胞导管化,小鼠胰腺炎模型制备成功。免疫荧光染色法,与对照组比较,模型组腺泡细胞严重的空泡化明显,CK19 表达明显增加,淀粉酶表达明显减少;与模型组比较,si-CCL19 组中腺泡细胞导管化程度降低,CK19 表达明显减少,淀粉酶表达明显增加;与正常组比较,慢性胰腺炎组小鼠胰腺组织中淀粉酶表达明显减少, CK19 和M1 型巨噬细胞标志物iNOS 及F4/80 表达均明显增加。ELISA 法, 与正常组比较, 慢性胰腺炎组小鼠血清中TNF-α、IL-6 和IL-1β 水平均明显升高(Plt;0. 05);与对照组比较,模型组细胞中TNF-α、IL-6 和IL-1β 水平均明显升高(Plt;0. 05);与模型组比较,si-CCL19 组细胞中TNF-α、IL-6 和IL-1β 水平均明显降低(Plt;0. 05)。免疫组织化学法,与正常组比较,慢性胰腺炎组小鼠胰腺组织中CCL19 蛋白表达明显增加。Western blotting 法,与正常组比较,慢性胰腺炎组小鼠胰腺组织中CCL19 蛋白表达水平和NF-κB 信号通路相关蛋白p-IKKα/β、p-P65及p-IκBα 蛋白表达水平均明显升高(Plt;0. 05)。与对照组比较,模型组细胞中CCL19、p-IKKα/β、p-P65和p-IκBα 蛋白表达水平均明显升高(Plt;0. 05);与模型组比较,si-CCL19 组细胞中CCL19、p-IKKα/β、p-P65和p-IκBα蛋白表达水平均明显降低 (Plt;0. 05)。结论:CCL19通过NF-κB信号通路促进巨噬细胞M1 型极化,诱导炎症微环境的产生,促进胰腺炎的发生发展。
[关键词] 胰腺炎; C-C 基序配体19; 巨噬细胞; M1 型极化; 核因子κB
[中图分类号] R364. 5 [文献标志码] A
胰腺是体内仅次于肝脏的第二大腺体,由内分泌部和外分泌部组成,外分泌部主要由腺泡细胞和导管细胞构成。腺泡细胞可以产生和释放大量消化酶,包括淀粉酶和脂肪酶等,这些消化酶经过胰腺导管输送至十二指肠,对机体消化过程发挥重要作用。在胰腺炎过程中,一部分胰腺腺泡细胞发生形态学改变,转变为管状结构,成为导管细胞,不再表达腺泡细胞标记物,但在治疗后胰腺导管细胞同样具有向腺泡细胞转化的潜能[1]。慢性胰腺炎是由多种病因导致的,胰酶在胰腺内被过度激活后引起胰腺组织自身消化、水肿、出血甚至坏死的炎症反应[2]。
免疫微环境是炎症微环境的重要组成部分,免疫微环境的改变是导致炎症产生的主要因素,其中巨噬细胞是免疫微环境的重要组成部分[3]。研究[4]显示:巨噬细胞的M1 型极化会通过分泌白细胞介素(interleukin, IL)-1β、IL-6 和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α) 等炎症因子促进炎症的产生。核因子κB (nuclear factor-kappa B,NF-κB) 信号通路,即NF- κB/κB 抑制物激酶α/β(inhibitor of κB kinase-α/β, IKKα/β) /磷酸化IKKα/β(phosphorylated IKKα/β, p-IKKα/β) /P65/磷酸化P65 (phosphorylated P65, p-P65) /IκBα/磷酸化IκBα (phosphorylated IκBα, p-IκBα), 其调控巨噬细胞炎症反应,是巨噬细胞M1 型极化的重要信号通路[5]。C-C基序配体19(C-C motif ligand 19,CCL19)是CC 类趋化因子家族成员,又称为巨噬细胞炎性蛋白3β,是内环境稳定性趋化因子。其主要由中性粒细胞、淋巴内皮细胞和淋巴结T淋巴细胞释放,趋化幼稚T 淋巴细胞和成熟树突细胞(dendriticcells,DC)[6]。CCL19 在慢性胰腺炎中对免疫微环境具体的调控机制尚未完全阐明。因此,本研究探讨CCL19 对NF-κB 信号通路的调节作用,阐明其诱导巨噬细胞M1 型极化促进胰腺炎发生的作用机制,为慢性胰腺炎的临床治疗提供参考。
1 材料与方法
1. 1 实验动物、主要试剂和仪器 雄性C57BL/6N小鼠50 只,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号:SCXK (辽) 2020-0001。RPMI-1640 培养基、Waymouth 培养基、胎牛血清和RIPA 缓冲液购自北京Biosharp 公司, NewSuper ECL 检测试剂盒购自北京百欧泰生物科技有限公司,兔抗CCL19 多克隆抗体、兔抗p-IKKα/β多克隆抗体、兔抗IKKα/β 多克隆抗体、兔抗p-P65多克隆抗体、兔抗P65 多克隆抗体、兔抗p-IκBα 多克隆抗体、兔抗CCL19 多克隆抗体和兔抗GAPDH多克隆抗体购自英国Abcam 公司, 小干扰RNACCL19 (small interfering RNA CCL19,si-CCL19)购自广东省广州锐博生物有限公司, 即用型HRP标记的羊抗兔二抗购自北京欣博盛生物科技有限公司,TNF-α、IL-6 和IL-1β 细胞因子酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测试剂盒购自广东省深圳康肽生物科技有限公司,荧光标记DAPI 购自北京索莱宝科技有限公司,IκBα一抗、 免疫荧光兔抗角质蛋白19( cytokeratin 19,CK19) 多克隆抗体、兔抗Amylase 多克隆抗体、兔抗F4/80 多克隆抗体、兔抗诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS) 多克隆抗体、Alexa Fluo488 山羊抗兔二抗和Rhodamine 山羊抗兔二抗购自美国Proteintech 公司,免疫组织化学试剂购自青岛海氏海诺医疗科技有限公司,其他生化试剂均为进口分装或国产分析纯。低温高速离心机和-80°C 冰箱购自美国Thermo 公司,酶标仪购自美国Bio-Tek 公司,倒置相差显微镜和倒置荧光显微镜购自日本Olympus 公司,电泳仪购自北京六一有限公司。
1. 2 小鼠胰腺腺泡细胞和腹腔巨噬细胞提取 提取胰腺腺泡细胞: 胰蛋白酶抑制剂加入1% 青-链霉素双抗和血清培养基混匀,磷酸二氢钾溶液、丙酮酸钠和1% 青-链霉素双抗消化液备用。取5 只小鼠,脱臼处死,置于75% 乙醇溶液浸泡,立即切取小鼠胰腺组织,磷酸盐缓冲液(phosphate bufferedsaline,PBS) 洗涤2 次,置于消化液中剪碎消化20 min。吸取上清液至离心管中, 皿中加入消化液,二次消化。吸出所有消化液,加入含大豆酶抑制剂的Waymouth 培养基终止消化, 1 720 r·min-1离心2 min, 弃上清液, 加入培养基, 重复离心1 次,弃上清。乙酸溶液中里加入鼠尾胶原后,加入到培养皿中,冲洗内壁。紫外照射放置1 h,PBS 缓冲液冲洗2 次,获得胰腺腺泡细胞,吸取培养液并加入新的培养基培养。提取腹腔巨噬细胞: 取5 只小鼠, 脱臼处死,置于75% 乙醇溶液中浸泡, 切开小鼠腹腔, 后用镊子夹起腹膜, 吸取冷PBS 和酶缓冲液注入至腹腔中灌洗,手指揉小鼠腹部,用镊子夹起腹膜再用针管吸出灌洗液,灌洗液中含有的巨噬细胞即为被采集的腹腔巨噬细胞。
1. 3 小鼠胰腺腺泡细胞与巨噬细胞共培养体系制备和分组 采用巨噬细胞-腺泡细胞共培养体系,Transwell 小室培养, 下室为巨噬细胞, 上室为腺泡细胞。共培养体系分为对照组、模型组和si-CCL19 组, 对照组下室的巨噬细胞为未极化的原代巨噬细胞,模型组下室的巨噬细胞为40 μg·L-1γ 干扰素(interferon-γ,IFN-γ) 和400 μg·L-1 脂多糖(lipopolysaccharide, LPS) 诱导的与炎症发展密切相关的M1 型巨噬细胞, si-CCL19 组下室为M1 型巨噬细胞并转染si-CCL19,3 组培养体系的上室均为提取的原代腺泡细胞[7]。按照参考文献[8]中方法培养腺泡细胞。共培养体系中的细胞制备结束后,加入RPMI-1640 培养基,孵育18 h,显微镜观察腺泡细胞形态表现。
1. 4 小鼠胰腺炎模型制备 选取 40 只体质量为20~22 g 的C57BL/6N 小鼠, 分为正常组和慢性胰腺炎组, 每组20 只。慢性胰腺炎组小鼠腹腔注射雨蛙素50 μg·kg-1 诱导小鼠胰腺炎模型,每周给药3 d,每日6 次,每次间隔1 h;正常组小鼠注射同等次数和剂量的生理盐水,至第4 周造模结束,处死小鼠后解剖,取出小鼠胰腺组织[9]。显微镜下观察胰腺炎模型小鼠胰腺组织导管化情况和CK19和淀粉酶表达情况,判定小鼠胰腺炎模型制备情况。
1. 5 HE 染色观察 2组小鼠胰腺组织病理形态表现 小鼠胰腺组织石蜡切片脱蜡后, 苏木素染色3~8 min,自来水冲洗,于1% 盐酸乙醇溶液分化数秒, 自来水冲洗, 0. 6% 氨水返蓝, 流水冲洗,伊红染色1~3 min。切片脱水,中性树胶封片,显微镜观察2 组小鼠胰腺组织病理形态表现。
1. 6 免疫荧光染色法观察 2 组小鼠胰腺组织中CK19、淀粉酶、iNOS和F4/80表达情况及各组共培养体系细胞中腺泡细胞形态表现及CK19和淀粉酶表达情况 小鼠胰腺组织石蜡切片脱蜡后进行抗原修复,置于抗原修复液体中,放入微波炉,中火处理30 min。冷却至室温后,回收抗原修复液。加入3% 过氧化氢溶液浸泡10 min, 冲洗。5% 山羊抗兔血清封闭, 水洗。加入兔抗CK19 一抗、兔抗Amylase 一抗、兔抗F4/80 一抗和兔抗iNOS 一抗,室温孵育2 h。回收一抗, PBS 缓冲液洗涤3 次。孵育山羊抗兔二抗,置于室温避光1 h,回收二抗,使用PBS 缓冲液冲洗。DAPI 染色5 min 后冲洗,显微镜观察2 组小鼠胰腺组织中CK19、淀粉酶、iNOS 和F4/80 免疫荧光强度及各组共培养体系细胞中腺泡细胞形态表现及CK19 和淀粉酶免疫荧光强度。
1. 7 ELISA法检测 2组小鼠血清和各组共培养体系细胞中TNF-α、IL-6和IL-1β水平 取2组小鼠血清,根据试剂盒说明书操作,检测2 组样本中炎症因子TNF-α、IL-6 和IL-1β 水平。酶标仪检测波长450 nm 处各样本吸光度(A) 值,绘制标准曲线,计算2 组小鼠血清和各组共培养体系细胞中TNF-α、IL-6 和IL-1β 水平。
1. 8 免疫组织化学法观察 2 组小鼠胰腺组织中CCL19 蛋白表达情况 小鼠胰腺组织石蜡切片脱蜡后抗原修复, 血清封闭, 水洗。加入兔抗CCL19 一抗孵育1. 5 h。PBS 缓冲液洗涤3 次, 孵育山羊抗兔二抗,置于室温30 min,苏木素染色。将复染后切片置于水中, 冲洗后脱水, 中性树胶封片。显微镜观察2 组小鼠胰腺组织中CCL19 蛋白表达情况。
1. 9 Western blotting 法检测 2 组小鼠胰腺组织和各组共培养体系细胞中CCL19蛋白及NF-κB信号通路相关蛋白表达水平 将巨噬细胞和小鼠胰腺组织于RIPA 缓冲液中裂解,细胞置于冰上快速充分研磨1 min,胰腺组织于液氮中取出后,置于破碎机研磨充分破碎。冰上放置15 min。置于4 ℃、11 000 r·min-1 离心15 min, 吸上清于新的离心管中。加入含β-巯基乙醇的上样缓冲液; 置于95 ℃的金属浴模块中加热变性10 min。制备10%SDS-PAGE 浓缩胶和分离胶进行电泳操作。使用聚偏二氟乙烯膜于300 mA 电流条件下进行转膜。TBST 溶液洗膜,脱脂牛奶封闭,兔抗CCL19 一抗(1∶ 1 000)、兔抗p-IKKα/β 一抗(1∶ 1 000)、兔抗IKKα/β 一抗(1∶ 1 000)、兔抗p-P65 一抗(1∶1 000)、兔抗P65 一抗(1∶1 000)、兔抗p-IκBα一抗(1∶ 1 000)、兔抗GAPDH 一抗(1∶ 1 000)和兔抗IκBα 一抗(1∶ 1 000), 室温孵育2 h 后回收, 再用TBST 溶液清洗3 次, 加入即用型HRP标记的羊抗兔二抗。孵育1h 后回收清洗。配制显影液,均匀洒在PVDF 膜上,将膜置于显影仪中显影, 采用Image J 软件分析蛋白条带灰度值, 以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1. 10 统计学分析 采用GraphPad Prism 7. 0 统计软件进行统计学分析。2 组小鼠血清和各组共培养体系细胞中TNF-α、IL-6 及IL-1β 水平,CCL19 蛋白和NF-κB 信号通路相关蛋白表达水平均符合正态分布,以x±s 表示。2 组间样本均数比较采用两独立样本t 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 2组小鼠胰腺组织病理形态表现 正常组小鼠胰腺组织腺泡细胞紧密排列。与正常组比较,慢性胰腺炎组小鼠胰腺组织腺泡细胞产生了明显的空泡化,即腺泡细胞导管化,小鼠胰腺炎模型制备成功。见图1。
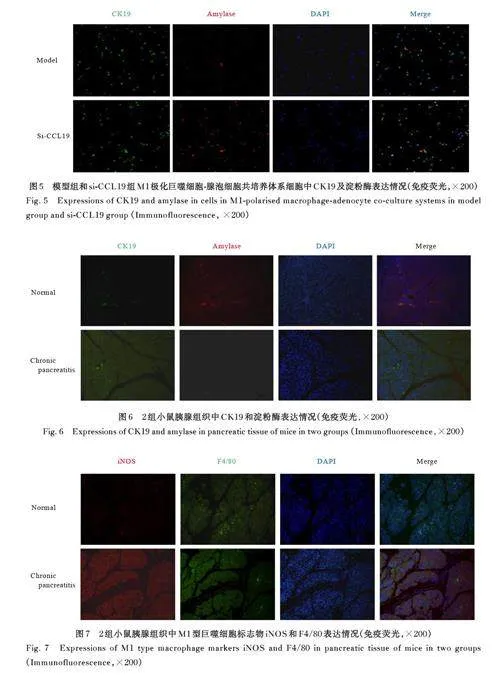
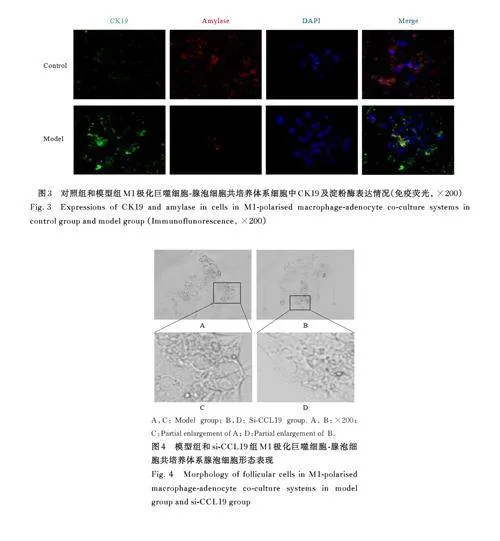
2. 2 各组 M1极化巨噬细胞-腺泡细胞共培养体系中腺泡细胞形态表现和细胞中 CK19 和淀粉酶表达情况 荧光显微镜下,绿色荧光强度代表CK19的表达,红色荧光强度代表淀粉酶的表达。与对照组比较, 模型组腺泡细胞严重的空泡化明显,CK19 表达明显增加,淀粉酶表达明显减少。与模型组比较, si-CCL19 组中腺泡细胞导管化程度降低, CK19 表达明显减少, 淀粉酶表达明显增加。见图2~5。
2. 3 2组小鼠胰腺组织中 CK19、淀粉酶、iNOS和F4/80表达情况 与正常组比较,慢性胰腺炎组小鼠胰腺组织中淀粉酶表达明显减少,CK19 和M1 型巨噬细胞标志物iNOS 及F4/80 表达均明显增加。见图6 和7。
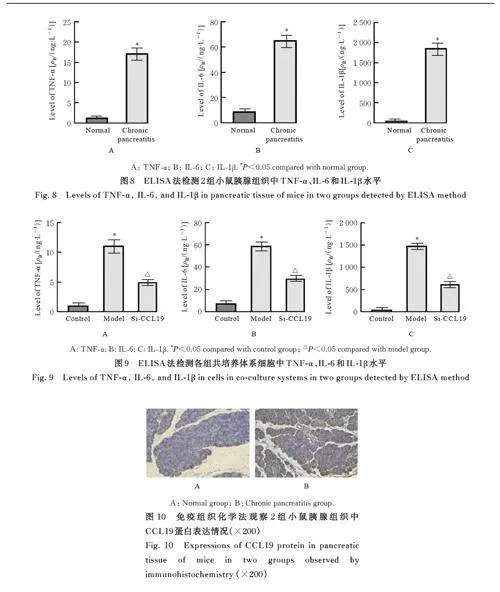
2. 4 2 组 小 鼠 血 清 和 各 组 共 培 养 体 系 细 胞 中TNF-α、IL-6及 IL-1β水平 与正常组比较,慢性胰腺炎组小鼠血清中TNF-α、IL-6 和IL-1β 水平均明显升高(Plt;0. 05)。与对照组比较,模型组细胞中TNF- α、IL-6 和IL-1β 水平均明显升高(Plt;0. 05)。与模型组比较,si-CCL19 组细胞中炎症因子TNF- α、IL-6 和IL-1β 水平均明显降低(Plt;0. 05)。见图8~9。
2. 5 2 组小鼠胰腺组织中 CCL19 蛋白表达情况 与正常组比较, 慢性胰腺炎组小鼠胰腺组织中CCL19 蛋白表达明显增加。见图10。
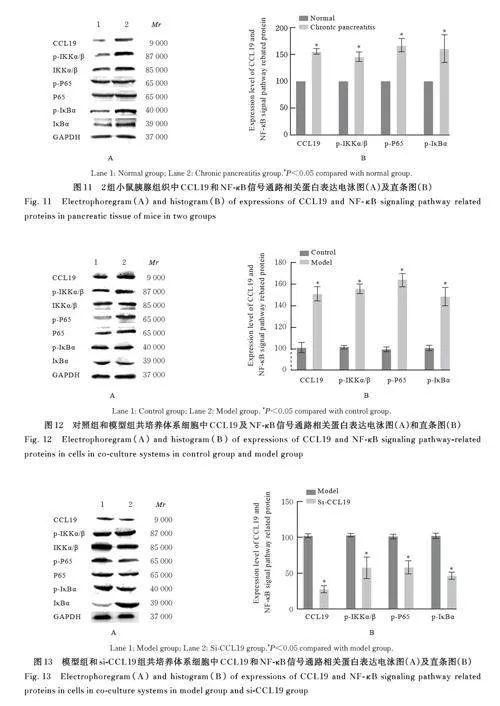
2. 6 2组小鼠胰腺组织和各组共培养体系细胞中CCL19蛋白及 NF-κB信号通路相关蛋白表达水平 与正常组比较, 慢性胰腺炎组小鼠胰腺组织中CCL19、p-IKKα/β、p-P65 和p-IκBα 蛋白表达水平均明显升高(Plt;0. 05)。与对照组比较, 模型组细胞中CCL19、p-IKKα/β、p-P65 和p-IκBα 蛋白表达水平均明显升高(Plt;0. 05)。与模型组比较,si-CCL19 组细胞中CCL19、p-IKKα/β、p-P65 和p-I κ B α 蛋白表达水平均明显降低(Plt;0. 05)。图11~13。
3 讨 论
慢性胰腺炎是一种胰腺进行性炎症, 病发后会伴随出现腹痛及内、外分泌失调等症状[10]。长期的慢性胰腺炎是诱发胰腺癌的主要诱因之一,因此治疗慢性胰腺炎对预防胰腺癌的发生具有重要意义[11-12]。慢性胰腺炎患者胰腺腺泡细胞导管化的过程可以通过多种机制发生, 包括细胞类型的选择性增殖或丢失及祖细胞的分化或转分化[13-14]。胰腺炎患者胰腺组织中CK19 表达增加,淀粉酶表达减少[10]。本研究结果显示: 胰腺炎小鼠胰腺组织中M1 型巨噬细胞数量增加, CCL19蛋白及NF- κB 信号通路相关蛋白表达水平升高,提示CCL19 可能与小鼠慢性胰腺炎中M1 型巨噬细胞NF- κB 信号通路有密切关联。敲低CCL19后,NF-κB 信号通路相关蛋白表达水平明显降低,且si-CCL19 组腺泡细胞导管化程度降低, 提示抑制CCL19 蛋白表达可以抑制NF- κ B 信号通路, 进而抑制巨噬细胞M1 型极化,抑制慢性胰腺炎的产生。
在慢性胰腺炎中,免疫微环境的改变是导致慢性胰腺炎发生发展的重要因素[15]。巨噬细胞是胰腺炎中丰富的免疫细胞群体,且具有高度异质性,可以响应微环境发生表型转化, 包括经典激活巨噬细胞(M1 型) 和交替激活巨噬细胞(M2 型)[16]。M1 型巨噬细胞具有促炎作用, 会在炎症部位富集并产生多种促炎细胞因子, 如IL-1β、IL-6 和TNF-α 等[17-18]。CK19 和淀粉酶表达情况为评价慢性胰腺炎的重要指标,而iNOS 和F4/80 表达情况是评价M1 巨噬细胞的指标。本研究结果显示:M1 型巨噬细胞-腺泡细胞共培养体系中,模型组腺泡细胞出现了明显的空泡化,即腺泡细胞导管化,且CK19 表达增加, 淀粉酶表达减少, 证实M1 型极化的巨噬细胞诱导腺泡细胞导管化,进而导致胰腺炎的产生。
CCL19 是CC 类趋化因子家族成员,是内环境稳定性趋化因子[19]。CCL19 与免疫微环境有密切关联,同时还可以通过调控免疫微环境对多种炎症具有促进作用[20]。例如,CCL19 可以通过趋化巨噬细胞加重小鼠结肠炎,通过招募中性粒细胞加重LPS 诱导的急性肺部炎症, 也可通过抑制中性粒细胞的积累抑制皮肤炎症的发生[21-23]。本研究成功构建小鼠胰腺炎模型,胰腺炎小鼠胰腺组织中CCL19 蛋白表达水平明显升高, 并伴有巨噬细胞浸润增加。在脂多糖处理的肝细胞中,多功能干细胞与转录激活因子相互作用激活了CCL19 的转录,CCL19 反作用于巨噬细胞, 促进了其在肝脏中的积累[24]。本研究结果显示:CCL19 可以通过促进NF-κB 信号通路相关蛋白表达, 进而对巨噬细胞M1 型极化发挥促进作用,诱导小鼠慢性胰腺炎的发生发展, 提示CCL19 在炎症中是一个重要的免疫微环境调控靶点, 可以通过干预CCL19 对炎症过程中的免疫微环境起调控作用, 从而达到治疗目的。
综上所述, CCL19 通过NF-κB 信号通路促进巨噬细胞M1 型极化,诱导炎症微环境的产生,从而促进胰腺炎的发生发展。CCL19 可以作为治疗慢性胰腺炎的靶点,本研究为后续胰腺炎相关疾病的临床治疗提供了新的思路。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:崔连鸷参与实验设计、细胞实验和论文撰写,张晓伟参与细胞实验和实验数据整理,翟悦和潘悦参与动物实验,于秀艳参与实验设计和数据整理。
[参考文献]
[1] ZHAO H, HUANG X Z, LIU Z X, et al. Use of a dual
genetic system to decipher exocrine cell fate conversions
in the adult pancreas[J]. Cell Discov, 2023, 9(1): 1.
[2] BEYER G, HABTEZION A, WERNER J, et al.
Chronic pancreatitis[J]. Lancet, 2020, 396(10249):
499-512.
[3] WATANABE T, KUDO M, STROBER W.
Immunopathogenesis of pancreatitis [J]. Mucosal
Immunol, 2017, 10(2): 283-298.
[4] KALKMAN H O, FEUERBACH D. Antidepressant
therapies inhibit inflammation and microglial M1-
polarization[J]. Pharmacol Ther, 2016, 163: 82-93.
[5] 李思瑞, 冯泽清, 吴玉章. C1632通过MAPK 和NF- κB
抑制巨噬细胞M1 型极化[J]. 免疫学杂志, 2022,
38(3): 185-192.
[6] 关少培, 陆爱国. 趋化因子CCL19在介导免疫细胞抗
肿瘤中的作用[J]. 上海交通大学学报(医学版), 2015,
35(3): 454-459.
[7] KLETTING S, BARTHOLD S, REPNIK U, et al.
Co-culture of human alveolar epithelial (hAELVi) and
macrophage (THP-1) cell lines[J]. ALTEX , 2018,
35(2): 211-222.
[8] LIU M M, YANG Y J, KANG W L, et al. Berberine
inhibits pancreatic intraepithelial neoplasia by inhibiting
glycolysis via the adenosine monophosphate-activated
protein kinase pathway[J]. Eur J Pharmacol, 2022,
915: 174680.
[9] 刘萌萌. 黄连素对胰腺癌的治疗作用及其机制
研究[D]. 大连: 大连理工大学, 2022.
[10]MARSTRAND-DAUCÉ L, LORENZO D,
CHASSAC A, et al. Acinar-to-ductal metaplasia
(ADM): on the road to pancreatic intraepithelial
neoplasia (PanIN) and pancreatic cancer[J]. Int J
Mol Sci, 2023, 24(12): 9946.
[11]TAO X F, CHEN Q, LI N, et al. Serotonin-RhoA/
ROCK axis promotes acinar-to-ductal metaplasia in
caerulein-induced chronic pancreatitis[J]. Biomedecine
Pharmacother, 2020, 125: 109999.
[12]KICHLER A, JANG S. Chronic pancreatitis:
epidemiology, diagnosis, and management updates[J].
Drugs, 2020, 80(12): 1155-1168.
[13]王张鹏, 吴 俊, 景光旭, 等. 急性胰腺炎相关腹腔
积液的研究进展[J]. 临床肝胆病杂志, 2023, 39(5):
1227-1233.
[14]KIRKEGÅRD J, MORTENSEN F V, CRONINFENTON
D. Chronic pancreatitis and pancreatic cancer
risk: a systematic review and meta-analysis[J]. Am J
Gastroenterol, 2017, 112(9): 1366-1372.
[15]GUPTE A, GOEDE D, TUITE R, et al. Chronic
pancreatitis[J]. BMJ, 2018: k2126.
[16]苑舒月, 刘春艳, 刘 冰, 等. 巨噬细胞的极化与牙
周炎[J]. 中国组织工程研究, 2023, 27(17): 2699-2707.
[17]SHAPOURI-MOGHADDAM A, MOHAMMADIAN S,
VAZINI H, et al. Macrophage plasticity, polarization,
and function in health and disease[J]. J Cell Physiol,
2018, 233(9): 6425-6440.
[18]CHEN L, GAO B Y, ZHANG Y D, et al. PAR2
promotes M1 macrophage polarization and inflammation
via FOXO1 pathway[J]. J Cell Biochem, 2019, 120(6):
9799-9809.
[19]PANG N Z, SHI J X, QIN L, et al. IL-7 and CCL19-
secreting CAR-T cell therapy for tumors with positive
glypican-3 or mesothelin[J]. J Hematol Oncol, 2021,
14(1): 118.
[20]ADACHI K, KANO Y, NAGAI T, et al. IL-7 and
CCL19 expression in CAR-T cells improves immune
cell infiltration and CAR-T cell survival in the tumor[J].
Nat Biotechnol, 2018, 36(4): 346-351.
[21]YAN Y, HU K, FU M, et al. CCL19 and CCL28
assist herpes simplex virus 2 glycoprotein D to induce
protective systemic immunity against genital viral
challenge[J]. mSphere, 2021, 6(2): e00058-e00021.
[22]DUAN D M, WANG K K, WEI C, et al. The BCMAtargeted
fourth-generation CAR-T cells secreting IL-7
and CCL19 for therapy of refractory/recurrent multiple
myeloma[J]. Front Immunol, 2021, 12: 609421.
[23]YAN Y, CHEN R F, WANG X, et al. CCL19 and
CCR7 expression, signaling pathways, and adjuvant
functions in viral infection and prevention[J]. Front Cell
Dev Biol, 2019, 7: 212.
[24]SCAPINI P, LAUDANNA C, PINARDI C, et al.
Neutrophils produce biologically active macrophage
inflammatory protein-3alpha (MIP-3alpha)/CCL20 and
MIP-3beta/CCL19[J]. Eur J Immunol, 2001, 31(7):
1981-1988.

