双酚A 对子宫内膜间充质干/基质细胞干性的影响及人脐带间充质干细胞源性上清对细胞损伤的改善作用

[摘 要] 目的:探讨双酚A(BPA)对子宫内膜间充质干/基质细胞(eMSCs)增殖活性和干性特征的影响,阐明人脐带间充质干细胞源性上清(hUCMSC-Sup)对细胞损伤的改善作用。方法:体外培养eMSCs,以0、200、250、300、350、400 μmol·L-1 BPA 处理。将eMSCs 分为对照组(仅培养液培养)、BPA 组(含200 μmol·L-1 BPA 的等体积培养液培养)、BPA+hUCMSC-Sup 组(含200 μmol·L-1 BPA 及50% 体积比hUCMSC-Sup 的等体积培养液培养) 和BPA+CHIR-99021 组(含200 μmol·L-1 BPA 及10 μmol·L-1 CHIR-99021 的等体积培养液培养),使用干细胞成球培养液培养eMSCs 干细胞球,其余细胞均使用DMEM/F12 完全培养基培养。噻唑蓝(MTT) 法检测各组eMSCs 存活率,球体形成实验检测各组eMSCs干细胞球数和直径,CCK-8法检测各组eMSCs干细胞球中细胞增殖活性,流式细胞术检测各组eMSCs中CD73+细胞百分率,实时荧光定量PCR(RT-qPCR)法检测各组eMSCs中性别决定区Y框蛋白2(Sox2)、八聚体结合转录因子4 (Oct4) 和Nanog mRNA 表达水平,Western blotting 法检测各组eMSCs中β-连环蛋白(β-catenin)蛋白表达水平。结果:MTT法检测,BPA作用24和48 h,与0 μmo·l L-1 BPA 组比较,200、250、300、350 和400 μmol·L-1 BPA 组eMSCs 存活率均明显降低(Plt;0. 01)。药物作用24 h时,与对照组比较,BPA组eMSCs存活率明显降低(Plt;0. 01);药物作用48 h时,与对照组比较,BPA 组eMSCs 存活率明显降低(Plt;0. 01);与BPA 组比较,BPA+hUCMSC-Sup 组eMSCs 存活率明显升高(Plt;0. 05)。球体形成实验检测,与培养3 d 组比较,培养4 和5 d 组eMSCs 干细胞球数和直径均明显增加(Plt;0. 05 或Plt;0. 01);与对照组比较,培养48 h 时BPA 组eMSCs 干细胞球数和直径均明显减少(Plt;0. 05或Plt;0. 01)。CCK-8法检测,处理24和48 h时,与对照组比较,BPA 组eMSCs 干细胞球中细胞增殖活性均明显降低(Plt;0. 01);与BPA组比较,BPA+hUCMSC-Sup组eMSCs干细胞球中细胞增殖活性均明显升高(Plt;0. 01)。流式细胞术检测,与对照组比较,BPA 组eMSCs中CD73+细胞百分率明显降低(Plt;0. 01);与BPA 组比较,BPA+hUCMSC-Sup组eMSCs中CD73+细胞百分率明显升高(Plt;0. 01)。RT-qPCR法检测,与对照组比较,BPA组eMSCs中Sox2、Oct4和Nanog mRNA表达水平均明显降低(Plt;0. 01);与BPA 组比较,BPA+hUCMSC-Sup组和BPA+CHIR-99021组eMSCs中Sox2、Oct4及NanogmRNA 表达水平均明显升高(Plt;0. 01)。Western blotting 法检测,与对照组比较,BPA 组eMSCs 中β-catenin 蛋白表达水平明显降低(Plt;0. 01);与BPA 组比较,BPA+hUCMSC-Sup 组和BPA+CHIR-99021 组 eMSCs 中 β -catenin蛋白表达水平均明显升高(Plt;0. 01)。结论:BPA能够抑制eMSCs的干性特征,损伤子宫内膜的自我更新及修复作用,其机制可能与下调细胞中Wnt/β-catenin 信号通路活性有关。hUCMSC-Sup 可以促进受损eMSCs 的增殖,并对BPA 诱导的eMSCs 干性损伤起到改善作用。
[关键词] 双酚A; 子宫内膜间充质干/基质细胞; 人脐带间充质干细胞; 干细胞球
[中图分类号] Q254 [文献标志码] A
子宫内膜间充质干/基质细胞(endometrialmesenchymal stem/stromal cells, eMSCs) 具有多向分化和高增殖的潜能,受激素严格调控,在子宫内膜周期性再生中发挥重要作用[1]。eMSCs 受损后会发生子宫内膜功能障碍,最终导致胚胎着床失败和早期流产,是女性不孕的主要原因之一[2]。当eMSCs 聚集成三维球状体时, 其整体功能增强,如参与组织再生的关键因子血管内皮生长因子(vascular endothelial growth factor,VEGF) 和前列腺素E2 (prostaglandin E2,PGE2) 分泌增加,多能基因Nanog 和性别决定区Y 框蛋白2 (sex determiningregion Y-box 2,Sox2) mRNA 表达上调[3]。
双酚A (bisphenol A,BPA) 的结构与雌激素类似,可与雌激素受体或其他激素受体结合干扰细胞的正常生理进程, 是最常见的内分泌干扰物(endocrine disrupting chemicals,EDCs)[4]。研究[5]显示: BPA 暴露与多种疾病的发生发展有关, 包括生育能力受损、乳腺癌、糖尿病、肥胖、认知障碍和心血管疾病。HARNETT 等[6] 发现:BPA 及其类似物对大鼠和人类干细胞有细胞毒性并能够诱导细胞凋亡。目前, BPA 对子宫内膜干细胞的影响尚未完全阐明。WANG 等[7] 研究表明:人脐带间充质干细胞(human umbilical cord mesenchymalstem cells,hUCMSCs) 与受损的人子宫内膜基质细胞(human endometrial stromal cells,hEndoSCs)在体外共培养后,受损的hEndoSCs 增殖率明显升高。本研究以BPA 作用eMSCs, 探讨BPA 对eMSCs 干性的影响, 阐明hUCMSCs 源性上清(hUCMSC-derived supernatunt, hUCMSC-Sup)对细胞损伤的改善作用。
1 材料与方法
1. 1 细胞、主要试剂和仪器 eMSCs和hUCMSCs为吉林省人民医院中心实验室传代保存。BPA (货号:#K2116009) 购自上海阿拉丁生化科技股份有限公司,CCK-8 试剂盒(货号:C0039) 购自上海碧云天生物技术有限公司,DMEM/F12 基础培养基(货号:SH30023. 01) 购自美国HyClone 公司,胎牛血清(fetal bovine serum,FBS) (货号: FB15015)购自美国Clark 生物公司,磷酸盐缓冲液(phosphatebuffer saline,PBS)( 货号:FG701-01)、1% 青-链霉素( 货号:FG101)、含EDTA的胰蛋白酶(货号:#FG301-01)、RNA 提取试剂盒和逆转录试剂盒均购自北京全式金生物技术有限公司,选择性糖原合酶激酶3 (glucogen synthase kinase-3, GSK-3)抑制剂CHIR-99021 购自美国MCE 公司,实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR) 反应体系SYBR Green 试剂盒购自美国Bio-Rad 公司,RT-qPCR 引物序列由苏州金唯智生物科技公司合成, β 连环蛋白(β -catenin) 抗体(货号:#8480S) 购自美国Cell Signaling Technology公司,CD73 抗体(货号:#560847) 购自美国BD公司。电泳仪购自美国Wealtec 公司,酶标仪购自美国Thermo 公司,流式细胞仪购自美国BD 公司,CO2 恒温培养箱购自美国赛默飞世尔科技公司,倒置荧光显微镜购自日本Olympus 公司, RT-qPCR仪购自美国Applied Biosystems 公司。
1. 2 细胞培养、分组和处理 采用含 10% FBS和1% 青-链霉素的DME/F12 完全培养基,于37 ℃、5% CO2培养箱中培养eMSCs,采用含EDTA 的胰蛋白酶消化传代。培养P3~P5 代hUCMSCs, 收集细胞对数生长期培养液,3 000 g 离心15 min,清除细胞和细胞碎片, 制备为hUCMSC-Sup, 分装后-80 ℃保存备用。不含血清的DMEM/F12 培养基中添加10 μg·L-1 EGF、10 μg·L-1 bFGF 和2% B27 (50×),配制干细胞成球培养液。将eMSCs分为对照组(仅培养液培养)、BPA 组(含200 μmol·L-1 BPA 的等体积培养液培养)、BPA+hUCMSC-Sup 组(含200 μmol·L-1 BPA 及50% 体积比hUCMSC-Sup 的等体积培养液培养)和BPA+CHIR-99021 组(含200 μmol·L-1 BPA 及10 μmol·L-1 CHIR-99021 的等体积培养液培养),使用干细胞成球培养液培养eMSCs 干细胞球, 其余细胞均使用DMEM/F12 完全培养基培养。
1. 3 噻唑蓝(methyl thiazolyl tetrazolium,MTT)法检测不同浓度BPA组eMSCs存活率 取对数生长期的eMSCs, 以每孔1×104 个细胞的密度接种于96 孔细胞培养板,待细胞生长至约70% 后,分别加入0、 200、 250、 300、 350 和400 μmol·L-1 BPA。并于加药处理后的24 和48 h, 每孔加入10 μLMTT 试剂, 4 h 后采用酶标仪检测波长492 nm 处吸光度(A) 值,计算细胞存活率。细胞存活率=(实验孔A 值-空白孔A 值) / (对照孔A 值-空白孔A 值) ×100%。单层培养细胞存活率检测:球体形成实验培养1 周后收集细胞球,吹打分散为单细胞悬浮液后再次接种于96 孔细胞培养板,待细胞生长至约70%后,分别加入培养液(对照组)、含BPA 的培养液(BPA 组) 和含BPA 及hUCMSC-Sup 的培养液(BPA+hUCMSC-Sup 组), 于加药处理后24 和48 h 每孔加入10 μL MTT 试剂,4 h 后采用酶标仪检测波长492 nm 处A 值,计算细胞存活率。细胞存活率= (实验孔A 值- 空白孔A 值) / (对照孔A 值-空白孔A 值) ×100%。每组实验重复4 次。
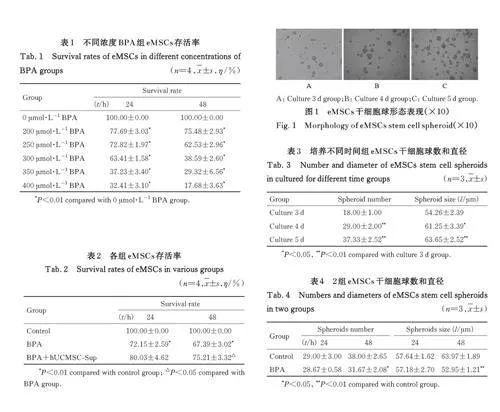
1. 4 球体形成实验检测各组eMSCs干细胞球体形态表现 eMSCs经胰酶消化后悬浮于干细胞成球培养液中,以每孔1×104个细胞的密度接种于低黏附6 孔细胞培养板中培养5 d,于培养第3、4 和5 天拍照并记录eMSCs 干细胞球数和直径变化。干细胞球培养至3 d 时按上述eMSCs 干细胞球体分组处理,于加药24 和48 h 后拍照并计数eMSCs 干细胞球数和直径。采用Image J 软件测量eMSCs 干细胞球直径,球体直径≥50 μm 则为1 个球体。
1. 5 CCK-8法检测各组eMSCs干细胞球中细胞增殖活性 将 eMSCs以每孔 5×103个细胞的密度接种于低黏附24 孔细胞培养板, 干细胞成球培养液培养3 d,按上述干细胞球体分组,于加药处理后0、24 和48 h, 每孔加入100 μL CCK-8 试剂, 4 h后采用酶标仪检测波长450 nm 处A 值,以仅加入培养液的空白孔为对照孔调零。以A 值代表各组eMSCs 干细胞球中细胞增殖活性。
1. 6 流式细胞术检测各组eMSCs中CD73+细胞百分率 将eMSCs接种于6孔细胞培养板,按照上述eMSCs 分组处理24 h 后, 加入APC-A 标记的CD73 抗体,避光冰上孵育30 min 后PBS 缓冲液洗涤3 次。采用流式细胞仪和FlowJo 软件检测各组eMSCs 中CD73+细胞百分率。
1. 7 RT-qPCR 法检测各组 eMSCs 中 Sox2、八聚体结合转录因子 4(octamer-binding transcriptionfactor 4,Oct4)和 Nanog mRNA 表 达 水 平 将eMSCs 铺于6 孔细胞培养板,并按照上述细胞分组处理24 h 后,采用TRIzol 试剂提取总RNA,反转录试剂盒合成cDNA, 以cDNA 作为模板, 使用SYBR Green qPCR Master Mix 进行RT-qPCR 扩增, 检测各组细胞中Sox2、Oct4 和Nanog mRNA表达水平。引物序列: GAPDH F 5'-TCAGGCGTCTGTAGAGGCTT-3', R 5'-ATGCACATCCTTCGATAAGACTG-3'; Sox2 F 5'-GCCGAGTGGAAACTTTTGTCG-3', R 5'-GCAGCGTGTACTTATCCTTCTT-3'; Oct4 F 5'-AAGCGATCAAGCAGCGACTA-3', R 5'-CAGAGTGGTGACGGAGACAG-3'; Nanog F 5'-CCCCAGCCTTTACTCTTCCTA-3', R 5'-CCAGGTTGAATTGTTCCAGGTC-3'。反应条件:94 ℃预变性5 min;94 ℃变性1 min、55 ℃退火30 s、72 ℃延伸1 min,循环40 次; 72 ℃ 终延10 min, 4 ℃ 保存。使用GAPDH 进行归一化处理, 采用2−ΔΔCt 法计算目的基因表达水平。
1. 8 Western blotting 法 检 测 各 组 eMSCs 中β-catenin 蛋白表达水平 将 eMSCs接种于 6孔细胞培养板, 按照上述细胞分组处理24 h 后, 收集eMSCs 进行裂解获取蛋白,经SDS-PAGE 电泳分离蛋白样品,转移至PVDF 膜,5% 脱脂奶粉TBST 溶液室温封闭1 h, 分别加入抗体β-catenin(1∶1 000) 和GAPDH (1∶1 000) 4 ℃孵育过夜。洗膜3 次, 加入HRP 标记的抗小鼠或抗兔二抗(1∶2 000) 室温孵育2 h,再次洗膜后加入ECL 发光检测试剂使条带显像。采用Image J 软件分析蛋白条带灰度值,计算目的蛋白表达水平,实验重复3 次。目的蛋白表达水平= 目的蛋白条带灰度值/GAPDH 蛋白条带灰度值。
1. 9 统计学分析 采用 SPSS 25. 0统计软件进行统计学分析。各组eMSCs 干细胞球数和直径及细胞增殖活性,各组eMSCs 存活率和CD73+细胞百分率,各组eMSCs 中Sox2、Oct4 和Nanog mRNA表达水平及β-catenin 蛋白表达水平均符合正态分布,以-x±s 表示,多组间样本均数比较采用单因素方差分析, 组间样本均数两两比较采用LSD-t 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 各组 eMSCs 存活率 BPA 作用 24 和 48 h,与0 μ mol·L -1 BPA 组比较, 200 、250 、350 和400 μmol·L-1 BPA 组eMSCs 存活率均明显降低(Plt;0. 01)。见表1。药物作用24 h 时, 与对照组比较, BPA 组eMSCs 存活率明显降低(Plt;0. 01); 与BPA 组比较, BPA+hUCMSC-Sup 组eMSCs 存活率差异无统计学意义(Pgt;0. 05)。药物作用48 h 时,与对照组比较,BPA 组eMSCs 存活率明显降低(Plt;0. 01); 与BPA 组比较,BPA+hUCMSC-Sup 组eMSCs 存活率明显升高(Plt;0. 05)。见表2。
2. 2 各组 eMSCs 干细胞球体形态表现 与培养3 d 组比较,培养4 和5 d 组eMSCs 干细胞球数和直径均明显增加(Plt;0. 05 或Plt;0. 01)。见图1 和表3。与对照组比较,培养24 h时BPA组eMSCs干细胞球数和直径差异均无统计学意义(Pgt;0. 05), 培养48 h 时BPA 组eMSCs 干细胞球数和直径均明显减少(Plt;0. 05 或Plt;0. 01)。见表4。
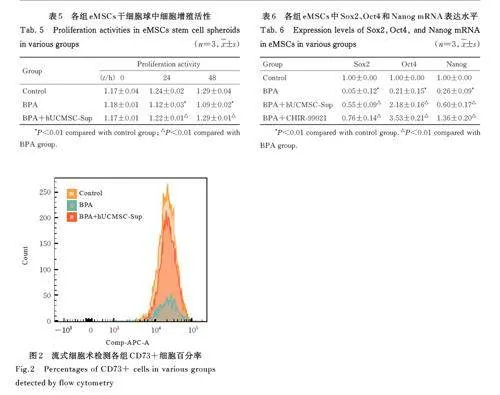
2. 3 各组 eMSCs 干细胞球中细胞增殖活性 处理0 h 时,各组eMSCs 干细胞球中细胞增殖活性比较差异均无统计学意义(Pgt;0. 05)。处理24 和48 h时,与对照组比较, BPA 组eMSCs 干细胞球中细胞增殖活性均明显降低(Plt;0. 01); 与BPA 组比较,BPA+hUCMSC-Sup 组eMSCs 干细胞球中细胞增殖活性均明显升高(Plt;0. 01)。见表5。2. 4 各组 eMSCs中 CD73+细胞百分率 与对照组(98. 20%±0. 98%) 比较,BPA 组eMSCs 中CD73+细胞百分率(44. 63%±18. 66%) 明显降低(Plt;0. 01);与BPA组比较,BPA+hUCMSC-Sup组eMSCs 中CD73+细胞百分率(91. 53%±7. 38%)明显升高(Plt;0. 01)。见图2。
2. 5 各组 eMSCs 中 Sox2、Oct4 和 Nanog mRNA表达水平 与对照组比较,BPA组eMSCs中Sox2、Oct4、Nanog mRNA 表达水平均明显降低(Plt;0. 01); 与BPA 组比较, BPA+hUCMSC-Sup 组和BPA+CHIR-99021 组eMSCs 中Sox2、Oct4 及Nanog mRNA 表达水平均明显升高(Plt;0. 01)。见表6。
2. 6 各组 eMSCs 中 β-catenin 蛋白表达水平 与对照组比较, BPA 组eMSCs 中β-catenin 蛋白表达水平明显降低(Plt;0. 01);与BPA 组比较,BPA+hUCMSC-Sup 组和BPA+CHIR-99021 组eMSCs 中β-catenin 蛋白表达水平均明显升高(Plt;0. 01)。见图3。
3 讨 论
BPA 能够提高塑料和合成产品的耐用性和柔韧性,被广泛用于塑料食品、液体容器、金属罐内衬、个人护理产品包装、运动器材及医疗和牙科设备中[8]。因此,人类日常接触BPA 是不可避免的。研究[9-10] 显示: BPA 暴露增强子宫内膜基质细胞侵袭能力,并通过WD 重复域蛋白5/甲基胞嘧啶双加氧酶2 (WD repeat-containing protein 5/tet methylcytosine dioxygenase 2, WDR5/TET2)介导的表观遗传途径上调子宫内膜中雌激素受体β(estrogen receptor beta,Erβ) 表达,从而促进子宫内膜异位症发生发展。CASERTA 等[11] 发现:BPA 促进核雌激素相关受体γ 易位,通过表皮生长因子(epidermal growth factor,EGF) 依赖性和非EGF 依赖性途径促进Ⅰ 级子宫内膜癌细胞增殖。此外,长期接触BPA 严重损害子宫内膜基质细胞向蜕膜细胞的分化,并会损害孕酮受体及其下游靶基因通路, 对胚胎着床和妊娠产生不利影响[12]。本研究结果显示: BPA 对eMSCs 存活率有抑制作用。
子宫内膜的再生能力与子宫内膜干细胞存在密切关联。研究[13-14] 证实: 人类和部分动物子宫内膜中存在基质干细胞。干细胞的“干性”包括自我更新能力和多向分化能力即多能性[15]。干细胞的特征是能够在悬浮培养下形成球体,球体形成实验可检测干细胞自我更新能力。WANG 等[16] 证实:与体外单层髓核细胞比较,髓核细胞球体表现出优秀的自我更新和细胞外基质合成能力。本研究结果显示:BPA 干预后eMSCs 干细胞球数和直径明显减少,细胞增殖活性明显降低,提示BPA 能够抑制eMSCs 干细胞活性。
Oct4、Sox2 和Nanog 等干性相关转录因子在维持胚胎干细胞的多能性和自我更新能力方面也发挥着重要作用[17]。KESHAVARZ 等[18] 研究表明:敲低长链非编码RNA (long non-coding RNA,lncRNA) ES1 会下调乳腺癌细胞中Oct4 和Sox2 的表达, 抑制ES1 可能会限制癌细胞增殖和细胞周期进展,诱导细胞凋亡和细胞衰老。本研究结果显示:与对照组比较,BPA 组 eMSCs 中 Sox2、Oct4 和Nanog mRNA 表达水平明显降低, eMSCs中CD73+细胞百分率明显降低,提示BPA 可抑制eMSCs 的干性。
多种信号通路参与损伤后组织再生和发育,其中Wnt/β-catenin 信号通路在维持各种干细胞类型的自我更新和分化调节中发挥重要作用。研究[19]显示: Wnt/β-catenin 信号通路在子宫内膜干细胞群的调节中具有重要作用。DAVIDSON 等[20] 证实: Wnt/β-catenin 信号的激活会促进干细胞表面标志物的表达。LI 等[21] 发现: 谷氨酰胺酶1(glutaminase 1,GLS1) 通过Wnt/β-catenin 信号传导调节细胞干性,敲除GLS1 可减少干性相关基因的表达并抑制体内肝癌干细胞致瘤性。本研究结果显示: BPA 可明显降低eMSCs 中β-catenin 蛋白表达水平。提示BPA 可能是通过抑制Wnt/β-catenin通路激活, 降低eMSCs 的干性, 损伤子宫内膜的周期性再生能力。
hUCMSCs 具有自我更新和多向分化的特性,可以修复受损组织, 被用于治疗多种疾病[22]。CHIR-99021 作为GSK-3 抑制剂,可以使GSK-3α/β失 活, 从 而 激 活 Wnt/β -catenin 通 路。GOVARTHANAN 等[23] 发现: CHIR-99021 处理后, 间充质干细胞( mesenchymal stem cells, MSCs)中β-catenin 的核定位增加且MSCs 的分化潜力提高。本研究结果显示: hUCMSC-Sup 可显著增强被BPA 抑制的eMSCs 干细胞球中细胞增殖活性,上调CD73+ 细胞百分率。eMSCs 中干性相关因子Sox2、Oct4 和Nanog mRNA 表达水平及β-catenin蛋白表达水平明显升高, 与CHIR-99021 处理结果相似。提示hUCMSC-Sup 具有改善eMSCs 干性的能力,可能与Wnt/β-catenin 通路激活有关。
综上所述,BPA 能够抑制eMSCs 的干性特征,损伤子宫内膜的自我更新及修复作用,其机制可能与下调细胞中Wnt/β -catenin 信号通路活性有关。hUCMSC-Sup 可以促进受损eMSCs 的增殖,并对BPA 诱导的eMSCs 干性损伤起到改善作用。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:王爱乔参与研究设计和论文撰写,王琳、张文琦和邓玲参与研究数据获取及分析,刘磊、林秀英和付建华参与论文修改及审校,米旭光和方艳秋参与研究设计。
[参考文献]
[1] BOZORGMEHR M, GURUNG S, DARZI S, et al.
Endometrial and menstrual blood mesenchymal stem/
stromal cells: biological properties and clinical
application[J]. Front Cell Dev Biol, 2020, 8: 497.
[2] SKLIUTĖ G, BAUŠYTĖ R, BORUTINSKAITĖ V,
et al. Menstrual blood-derived endometrial stem cells’
impact for the treatment perspective of female
infertility[J]. Int J Mol Sci, 2021, 22(13): 6774.
[3] DOMNINA A, NOVIKOVA P, OBIDINA J, et al.
Human mesenchymal stem cells in spheroids improve
fertility in model animals with damaged endometrium[J].
Stem Cell Res Ther, 2018, 9(1): 50.
[4] STREET M E, ANGELINI S, BERNASCONI S,
et al. Current knowledge on endocrine disrupting
chemicals (EDCs) from animal biology to humans, from
pregnancy to adulthood: highlights from a national
Italian meeting[J]. Int J Mol Sci, 2018, 19(6): 1647.
[5] KODILA A, FRANKO N, SOLLNER DOLENC M.
A review on immunomodulatory effects of BPA
analogues[J]. Arch Toxicol, 2023, 97(7): 1831-1846.
[6] HARNETT K G, CHIN A, SCHUH S M. BPA and
BPA alternatives BPS, BPAF, and TMBPF, induce
cytotoxicity and apoptosis in rat and human stem
cells[J]. Ecotoxicol Environ Saf, 2021, 216: 112210.
[7] WANG J Y, HU R M, XING Q, et al. Exosomes
derived from umbilical cord mesenchymal stem cells
alleviate mifepristone-induced human endometrial
stromal cell injury[J]. Stem Cells Int, 2020, 2020:
6091269.
[8] RUSSO G, BARBATO F, MITA D G, et al.
Occurrence of bisphenol A and its analogues in some
foodstuff marketed in Europe[J]. Food Chem Toxicol,
2019, 131: 110575.
[9] WEN X, XIONG Y, JIN L, et al. Bisphenol A
exposure enhances endometrial stromal cell invasion and
has a positive association with peritoneal
endometriosis[J]. Reprod Sci, 2020, 27(2): 704-712.
[10]WEN X, XIONG Y, GENG T, et al. BPA modulates
the WDR5/TET2 complex to regulate ERβ expression
in eutopic endometrium and drives the development of
endometriosis[J]. Environ Pollut, 2021, 268(Pt B):
115748.
[11]CASERTA D, DE MARCO M P, BESHARAT A R,
et al. Endocrine disruptors and endometrial cancer:
molecular mechanisms of action and clinical
implications, a systematic review[J]. Int J Mol Sci,
2022, 23(6): 2956.
[12]CASERTA D, COSTANZI F, DE MARCO M P,
et al. Effects of endocrine-disrupting chemicals on
endometrial receptivity and embryo implantation: a
systematic review of 34 mouse model studies[J]. Int J
Environ Res Public Health, 2021, 18(13): 6840.
[13]BUKOWSKA J, ZIECIK A J, LAGUNA J, et al. The
importance of the canonical Wnt signaling pathway in the
porcine endometrial stromal stem/progenitor cells:
implications for regeneration[J]. Stem Cells Dev, 2015,
24(24): 2873-2885.
[14]BAUSYTE R, VAIGAUSKAITE-MAZEIKIENE B,
BORUTINSKAITE V, et al. Human endometriumderived
mesenchymal stem/stromal cells application in
endometrial-factor induced infertility[J]. Front Cell Dev
Biol, 2023, 11: 1227487.
[15]PHAN T N, FAN C H, YEH C K. Application of
ultrasound to enhancing stem cells associated
therapies[J]. Stem Cell Rev Rep, 2023, 19(6):
1709-1725.
[16]WANG Y Y, WANG H M, ZHUO Y Y, et al.
Spheroid formation enhances the regenerative capacity of
nucleus pulposus cells via regulating N-CDH and ITGβ1
interaction[J]. Int J Biol Sci, 2022, 18(9): 3676-3696.
[17]SOHN E J, MOON H J, LIM J K, et al. Regulation of
the protein stability and transcriptional activity of OCT4
in stem cells[J]. Adv Biol Regul, 2021, 79: 100777.
[18]KESHAVARZ M, ASADI M H. Long non-coding
RNA ES1 controls the proliferation of breast cancer cells
by regulating the Oct4/Sox2/miR-302 axis[J]. FEBS J,
2019, 286(13): 2611-2623.
[19]NGUYEN H P T, SPRUNG C N, GARGETT C E.
Differential expression of Wnt signaling molecules
between pre- and postmenopausal endometrial epithelial
cells suggests a population of putative epithelial stem/
progenitor cells reside in the basalis layer [J].
Endocrinology, 2012, 153(6): 2870-2883.
[20]DAVIDSON K C, ADAMS A M, GOODSON J M,
et al. Wnt/β -catenin signaling promotes differentiation,
not self-renewal, of human embryonic stem cells and is
repressed by Oct4[J]. Proc Natl Acad Sci U S A, 2012,
109(12): 4485-4490.
[21]LI B H, CAO Y J, MENG G, et al. Targeting
glutaminase 1 attenuates stemness properties in
hepatocellular carcinoma by increasing reactive oxygen
species and suppressing Wnt/beta-catenin pathway[J].
EBioMedicine, 2019, 39: 239-254.
[22]XIE Q X, LIU R, JIANG J, et al. What is the impact of
human umbilical cord mesenchymal stem cell
transplantation on clinical treatment?[J]. Stem Cell Res
Ther, 2020, 11(1): 519.
[23]GOVARTHANAN K, VIDYASEKAR P, GUPTA P K,
et al. Glycogen synthase kinase 3β inhibitor- CHIR
99021 augments the differentiation potential of
mesenchymal stem cells[J]. Cytotherapy, 2020, 22(2):
91-105.

