转BpGLK白桦土壤酶活及根际土壤细菌、真菌群落组成分析
摘要:【目的】白桦(Betula platyphylla)BpGLK转录因子参与调控叶绿体发育及叶色,BpGLK抑制表达白桦在生长期内叶色呈黄绿色,在园林绿化中极具观赏价值。但作为转基因植物,大面积的推广应用是否会对环境产生不利影响引起研究者的重视。研究转BpGLK白桦对土壤酶活及根际土壤细菌、真菌群落组成的影响,为后续环境释放及商业化应用提供理论依据。【方法】以3年生转BpGLK白桦(OE株系及RE株系)及对照野生型(WT)白桦为材料,采用分光光度法测定土壤蔗糖酶、脲酶、中性蛋白酶、过氧化氢酶及纤维素酶的活性,利用 Illumina-Miseq 高通量测序平台对根际土壤微生物进行 16S rRNA 和 ITS 测序分析,对根际土壤细菌和真菌群落丰富度和多样性变化、结构差异性、群落组成进行分析,了解转基因活动对白桦土壤酶活性及根际土壤微生物组成的影响。【结果】在测定的4个时间点(6月15日、7月15日、8月15日和9月15日)转BpGLK白桦与WT株系的土壤脲酶、蔗糖酶、纤维素酶、中性蛋白酶活性均存在显著差异(P<0.05),而过氧化氢酶活性则呈现WT株系与部分转基因株系间存在显著差异,土壤脲酶和纤维素酶活性在8月中旬和9月中旬明显降低,而土壤中性蛋白酶活性在9月中旬明显升高,OE株系的土壤中性蛋白酶活性在4个时期均高于或显著高于WT株系(P<0.05)。根际土壤细菌群落属水平上,具有促生功能的伯克霍尔德菌属(Burkholderia)是转基因株系与WT株系的优势菌,该菌属在转基因株系根际土壤中的相对丰度显著提高;在根际真菌群落属水平上,棉革菌属(Tomentella)是转基因RE株系根际的优势类群,锁瑚菌属(Clavulina)是WT及转基因OE株系根际的优势类群,蜡蘑菌属(Laccaria)的相对丰度在OE株系和RE株系中显著降低(P<0.05);Alpha多样性分析显示,在细菌群落组成方面,转基因白桦的可观测物种数(observed species)、Chao1、香农(Shannon)及辛普森(Simpson)指数与WT株系间未达到显著差异;在真菌群落组成方面,RE株系的群落丰度、多样性均显著高于或高于WT株系,而OE与WT株系间差异未达到显著水平。韦恩图结果显示,转基因株系与野生型株系间的特征序列(ASV)差异显著;主成分分析结果显示,在细菌群落组成上,RE与WT株系的群落组成差异较小,而OE与WT株系差异相对较大;在真菌群落组成上,OE与WT株系的群落组成差异较小,而RE与WT株系差异相对较大。【结论】目标BpGLK基因的导入对白桦根际细菌、真菌群落丰度及多样性产生一定影响,并可能利于植物生长并提升自身抗逆性,但这种影响是否长期存在仍需后续试验验证。
关键词:白桦;转基因;土壤酶活性;根际;细菌;真菌;群落组成
中图分类号:S718;S68""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)06-0129-09
Analysis of bacterial and fungal community composition and soil enzyme activities" in the rhizosphere of transgenic" Betula platyphylla
CAO Li1,JIN Dongxue1,JIANG Jing1,LI Tianfang2*
(1.State Key Laboratory of Forest Genetics and Breeding,Northeast Forestry University,Harbin 150040,China; 2.Heilongjiang Academy of" Forestry, Harbin" 150081, China)
Abstract: 【Objective】The BpGLK transcription factor of Betula platyphylla is involved in regulating chloroplast development and leaf color. The leaf color of B. platyphylla with inhibited BpGLK expression is yellow-green during the growth period, which holds great ornamental value in landscaping. However, as a genetically modified crop, concerns exist regarding the potential adverse environmental effects of widespread use. This study aims to examine the impact of transgenic BpGLK B. platyphylla on soil enzyme activity and the composition of rhizosphere soil bacterial and fungal communities, providing theoretical data for future environmental release and commercialization.【Method】Three-year-old transgenic B. platyphylla (OE and RE strains) and wild-type (WT) B. platyphylla are used as materials. Soil sucrase, urease, neutral protease, catalase, and cellulase activities were measured using the spectrophotometric method. In addition, 16S rRNA and ITS sequencing analyses of rhizosphere soil microorganisms were conducted using the Illumina-Miseq high-throughput sequencing platform. The richness and diversity of bacterial and fungal communities, structural differences, and community composition in rhizosphere soil were analyzed to understand the effects of transgenic activity on soil enzyme activity and microbial composition in the rhizosphere soil of B. platyphylla.【Result】 Significant differences (P lt; 0.05) are observed in soil urease, sucrase, cellulase" and neutral protease activities between BpGLK-transformed B. platyphylla and WT strains at four time points (June 15, July 15, August 15" and September 15). However, catalase activity showed significant differences between WT and some transgenic strains. Soil urease and cellulase activities decrease significantly in mid-August and mid-September. The activity of soil neutral protease in OE strains was higher than that of the WT strain at all four periods (P lt; 0.05). At the rhizosphere bacterial community level, Burkholderia, a growth-promoting function, was the dominant genus in transgenic and WT strains. The relative abundance of Burkholderia in the rhizosphere soil of transgenic strains significantly increased. At the rhizosphere fungal community level, Tomentella dominated the rhizosphere of transgenic RE strains, while Clavulina dominated the rhizosphere of WT and OE strains. The relative abundance of Laccaria was significantly lower in OE and RE strains (P lt; 0.05). The Observed, Chao1, Shannon" and Simpson indices of transgenic B. platyphylla did not differ significantly from those of WT strains, while the community abundance and diversity of RE strains were significantly higher than those of WT strains. The difference between OE and WT strains was not significant. Venn diagram analysis revealed significant differences in ASV composition between transgenic and WT strains. In contrast, principal component analysis showed slight differences in community composition between RE and WT strains, while the difference between OE and WT strains was relatively larger. However, the difference between OE and WT strains remainsed smaller than that between RE and WT strains.【Conclusion】The results indicated that the introduction of the exogenous BpGLK gene had a specific effect on the abundance and diversity of rhizosphere bacterial and fungal communities in B. platyphylla. These changes can promote plant growth and enhance resistance. However, whether these effects persist over the long term remains to be confirmed in future experiments.
Keywords:birch(Betula platyphylla);transgenic;soil enzyme activities;rhizosphere;bacteria;fungi;community composition
白桦(Betula platyphylla)为落叶乔木,是我国北方地区主要的城市绿化树种,其树皮呈灰白色,树干姿态优美,极具观赏价值,常被用作行道树、庭院树等[1]。Golden2-like (GLK)转录因子是GARP转录因子超家族中的一员,1926年首次在黄化的玉米(Zea mays)植株中被发现并命名[2]。GLK转录因子通常包含两个保守结构域,即Myb-DNA结构域(DBD)和C-末端的GCT box[3]。GLK在植物叶绿体的形成和发育中起着重要作用,并参与植物细胞分化、果实品质和叶片衰老等生物学进程以及各种防御过程(包括生物和非生物胁迫)[4-7]。研究团队前期利用农杆菌介导法获得的转BpGLK基因过表达白桦、转BpGLK抑制表达白桦,1年生抑制表达株系由于叶片叶绿素含量降低,叶色呈现黄绿色[8],在园林绿化中应用前景广阔。然而,转基因植物在进行环境释放之前必须进行环境安全性评价,以评估转基因活动是否对周边环境产生不利的影响。
研究证明,土壤微生物在植物生长过程中发挥着重要的作用,参与根系与土壤的相互作用。一方面,植物将光合作用生产的有机物以根系分泌物或黏液的形式释放到土壤中,为土壤微生物提供营养物质;另一方面,根际土壤微生物将植物释放的有机物分解,以无机物的形式归还到土壤中,促进生态系统的养分循环[9]。鉴于土壤微生物在维持土壤生态功能方面的重要作用,人们十分关注整合于转基因植物基因组的外源基因表达产物对土壤酶活性及根际土壤微生物群落组成产生的影响。
目前有关林木转基因的相关报道主要针对杨树,例如,转DREB毛白杨(Populus tomentosa)与非转基因对照间根际土壤微生物数量差异不显著[10];转抗虫基因HPb1欧美杨(P.×euramericana)、转Bt基因‘南林895’杨(P. deltoides×P. euramericana ‘Nanlin 895’)、转基因银中杨(P. alba × P. berolinensis)、转基因银腺杂种杨(P. alba ×P. glandulosa)等外源基因的导入对根际细菌或真菌群落组成几乎没有影响或影响非常有限[11-16];转基因小黑杨(P. simonii ×P. nigra)根际土壤中有益细菌和真菌相对丰度增加,致病菌属相对丰度降低[17]。
为了研究转BpGLK白桦对根际土壤微生物群落结构的影响,本研究以转BpGLK白桦土壤为试材,测定土壤脲酶、纤维素酶、过氧化氢酶、蔗糖酶、中性蛋白酶活性,通过高通量测序技术分析其根际土壤中细菌及真菌群落组成特征,明确转基因白桦对土壤酶活性及根际土壤中微生物群落的影响,为后续转BpGLK白桦的产业化和推广应用奠定理论基础。
1 材料与方法
1.1 研究区概况
试验地位于黑龙江省哈尔滨市东北林业大学白桦育种基地(126°64′ E, 45°72′ N)。属中温带大陆性季风气候,全年平均气温5.6 ℃,最高月均气温23.6 ℃,最低月均气温-15.8 ℃,年均降水量为569.1 mm,主要降水月为 6—9 月,无霜期为168 d。
1.2 植物材料
种植于东北林业大学育种基地的3年生转BpGLK基因白桦过表达株系(OE1、OE2、OE3)、抑制表达株系(RE1、RE2、RE7)及野生型白桦(WT)。每个株系30株,种植于直径30 cm × 高20 cm的花盆中,移栽到东北林业大学白桦育种基地进行常规管理。
1.3 测试方法
1.3.1 土壤酶活性测定
于2020年6月15日、7月15日、8月15日和9月15日,分别选取 OE1、OE2、OE3、RE1、RE2、RE7及WT各3株,将花盆表层5 cm的浮土去除后,每花盆选取3点取样,收集植物周边土壤,均匀混合组成待测土样,风干后过0.28 mm孔径(50目)筛,利用苏州科铭生物技术有限公司提供的分光光度法酶活测定试剂盒测定土壤酶活性。土壤脲酶(S-UE)、蔗糖酶(S-SC)、纤维素酶(S-CL)、过氧化氢酶(S-CAT)、中性蛋白酶(S-NPT)活力单位分别为μg/(d·g)、mg/(d·g)、mg/(d·g)、μmol/(d·g)、mg/(d·g)。
1.3.2 土壤微生物群落分析
于2020年9月1日,分别选取长势一致的上述转BpGLK白桦(OE、RE)及WT,每株系各选3株,共计21株苗木。采用手动土壤取样器向下至花盆中间层采集带土的根系,每花盆选取3点取样,采用抖落法轻轻抖掉松散的土壤,分别将附着土壤的根系装入自封袋,带回实验室用于测定根际微生物群落组成。将21个样品的根系置于无菌三角瓶中,再加入40 mL 0.85%(质量分数)的无菌NaCL溶液,封口后200 r/min震荡15 min;弃根系,收集土壤悬浊液,吸取2 mL土壤悬浊液于离心管中,4 ℃、10 000 r/min,离心10 min;弃上清液,收集土壤沉淀(每个样本收集3管,合并后备用)。以收集的土壤沉淀为试验材料,采用QIAGEN公司的DNeasy PowerSoil Kit提取土壤微生物总DNA,将得到的DNA样品进行PCR扩增,使用上游引物5′-ACTCCTACGGGAGGCAGCA-3′和下游引物5′-GGACTACHVGGGTWTCTAAT-3′对细菌16SrRNA基因V3—V4区进行PCR扩增,扩增片段大小为500 bp;采用上游引物5′-GGAAGTAAAAGTCGTAACAAGG-3′和下游引物5′-GCTGCGTTCTTCATCGATGC-3′对真菌ITS rDNA 的ITS1 区进行PCR扩增,扩增片段大小为280 bp。
扩增体系共25 μL :5×反应缓冲液5 μL,5×GC Buffer 5 μL,2 μL 2.5 mmol/L的 dNTP,1 μL 10 μmol/L的正向引物,1 μL 10 μmol/L的反向引物,2 μL DNA模板,8.75" μL ddH2O,Q5 DNA聚合酶0.25 μL。PCR扩增条件为:98 ℃" 2 min;98 ℃ 15 s,55 ℃" 30 s,72 ℃" 30 s,25~30个循环;72 ℃" 5 min。扩增完成后将DNA样本送至上海派森诺生物科技有限公司进行细菌16SrRNA、真菌ITS建库及高通量测序。
1.4 数据分析
用DADA2方法[18]进行去引物、质量过滤、去噪、拼接和去嵌合体等。用QIIME 2 软件进行Alpha多样性、物种组成及差异分析。用Excel 2019、SPSS Statistics 27、Heml等软件进行数据处理和作图。
2 结果与分析
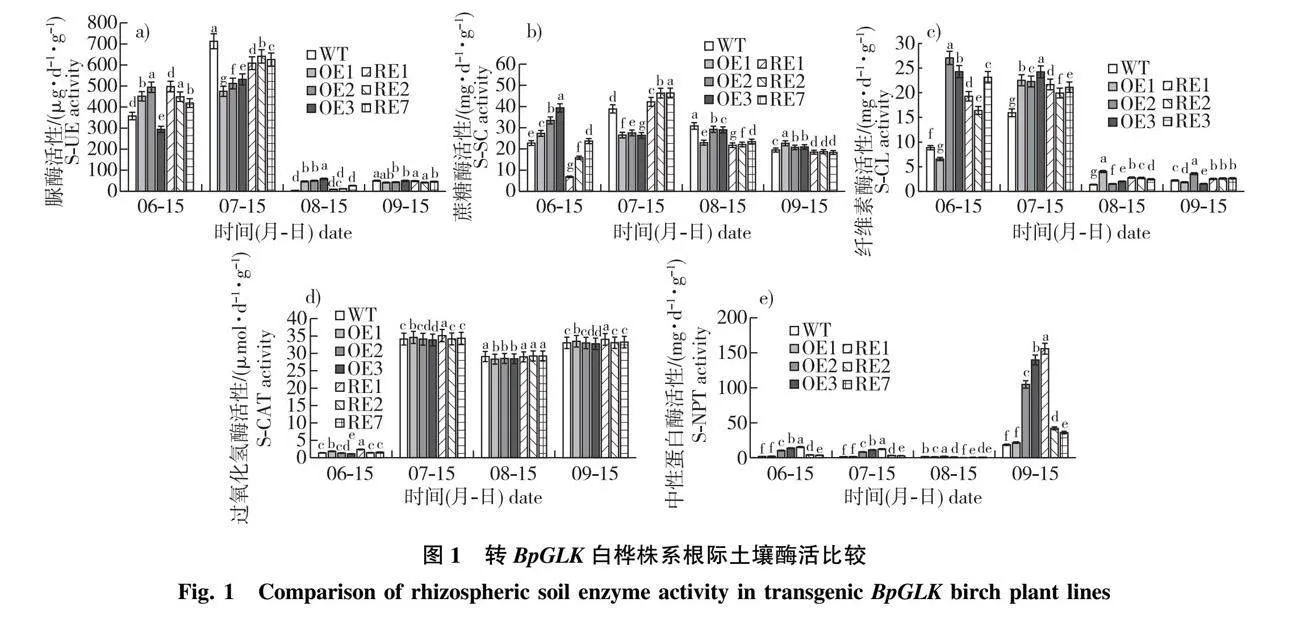
2.1 转BpGLK白桦土壤酶活性分析
对转BpGLK白桦抑制表达株系(RE株系)和过表达株系(OE株系)根际土壤脲酶、蔗糖酶、纤维素酶、过氧化氢酶及中性蛋白酶的活性测定结果进行分析可知,在6月中旬,参试株系(除OE3外)土壤脲酶活性均显著高于WT株系;7月中旬,转基因株系的土壤脲酶活性均显著低于WT株系,OE株系土壤脲酶活性均值为505.98 μg/(d·g),低于WT 28.97%,RE株系均值为624.94 μg/(d·g),低于WT 12.27%(图1a)。在试验涉及的4个时期,土壤蔗糖酶活性在转基因株系与WT株系之间均存在显著差异(P<0.05),RE株系土壤蔗糖酶活性在7月15日显著高于WT和OE株系,而OE株系在6月中旬和9月中旬显著高于WT株系和RE株系(图1b)。转基因株系的土壤纤维素酶在4个时期均显著高于WT株系(OE1及OE3除外)(图1c)。土壤过氧化氢酶只在OE1、OE3及RE1株系与WT株系间存在显著差异;土壤脲酶和纤维素酶在8月中旬和9月中旬明显降低,而土壤中性蛋白酶在9月中旬明显升高,OE株系的土壤中性蛋白酶活性在4个时期均高于或显著高于WT株系(P<0.05)(图1e)。
2.2 转BpGLK白桦根际细菌及真菌群落组成特征
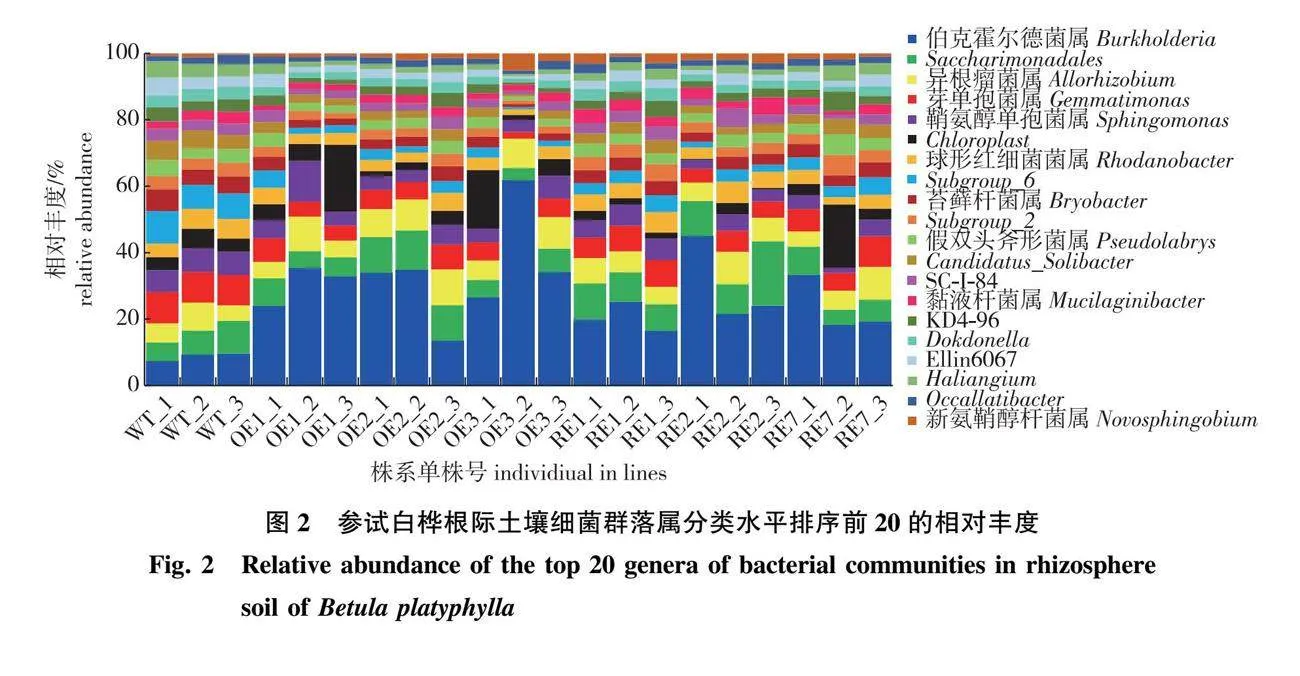
参试株系根际土壤细菌群落在属水平上共有995个属,根际细菌的伯克霍尔德菌属(Burkholderia)是7个株系细菌群落的优势类群,该属菌在RE株系、OE株系及WT株系中的相对丰度分别为11.83%、17.22%、3.27%;该菌属在RE株系和OE株系的相对丰度显著高于WT株系(P<0.05)(图2)。
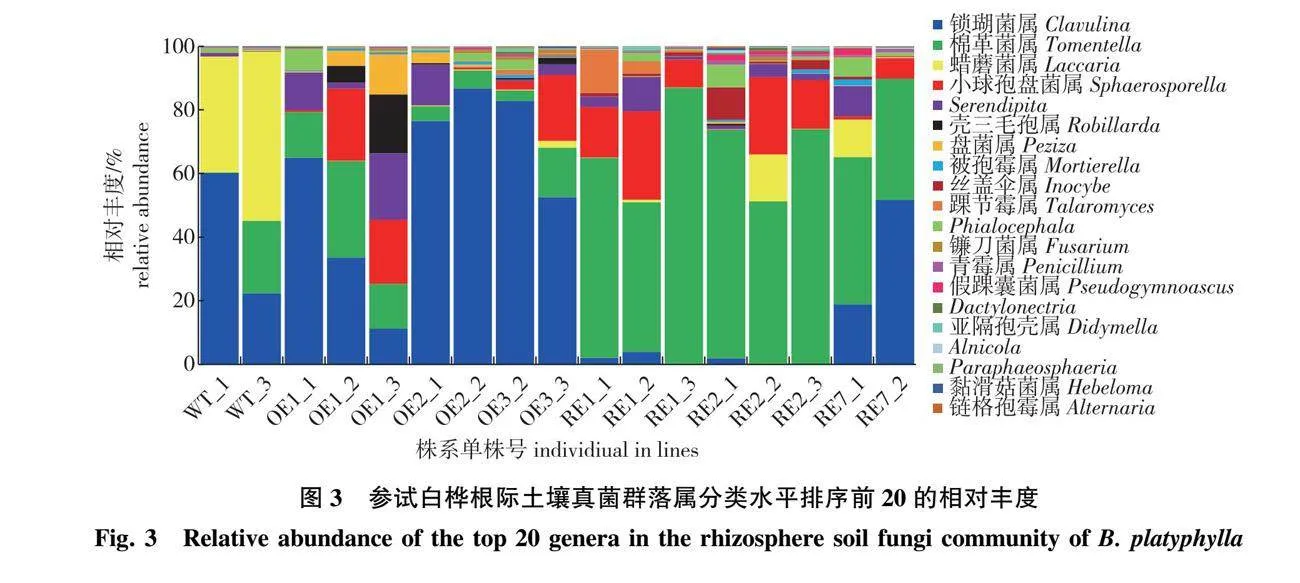
参试株系根际土壤真菌群落在属水平共有391个属。其中棉革菌属(Tomentella)是RE株系根际的优势类群,该属菌在RE株系中的相对丰度均显著高于OE株系及 WT株系(P<0.05)(图3);锁瑚菌属(Clavulina)是WT及OE株系根际的优势类群;蜡蘑菌属(Laccaria)的相对丰度在OE株系和RE株系中显著降低(P<0.05)。
2.3 转BpGLK白桦根际土壤细菌、真菌群落丰度和Alpha多样性变化
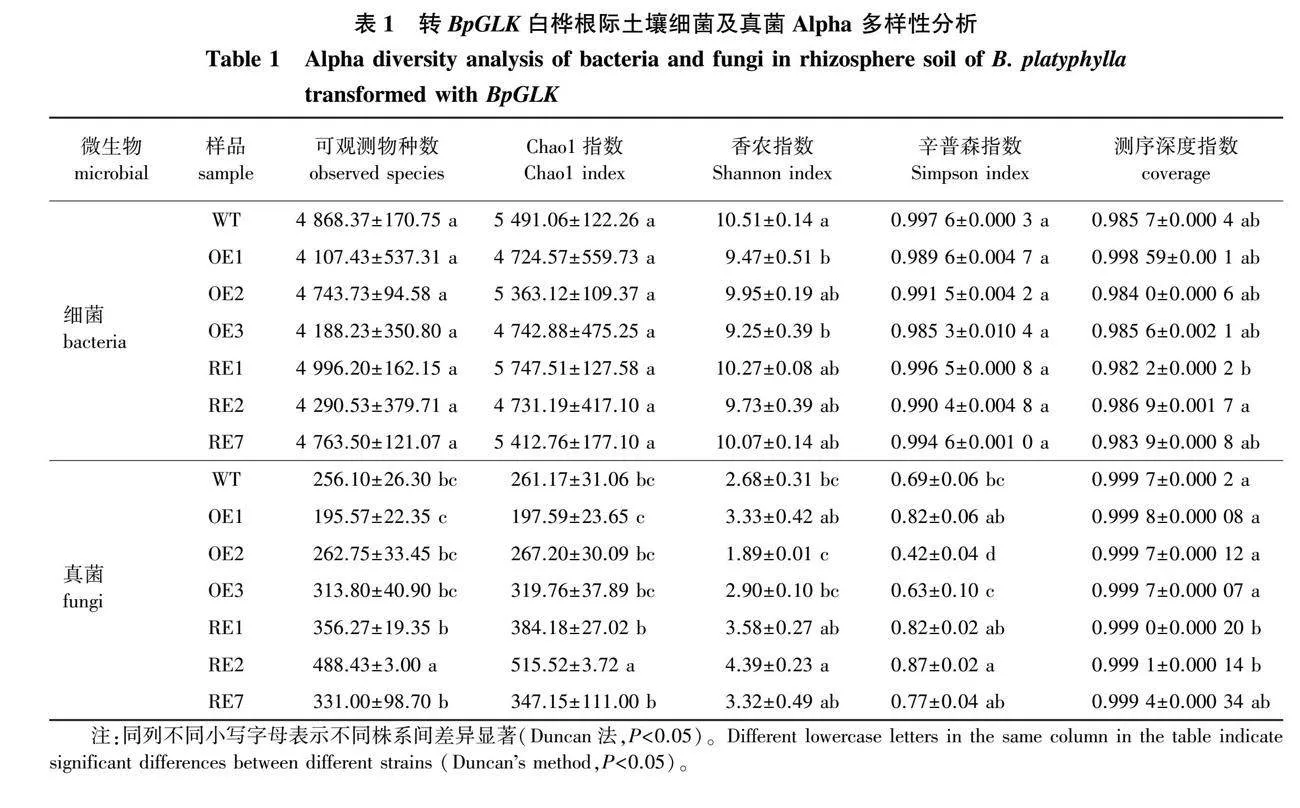
由转BpGLK白桦根际土壤细菌及真菌Alpha 多样性分析结果(表1)可知,参试样本细菌及真菌的测序深度指数(coverage)均在98%以上,表明样本中序列被测出的概率高于98%,即测序结果能够真实反映根际土壤细菌及真菌群落多样性变化。
对可观测物种数(observed species)、Chao1指数、香农(Shannon)指数、辛普森(Simpson)指数分析显示,在细菌群落组成方面,OE株系、RE株系与WT株系细菌群落丰度、多样性均无显著差异(P<0.05)(OE1及OE3株系Shannon指数除外)。在真菌群落组成方面,RE株系的群落丰度、多样性均显著高于或高于WT株系,而OE株系的群落丰度、多样性与WT株系差异未达到显著水平。
2.4 转BpGLK白桦根际土壤细菌及真菌群落组成差异分析
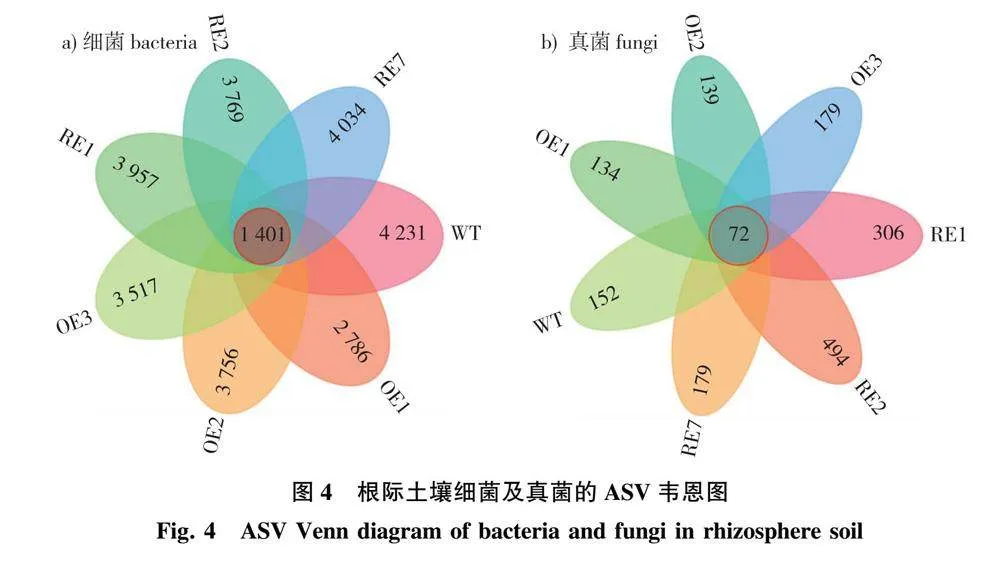
基于参试株系根际土壤细菌和真菌的特征序列(ASV)分别绘制了韦恩图。在根际土壤细菌方面:参试株系共有的ASV为1 401个,占总数的3.61%,说明各样本间ASV差异显著(图4a)。WT株系特有的ASV为4 231个;3个OE株系特有的ASV分别为2 786、3 756、3 517个;3个RE株系特有的ASV分别为3 957、3 769、4 034个。
在根际土壤真菌方面,参试株系共有的ASV为72个,占总数的3.07%,同样说明各样本间ASV存在差异(图4b)。WT株系特有的ASV为152个;3个OE株系特有的ASV分别为134、139、179个;3个RE株系特有的ASV分别为306、494、179个。
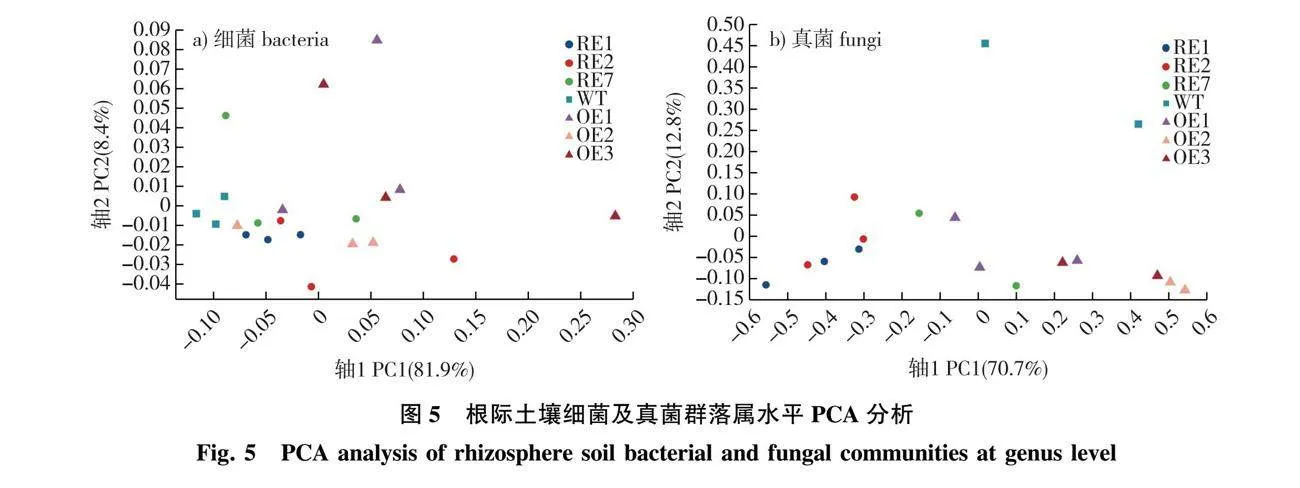
对参试株系根际土壤细菌和真菌在ASV水平上进行主成分分析(PCA),结果(图5)显示,PC1和PC2对根际土壤细菌群落结构的贡献率分别为81.9%和8.4%(图5a),累积贡献率为90.3%。同时在根际土壤真菌群落PCA分析中,PC1和PC2的贡献率分别为70.7%和12.8%(图5b),累积贡献率为83.5%。
PCA分析中,样本在坐标轴上的投影距离越近,反映出样本间的物种丰度组成在相应维度中越相似。由图5可以得出,在细菌群落组成上,RE株系与WT株系的群落组成差异较小,而OE株系与WT株系差异相对较大;在真菌群落组成上,OE株系与WT株系的群落组成差异较小,而RE株系与WT株系差异相对较大。
3 讨 论
土壤酶能积极参与土壤中营养物质的循环,在土壤养分的循环代谢过程中起着重要的作用,是各种生化反应的催化剂。土壤酶活性与土壤生物数量、生物多样性密切相关,是土壤生物学活性的表现,可以作为土壤质量的整合生物活性指标[19]。转基因植物的外源基因可通过根系分泌物或植物残体等进入土壤,从而可能对土壤酶活性产生影响[20-22]。故此,人们试图通过转基因植物根际土壤酶活性测定监控转基因植物对土壤微生态的影响。
试验对参试株系根际土壤酶活分析显示,在测定时间内,转基因白桦与WT株系在土壤脲酶、蔗糖酶、纤维素酶、过氧化氢酶及中性蛋白酶存在显著差异,且土壤酶活性存在明显的季节性变化。前人研究发现,转基因活动会影响土壤酶活性,例如,俞元春等[23]研究发现,种植10 a的转基因抗虫棉显著提高了土壤过氧化氢酶活性,但同时土壤酶活性与土壤温度、理化性质及根际生物量等多种生物因素和非生物因素相关[24-25];冯翠莲等[26]发现抗虫转基因甘蔗对其根际土壤酶活性的影响会因甘蔗生长周期、抗虫转基因甘蔗株系以及酶的种类而大有不同。因此,本研究中根际土壤的酶活性发生的改变,是否由于转基因株系造成的,还需要进一步测定土壤理化性质进行分析研究。
根际微生物对植物生长和发育具有重要作用,其参与植物的营养吸收、病原菌防御和非生物胁迫等重要生理过程。转基因植物是否影响植物根际土壤中的微生物,是近年来的研究热点。转EPSPS基因玉米根际细菌α多样性和β多样性指数与野生型玉米间无显著差异,但能够促进植物生长的慢生根瘤菌属(Bradyrhizobium)和芽孢杆菌属(Bacillus)的相对丰度显著降低,而食酸菌属(Acidovorax)的相对丰度显著升高[27];试验结果显示,伯克霍尔德菌是转BpGLK白桦根际的优势细菌属。伯克霍尔德菌是一类革兰氏阴性细菌,分布广泛、功能多样,其分类复杂,成员占据了包括土壤、水、植物和动物在内的各种生态位[28]。近年来,随着与植物相关的伯克霍尔德菌的研究增加,越来越多的证据表明,该菌属的大部分物种是一类重要的植物根际促生菌,经常在植物根系中被发现。据报道,伯克霍尔德菌能够在至少30种植物的根系中大量定殖[28-30],具有生物固氮、解磷、促生、产生吲哚乙酸等植物激素、抗菌、降解环境中的微生物等功能[31]。伯克霍尔德菌在转基因株系的根际土壤中相对丰度显著升高,同时转基因株系在生长期的苗高显著高于WT株系[32],这也证实了伯克霍尔德菌对植物具有促生功能。
参试株系通过ITS测序分析显示,根际土壤真菌群落中棉革菌属(Tomentella)为转BpGLK基因白桦抑制表达株系优势类群,该属为全球广布属,几乎所有的种均为菌根菌,可与松科(Pinaceae)、壳斗科(Fagaceae)、桦木科(Betulaceae)、杨柳科(Salicaceae)、半日花科(Cistaceae)的植物形成外生菌根[33-35]。越来越多的研究表明,该属真菌在北温带、温带和热带地区森林生态系统中,特别是针叶林和阔叶落叶林中很常见且占主导地位的外生菌根真菌类群[36-39]。而锁瑚菌属(Clavulina)是WT及OE株系根际的优势类群,其外生菌根真菌不具有宿主专一性,且分布较为广泛,是一种常见的外生菌根真菌[40-42];且部分外生菌根真菌能够形成子实体,具有食药用价值。蜡蘑菌属(Laccaria)的相对丰度在OE株系和RE株系中显著降低,蜡蘑属真菌作为外生菌根菌,它具有促进植物生长发育,提高植物抗逆性,修复污染与退化土壤、改善土壤质量与健康状况,保持生态平衡、稳定生态系统及其可持续生产力等作用[43]。该菌属在转基因株系中的相对丰度虽有所下降,但植物生长主要受到光合作用的影响,同时根际中的伯克霍尔德菌也具有促进植物生长发育的功能,微生物之间的协同作用及相互影响,使转基因株系的苗高均显著高于WT株系[32],因此蜡蘑属菌的下降没有影响转基因株系的高生长。
试验虽然发现转BpGLK白桦对土壤酶活性、根际土壤细菌及真菌群落结构产生了一定的影响,但这些影响并没有对植物的生长发育产生不利的影响。本研究中仅为3年生转BpGLK白桦的研究结果,该结果不足以说明转BpGLK白桦是否安全。因此,后续仍需进行长期的跟踪调查研究,分析微生物间是否会产生拮抗作用,在植物不同生长发育阶段微生物群落结构是否会发生变化,进一步获得较为全面的转BpGLK基因白桦对根际及周边土壤影响的基础数据,以评估其大面积释放对土壤微生态环境的安全性。
参考文献(reference):
[1]李天芳,姜静,杨传平,等.我国白桦育种研究概况[J].江苏林业科技,2008,35(2):47-49.LI T F,JIANG J,YANG C P,et al.Status of breeding research on Betula platyphylla in China[J].J Jiangsu For Sci Technol,2008,35(2):47-49.DOI: 10.3969/j.issn.1001-7380.2008.02.013.
[2]MERLE" J. A second gene producing golden plant color in maize[J]. American Naturalist, 1926,60(670):484-488.
[3]ROSSINI L,CRIBB L,MARTIN D J,et al.The maize golden2 gene defines a novel class of transcriptional regulators in plants[J].Plant Cell,2001,13(5):1231-1244.DOI: 10.1105/tpc.13.5.1231.
[4]NGUYEN C V,VREBALOV J T,GAPPER N E,et al.Tomato GOLDEN2-LIKE transcription factors reveal molecular gradients that function during fruit development and ripening[J].Plant Cell,2014,26(2):585-601.DOI: 10.1105/tpc.113.118794.
[5]KOBAYASHI K,SASAKI D,NOGUCHI K,et al.Photosynthesis of root chloroplasts developed in Arabidopsis lines overexpressing GOLDEN2-LIKE transcription factors[J].Plant Cell Physiol,2013,54(8):1365-1377.DOI: 10.1093/pcp/pct086.
[6]CHEN M,JI M L,WEN B B,et al.GOLDEN 2-LIKE transcription factors of plants[J].Front Plant Sci,2016,7:1509.DOI: 10.3389/fpls.2016.01509.
[7]HAN X Y,LI P X,ZOU L J,et al.GOLDEN2-LIKE transcription factors coordinate the tolerance to Cucumber mosaic virus in Arabidopsis[J].Biochem Biophys Res Commun,2016,477(4):626-632.DOI: 10.1016/j.bbrc.2016.06.110.
[8]GANG H X,LIU G F,CHEN S,et al.Physiological and transcriptome analysis of a yellow-green leaf mutant in birch (Betula platyphylla × B.pendula)[J].Forests,2019,10(2):120.DOI: 10.3390/f10020120.
[9]陆雅海,张福锁.根际微生物研究进展[J].土壤,2006,38(2):113-121.LU Y H,ZHANG F S.The advances in rhizosphere microbiology[J].Soils,2006,38(2):113-121.DOI: 10.3321/j.issn:0253-9829.2006.02.001.
[10]GUO Q,LU N,LUO Z J,et al.An assessment of the environmental impacts of transgenic triploid Populus tomentosa in field condition[J].Forests,2018,9(8):482.DOI: 10.3390/f9080482.
[11]侯英杰,苏晓华,焦如珍,等.转基因银腺杂种杨对土壤微生物的影响[J].林业科学,2009,45(5):148-153.HOU Y J,SU X H,JIAO R Z,et al.Effects of transgenic Populus alba × P.glandulosa on soil microorganism[J].Sci Silvae Sin,2009,45(5):148-153.DOI: 10.3321/j.issn:1001-7488.2009.05.023.
[12]吕秀华.转基因银中杨ABJ系列对土壤微生物类群的影响[J].基因组学与应用生物学,2017,36(5):1991-1996.LYU" X H.The impact of transgenic poplar (ABJ series) on soil microorganism group[J].Genom Appl Biol,2017,36(5):1991-1996.DOI: 10.13417/j.gab.036.001991.
[13]吕秀华.转基因银中杨对根际土壤微生物的影响[J].基因组学与应用生物学,2018,37(5):1965-1970.LYU" X H.The impact of transgenic poplar on soil microorganism group[J].Genom Appl Biol,2018,37(5):1965-1970.DOI: 10.13417/j.gab.037.001965.
[14]孙伟博,魏朝琼,马晓星,等.3类转基因南林895杨田间试验的安全性评估[J].林业科学,2020,56(10):53-62.SUN W B,WEI Z Q,MA X X,et al.Safety assessment of a field trial of three types of transgenic poplar Nanlin895[J].Sci Silvae Sin,2020,56(10):53-62.DOI: 10.11707/j.1001-7488.20201006.
[15]周培军,李玲玲,李红岩,等.转Bt基因‘南林895’杨时空表达及生物安全分析[J].分子植物育种,2022,20(5):1568-1580. ZHOU P J,LI L L,LI H Y, et al. Spatio-temporal expression and biosafety analysis of transgenic ‘Nanlin 895’ poplar with Bt[J]. Molecular Plant Breeding,2022,20(5): 1568-1580.
[16]FAN J M,DONG Y,YU X Y,et al.Assessment of environmental microbial effects of insect-resistant transgenic Populus" ×" Euramericana cv.‘74/76’ based on high-throughput sequencing[J].Acta Physiol Plant,2020,42(11):167.DOI: 10.1007/s11738-020-03148-3.
[17]王阳,王伟,姜静,等.转基因小黑杨根际土壤微生物群落特征研究[J].南京林业大学学报(自然科学版),2023,47(1):199-208.WANG Y,WANG W,JIANG J,et al.Diversity of microbial community in rhizosphere of genetically modified Populus simonii × P.nigra[J].J Nanjing For Univ (Nat Sci Ed),2023,47(1):199-208.
[18]CALLAHAN" B" J, MCMURDIE P J, ROSEN M J, et al. Dada 2:high-resolution sample inference from illumina amplicon dada[J]. Nature Methods, 2016, 13(7), 581-583.
[19]戴伟,白红英.土壤过氧化氢酶活度及其动力学特征与土壤性质的关系[J].北京林业大学学报,1995,17(1):37-41.DAI W, BAI H Y. Correlations of soil catalase activity and it’s kinetic characteristic with some soil properties[J]. Journal of Beijing Forestry University, 1995, 17(1):37-41.
[20]DICK R P,SANDOR J A,EASH N S.Soil enzyme activities after 1500 years of terrace agriculture in the Colca Valley,Peru[J].Agric Ecosyst Environ,1994,50(2):123-131.DOI: 10.1016/0167-8809(94)90131-7.
[21]林天,何园球,李成亮,等.红壤旱地中土壤酶对长期施肥的响应[J].土壤学报,2005,42(4):682-686.LIN T,HE Y Q,LI C L,et al.Response of soil enzymes to long-term fertilization in upland red soil[J].Acta Pedol Sin,2005,42(4):682-686.DOI: 10.3321/j.issn:0564-3929.2005.04.022.
[22]杨宁,杨满元,雷玉兰,等.衡阳紫色土丘陵坡地土壤酶活性对植被恢复的响应[J].生态环境学报,2014,23(4):575-580.YANG N,YANG M Y,LEI Y L,et al.Response of soil enzyme activities to re-vegetation on sloping-land with purple soils in Hengyang of Hunan Province,China[J].Ecol Environ Sci,2014,23(4):575-580.DOI: 10.3969/j.issn.1674-5906.2014.04.005.
[23]俞元春,冷春龙,舒洪岚,等.转基因抗虫棉对土壤养分和酶活性的影响[J].南京林业大学学报(自然科学版),2011,35(5):21-24.YU Y C,LENG C L,SHU H L,et al.Effects of insect-resistant transgenic cotton on soil nutrients and enzyme activities[J].J Nanjing For Univ (Nat Sci Ed),2011,35(5):21-24.DOI: 10.3969/j.issn.1000-2006.2011.05.005.
[24]DEFOREST J L.The influence of time,storage temperature,and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and L-DOPA[J].Soil Biol Biochem,2009,41(6):1180-1186.DOI: 10.1016/j.soilbio.2009.02.029.
[25]LUCAS-BORJA M E,HEDO J,CERD A,et al.Unravelling the importance of forest age stand and forest structure driving microbiological soil properties,enzymatic activities and soil nutrients content in Mediterranean Spanish black pine(Pinus nigra Ar.ssp.salzmannii) forest[J].Sci Total Environ,2016,562:145-154.DOI: 10.1016/j.scitotenv.2016.03.160.
[26]冯翠莲,万玥,赵婷婷,等.抗虫转基因甘蔗对土壤酶活性的影响[J].热带生物学报,2020,11(1):1-6.FENG C L, WAN Y, ZHAO T T, et al. Effect of insect-resistant transgenic sugarcane on soil enzyme activities in the rhizosphere[J].Journal of Tropical Biology, 2020, 11(1):1-6.DOI: 10.15886/j.cnki.rdswxb.2020.01.001.
[27]WEN Z L,YANG M K,DU M H,et al.Enrichments/derichments of root-associated bacteria related to plant growth and nutrition caused by the growth of an EPSPS-transgenic maize line in the field[J].Front Microbiol,2019,10:1335.DOI: 10.3389/fmicb.2019.01335.
[28]COENYE T,VANDAMME P.Diversity and significance of Burkholderia species occupying diverse ecological niches[J].Environ Microbiol,2003,5(9):719-729.DOI: 10.1046/j.1462-2920.2003.00471.x.
[29]SUREZ-MORENO Z R,CABALLERO-MELLADO J,COUTINHO B G,et al.Common features of environmental and potentially beneficial plant-associated Burkholderia[J].Microb Ecol,2012,63(2):249-266.DOI: 10.1007/s00248-011-9929-1.
[30]COMPANT S,NOWAK J,COENYE T,et al.Diversity and occurrence of Burkholderia spp. in the natural environment[J].FEMS Microbiol Rev,2008,32(4):607-626.DOI: 10.1111/j.1574-6976.2008.00113.x.
[31]张珂飞,钟永嘉,孙丽莉,等.植物有益伯克霍尔德氏菌的研究进展及其在农业中的应用[J].微生物学报,2021,61(8):2205-2218.ZHANG K F,ZHONG Y J,SUN L L,et al.Plant-associated beneficial Burkholderia[J].Acta Microbiol Sin,2021,61(8):2205-2218.DOI: 10.13343/j.cnki.wsxb.20200562.
[32]刘佳琦,宋逸欣,成星川,等.转BpGLK1基因白桦叶色变异规律及生长特性分析[J].江西农业学报,2021,33(8):17-23.LIU J Q,SONG Y X,CHENG X C,et al.Analysis of leaf color variation and growth characteristics of transgenic BpGLK1" brich[J].Acta Agric Jiangxi,2021,33(8):17-23.DOI: 10.19386/j.cnki.jxnyxb.2021.08.004.
[33]DE ROMAN M,CLAVERIA V,DE MIGUEL A M.A revision of the descriptions of ectomycorrhizas published since 1961[J].Mycol Res,2005,109(Pt 10):1063-1104.DOI: 10.1017/s0953756205003564.
[34]JAKUCS E,KOVCS G M,SZEDLAY G,et al.Morphological and molecular diversity and abundance of tomentelloid ectomycorrhizae in broad-leaved forests of the Hungarian Plain[J].Mycorrhiza,2005,15(6):459-470.DOI: 10.1007/s00572-005-0351-8.
[35]WALKER J F,MILLER O K Jr,HORTON J L.Hyperdiversity of ectomycorrhizal fungus assemblages on oak seedlings in mixed forests in the southern Appalachian Mountains[J].Mol Ecol,2005,14(3):829-838.DOI: 10.1111/j.1365-294X.2005.02455.x.
[36]HAUG I,WEISS M,HOMEIER J,et al.Russulaceae and Thelephoraceae form ectomycorrhizas with members of the Nyctaginaceae (Caryophyllales) in the tropical mountain rain forest of southern Ecuador[J].New Phytol,2005,165(3):923-936.DOI: 10.1111/j.1469-8137.2004.01284.x.
[37]JAKUCS E,EROS-HONTI Z.Morphological-anatomical characterization and identification of Tomentella ectomycorrhizas[J].Mycorrhiza,2008,18(6/7):277-285.DOI: 10.1007/s00572-008-0183-4.
[38]DAHLBERG A.Effect of soil humus cover on the establishment and development of mycorrhiza on containerised Pinus sylvestris" and Pinus contorta ssp. Latifolia Engelm.after outplanting[J].Scand J For Res,1990,5(1/2/3/4):103-112.
[39]TROWBRIDGE J,JUMPPONEN A.Fungal colonization of shrub willow roots at the forefront of a receding glacier[J].Mycorrhiza,2004,14(5):283-293.DOI: 10.1007/s00572-003-0264-3.
[40]魏松坡,宋怡静,贾黎明,等.太行山片麻岩区栓皮栎外生菌根真菌多样性[J].菌物学报,2018,37(4):422-433.WEI S P,SONG Y J,JIA L M,et al.Diversity of ectomycorrhizal fungi associated with Quercus variabilis in gneissose area of Taihang Mountains[J].Mycosystema,2018,37(4):422-433.DOI: 10.13346/j.mycosystema.170226.
[41]杨岳,闫伟,魏杰.黑里河和贺兰山自然保护区华北落叶松根区土壤中外生菌根真菌群落[J].菌物学报,2019,38(1):48-63.YANG Y,YAN W,WEI J.Ectomycorrhizal fungal community in the root zone soil of Larix gmelinii var. Principis-rupprechtii in Heilihe and Helanshan National Nature Reserve[J].Mycosystema,2019,38(1):48-63.DOI: 10.13346/j.mycosystema.180153.
[42]SMITH M E,HENKEL T W,CATHERINE AIME M,et al.Ectomycorrhizal fungal diversity and community structure on three co-occurring leguminous canopy tree species in a Neotropical rainforest[J].New Phytol,2011,192(3):699-712.DOI: 10.1111/j.1469-8137.2011.03844.x.
[43]木兰.白音敖包国家级自然保护区大型真菌资源调查兼中国蜡蘑属的分类学研究[D].长春:吉林农业大学,2015.MU L.Investigation on macrofungi resources in Baiyin Aobao National Nature Reserve and taxonomic study on Tricholoma in china[D].Changchun:Jilin Agricultural University,2015.
(责任编辑 吴祝华)

