博瑞医药:原料药市场空间大 制剂有望国产替代
博瑞医药(688166)成立于2001年,主要聚焦于高技术壁垒的医药中间体、原料药的合成工艺开发与生产。凭借自身在微生物发酵、高难度药物合成工艺、药物合成原创路线设计、药物新晶型及药物靶向递送等方面积累的技术优势,建立了发酵半合成技术平台、多手性药物技术平台、靶向高分子偶联技术平台和非生物大分子技术平台等核心药物研发技术平台。2006年公司开发出首个重磅品种恩替卡韦的具有自主权的合成技术,助力天晴恩替卡韦片拿下首仿。此后公司聚焦高难原料药合成技术的开发,公司也进一步向制剂产品领域拓展,逐步建立起原料药与制剂一体,仿制药与创新药结合的业务体系。
原料药市场空间广阔
特色原料药业务为公司支柱业务,构成公司业务的基本盘。公司原料药业务收入从2018年的3.48亿元增长至2022年的7.78亿元,CAGR为17.46%,增长迅速。原料药收入占比始终保持80%以上,但历年增速存在较大波动,主要因为不同地区不同产品获批情况导致销售放量速度不一致。
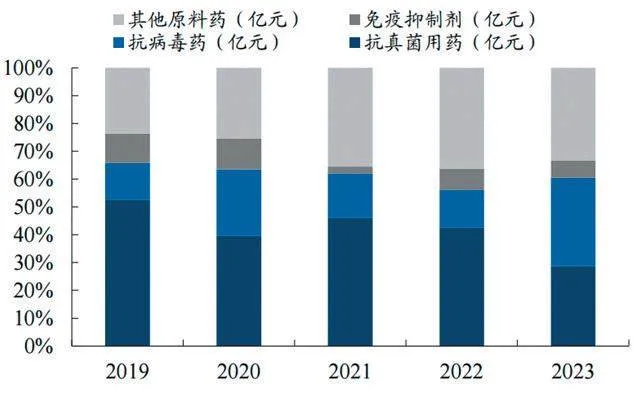
公司特色原料药分为抗真菌类、抗病毒类、免疫抑制类和其他类品种,其中抗真菌类是公司当家品种,销售额占比始终保持50%左右(见图),核心产品主要包括卡泊芬净、米卡芬净、阿尼芬净等,未来市场空间广阔。比如卡泊芬净,全球市场方面,据Acumen Researchand Consult⁃ing,卡泊芬净全球市场规模将从2022年的4.69亿美元增长至2032年的5.74亿美元,CAGR为2.1%。而亚太地区CAGR会快于全球,达2.5%。国内方面,2023年11月第九批国家集采结果显示,注射用醋酸卡泊芬净入选,预计伴随集采销售量增加,对原料药需求也将提振。
当前,公司原料药制剂产能持续扩张。公司泰兴原料药和制剂生产基地(二期)已完成所有单体建筑物、消防验收,其中泰兴原料药生产基地目前维护结构已完成,机电主材已进场,试生产已通过专家签字意见,环保专家意见已出并整改中;苏州吸入剂及其他化学药品制剂生产基地和生物医药研发中心项目(一期)厂房结构已封顶;苏州吸入剂及其他化学药品制剂生产基地和生物医药研发中心新建项目(二期)软雾车间机电安装调试完成;创新药制剂和原料生产基地建设项目(一期)和苏州制剂生产基地目前围护结构已完成,机电主材已进场,施工已完成30%。
制剂产品国产替代空间大
此外,公司的制剂产品持续丰富。截至2024年9月公司累计有16款制剂获批上市。2024年上半年,公司实现制剂产品收入1.10亿元,同比增长30.4%;制剂产品收入占产品销售收入的比例进一步提升至17.9%。截至2024年9月,公司吸入用布地奈德混悬液已在国内申报;噻托溴铵奥达特罗吸入喷雾剂、噻托溴铵吸入喷雾剂已通过BE试验,预计今年年内进行申报;沙美特罗替卡松吸入粉雾剂临床试验申请已获批;噻托溴铵吸入粉雾剂已经完成中试。另外羧基麦芽糖铁也已完成BE试验。
目前国内吸入制剂市场主要由外资把持,外资药企占据超90%的市场规模,国内仅天晴、上海医药等厂家分得极少吸入制剂份额,国产化率不足10%,主要归因于:(1)吸入制剂多为药械一体,技术壁垒极高;(2)吸入剂处方设计复杂同时临床试验较为困难;(3)吸入制剂审批难度大,较难获批。因此,在国家鼓励国产化替代、医保控费的大背景下,中国吸入制剂市场竞争格局较好,后来国产吸入制剂对进口品牌有较大替代空间。公司对吸入制剂的布局有望打开未来业绩的想象空间。
降糖减重药持续推进
博瑞医药2024年三季报显示:公司2024年前三季度实现营业收入9.77亿元,同比增长6.77%;归母净利润1.77亿元,同比下滑7.50%;扣非归母净利润1.74亿元,同比下滑7.50%。公司2024年三季度实现营业收入3.19亿元,同比下滑2.52%;归母净利润0.71亿元,同比下滑13.73%;扣非归母净利润0.68亿元,同比下滑17.34%。
利润下滑主要由于公司BGM0504降糖和减重适应症2期临床均已完成,计提较多研发费用。三季度公司研发投入0.79亿元,同比增长30.53%,其中研发费用0.70亿元,同比增长16.7%。前三季度经测算,剔除创新药研发费用影响后,2024三季度归母净利润同比增长16.11%。从销售毛利率和净利率看,三季度公司毛利率为63.58%,同比增长0.42%,净利率20.22%,同比下滑3.71个百分点。
公司BGM0504二期临床数据优异,后续临床正常推进中。BGM0504注射液减重和2型糖尿病治疗两项适应症在国内的II期临床试验达成预期目标,减重适应症中第24周时5mg组、10mg组和15mg组体重较基线平均降幅百分比(扣除安慰剂)分别为10.8%、16.2%和18.5%,腰围较基线平均降幅(扣除安慰剂)分别为6.4cm、8.8cm和10.2cm,次要指标提升显著降低多项心血管代谢风险指标,且安全性及耐受性良好;降糖适应症中5mg组、10mg组、15mg组和司美格鲁肽注射液HbA1c较基线平均降幅(扣除安慰剂)分别为1.99%、2.21%、2.76%和1.71%,中高剂量组中分别有27.3%和50%的受试者达到了糖化正常水平(HbA1c<5.7%),远高于司美格鲁肽注射液组的12.5%,此外空腹血糖、餐后2h血糖等降糖指标以及HbA1c/体重复合达标率指标等均较基线有显著的改善。
展望未来,BGM0504注射液减重适应症已获得III期临床试验伦理批件,且首例受试者已入组,降糖适应症III期沟通交流已获CDE答复,同意开展III期临床,目前尚待获得医院临床试验伦理批件后方可开展III期临床研究。国际化拓展方面减重适应症在美国已获批IND,目前首例受试者已入组;口服BGM0504目前也处于临床前研究阶段。
图:博瑞医药原料药各品种收入拆分