玉米穗腐病致病南方镰孢菌菌株JX18-4效应蛋白的预测及分析

摘要:为挖掘与玉米受体蛋白互作进而触发免疫反应的南方镰孢菌效应蛋白,基于南方镰孢菌菌株JX18-4全基因组编码蛋白序列,利用Signal P、WoLFP SORT、Target P、TMHMM和big PI Predictor等生物信息学软件预测出分泌蛋白684个,随后再用EffectorP软件预测出效应蛋白157个,随后筛选出氨基酸残基数lt;400且半胱氨酸残基数≥4的效应蛋白115个。植物与寄主互作(PHI)和碳水化合物酶类(CAZymes)分析结果表明,获得PHI和CAZymes数据库注释的效应蛋白数分别为14、26个。10个效应蛋白获得PHI和CAZymes 2个数据库注释,其中6个候选效应蛋白的注释结果一致。本研究所预测出的南方镰孢菌菌株JX18-4效应蛋白将会为南方镰孢菌引起的玉米穗腐病的致病机制及防控方法研究提供了参考依据。
关键词:南方镰孢菌;玉米穗腐病;全基因组;分泌蛋白;效应蛋白
中图分类号:S435.131.4+9" 文献标志码:A
文章编号:1002-1302(2024)23-0124-05
苏月贵,唐照磊,杜" 青,等. 玉米穗腐病致病南方镰孢菌菌株JX18-4效应蛋白的预测及分析[J]. 江苏农业科学,2024,52(23):124-128.
doi:10.15889/j.issn.1002-1302.2024.23.017
收稿日期:2024-02-02
基金项目:广西自然科学基金(编号:2020GXNSFAA297137);广西农业科学院科技发展基金(编号:桂农科2021JM39、桂农科2022JM17)。
作者简介:苏月贵(1984—),男,广西灵川人,硕士,助理研究员,从事玉米抗病性研究。E-mail:suyuegui@163.com。
通信作者:杜" 青,硕士,副研究员,从事玉米抗病性研究。E-mail:duq82@163.com。
穗腐病是玉米生产上的重要病害之一,在世界范围内普遍发生,也是我国最常见的玉米真菌病害。镰孢菌主要引起的2种类型的玉米穗腐病,分别为镰孢穗腐病(Fusarium ear rot,简称 FER)和赤霉穗腐病(Gibberella ear rot,简称GER)[1],南方镰孢(Fusarium meridionale)与禾谷镰孢(F.graminearum)同为禾谷镰孢复合种的不同发育种,均能引起 GER。在国外,由南方镰孢引起的玉米穗腐病主要发生在气候温润的巴西南部、阿根廷东北部和我国西南近邻尼泊尔等地[2-4];在我国,主要分布在西南玉米产区,如广西、贵州、云南、四川、陕西、重庆等地,也是引起广西玉米穗腐病的重要致病菌[5-7]。南方镰孢穗腐病导致玉米产量损失和品质下降,更重要的是收获感染了该病菌的果穗,可能会导致真菌毒素如雪腐镰刀菌烯醇(nivalenol,简称NIV)和赤霉烯酮(zearalenone,简称ZEA)的污染,给人畜的生命健康构成严重威胁。
南方镰孢喜好冷凉和湿度较高的环境,在22~28 ℃,开花期或收获期遇到降雨、雾水等潮湿的环境有利于该病害的发生[7-8]。Machado等认为,巴西南方镰孢菌株的侵染力和竞争性要强于禾谷镰孢,导致南方镰孢相比禾谷镰孢处于优势地位[2]。桂北是广西的玉米主产区,具有冷凉、多山、多雾、多雨、寡照等气候特点,适宜南方镰孢生长繁殖,而玉米是该地区最主要的口粮作物之一,因此尤其需要重视该病害在该区域的防控,而选育抗性品种成为防控玉米穗腐病最经济和安全有效的方法[9]。
植物对病原菌的侵染存在2种类型的免疫机制,被称为PTI(PAMP-triggered immunity)途径和ETI(effector-triggered immunity)途径[10],当病原菌侵染作物时,病原相关分子模式(pathogen-associated molecular paterns,PAMP)分子机制识别病原菌,启动PTI免疫反应,该防卫反应是系统性、广谱性的,其烈度相对较弱,因此很多病原菌能够突破植物的PTI免疫反应而进一步增殖。病原菌为了克服植物的本底防御反应,在侵染植物时会分泌效应蛋白(effector)来抑制植物免疫反应使植物感病(effector-triggered susceptibility,ETS)。植物为了克服ETS反应,进化出了第2种防御机制ETI,即病原菌效应蛋白诱导的免疫反应。ETI反应往往伴随着植物超敏反应的发生,是更剧烈的防卫反应,能够在病原菌侵染点附近引起过敏性坏死反应,导致植物细胞程序性死亡,从而将病原菌限制在侵染点,具有持久性、高效性。稻瘟菌的无毒基因与植物的抗病基因相互作用符合经典的“基因对基因”理论,病原菌侵入植物体内释放效应蛋白,植物的抗性蛋白能够特异性识别病原菌分泌的效应蛋白,从而激活下游的免疫反应[10]。
真菌效应子大多具有以下特征:(1)氨基酸序列N端具有一段信号肽,定位在胞外;(2)无GPI锚定位点;(3)一般在侵染宿主前期阶段活跃表达;(4)蛋白长度为50~400个氨基酸,并且含有大量的半胱氨酸残基(Cys),这些参数常被用来预测真菌效应蛋白[11-12]。研究者已经开发出Signal P、WoLFP SORT、Target P、TMHMM、big PI Predictor等可以预测分泌蛋白的软件,在此基础上再用EffectorP软件预测效应子。
本研究前期从一个采自广西靖西市的玉米病穗上单孢分离得到1株南方镰孢菌菌株JX18-4,经形态学鉴定后,采用FUSARIUM-ID v.3.0对引物延伸因子TEF-1α基因(NCBI登录号:OR513044)进行序列比对分析,明确其为南方镰孢菌。随后对该菌株进行三代 Pacbio 和二代 Illumina 全基因组测序。本研究利用生物信息学软件进行分泌蛋白和效应蛋白的序列特征预测,并利用数据库对预测到的效应蛋白进行注释。以期为后续南方镰孢菌引起的玉米穗腐病的致病机制及防控机制研究提供参考依据。
1" 材料与方法
1.1" 基因组信息
南方镰孢菌菌株 JX18-4 分离自2019年秋季广西靖西市玉米田玉米穗腐病发病果穗,全基因组蛋白信息来源于 NCBI(登录号:PRJNA977470),下载地址为(https://www.ncbi.nlm.nih.gov/datasets/genome/GCA_032355295.1/),该南方镰孢菌基因组共包含11 920个蛋白。
1.2" 分泌蛋白预测
参考文献[11-12]中的方法,使用多种软件对基因进行预测分析。(1)使用SignalIP 5.0在线软件(http://www.Cbs.dtu.dk /services/SignalP /)预测分泌信号肽,保留有信号肽的基因。(2)使用SecretomeP软件(https://services.healthtech.dtu.dk/services/SecretomeP-2.0/)对缺乏信号肽的蛋白预测非经典分泌蛋白(NN-scoregt;0.5)。(3)使用TargetP软件TargetP v2.0(http://www.cbs.dtu.dk /services/TargetP-2.0/)对SignalP和SecretomeP预测结果所保留的基因进行TargetP分析,去除其中的线粒体蛋白。(4)利用TMHMM 2.0 sever(http://www.cbs.dtu.dk/services/TMHMM/)对具有N-端信号肽且定位于胞外的蛋白质进行跨膜结构域分析,仅保留跨膜结构域数目≤1的蛋白质。(5)使用WoLF PSORT软件(https://wolfpsort.hgc.jp/)进行蛋白的亚细胞定位分析,选择得分大于17的细胞外目的蛋白。(6)使用big-PI predictor(https://mendel.imp.ac.at/gpi/gpi_server.html)分析锚定位点,无 GPI 锚定位点的蛋白为候选分泌蛋白。
1.3" 效应蛋白的预测
对预测出的分泌蛋白进一步进行效应子预测,利用EffectorP软件(https://effectorp.csiro.au/)预测分泌蛋白中的真菌的候选效应蛋白。随后筛选出氨基酸残基数lt;400且半胱氨酸残基数≥4的效应蛋白[13]。
1.4" PHI 及CAZymes基因注释
基于 PHI(Pathogen-Host Interaction database,http:/ /www.phi-base.org /downloadLink.Htm)数据库,对预测到的效应子进行植物病原互作相关基因注释,同时,利用CAZymes(Carbohydrate-Active enzymes,CAZymes,http://www.cazy.org/)对分泌蛋白、候选效应蛋白与碳水化合物酶类序列进行BlastP同源性比对。优先关注E-value最低、 比对得分(score)最高的注释,同时关注注释基因的功能描述。
2" 结果与分析
2.1" 南方镰孢菌分泌蛋白预测
对利用SignalIP 5.0南方镰孢菌菌株JX18-4预测出的11 920个蛋白质进行信号肽预测,具有N端信号肽的蛋白序列有1 248个,这些蛋白属于典型的内质网/高尔基体途径进行运输,并最终分泌到细胞外SP(Sec/SPI)型经典分泌蛋白。为不遗漏不具备信号肽特征却能分泌到细胞外发挥功能的非经典分泌蛋白,SecretomeP软件分析结果显示,NN-score分值高于0.5的蛋白序列为5 602个。SignalIP和SecretomeP软件分析所得的共6 850个蛋白序列采用TargetP v2.0软件预测蛋白的亚细胞定位,去除定位在线粒体上的蛋白后,共获得5 868个蛋白序列。采用TMHMM v2.0软件对上述蛋白序列进行跨膜结构域分析,751个蛋白序列具有2个以上跨膜区,即分泌到其他细胞器的蛋白,仅保留跨膜结构域数≤1的蛋白序列5 117个。利用WoLF PSORT对含有上述蛋白序列进行亚细胞定位分析,794个蛋白得分大于17,是分泌到细胞外的目的蛋白。最后用big-PI predictor软件排除含有锚定位点的蛋白序列,最终获得684个分泌蛋白(图1)。684个分泌蛋白中,635个蛋白是具有信号肽序列特征,占比92.84%,另外49个是不具备信号肽特征序列的非经典分泌蛋白,占比7.16%。
2.2" 效应蛋白的筛选
利用EffectorP软件预测分泌蛋白中的真菌效应蛋白,不是效应子的蛋白序列405个,剔除掉筛选出不大可能是效应子的蛋白序列22个[可能性(probability)值lt;0.55],预测出效应子157个(probability值≥0.55),这些效应蛋白的可能性probability为0.553~0.984不等。大多数已知效应蛋白氨基酸残基较少且富含半胱氨酸,且缺乏保守的氨基酸序列特征,真菌效应蛋白的预测一般采用相对宽泛的标准[13]。不同研究往往采用的参数指标并不一致,本研究以蛋白序列长度小于400个氨基酸且半胱氨酸残基数≥4的标准进一步筛选效应蛋白[11,13],最终获得115个符合要求的效应蛋白(图1)。
2.3" PHI和CAZymes注释分析
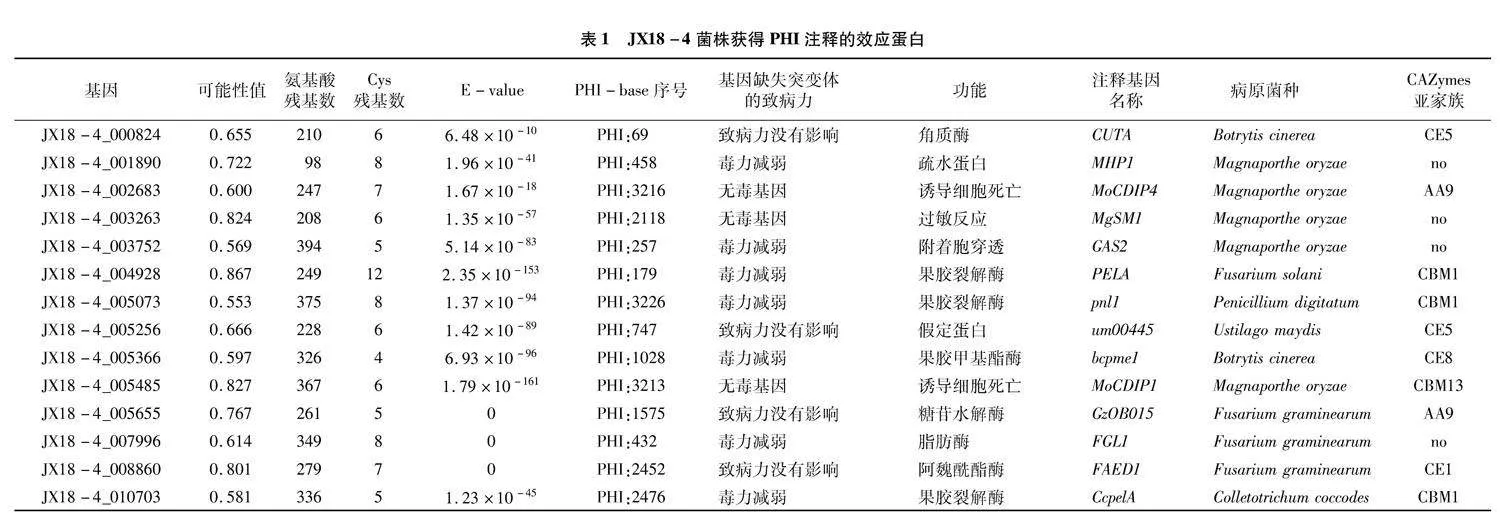
从“2.2”节中得到的115个效应蛋白序列,仅14个获得PHI数据库注释(表1)。其中注释为无毒效应子的3个, 均与稻瘟病菌诱导过敏性反应相
关;注释为基因敲除突变体后毒力减弱的基因7个;注释为基因敲除后突变体无致病力变化的4个。
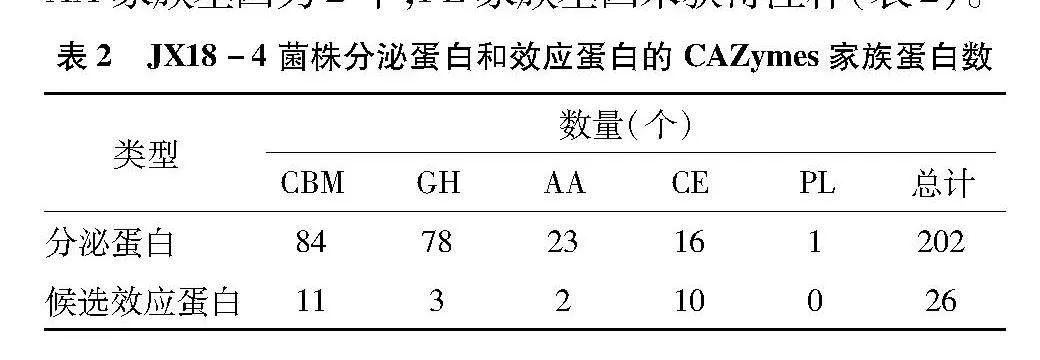
684个分泌蛋白,获得CAZymes注释的基因为202个。碳水化合物结合模块(carbohydrate-binding module,CBM)家族基因最多,为84个,糖苷水解酯酶(glycoside hydrolases,GH)家族基因次之,为78个,辅助氧化还原酶类(auxiliary activities,AA)家族基因23个,碳水化合物酯酶(carbohydrate esterases,CE)家族基因16个,多糖裂解酶(polysaccharide lyases,PL)家族基因仅1个(表2)。115个候选效应蛋白中,CBM家族基因最多,为11个,CE家族基因次之,为10个,GH家族基因为3个,AA家族基因为2个,PL家族基因未获得注释(表2)。
表2" JX18-4菌株分泌蛋白和效应蛋白的CAZymes家族蛋白数
类型数量(个)CBMGHAACEPL总计
分泌蛋白847823161202
候选效应蛋白113210026
10 个效应蛋白获得PHI和CAZymes 2个数据库注释,6个基因的注释基因功能一致,例如JX18-4_002683的基因功能为糖苷水解酶,JX18-4_004928、JX18-4_005073、JX18-4_010703注释为果胶裂解酶,JX18-4_005366注释为果胶酯酶,JX18-4_008860注释为阿魏酸酯酶。
3" 讨论
本研究基于南方镰孢菌株JX18-4的全基因组测序后的序列分析,共预测到115个效应蛋白,其中获得PHI数据注释的效应蛋白为14个,获得CAZymes注释的基因为26个,这可能是由于大量真菌效应子还未被发掘和报道,植物病原真菌效应蛋白与寄主植物的互作机制研究报道还极不充分。14个PHI数据库注释的效应蛋白中,10个被CAZymes数据库注释,其中6个基因的注释功能一致,说明本注释结果具有较好的一致性。这些已报道、注释到的基因在其他物种上影响着病害的发生程度,其是否影响玉米穗腐病的致病情况有待进一步进行研究。利用高通量测序技术预测分泌蛋白和效应蛋白,能极大程度地为后续研究进行前期筛选。随着病原真菌和植物寄主间的互作机理研究逐渐深入,大量病原菌效应蛋白将会不断被鉴定和报道,合理利用预测出的115个南方镰孢效应蛋白序列,与已报道、影响致病力的效应蛋白序列进行序列比对,将有利于阐明南方镰孢菌与玉米的互作机制。随着测序技术的发展,真菌全基因组测序价格快速降低,基于全基因组测序后的真菌效应蛋白预测,能大大加快真菌效应蛋白的挖掘进程。
JX18-4_002683、JX18-4_003263和JX18-4_005485共3个基因注释为无毒效应蛋白,诱导过敏性坏死反应。JX18-4_002683注释到的基因MoCDIP4作用是诱导细胞死亡,包含1个糖基水解酶家族结构域和1个真菌纤维素结合结构域,C末端的纤维素结合结构域在诱导细胞死亡中具有重要的功能[14]。JX18-4_003263注释到的稻瘟病病菌基因MgSM1,无论是在真菌生长还是在水稻的初侵染过程中都能组成型表达,在拟南芥中通过上调防卫基因的表达引起叶片的过敏性反应[15]。JX18-4_005655注释到的MoCDIP1基因的N端PbH1 motif基序功能为诱导植物细胞过敏性坏死[14]。这3个基因作为稻瘟病菌的无毒基因,侵入寄主细胞后,可能与植物细胞中的R基因发生互作,可诱导寄主产生过敏性坏死反应,从而导致寄主抗病。然而,南方镰孢菌作为玉米穗腐病、玉米茎腐病、小麦赤霉病、水稻赤霉病和大豆荚枯病[5-7,16]的致病菌,是否会在玉米叶片、茎秆、籽粒组织中引起ETI免疫应答反应还尚待后续验证。广西玉米育种家当前极缺乏玉米赤霉穗腐病优异抗源,笔者所在项目组前期已经鉴定出CML287、CML362等极少量抗南方镰孢菌穗腐病的玉米自交系,但其抗病机制尚不明确,从抗病自交系中发掘出与无毒效应子互作的抗病基因,合理利用其剧烈的ETI防卫反应机制,对于玉米抗穗腐病育种具有重要价值。
玉米籽粒中富含淀粉,主要存在于玉米胚乳中,纤维素主要存在于玉米的种皮和内皮中,果胶作为一种半乳糖醛酸的聚合多糖,存在于玉米的种皮或细胞壁中。注释到的部分效应蛋白为潜在的淀粉、纤维素、果胶等物质降解酶。植物病原真菌分泌到胞外的碳水化物酶是一类重要的活性蛋白,依据这些酶的氨基酸序列的保守结构域,将这些活性酶归入不同的蛋白质家族,其功能结构域可能通过作用于寄主的糖复合物、寡糖和多糖等方式,从而降解玉米籽粒中的多种物质。26个获得CAZymes注释的效应蛋白中,碳水化合物结合模块(CBM)家族11个,碳水化合物酯酶(CE)家族11个。JX18-4_004928、JX18-4_005073和JX18-4_010703等3个基因的PHI和CAZymes数据库注释均为果胶裂解酶,CAZymes数据库注释均为CBM1亚家族,CBM1亚家族被称为纤维素结合模块蛋白,例如,里氏木霉的Cel7A酶中含有该蛋白,EC分类号为3.2.1.176,其底物为纤维素[17]。
南方镰孢与禾谷镰孢为禾谷镰孢复合种的不同发育种[5],禾谷镰孢菌模式菌株PH-1与本研究中南方镰孢菌菌株JX18-4具有极高的共线性关系(另文发表),利用已报道禾谷镰孢菌致病相关基因与南方镰孢菌菌株JX18-4进行序列比对,基因预测会更为准确。PHI数据库注释结果显示,3个效应蛋白的E-value值为0,JX18-4_005655、JX18-4_007996和JX18-4_008860对应的物种均为禾谷镰孢菌,说明这3个效应蛋白与注释基因高度同源。只有JX18-4_007996注释基因FGL1明确为侵染小麦赤霉病和玉米穗腐病的毒力因子,具有细胞外脂肪酶分解活性[18]。然而,禾谷镰孢效应蛋白与玉米靶标蛋白互作调控玉米穗腐病抗性机制的报道尚不充分,亦未见南方镰孢菌效应蛋白相关的报道。本研究所预测出的115个南方镰孢菌效应蛋白,可能对禾谷镰孢菌引起的病害亦具有一定参考价值。
前人的研究已成功定位了大量玉米抗禾谷镰孢菌引起的赤霉穗腐病QTL[19],却未见明确抗赤霉穗腐病基因的相关报道。这可能是由于玉米的基因组较大,采用常规QTL定位方法,抗病QTL定位区间往往过大且表型解释率较低,难以聚焦到寄主中与效应蛋白互作的、免疫反应相关的蛋白质。为了阐明玉米抗病基因与镰孢菌的互作机制,鉴定并明确南方镰孢效应蛋白,通过酵母双杂交技术,利用效应蛋白作为诱饵,筛选与效应蛋白互作的玉米靶标蛋白,缩小候选抗病基因的筛选范围。本研究结果可为南方镰孢效应蛋白与玉米靶标蛋白互作机制、抗玉米穗腐病基因的挖掘及分子育种奠定基础。
参考文献:
[1]Munkvold G P. Epidemiology of Fusarium diseases and their mycotoxins in maize ears[J]. European Journal of Plant Pathology,2003,109(7):705-713.
[2]Machado F J,Kuhnem P R,Casa R T,et al. The dominance of Fusarium meridionale over F.graminearum causing Gibberella ear rot in Brazil may be due to increased aggressiveness and competitiveness[J]. Phytopathology,2021,111(10):1774-1781.
[3]Sampietro D A,Díaz C G,Gonzalez V,et al. Species diversity and toxigenic potential of Fusarium graminearum complex isolates from maize fields in northwest Argentina[J]. International Journal of Food Microbiology,2011,145(1):359-364.
[4]Desjardins A E,Proctor R H. Genetic diversity and trichothecene chemotypes of the Fusarium graminearum clade isolated from maize in Nepal and identification of a putative new lineage[J]. Fungal Biology,2011,115(1):38-48.
[5]杜" 青,唐照磊,李石初,等. 广西玉米穗腐病致病镰孢种群构成与毒素化学型分析[J]. 中国农业科学,2019,52(11):1895-1907.
[6]Duan C X,Qin Z H,Yang Z H,et al. Identification of pathogenic Fusarium spp.causing maize ear rot and potential mycotoxin production in China[J]. Toxins,2016,8(6):186.
[7]Zhou D N,Wang X M,Chen G K,et al. The major Fusarium species causing maize ear and kernel rot and their toxigenicity in Chongqing,China[J]. Toxins,2018,10(2):90.
[8]Dalla Lana F,Madden L V,Paul P A. Natural occurrence of maize Gibberella ear rot and contamination of grain with mycotoxins in association with weather variables[J]. Plant Disease,2021,105(1):114-126.
[9]尹泽超,王晓芳,龙" 艳,等. 玉米穗腐病抗性鉴定、遗传分析与分子机制[J]. 中国生物工程杂志,2021,41(12):103-115.
[10]巫浩翔,陆展华,方志强,等. 稻瘟病菌效应蛋白与水稻互作研究现状及展望[J]. 广东农业科学,2023,50(12):52-61.
[11]何艳秋,颜" 瑞,蒙" 姑,等. 香蕉枯萎病菌1号小种分泌蛋白与效应子的预测与分析[J]. 植物病理学报,2020,50(2):129-140.
[12]李枭艺,董章勇,罗" 梅. 棘孢木霉分泌蛋白和效应子的预测及分析[J]. 仲恺农业工程学院学报,2022,35(1):13-17.
[13]Jones D A,Bertazzoni S,Turo C J,et al. Bioinformatic prediction of plant-pathogenicity effector proteins of fungi[J]. Current Opinion in Microbiology,2018,46:43-49.
[14]Chen S B,Songkumarn P,Venu R C,et al. Identification and characterization of in planta-expressed secreted effector proteins from Magnaporthe oryzae that induce cell death in rice[J]. Molecular Plant-Microbe Interactions,2013,26(2):191-202.
[15]Yang Y Y,Zhang H J,Li G J,et al. Ectopic expression of MgSM1,a Cerato-platanin family protein from Magnaporthe grisea,confers broad-spectrum disease resistance in Arabidopsis[J]. Plant Biotechnology Journal,2009,7(8):763-777.
[16]Liu X,Fang X,Yu F W,et al. Improved whole-genome sequence of Fusarium meridionale,the fungal pathogen causing Fusarium head blight in rice[J]. Molecular Plant-Microbe Interactions,2022,35(1):85-89.
[17]van Tilbeurgh H,Tomme P,Claeyssens M,et al. Limited proteolysis of the cellobiohydrolase Ⅰ from Trichoderma reesei[J]. Federation of European Biochemical Societies Letter,1986,204(2):223-227.
[18]Voigt C A,Schfer W,Salomon S. A secreted lipase of Fusarium graminearum is a virulence factor required for infection of cereals[J]. Plant Journal,2005,42(3):364-375.
[19]Gaikpa D S,Miedaner T. Genomics-assisted breeding for ear rot resistances and reduced mycotoxin contamination in maize:methods,advances and prospects[J]. Theoretical and Applied Genetics,2019,132(10):2721-2739.

