γ-氨基丁酸引发对NaCl胁迫下油菜种子萌发及幼苗抗性生理的影响
摘要:为探究NaCl胁迫下,γ-氨基丁酸(GABA)引发对油菜种子萌发及幼苗抗逆生理的影响,以中双11为试验材料,在150 mmol/L 的NaCl溶液胁迫下,经去离子水和1.5 mmol/L GABA进行种子引发,试验设置CK(未引发,无胁迫)、S(未引发+NaCl 胁迫)、H(去离子水引发,无胁迫)、HS(去离子水引发+NaCl 胁迫)、G(GABA引发处理,无胁迫)、GS(GABA引发+NaCl 胁迫)6个处理。结果表明,NaCl胁迫显著抑制了油菜种子萌发,降低了叶绿素含量和根系活力,降幅分别为55.86%和90.31%;增加了油菜幼苗渗透调节物质的积累,提高了活性氧、丙二醛含量及抗氧化酶活性,降低AsA-GSH循环能力,抑制了油菜幼苗的生长。与胁迫处理相比,GS处理促进NaCl胁迫下油菜种子萌发和幼苗生长,其中根长和地下干重分别增加114.40%和57.32%;提高了叶片叶绿素含量和根系活力,增加了叶片和根系中可溶性糖、可溶性蛋白和脯氨酸的含量,显著降低丙二醛、过氧化氢和超氧阴离子含量,激活超氧化物歧化酶、过氧化物酶和过氧化氢酶活性,同时增加AsA-GSH循环系统中AsA、DHA、GSH和GSSG的含量,提高关键酶APX、GR、MDHAR和DHAR的活性,从而增强油菜幼苗的抗氧化能力以缓解NaCl胁迫造成的氧化损伤,而水引发的效果次于GABA引发处理。综上所述,NaCl胁迫下,GABA引发处理能增强种子活力,增加叶绿素的积累并提高根系活力从而促进油菜幼苗生长,并通过增强渗透调节能力、抗氧化酶水平和AsA-GSH循环有效地提高油菜种子萌发和幼苗生长对NaCl胁迫的耐受性。
关键词:GABA;油菜;NaCl胁迫;种子引发;抗氧化;AsA-GSH循环
中图分类号:S634.301" 文献标志码:A
文章编号:1002-1302(2024)23-077-10
张淑玉,赵黎明,蒋文鑫,等. γ-氨基丁酸引发对NaCl胁迫下油菜种子萌发及幼苗抗性生理的影响[J]. 江苏农业科学,2024,52(23):77-86.
doi:10.15889/j.issn.1002-1302.2024.23.011
收稿日期:2023-12-15
基金项目:湛江市科技计划(编号:2022A01044)。
作者简介:张淑玉(1998—),女,广东汕头人,硕士,主要从事油菜耐盐生理研究。E-mail:3021980990@qq.com。
通信作者:沈雪峰,博士,教授,硕士生导师,主要从事作物栽培与逆境生理研究。E-mail:shenxuefeng@gdou.edu.cn。
土壤盐渍化是影响全球农田的严重环境胁迫之一[1] 。据统计,土壤盐渍化影响了全球20%以上的耕地,并且由于环境气候的变化,加上不适宜的耕作方式和水肥管理,土壤盐渍化的现象愈发加剧,影响作物的生长发育,降低农作物的产量[2]。高盐环境容易造成作物渗透失衡,诱发活性氧(ROS)的大量积累,造成细胞膜质过氧化,从而影响植株的生理代谢过程,抑制植株的生长发育[3-4]。在此过程中,作物能通过调节自身的渗透平衡、增强抗氧化系统来清除ROS以缓解NaCl胁迫对细胞的损伤,从而增强自身的抗逆性;但当胁迫超过作物的耐受阈值,将会对作物的生长发育造成不可逆的伤害[1]。因此,提高作物对盐胁迫的耐受性有利于其正常生长发育。
油菜(Brasscia napus L.)是我国种植面积最大的油料作物,同时也是改良盐碱土的重要作物[5-6]。就其整个生育期而言,油菜在种子萌发阶段容易受环境影响,其中盐胁迫会抑制油菜种子的萌发,降低出苗率,导致后期生长发育不良,这给油菜的种植和生产造成了极大影响[7]。因此,研究提高油菜种子萌发期的耐盐方法,对于增强油菜耐盐性、提高油菜在盐渍化土地的出苗整齐率、促进其生长发育具有重要意义。
种子引发是一种广泛应用于提高植株生长发育及其抗逆性的种子处理技术[8-9]。γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种非蛋白质氨基酸,广泛存在于植物体内,在植物的生长和发育过程中常常发挥渗透调节或以信号分子发挥重要作用[10-11]。研究表明,植物内的GABA能调节细胞内pH值、刺激离子转运、激活抗氧化系统和清除ROS,对提高作物的抗盐性具有重要作用[12]。此外,研究发现γ-氨基丁酸作为外源调节剂也能提高植物的耐受性。在Ma等的研究中,使用外源γ-氨基丁酸能有效诱导内源γ-氨基丁酸、脯氨酸及总酚类的积累,从而调节渗透胁迫[11];Cheng等发现γ-氨基丁酸浸种能有效提高盐胁迫下白三叶草种子的萌发率,提高渗透调节物质的含量并增强抗氧化酶活性,进而缓解NaCl胁迫对种子萌发的影响[13]。目前的研究中,γ-氨基丁酸在油菜耐盐领域的应用尤其是对其萌发阶段的影响鲜少报道。为此,本研究以盐敏感油菜品种中双11为试验材料,探索 γ-氨基丁酸引发对NaCl胁迫下油菜种子萌发和幼苗生长发育的影响,旨在为盐碱地油菜种植推广提供理论依据和实践指导。
1" 材料与方法
1.1" 试验材料
供试材料为中双11油菜种子,该品种为半冬性甘蓝型常规油菜品种,具有盐敏感性,由中国农业科学院油料作物研究所选育。供试药剂有γ-氨基丁酸(GABA,粉剂),纯度为97%;氯化钠(NaCl),为分析纯,均购自索莱宝生物科技有限公司。
1.2" 试验设计
试验于2022年9—12月在广东海洋大学生物技术所进行。挑选颗粒饱满、大小均匀的油菜种子,经3% 过氧化氢溶液消毒10 min后,用去离子水冲洗3~4次,并吸干表面水分。分别以去离子水和GABA溶液(经预试验发现1.5 mmol/L GABA具有促进作用)引发消毒后的油菜种子,将种子与引发剂按1 g ∶10 mL的比例拌匀并置于烧杯中,用保鲜膜密封,在20 ℃黑暗条件下引发8 h,结束后,经去离子水反复冲洗,用滤纸吸干种子表面浮水,随后置于室温条件下回干至原始重量。试验共设置6个处理,即:CK(未引发,无胁迫)、S(未引发+150 mmol/L NaCl溶液)、H(去离子水引发,无胁迫)、HS(去离子水引发+150 mmol/L NaCl溶液)、G(GABA引发处理,无胁迫)、GS(GABA引发+150 mmol/L NaCl溶液)。每个处理挑选50粒种子,置于垫有双层滤纸的发芽盒(12 cm×12 cm×6 cm)中,其中,以10 mL 150 mmol/L NaCl溶液润湿滤纸为胁迫处理,以等量去离子水润湿的滤纸作对照,每个处理重复5次,并置于人工气候箱中,培养温度为25 ℃/20 ℃(昼/夜),光照周期为12 h—12 h(光照—黑暗),相对湿度为(75±2)%,每隔 2 d 更换1次滤纸,以保证相同NaCl浓度。于NaCl胁迫处理后第7天分别对幼苗地上部和地下进行取样,经液氮速冻30 min快速置于-80 ℃冰箱中保存、备用。
1.3" 测定项目与方法
1.3.1" 种子萌发相关指标
参照Cheng等的方法[13],每天记录萌发的种子数,以胚根长至2~3 mm 为发芽标准[7],连续3 d没有种子发芽即为萌发结束。于胁迫后第7天,调查种子的发芽率、发芽指数、活力指数和平均发芽时间;各处理随机选取3株幼苗测量苗高、根长和鲜重,随后将样品置于 50 ℃ 的烘箱烘48 h至恒重,每个处理3次重复。相关指标计算公式如下:
发芽率=(第7 天发芽种子数/对照的种子总数)×100%;
发芽指数=∑(Gt/Dt);
活力指数=发芽指数×正常幼苗鲜重;
平均发芽时间=∑(Gt×Dt)/∑Gt;
式中:Gt为第t天的发芽数;Dt为相应的发芽天数。
1.3.2" 生理指标测定
使用氯化三苯基四氮唑(TTC)法[14]测定幼苗根系活力,使用乙醇提取法[15]测定子叶的总叶绿素含量;参照鲁克嵩等的方法[16],可溶性糖含量采用蒽酮比色法测定,可溶性蛋白含量使用考马斯亮蓝染色法检测,脯氨酸含量使用酸性茚三酮染色法测定;参照肖爽等的方法[17],使用羟胺氧化法测定超氧阴离子(O-2·)含量,采用硫代巴比妥酸比色法测定丙二醛(MDA)的含量;过氧化氢(H2O2)含量的测定采用分光光度法[18];采用氯化硝基四氮唑蓝光化学还原反应法测定超氧化物歧化酶(SOD)活性,使用愈创木酚法测定过氧化物酶(POD)活性,采用紫外分光光度法测定过氧化氢酶(CAT)活性和抗坏血酸过氧化物酶(APX)活性[16]。
抗坏血酸(AsA)含量测定采用 4,7-二苯基-1,10-菲咯啉比色法[19]测定;谷胱甘肽(GSH)含量测定运用5,5-二硫代双-2-硝基苯甲酸比色法[19]测定;氧化还原物质脱氢抗坏血酸(DHA)、氧化型谷胱甘肽(GSSG)含量及关键酶单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)活性的测定按照Cheng等的方法[13,20]进行测定。
1.4" 统计分析
使用Office Excel 2019进行数据收集与整理。采用SPSS 26.0软件进行方差分析,所有数值均为3次重复的平均值,具体表示为“平均值 ± 标准差”,Plt;0.05表示差异显著。运用Origin 2021进行绘图。
2" 结果与分析
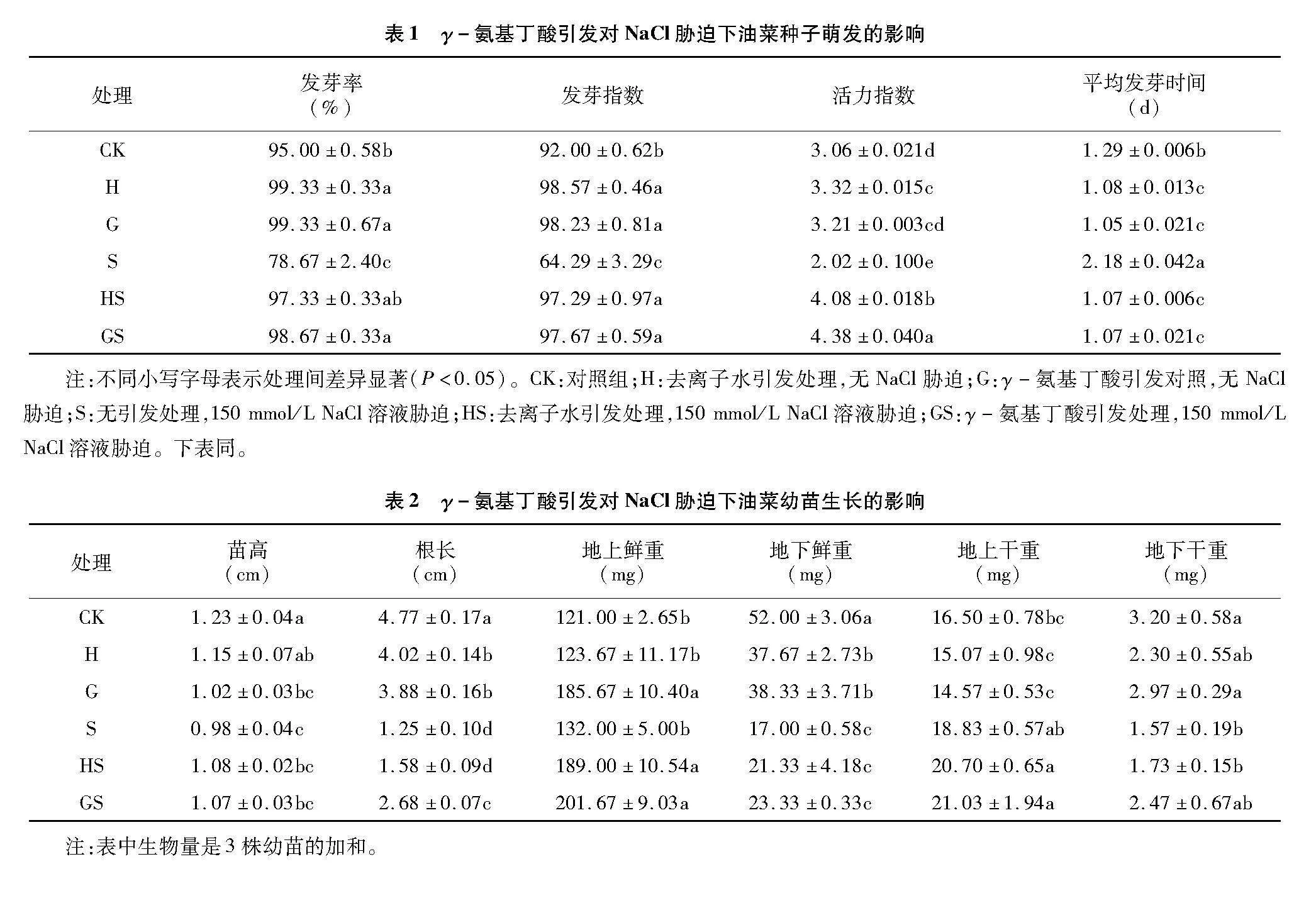
2.1" γ-氨基丁酸引发对NaCl胁迫下油菜种子萌发和幼苗生长的影响
由表1、表2可知,NaCl胁迫严重影响油菜种子的萌发,降低发芽率和活力指数,抑制油菜幼苗的生长发育。与CK相比,H和G处理均显著提高了油菜的发芽率,促进幼苗的生长,而NaCl胁迫下(S处理下),油菜种子的发芽率、发芽指数、活力指数分别显著降低了17.19%、30.12%和33.99%,平均发芽时间延长了68.99%。同时影响了油菜幼苗的生长,对根部的影响尤其显著,地下部鲜重和干重分别显著降低了67.31%和50.00%。与S处理相比,HS和GS处理油菜种子的发芽率、发芽指数和活力指数显著提高,其中GS处理的发芽率和活力指数较HS处理显著增加了1.38%和7.35%;另外,GS处理的油菜幼苗高和根长分别提高了9.18%和114.40%,地上、地下鲜重和干重分别增加52.78%、23.53%、11.68%和57.32%,HS处理苗高和根长分别增加了10.20%和26.40%,地上鲜重和地下干重增加了46.15%和10.19%,其中GS处理下根长显著高于HS处理,其他指标无显著差异。
2.2" γ-氨基丁酸引发对NaCl胁迫下油菜幼苗叶绿素含量和根系活力的影响
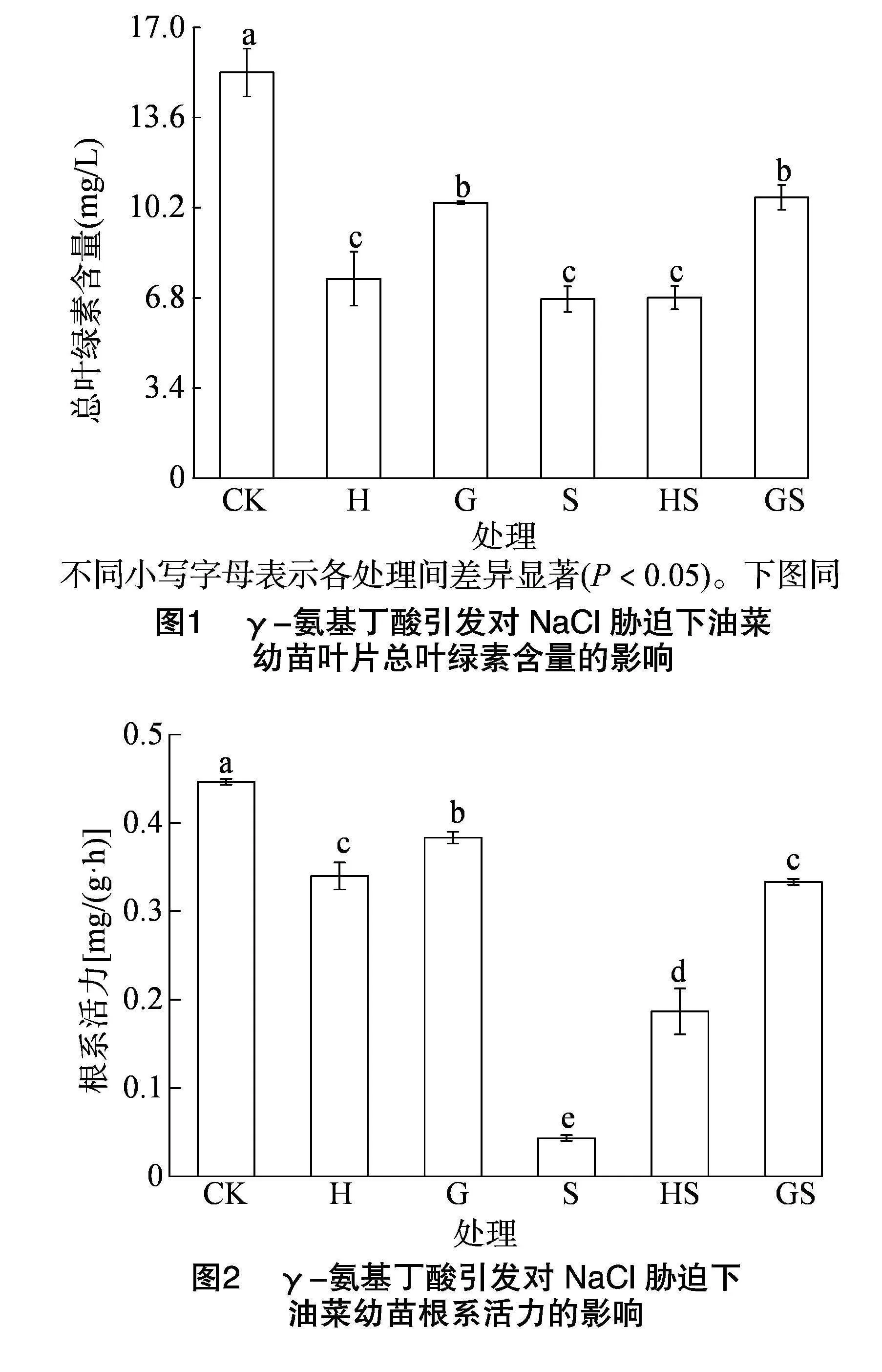
与CK相比,H和G处理的总叶绿素含量和根系活力显著下降,NaCl胁迫下油菜幼苗叶片总叶绿素含量显著降低55.86%(图1),根系活力下降了90.31%(图2)。与S处理相比,HS处理的叶片总叶绿素含量变化不显著,而GS处理显著提高了56.83%(图1);HS和GS处理的根系活力均显著增强,分别提高了331.18%和669.75%,其中GS处理较HS处理显著提高了73.68%(图2)。表明GS处理能增加NaCl胁迫下叶绿素的合成,增强根系活力,促进幼苗生长。
2.3" γ-氨基丁酸引发对NaCl胁迫下油菜幼苗渗透调节物质含量的影响
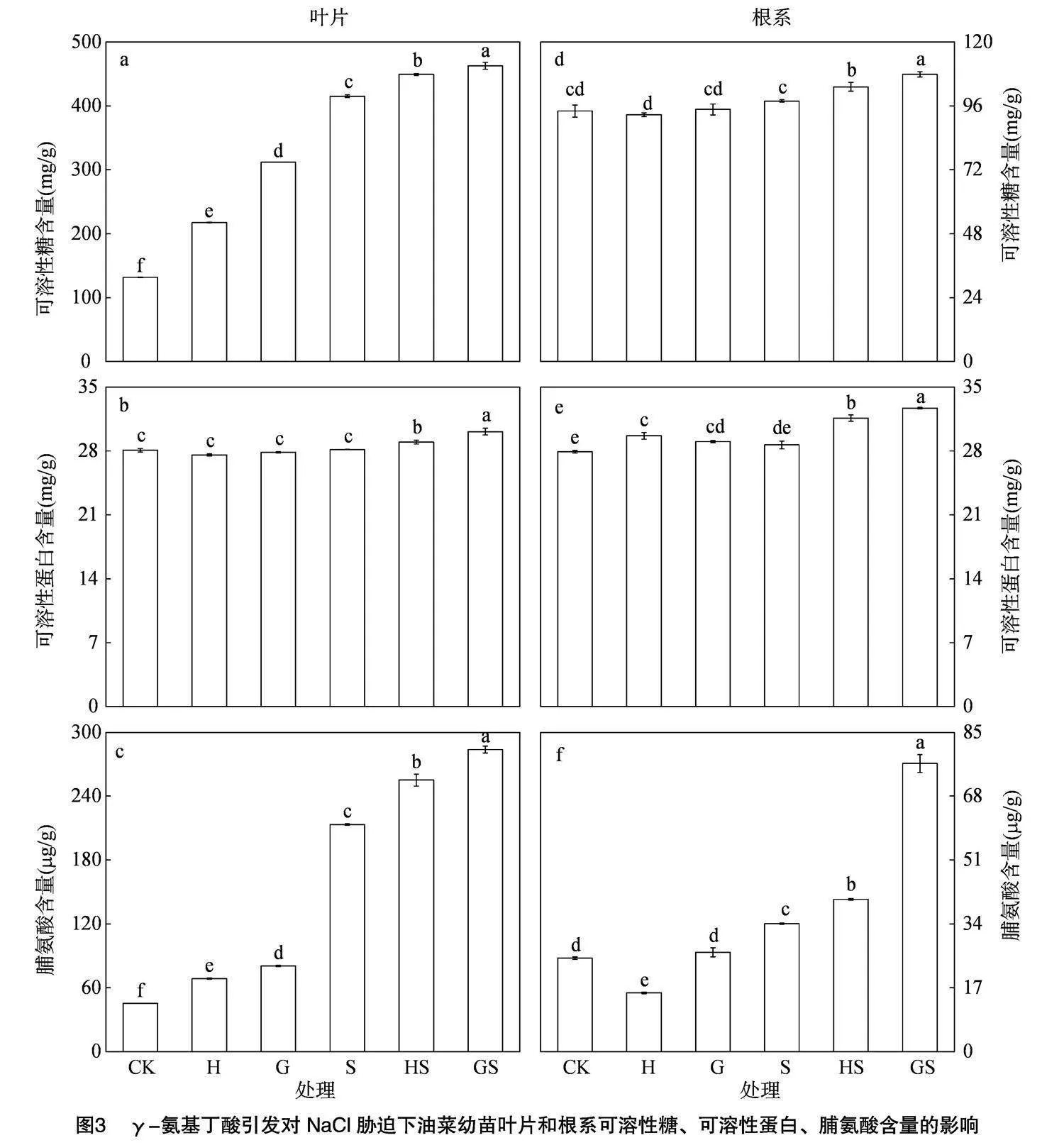
由图3知,非胁迫下,H处理根系的可溶性糖、脯氨酸含量较CK降低而可溶性蛋白含量增加,叶片的可溶性蛋白含量变化不显著,可溶性糖和脯氨酸含量分别显著增加了65.22%和50.78%,而G处理下,叶片可溶性糖和脯氨酸含量较CK分别显著提高了137.02%和76.77%,根系的可溶性糖、可溶性蛋白和脯氨酸含量均有所增加。而NaCl胁迫下油菜幼苗根系和叶片的可溶性糖、可溶性蛋白和脯氨酸含量较CK均有所增加,其中根系中脯氨酸含量增幅为36.75%,叶片的可溶性糖和脯氨酸含量分别增加了215.28%和368.87%。与S处理相比,HS和GS处理均提高了油菜幼苗根系和叶片的可溶性糖、可溶性蛋白和脯氨酸的含量,且GS处理根系可溶性糖、可溶性蛋白和脯氨酸含量较HS处理分别增加了0.45%、0.34%和89.20%,叶片可溶性糖、可溶性蛋白和脯氨酸含量分别提高了0.30%、0.39%和11.33%,表明γ-氨基丁酸引发处理能更显著地提高油菜幼苗渗透调节物质含量,尤其是脯氨酸含量来降低NaCl 胁迫造成的渗透失衡。
2.4" γ-氨基丁酸引发对NaCl胁迫下油菜幼苗ROS积累和氧化损伤的影响
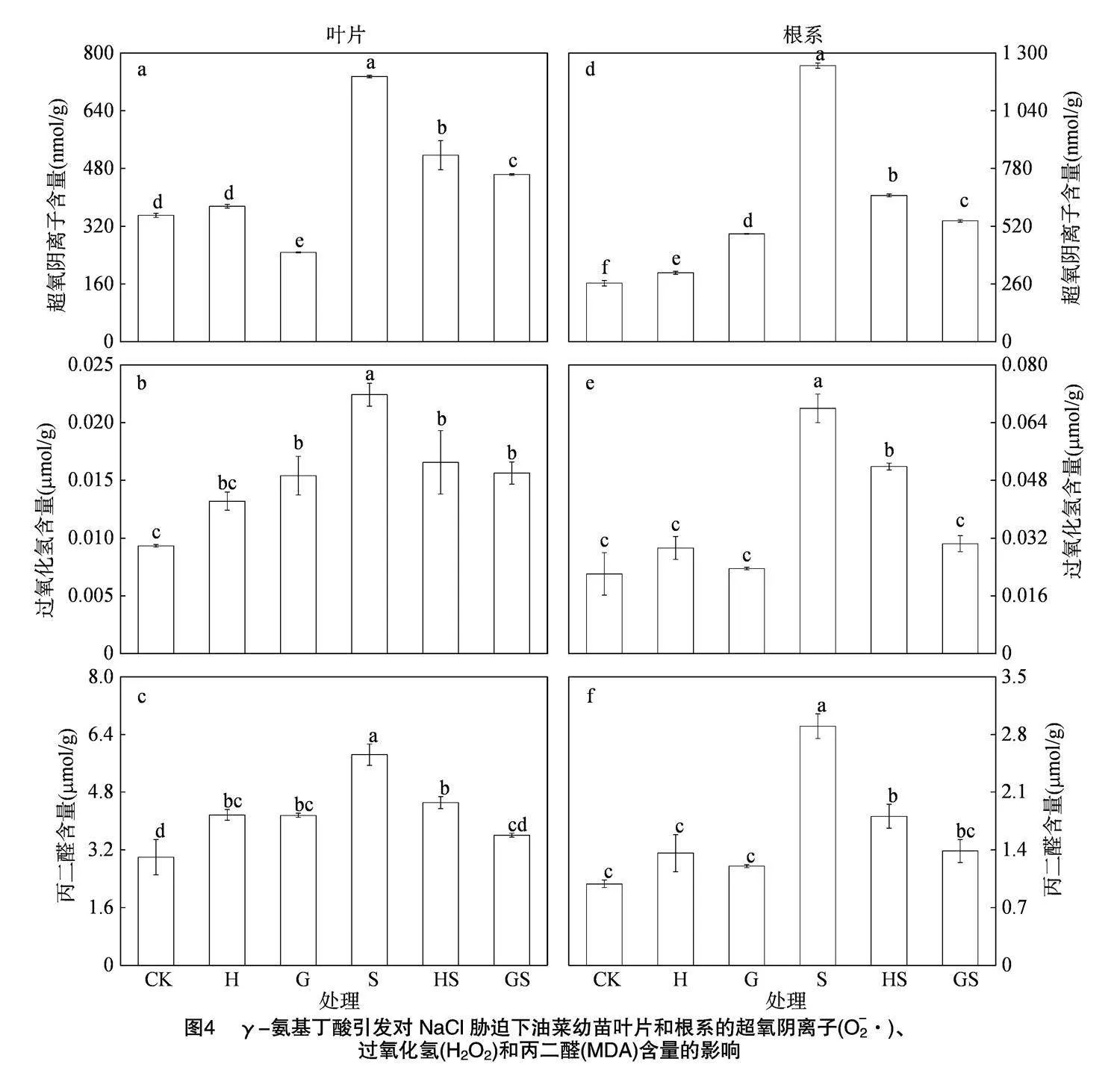
由图4可知,NaCl胁迫下H2O2和O-2·含量显著高于CK,其中根系H2O2和O-2·含量增幅分别为208.20%、371.30%,叶片H2O2和O-2·含量分别显著增加了140.40%、109.90%,与S处理相比,NaCl 胁迫下水引发和γ-氨基丁酸引发均能显著降低油菜幼苗根系和叶片中H2O2和O-2·含量,其中GS处理的根系中H2O2和O-2·含量分别较HS处理显著降低了41.27%和17.43%,叶片H2O2和O-2·含量的降幅分别为5.64%和10.42%。MDA是衡量植物脂质过氧化的主要指标。与CK相比,H处理下油菜幼苗根系和叶片中MDA含量分别提高了37.75%和39.13%,而G处理增幅低于H处理,NaCl胁迫下油菜幼苗根系和叶片中MDA含量分别显著增加了193.99%和95.10%。与S处理相比,HS和GS处理幼苗根系和叶片的MDA含量均显著降低,其中HS处理分别降低了37.76%和22.84%,GS处理则分别显著降低了52.26%和38.31%。表明γ-氨基丁酸引发处理能显著降低NaCl胁迫下油菜幼苗的ROS积累并缓解氧化损伤。
2.5" γ-氨基丁酸引发对NaCl胁迫下油菜幼苗抗氧化能力的影响
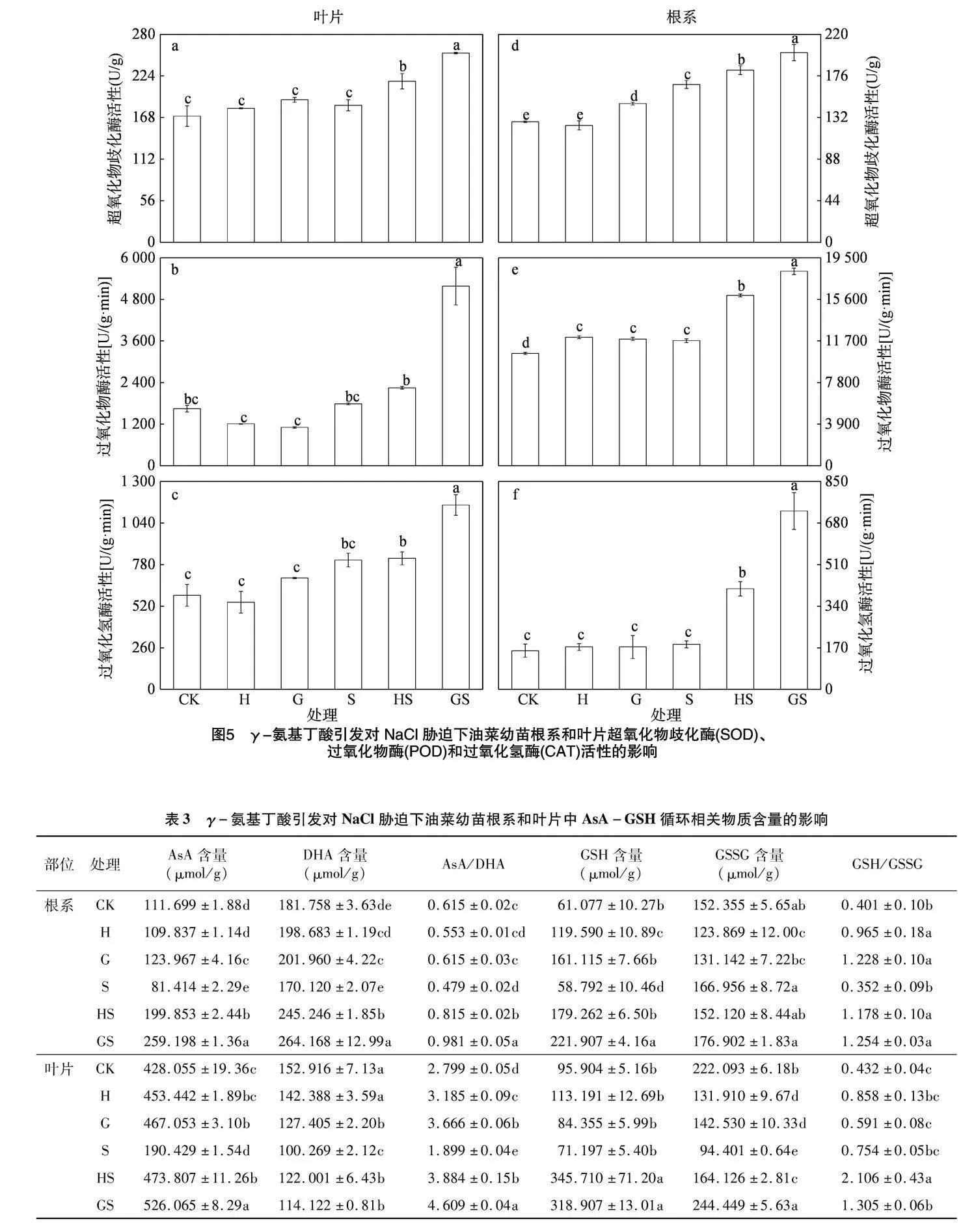
由图5可知,与CK相比,H和G处理叶片抗氧化酶SOD、POD和CAT活性变化不显著,根系SOD和POD活性显著增加,而CAT活性变化不显著;NaCl胁迫下油菜幼苗叶片SOD活性有所增加但不显著,POD和CAT活性分别增加了8.66%、37.58%,根系SOD、POD和CAT活性分别增加了
31.04%、11.33%和16.41%。与S处理相比,水引发和GABA引发处理均显著增强了NaCl胁迫下根系和叶片中SOD、POD和CAT活性,其中HS叶片SOD、POD和CAT活性分别增加17.57%、25.81%和1.29%,根系SOD、POD和CAT活性分别增加9.04%、36.18%和123.60%;而GS处理的根系和叶片中SOD、POD和CAT活性较HS处理均显著增强,其中根系SOD、POD和CAT活性增幅分别为10.19%、14.15%和77.32%,而叶片SOD、POD和CAT活性较HS处理则分别增加了17.60%、130.48%和40.72%。由此可知,γ-氨基丁酸引发处理能通过增强抗氧化酶活性提高油菜幼苗的耐盐性。
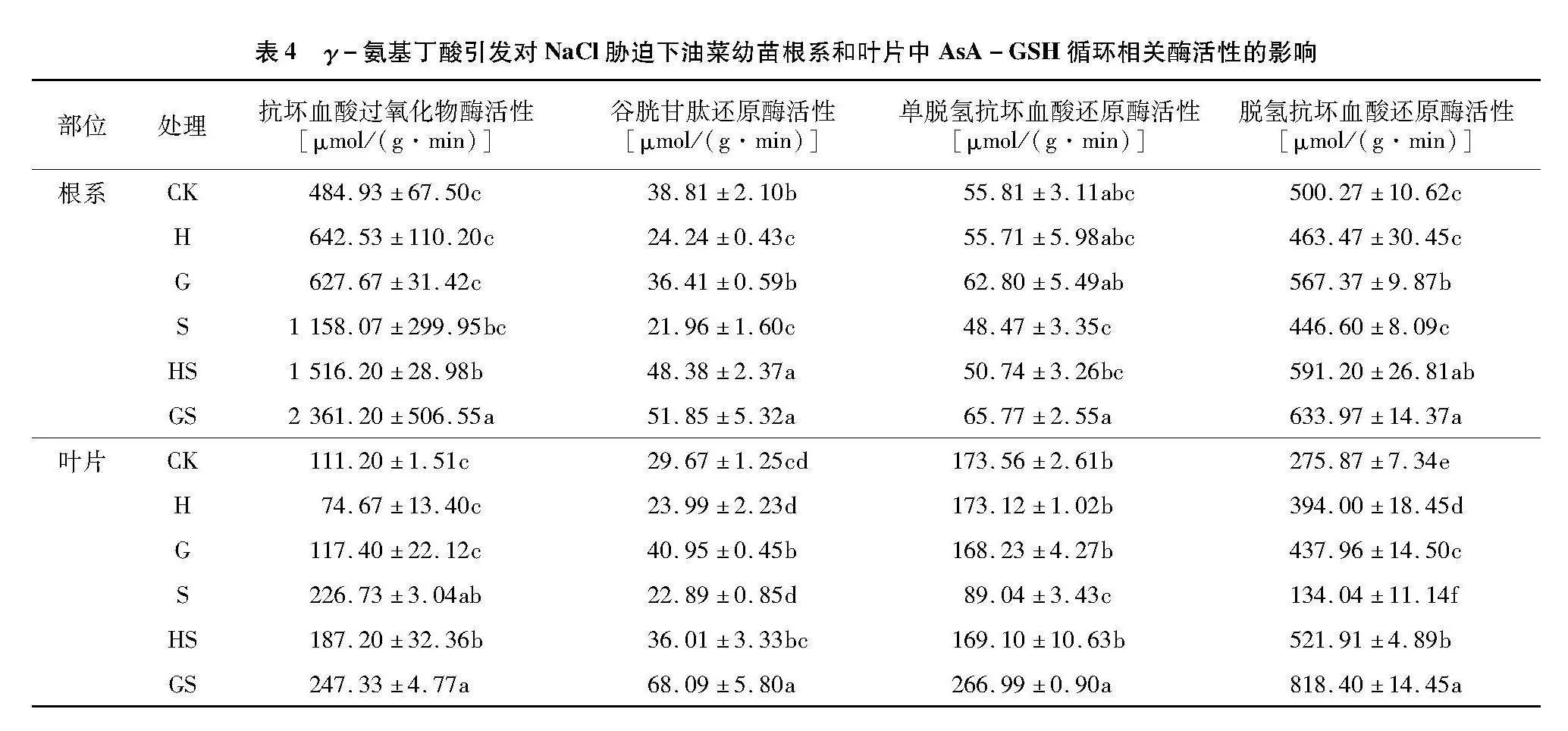
2.6" γ-氨基丁酸引发对NaCl胁迫下油菜幼苗AsA-GSH循环的影响
由表3可知,与CK相比,H处理的根系AsA含量和叶片DHA含量变化不显著,叶片AsA含量和根系DHA含量增加,G处理下油菜幼苗根系AsA和DHA含量显著增加,叶片AsA含量增加而DHA含量降低;NaCl胁迫下油菜幼苗根系和叶片的AsA含量分别显著下降了27.11%和55.51%,同时DHA含量分别降低了0.64%和34.42%,AsA/DHA也分别显著降低22.11%和32.15%。与S处理相比,HS和GS处理根系和叶片的AsA和DHA的含量均显著增加,其中GS处理下根系和叶片AsA含量显著分别提高了218.37%和176.25%, DHA含
量分别提高了55.28%和13.81%,AsA/DHA分别增加了104.80%、142.71%,HS处理效果次之。
与CK相比,H处理下油菜幼苗根系GSH含量下降了25.75%,叶片GSH含量增加了18.03%,G处理下的油菜幼苗叶片GSH含量降低了12.04%,根系GSH含量变化不显著,同时H和G处理的根系GSSG含量均显著下降。NaCl胁迫下油菜幼苗根系和叶片的GSH含量较CK分别显著降低了63.50%和25.76%,根系的GSSG含量增加了9.58%,而叶片GSSG含量降低了57.49%。与S处理相比,HS处理根系和叶片GSH含量分别增加了204.91%和385.57%,GS处理根系和叶片GSH含量则显著提高了277.44%和347.92%;HS处理根系GSSG含量降低了8.89%,叶片GSSG含量显著增加了73.86%,GS处理根系和叶片GSSG含量显著增加,增幅分别为5.96%和158.95%,同时GS处理的根系和叶片GSH/GSSG分别提高了255.11%和73.08%。
由表4可知,与CK相比,H处理根系和叶片APX活性变化不显著,根系GR和叶片DHAR活性显著提高,G处理叶片GR、DHAR活性和根系DHAR活性显著增强;NaCl胁迫下根系和叶片的APX活性分别增加了138.81%和103.90%,GR活性分别降低了43.3%和22.83%,DHAR活性分别降低了10.73%和51.41%,MDHAR活性分别降低了13.15%和48.70%。
与S处理相比,HS处理下根系APX活性显著提高了30.93%,根系和叶片的GR活性分别提高了120.34%和57.30%,DHAR活性分别增加了32.38%和289.37%,MDHAR活性分别提高了4.68%和89.92%;而GS处理下根系和叶片的APX活性分别提高了103.89%和9.08%,GR活性分别增加了136.14%和197.41%,DHAR活性增幅分别为41.96%和510.56%,MDHAR活性分别提高了35.68%和199.87%。其中,GS处理下油菜幼苗中参与AsA-GSH循环的关键酶活性均显著高于HS处理,显然γ-氨基丁酸引发处理下能更好地提高APX、GR、DHAR、MDAHAR的活性来增强AsA-GSH循环。
3" 讨论
3.1" γ-氨基丁酸引发调控NaCl胁迫下油菜萌发和幼苗生长
种子萌发是作物生命周期的初始阶段,该阶段对环境的变化较为敏感,当遭受盐胁迫时,种子的萌发、出苗及后续的生长发育等易受到影响[4]。诸多研究表明,使用引发技术能增强种子的抗逆性,提高萌发率和出苗整齐率等[21]。本研究中,NaCl胁迫显著抑制了油菜种子的萌发,同时降低了油菜幼苗的苗高、根长、鲜重和干重,严重影响了油菜幼苗的生长发育,这与Cheng等的研究结果[13,22]相一致。根系活力的高低表示根系吸收营养的强弱,能够反映植物根系的生长情况[23]。此外有研究表明,根系活力是衡量植物抗盐性的指标,反映植物的抗盐能力[17]。本研究中,NaCl胁迫下,油菜幼苗的根系活力显著降低,γ-氨基丁酸引发显著提高NaCl胁迫下油菜幼苗的根系活力,表明γ-氨基丁酸引发处理能促进油菜幼苗根系发育,提高根系活力,有利于根系吸收水分和矿物质,增强油菜幼苗的耐盐性。
叶绿素与植物的光合作用密切相关,植物的叶绿素含量减少会使光合速率下降,导致净光合产物减少,从而影响植物体的生物量[24]。盐胁迫会降低植物的光合色素水平从而影响植物的光合作用[25-26]。植物在盐胁迫环境下,由于根系活力减弱,营养和水分向上运输不足,容易造成植株营养不良,叶片中叶绿素含量也会受到影响[2,27]。本研究中,NaCl胁迫显著降低了油菜幼苗叶片的叶绿素含量,γ-氨基丁酸引发处理能显著提高NaCl胁迫下叶片总叶绿素含量,表明γ-氨基丁酸引发可能通过提高根系活力来缓解NaCl胁迫对叶片光合色素合成的抑制,从而促进幼苗的生长。
3.2" γ-氨基丁酸引发调控渗透调节物质含量提高油菜幼苗抗盐性
当植物受到盐胁迫刺激时,最先会表现出吸水力下降、水分失衡等渗透胁迫反应,一般情况下植物能通过增加渗透调节物质如可溶性糖、可溶性蛋白和脯氨酸等的含量来参与细胞内的渗透调节过程,以维持细胞水势平衡,增强植株对盐胁迫的耐受性[28]。研究发现,γ-氨基丁酸引发处理能增加盐胁迫下植物的可溶性糖、可溶性蛋白和脯氨酸的积累,从而调节渗透平衡[13]。本研究中,NaCl胁迫下,油菜幼苗的根系和叶片可溶性糖和脯氨酸含量较CK均显著增加,γ-氨基丁酸引发显著提高了NaCl胁迫下油菜幼苗根系和叶片可溶性糖、可溶性蛋白和脯氨酸含量,且脯氨酸含量极显著增加,表明γ-氨基丁酸引发处理增强了NaCl胁迫下油菜幼苗的生理活动,在一定程度上维持细胞内的渗透平衡,增强幼苗的耐盐性。
3.3" γ-氨基丁酸引发调控抗氧化系统提高油菜幼苗抗盐性
盐胁迫会导致植物体内ROS的大量积累,其中O-2·直接作用于植物体内的蛋白质和核酸等大分子物质,同时能与H2O2反应生成攻击性更强的羟自由基,引发细胞膜脂过氧化反应,对植物细胞产生毒害作用[28-29],在对冬油菜[30]和高粱[31]等作物的耐盐碱研究中均得到证实。MDA由植物细胞膜脂过氧化产生,可以反映植物受伤害及对逆境响应的程度[3]。本研究发现NaCl胁迫下,油菜幼苗的H2O2、O-2·和MDA含量显著增加,说明NaCl 胁迫导致油菜幼苗积累大量ROS,造成严重的膜脂过氧化,而水引发和GABA引发处理有效降低了NaCl胁迫下油菜幼苗根系和叶片中H2O2、O-2·和MDA的积累,表明γ-氨基丁酸种子引发可能通过清除或者抑制H2O2和O-2·的合成,降低MDA水平,缓解NaCl 胁迫对植株造成的氧化损伤,维持细胞膜的完整性。
当植物体内ROS过多时,其抗氧化系统会受到刺激从而产生更多的抗氧化酶如SOD、POD和CAT等来清除积累的ROS,保护植物细胞[8]。Hussain等研究发现,砷引发处理后,油菜在遭受NaCl胁迫时能够激活抗氧化系统,降低ROS的积累,增强油菜的耐盐性[32]。而γ-氨基丁酸引发小麦种子后,盐胁迫下小麦幼苗的CAT、SOD活性显著增强,抗氧化能力得以提高[25]。本研究中,NaCl胁迫处理下油菜幼苗根系SOD、POD活性和叶片CAT活性显著提高,表明NaCl胁迫下,油菜幼苗可能通过抗氧化酶协同作用以拮抗ROS的积累;而NaCl胁迫下水引发和γ-氨基丁酸引发处理显著增强了SOD、POD和CAT活性,其中γ-氨基丁酸引发处理下抗氧化酶的活性显著高于水引发处理,说明γ-氨基丁酸引发种子可以更加有效地增强油菜幼苗抗氧化系统,清除积累的过量ROS,提高油菜萌发期对NaCl胁迫的耐受性。
3.4" γ-氨基丁酸引发调控AsA-GSH循环提高油菜幼苗抗盐性
AsA-GSH循环是由抗氧化剂AsA、GSH以及关键酶APX、MDHAR、DHAR、GR构成的能够有效清除自由基的循环系统,是植物体内重要的非酶促抗氧化保护系统[18]。在AsA-GSH循环中,AsA与H2O2由APX催化生成MDHA,其中部分MDHA经非酶促反应氧化为DHA,而MDHA和DHA分别由MDHAR和DHAR催化生成AsA,同时DHAR催化GSH生成GSSG,GSSG则经GR催化再形成GSH,而该循环中AsA/DHA、GSH/GSSG反映了植物内的氧化还原状态,可以作为植物体内的信号激活抗逆基因的表达[14,33]。
研究发现,作物能通过调节AsA-GSH循环的抗氧化物质的含量和相关酶的活性来平衡植物体内的氧化还原反应,从而增强自身应对盐胁迫的耐受性[33-35]。Zhou等研究发现,使用γ-氨基丁酸可以上调AsA和GSH生物合成的相关基因,增加了AsA和GSH的含量,从而提高植物的耐寒性[36]。外源水杨酸能够调节AsA-GSH循环来提高油菜的耐盐性[37]。在Mahmud的研究中,β-氨基丁酸引发提高了NaCl胁迫下油菜幼苗AsA和GSH含量,增强了APX、MDHAR、DHAR和GR的活性,增强了植物细胞的抗氧化能力[7]。本试验也得到类似结果,NaCl胁迫下油菜幼苗根系和叶片AsA和GSH含量降低,AsA/DHA、GSH/GSSG降低,APX、MDHAR、DHAR和GR的活性减弱,表明NaCl胁迫加剧了油菜幼苗的氧化损伤;而γ-氨基丁酸引发使油菜幼苗遭受NaCl时,能进一步增加抗氧化剂AsA、DHA、GSH和GSSG的积累,提高关键酶APX、MDHAR、DHAR和GR的活性,推测γ-氨基丁酸引发处理下油菜幼苗可能通过维持植株体内较高水平的抗氧化剂含量和抗氧化酶活性以平衡氧化还原状态,保证AsA-GSH循环高效运行,从而加快清除ROS和减少MDA的积累。
4" 结论
经γ-氨基丁酸引发处理显著提高了油菜种子的萌发力和根系活力,积累了可溶性糖、可溶性蛋白和脯氨酸,提高了抗氧化酶活性,增加了AsA-GSH循环中的抗氧化物含量和关键性酶活性,起到渗透保护和ROS清除作用,降低了细胞膜脂过氧化,有效缓解了盐胁迫对幼苗的伤害。
参考文献:
[1]Isayenkov S V,Maathuis F J M. Plant salinity stress:many unanswered questions remain[J]. Frontiers in Plant Science,2019,10:80.
[2]Zhao S S,Zhang Q K,Liu M Y,et al. Regulation of plant responses to salt stress[J]. International Journal of Molecular Sciences,2021,22(9):4609.
[3]Wu W L,Zhang Q,Ervin E H,et al. Physiological mechanism of enhancing salt stress tolerance of perennial ryegrass by 24-epibrassinolide[J]. Frontiers in Plant Science,2017,8:1017.
[4]马金虎,郭数进,王玉国,等. 种子引发对盐胁迫下高粱幼苗生物量分配和渗透物质含量的影响[J]. 生态学杂志,2010,29(10):1950-1956.
[5]汪" 波,文" 静,张凤华,等. 耐盐碱油菜品种选育及修复利用盐碱地研究进展[J]. 科技导报,2021,39(23):59-64.
[6]刘" 成,冯中朝,肖唐华,等. 我国油菜产业发展现状、潜力及对策[J]. 中国油料作物学报,2019,41(4):485-489.
[7]Mahmud J A,Hasanuzzaman M,Khan M R,et al. β-aminobutyric acid pretreatment confers salt stress tolerance in Brassica napus L.by modulating reactive oxygen species metabolism and methylglyoxal detoxification[J]. Plants,2020,9(2):241.
[8]Ibrahim E A. Seed priming to alleviate salinity stress in germinating seeds[J]. Journal of Plant Physiology,2016,192:38-46.
[9]Sheteiwy M S,Shao H B,Qi W C,et al. Seed priming and foliar application with jasmonic acid enhance salinity stress tolerance of soybean (Glycine max L.) seedlings[J]. Journal of the Science of Food and Agriculture,2021,101(5):2027-2041.
[10]Hasan M M,Alabdallah N M,Alharbi B M,et al. GABA:a key player in drought stress resistance in plants[J]. International Journal of Molecular Sciences,2021,22(18):10136.
[11]Ma Y,Wang P,Chen Z J,et al. GABA enhances physio-biochemical metabolism and antioxidant capacity of germinated hulless barley under NaCl stress[J]. Journal of Plant Physiology,2018,231:192-201.
[12]Yuan D,Wu X L,Gong B B,et al. GABA metabolism,transport and their roles and mechanisms in the regulation of abiotic stress (hypoxia,salt,drought) resistance in plants[J]. Metabolites,2023,13(3):347.
[13]Cheng B Z,Li Z,Liang L L,et al. The γ-aminobutyric acid (GABA) alleviates salt stress damage during seeds germination of white clover associated with Na+/K+ transportation,dehydrins accumulation,and stress-related genes expression in white clover[J]. International Journal of Molecular Sciences,2018,19(9):2520.
[14]丁顺华,陈" 珊,卢从明. 植物叶绿体谷胱甘肽还原酶的功能研究进展[J]. 植物生理学报,2016,52(11):1703-1709.
[15]田" 甜,王海江,王金刚,等. 盐胁迫下施加氮素对饲用油菜有机渗透调节物质积累的影响[J]. 草业学报,2021,30(10):125-136.
[16]鲁克嵩,闫" 磊,侯佳玉,等. 盐胁迫下外源脯氨酸对油菜Na+/K+平衡、生长及抗氧化系统的影响[J]. 华中农业大学学报,2023,42(5):141-148.
[17]肖" 爽,韩雨辰,号宇然,等. 聚乙二醇引发对盐胁迫下棉种萌发及生理特性的影响[J]. 核农学报,2021,35(1):202-210.
[18]卢" 园,李瑞娟,赵" 娜,等. 硅对镉胁迫下玉米生长和抗氧化防御系统的影响[J]. 江苏农业科学,2023,51(20):77-84.
[19]Bano K,Kumar B,Alyemeni M N,et al. Exogenously-sourced salicylic acid imparts resilience towards arsenic stress by modulating photosynthesis,antioxidant potential and arsenic sequestration in Brassica napus plants[J]. Antioxidants,2022,11(10):2010.
[20]Ma F W,Cheng L L. The sun-exposed peel of apple fruit has higher xanthophyll cycle-dependent thermal dissipation and antioxidants of the ascorbate-glutathione pathway than the shaded peel[J]. Plant Science,2003,165(4):819-827.
[21]Johnson R,Puthur J T. Seed priming as a cost effective technique for developing plants with cross tolerance to salinity stress[J]. Plant Physiology and Biochemistry,2021,162:247-257.
[22]Wang J J,Lv P H,Yan D,et al. Exogenous melatonin improves seed germination of wheat (Triticum aestivum L.) under salt stress[J]. International Journal of Molecular Sciences,2022,23(15):8436.
[23]颜统利,何" 雨,玛丽亚,等. 外源钙对盐胁迫下不同衰老类型小麦幼苗生长生理的缓解效应[J]. 浙江农林大学学报,2023,40(5):991-998.
[24]罗黄颖,高洪波,夏庆平,等. γ-氨基丁酸对盐胁迫下番茄活性氧代谢及叶绿素荧光参数的影响 [J]. 中国农业科学,2011,44(4):753-761.
[25]Wang W Y,Liu S,Yan M Y. Synthesis of γ-aminobutyric acid-modified chitooligosaccharide derivative and enhancing salt resistance of wheat seedlings[J]. Molecules,2022,27(10):3068.
[26]常丽丽,彭存智,王" 丹,等. 盐芥叶片应答盐胁迫的蛋白质组学分析[J]. 江苏农业学报,2022,38(1):49-64.
[27]张" 亮,李玉婷,夏文静,等. 盐胁迫下异甜菊醇浸种对油菜种子萌发和幼苗生长的影响[J]. 福建农业学报,2020,35(8):883-890.
[28]赵怀玉,林鸿宣. 植物响应盐碱胁迫的分子机制[J]. 土壤与作物,2020,9(2):103-113.
[29]魏茜雅,林欣琪,梁腊梅,等. 褪黑素引发处理提高朝天椒种子萌发及幼苗耐盐性的生理机制[J]. 江苏农业学报,2022,38(6):1637-1647.
[30]刘自刚,王志江,方" 圆,等. NaCl胁迫对白菜型冬油菜种子萌发和幼苗生理的影响[J]. 中国油料作物学报,2017,39(3):351-359.
[31]王旺田,谢光辉,刘文瑜,等. 外源NO对盐胁迫下甜高粱种子萌发和幼苗生长的影响 [J]. 核农学报,2019,33(2):363-371.
[32]Hussain S,Ahmed S,Akram W,et al. Selenium seed priming enhanced the growth of salt-stressed Brassica rapa L.through improving plant nutrition and the antioxidant system[J]. Frontiers in Plant Science,2023,13:1050359.
[33]赵肖琼,梁泰帅,张恒慧. Spd对NaCl胁迫下小白菜幼苗生长、AsA-GSH循环及氮代谢的影响[J]. 中国瓜菜,2022,35(4):51-55.
[34]张建新,孙靖菲,叶玢妤,等. 外源褪黑素对铝胁迫下番茄生长的调节作用[J]. 福建农业学报,2023,38(6):698-706.
[35]Ruiz J M,Blumwald E. Salinity-induced glutathione synthesis in Brassica napus[J]. Planta,2002,214(6):965-969.
[36]Zhou C J,Dong W Q,Jin S W,et al. γ-Aminobutyric acid treatment induced chilling tolerance in postharvest peach fruit by upregulating ascorbic acid and glutathione contents at the molecular level[J]. Frontiers in Plant Science,2022,13:1059979.
[37]Hasanuzzaman M,Alam M M,Nahar K,et al. Exogenous salicylic acid alleviates salt stress-induced oxidative damage in Brassica napus by enhancing the antioxidant defense and glyoxalase systems[J]. Australian Journal of Crop Science,2014,8(4):631-639.

