草莓叶斑病及其防治的研究进展






摘要:草莓叶斑病的典型症状是在草莓叶片上出现病斑。随着研究的深入,发现引发草莓叶斑病的病原菌种类越来越多;同时还发现一些病原菌还会侵染到草莓的茎部、根部以及果实,严重影响草莓的产量和品质,给草莓生产造成了巨大的经济损失。本文从叶斑病的病害症状、病原菌的分离鉴定、病原菌生物学特性、侵染机制和病害的防治方法等方面简单综述了草莓叶斑病的相关研究进展。根据病原菌种类,可以将草莓叶斑病分为细菌性叶斑病和真菌性叶斑病。细菌性叶斑病的病原菌为Xanthomonas fragariae;而真菌性叶斑病的病原菌则种类较多,本文详细叙述了6类病原菌,包括Pilidium、Pestalotiopsis和Neopestalotiopsis等属的菌株以及Mycobacterium fragariae、Pseudopithomyces maydicus、Corynespora cassiicola、Exserohilum rostratum。不同的病原菌引发的病害症状各不相同。在生产中,化学药剂使用量在大幅度降低,微生物菌剂、植物源杀菌剂等使用越来越广泛,例如拮抗菌贝莱斯芽孢杆菌(Bacillus velezensis)G3-23 和单宁酸等都具有一定的生防潜力。最后,本文还将草莓叶斑病与炭疽病、白粉病在叶片上的病症表现进行了对比。综上所述,本文较为全面地介绍了草莓叶斑病的研究进展,不仅有助于对此病害有更加深入的了解,还为病害的早期诊断提供了可靠的科学依据,同时也为草莓叶斑病的绿色防治提供了理论参考。
关键词:草莓叶斑病;病原菌;草莓炭疽病;草莓白粉病;防治
中图分类号:S436.68+4" 文献标志码:A
文章编号:1002-1302(2024)23-0001-14
陈" 哲,梁" 宏,黄" 静,等." 草莓叶斑病及其防治的研究进展[J]. 江苏农业科学,2024,52(23):1-14.
doi:10.15889/j.issn.1002-1302.2024.23.001
收稿日期:2023-05-23
基金项目:山西省科技合作交流专项(编号:202204041101049);山西省科技成果转化引导专项(编号:201904D131033)。
作者简介:陈" 哲(1984—),女,山西五台人,硕士,副研究员,从事植物病原菌的相关研究。E-mail:cjy0124@126.com。
通信作者:董艳辉,硕士,副研究员,从事分子植物育种等相关研究。E-mail:yankunchen2015@sxau.edu.cn。
草莓是蔷薇科草莓属多年生草本植物,现已成为世界上栽种范围最广的水果之一,具有极高的营养、药用价值和抗衰老功效,备受消费者喜爱。草莓产业不但为促进农民增收、脱贫致富发挥了积极的推动作用,而且草莓作为适宜农业旅游、观光采摘的水果,也促进了一二三产业的融合发展。随着草莓种植面积的连年增加,草莓病害的种类也越来越多,而且病情也越来越严重,病程发展也越来越快,给生产造成了严重危害,导致重大经济损失。
目前,草莓生产中遇到的病害主要为真菌性病害、细菌性病害以及病毒病。其中,真菌性病害包括根腐病[1]、炭疽病[2]、灰霉病、白粉病、疫病和叶斑病等;细菌性病害如细菌性角叶斑病等;病毒病包括草莓斑驳病毒、草莓轻型黄边病毒、草莓镶脉病毒、草莓皱缩病毒和草莓潜隐环斑病毒等[3]。在上述病害中,草莓叶斑病略为特殊,既可以由细菌感染引发,也可以由真菌侵染所致,以下就近年来国内外草莓叶斑病的主要研究进展作简要综述。
1" 细菌性角叶斑病
1.1" 病害症状
1962年美国明尼苏达州首次在草莓植株上发现一种病害[4],感病植株叶片出现病斑、干缩、穿孔等症状,进而造成草莓大量减产,报道中将此病害命名为角叶斑病(angular leaf spot,后期多称为角斑病,缩写为ALS),并指出病原菌为Xanthomonas fragariae。之后随着草莓种苗的流通,欧洲大多地区以及非洲、大洋洲、亚洲等部分地区也相继发现了此病害。
1989年,我国在吉林省通化市发现了草莓细菌性叶疫病,研究表明,病原菌同样是X.fragariae,但由于我国草莓业还没有形成较大规模,此病害并没有在我国流传开来[5]。直到2007年,我国将 X.fragariae 列入了《中华人民共和国进境植物检疫性有害生物名录》中[6-8],同时检疫人员开展了相关研究,筛选得到了一批对草莓角斑病病菌抑制效果不错的药剂,为防治该病害的发生与流行提供参考依据[9]。
2017年,在北京市昌平区草莓种植地发现了疑似草莓角叶斑病症状的草莓病株,经过形态学鉴定和分子生物学分析,发现引发此病害的病原菌就是X.fragariae[10],这是首次在国内明确报道 X.fragariae 引发了草莓角叶斑病。随后在天津、江苏、云南等地也陆续发现了感染草莓角叶斑病的植株,病原菌同样为X.fragariae[11-13]。
草莓细菌性角叶斑病的发病初期症状不太明显,症状表现为在叶片背面出现浅绿色的水浸状不规则斑点,斑点形状多呈角形;随着病情的发展,病斑会逐渐扩大,并变成红褐色,此时叶片的正面也会出现病斑;若遇到环境中的湿度变大时,叶背会出现肉眼可见的菌脓溢出,农户形象地将其称为“淌鼻涕”病。有研究称病情严重时将草莓根茎部进行解剖,发现根茎内部组织被病原菌感染坏死,出现“空心”状态[11-12]。
此病的发病适温为25~30 ℃,湿度越高越容易发病[13],尤其是移栽前和现蕾前后,如果种植环境较为湿润的话,草莓非常容易发生病害。一旦发现有症状的病株,病害很快就会在周边的植株中传播,并迅速蔓延,严重影响草莓产量和品质。
据统计,2021年9月,在云南玉溪地区的草莓种植区,发现草莓细菌性角斑病发病率为10%~20%,病情严重时,发病率会高达40%,严重感染的草莓植株不仅叶片发病,其冠部也会受到感染,最终导致植株活力下降、发生倒伏,直至死亡[14];同一年,在陕西关中地区约有30%的草莓园区不同程度地发生了细菌性角斑病侵染植株的现象,其中约10%的园区死苗率达100%[15]。
1.2" 病原菌
草莓角斑病的病原菌是X.fragariae,很多报道将其称为草莓角斑病菌,也有人称为草莓黄单胞菌。此细菌属于黄单胞菌科(Xanthomonadaceae)黄单胞菌属(Xanthomonas)。
X.fragariae菌株为革兰氏阴性菌,菌体生长温度为20~25 ℃,生长速度较慢,超过32 ℃菌体死亡。在YDC培养基(yeast extract-dextrose-calcium carbonate medium )上,20 ℃ 培养5 d后,菌落的特征为颜色为黄色,菌落隆起呈圆屋顶形,表面光滑有光泽,边缘规则[16](图1)。在透射电镜下,菌体为杆状,具单极鞭,无芽孢,无荚膜,大小约为 0.4 μm×1.3 μm[6]。
有试验表明,X.fragariae的特异性引物是XF9/XF12、245A/B和295A/B[17]。X.fragariae的全基因组序列草图最早在2013年获得(菌株LMG 25863),大小为4.2 Mb[18],包含1个染色体和2个质粒DNA。菌株LMG 25863的编码细胞壁降解酶和Tonb依赖转运体的基因仅为同属菌株的一半,还有一些与植物互作的相关基因有所缺失。到目前为止,NCBI上能够查询到66个 X.fragariae 菌株的基因组序列,这为研究者了解病原菌进化过程、筛选致病基因以及探索感染机制奠定了坚实的基础[19]。
近年来,随着人们对于草莓角叶斑病的重视程度越来越深,有关病原菌的相关研究也越来越多,侵染机制以及侵染引发的变化等逐渐成为病害研究的重点方向。
有报道称,当病原菌接触到叶片气孔后,就在此处开始繁殖生长,在生长过程中会产生大量的胞外多糖,待到菌体积累到一定程度时,叶片上就会出现水浸状的损伤,也就是我们在病害早期看到的水浸状斑点[19]。此时在电镜下观察叶片,发现菌体细胞悬浮在大量的胞外多糖中,定殖于叶肉细胞的空间中。也有研究称,病原菌更有可能通过气孔进入叶片,而非通过叶缘处;当细菌进入叶片后,沿着大的叶脉系统地定殖在植物体内,但在维管组织中并没有发现此病原菌,只在沿着叶脉的薄壁组织中发现了病原菌的存在[20]。还有研究发现,病原菌会随着叶柄进入草莓根冠茎部,侵染内部组织,导致组织坏死,草莓根系营养无法输送到地上部分,植株干枯死亡[15]。还有研究者通过对患病草莓的叶片进行转录组分析,发现病原菌侵染叶片后,大约有1 995个基因的表达发生了改变(966个下调,1 029 个上调)。其中,细菌细胞运动、信号转导以及无机离子转运和代谢等的相关基因发生了过表达,而表达量增加最多的基因与鞭毛合成以及趋化性相关。此外,研究还发现,在病原菌的质粒中也存在表达量改变的基因,预示了质粒也参与了植物与病原菌互作的可能性[21]。
在目前的研究报道中,X.fragariae感染草莓引发的都是细菌性角斑病,主要病症就是在叶片背面会出现水浸状角性斑点,但是近年来也有一些报道称此菌也可以侵染草莓其他部分,引发草莓出现一些新的病症。有研究称,在发病草莓植株的冠部组织内观察到几个直径为0.3~0.8 mm的囊袋,认为此病菌还会引发草莓空颈病(crown infection pockets)[22],此文中描述的患病草莓初期症状和细菌性角斑病的病症一致,都是叶片背部出现水浸状版块,就是在发病严重时在草莓的冠部组织中的病症略有不同,笔者认为从叶片病症以及病原菌的角度来分析,文章中所发现的此种病害也能归为细菌性角斑病。
1.3" 防治方法
病害防治的方法主要包含农业防治、物理防治、化学防治以及生物防治等方式,由于田间气候和环境条件的复杂性和多变性,在生产中大多是采用多种方法配合使用的方式,才能达到理想的防治效果。
我国云南地区预防草莓细菌性角叶斑病的措施就是多方位的综合性措施,首先要选择抗病的丹莓二号、艳丽等品种,不能选择常种品种章姬;同时为避开茎叶旺长期与多雨和高温季节重合的矛盾,可采取提前移栽或营养袋假植育苗延期移栽;推广一垄双行栽培模式,便于排水,并采用避雨控温设施,调控植株生长环境的温湿度,减少发病率;同时旺长田块要合理增施有机肥、磷钾肥,增强植株抗性,不要过多施用氮肥[13]。
韩国研究者对于草莓角叶斑病的流行病学研究表明,病原菌主要通过受感染的植株进行传播,携带病原菌的草莓植株培育出的后代体内可以检测出病原菌,同时在其生长的土壤环境中也能检测到病原菌的存在,反而降水和喷灌水则不是控制病害发生的必要条件[16]。所以,研究认为通过采取种植健康未感病的草莓植株、改善栽培设施、适当使用杀菌剂以及进行土壤熏蒸,可以有效预防和控制草莓角叶斑病的发生。
在众多防治措施中,选育抗性品种是预防病害的最优方法之一,抗病品种可以在源头上切断叶斑病感染的可能性,因此筛选抗病基因等相关研究也越来越多。美国佛罗里达的研究者在草莓中找到一个抗性位点FaRXf1,该位点的鉴定将有助于通过标记辅助选择来开发抗性品种[23]。相信随着研究的深入,越来越多的抗性位点会被开发出来,为加快抗细菌性角叶斑病草莓品种的商业化提供强有力的理论基础。
草莓细菌性角叶斑病的传播速度非常迅速,并且在感染的早期阶段,病症并非十分明显,所以需要有识别角叶斑病经验的人进行频繁和仔细的现场检查。有研究对草莓角叶斑病的病害传播进行了基于距离指数的空间分析(SADIE),发现在栽培过程中周期性的农事操作,在病害传播中起着非常重要的作用,如果改善操作方式方法,则可以大大地提高对于病害的控制力[4]。因此,在田间一旦观察到有此症状的草莓植株,必须将病株以及周边一定范围内的植株一并移除处理,还要将接触过病株的机器以及衣物等全部进行消毒,以减少病菌的进一步传播。同时,要选择合适的杀菌剂对种植区内的其余草莓植株进行喷施,避免病害出现更大面积的传播。
为了保护环境以及保证食品安全,在草莓生产中化学药剂使用量都在大幅度降低,生物类杀菌剂使用越来越广泛,相关的研究重点也都集中在如何更好地将化学药剂和生物学药剂配合使用。研究发现,草莓在种植前,使用生物类药剂春雷霉素及春雷霉素与溴菌清、氧氯化铜、喹啉铜配成的复配剂进行蘸根处理,可以有效预防角叶斑病的发生;同时对草莓的促生效果也较为显著[12]。还有研究表明,在草莓细菌性角斑病发病初期,采用叶面喷施3%噻霉酮水分散粒剂和2%春雷霉素,同时用多黏类芽孢杆菌 KN-03的300倍稀释液灌根的手段,间隔10 d、连续施用3次,优于其他混配方式的防治效果[15]。也有研究者认为,在草莓苗圃和栽培区域使用33.5%喹啉铜悬浮剂和5%井冈霉素水剂可有效控制病害的发生,也可施用杀菌剂90%新植霉素可湿性粉剂4 000倍液、3%中生菌素可湿性粉剂1 000倍液等进行防治[24]。还有研究表明,单宁酸可以降低病原菌的致病力,且其本身是一种相对便宜、具水溶性、较为安全、植物衍生的可再生资源,具有开发成一种新型叶面喷雾剂的潜在可能性,这给研究者提供了一个未来的研究方向,如果能够研发成功,单宁酸将会是一个非常理想的生物类杀菌剂[25]。
2" 真菌性叶斑病
草莓叶斑病的真菌病原菌不是单一菌株,包含的菌株种类较多,尤其是近年来新报道的可以引发叶斑病的病原菌越来越多,每种病原菌引发的病症也略有不同,以下按照不同的病原菌依次进行综述。
2.1" Pilidium菌株引发的褐色叶斑病
2.1.1" 病害症状
Pilidium的菌株Pilidium concavum能够危害草莓的首次报道是在日本,之后陆续在巴西、比利时和波兰等地发现此菌株可以引起草莓果实腐烂(tan-brown rot)[26-28]。
2012年,我国研究者在北京市昌平区的草莓温室发现了一种新型病害,在草莓植株的老叶上发现棕褐色病斑,病斑上还生长了粉红色的孢子团。此病害早期症状表现为叶片中间或者边缘处形成小而圆的水浸状褐色斑点,后期病斑逐渐扩大,形成圆形或者不规则形状,直径为1~3 cm,颜色由褐色转变为深褐色。最终,病斑的表面会形成黑色的分生孢子座,并且在湿润条件下释放出粉色的分生孢子团。经过分离鉴定,认定引发上述病害的病原菌为P.concavum,又根据叶片的病症将此病害命名为褐色叶斑病[29]。2014年有报道称,P.concavum引发的褐色叶斑病主要危害草莓的下部叶片,也就是老叶;并且发现病斑在扩大后,中间会变灰白色,潮湿条件下病斑会产橘红色的团状黏质小点[30]。这与之前的描述略有不同,可能是潮湿程度不同导致病原菌产生的色素有所区别。
2020年,研究者在贵州发现有典型褐色叶斑病症状的草莓病株,经过组织分离、病原菌形态学观察、柯赫氏法则验证和rDNA-ITS 鉴定,明确了引起该病害的病原菌为P.lythri[31]。
2.1.2" 病原菌
P.concavum和P.lythri都属于Chaetomellaceae科Pilidium属。目前,这2个菌株都还没有准确的中文译名。
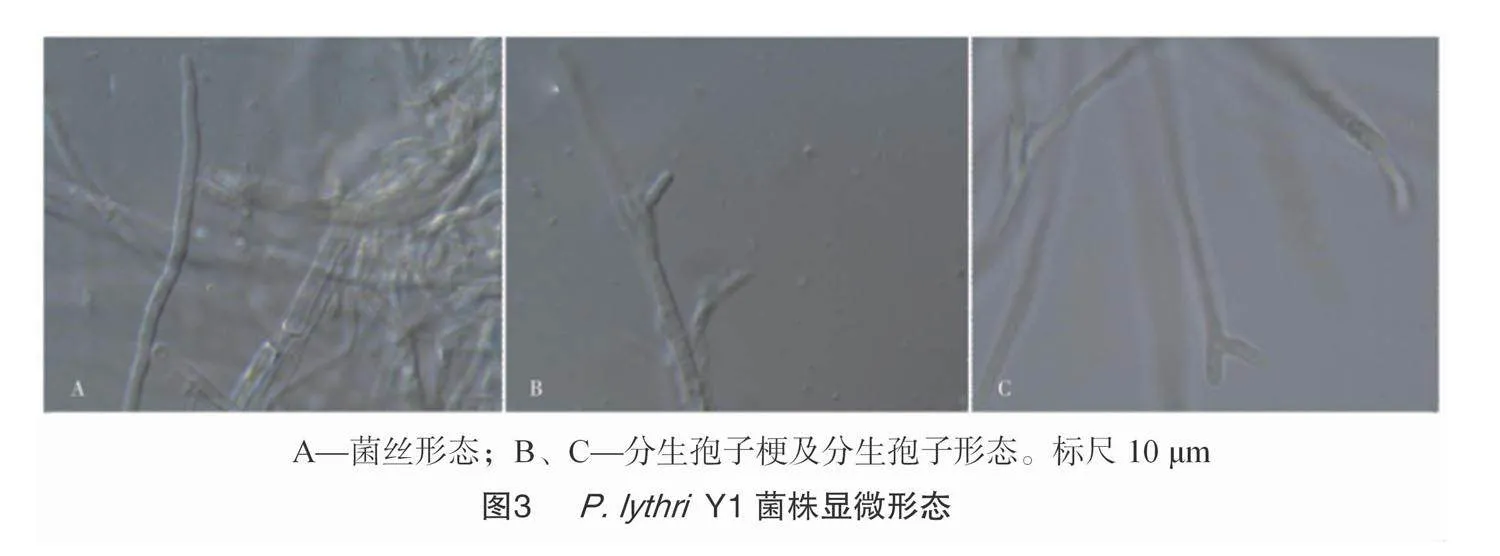
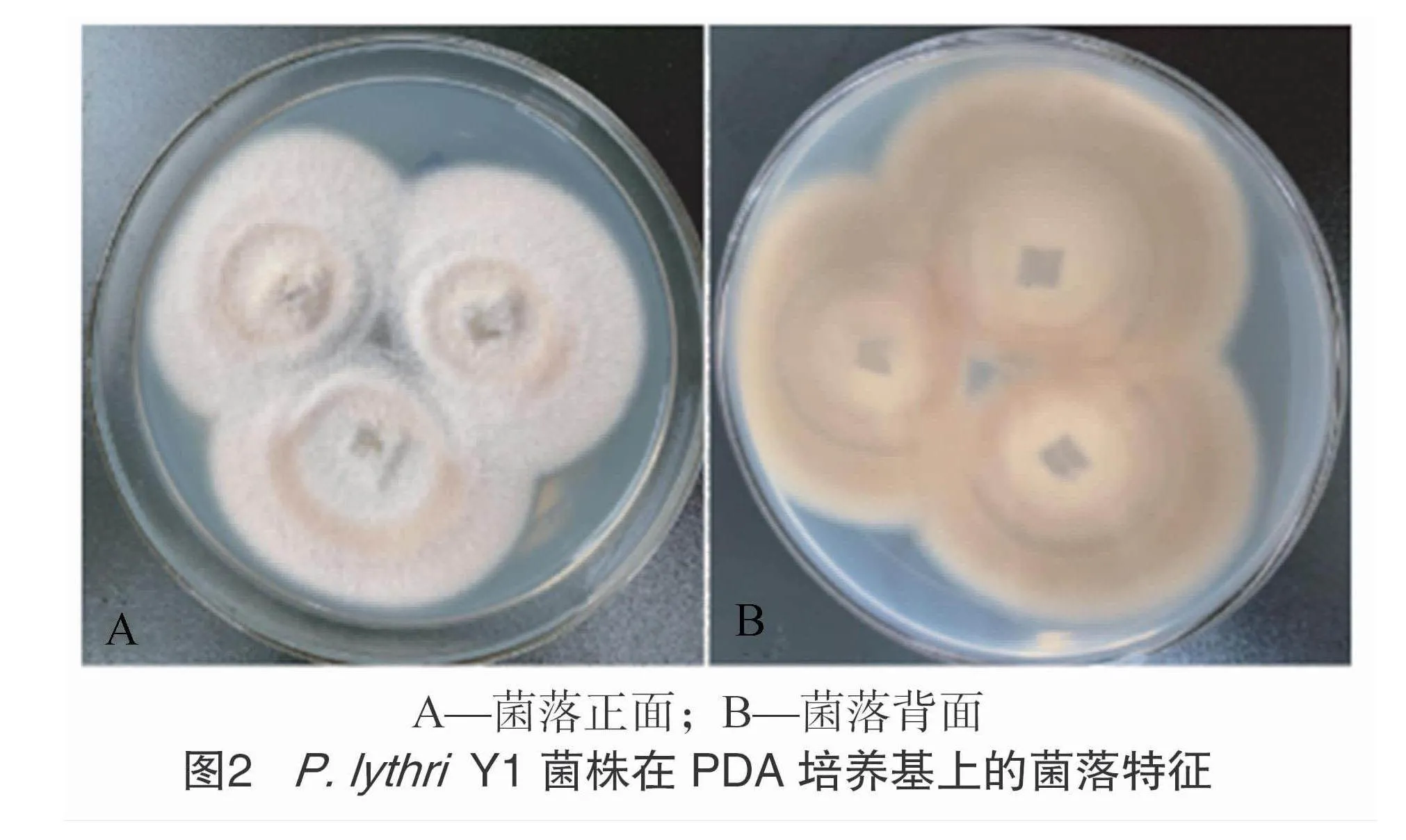
试验表明,P.lythri菌株Y1在PDA培养基上生长缓慢,产孢量极少,28 ℃培养5 d后菌落直径为 5 cm。气生菌丝为白色绒毛状,较致密,菌落边缘整齐且厚实,产生淡褐色色素,菌落背面为深黄褐色(图2)。光学显微镜下,分生孢子为卵圆形,顶生,单胞,无色,光滑,大小为(3.5~11.8) μm×(1.5~3.8) μm(图3)[31]。
菌株P.concavum在PDA培养基上的生长状态与P.lythri基本一致,生长较为缓慢,菌丝致密,呈绒毛状,产生黄褐色色素[32]。镜下观察分生孢子,其大小为(3.1~10.2) μm×(1.5~3.0) μm,单胞,透明,形状为伞状、独木舟形或者长椭圆形[29]。试验表明,菌丝生长的最适温度为25 ℃,产孢的最适温度为30 ℃;菌丝生长的最适 pH值为6,pH值为11时产孢最多;光照对菌丝生长、产孢无显著影响;最有利于菌丝生长及产孢量的碳氮源为葡萄糖与酵母膏[33]。
还有研究表明,P.lythri(曾用名Hainesia lythri)与P.concavum 为同一病原物的2种不同形态的共无性型。区别在于载孢体形态不同,前者产生盘状载孢体,后者产生半球形载孢体;而二者的分生孢子梗、产孢细胞、分生孢子等形态及ITS序列都表现出高度的相似性[34]。
有关病原菌的致病机制研究并不多,有人对菌株P.concavum 产生的降解酶进行了研究,发现病原菌能产生多种细胞壁降解酶,其中果胶酶[多聚半乳糖醛酸酶(PG)、果胶甲基半乳糖醛酸酶(PMG)]会引起叶片坏死,说明这2种酶在病原菌的致病过程中发挥了重要的作用[31]。
有研究表明,贝莱斯芽孢杆菌(Bacillus velezensis)G3-23 能够分泌蛋白酶和纤维素酶,抑制草莓褐色叶斑病菌菌丝生长,导致菌丝外壁降解,菌丝萎缩,肿胀变形;并且菌株G3-23可以在离体草莓叶片上成功定殖,在叶片上抑制病斑扩展的效果接近阳性对照戊唑醇,表现出较好的生防潜力[35]。
2.2" Corynespora cassiicola引发的草莓棒孢叶斑病
2.2.1" 病害症状
2018年,研究者在河南省草莓田中发现了一种新的叶片病害,在甜查理、贝尼霍普和秋明3个品种上均有发现,据统计有10%~60%的草莓植株被感染。该病早期症状表现为在叶片上形成小而圆的浅棕色斑点,在7 d内病斑的直径会从10 mm扩大到20 mm,病斑外围会形成黄色光晕,在潮湿的环境中,病斑叶片的表面可以发现棕色的分生孢子。发病严重时,病斑会逐渐扩大,占据一半的叶子面积,最终导致整个叶片枯死,对草莓产业的发展存在很大威胁。通过在立体显微镜下使用针头从有症状的叶组织中提取单个分生孢子,在马铃薯葡萄糖琼脂(PDA)上进行分离纯化,得到1株纯化真菌。然后,根据形态学和基因序列,将菌株鉴定为多主棒孢霉(Corynespora cassiicola)[36]。
2019年,温浩等在山东省诸城市也发现了有同样症状的草莓病株,经过分析发现,病原菌同为多主棒孢霉(C.cassiicola)[37],并在文中首次将病害称为棒孢叶斑病。
2021年,台湾地区报道C.cassiicola可以引发草莓出现类似的病株。可能由于地域的差异,台湾地区发现的病害早期症状与内地报道的部分相同,不同之处是此处发现的叶片病斑周围存在浅绿色光晕,还有一些病斑的中心会变成灰色,还发现随着病情的发展2~3个病斑会逐渐合并为1个大病斑,随后会被黄色的组织包围。更为不同的是在台湾地区草莓病株的茎上也观察到圆形至椭圆形的褐色斑点,所以给病害命名为草莓靶斑病(target spot)(图4)[38]。
2.2.2" 病原菌
病原菌C.cassiicola属于棒孢菌科(Corynesporascaceae)棒孢菌属(Corynespora)。已有研究表明,该菌是一种世界性分布的真菌,除危害草莓外,还可危害多种作物,寄主范围广泛,可侵染黄瓜(Cucumis sativus)[39]、生菜(Lactuca sativa var.ramosa Hort.)[40]、苦荬菜(Ixeris polycephala)[41]以及棉花(Gossypium spp.)[42]等。
在PDA培养基上,病原菌C.cassiicola的菌落正面颜色为灰色至灰黑色,菌丝棉絮状,背面颜色以灰黑色为主。分生孢子梗直立,棕色,单生或簇生,不分枝,大小为(200~400) μm×(4~8) μm;分生孢子透明,2~12个隔膜,呈棒状,一端略细,大小为(22.3~29.7) μm×(6.5~8.4) μm[37]。在台湾地区发现的病原菌C. cassiicola 的分生孢子则为卵形至圆柱形,1~16个隔膜,橄榄色至深棕色,大小为(5.6~6.7) μm×(28.1~270.0) μm[38](图5)。此外,有研究证实C.cassiicola最适生长的温度范围为25~30 ℃,最适pH值为6~10,在光暗交替条件下菌丝生长最快,最适碳源为葡萄糖,最适氮源为KNO3和NaNO3;同时,相关侵染试验结果表明,C.cassiicola 侵染前期,其分生孢子萌发产生芽管,而芽管顶端可在远离气孔的位置形成类似附着胞的结构,推测其是通过侵染性菌丝直接穿透寄主角质层进入叶片组织内的[43]。
C.cassiicola的首个全基因组序列在2014年获得,大小为41.39 Mb(菌株UM591),目前在NCBI上可以查询到56个菌株的全序列。
部分研究者通过室内毒力测定认为,双苯菌胺对C.cassiicola菌丝生长有很强的抑制作用,对50%个体有效的药物浓度(EC50)为 (0.27±0.18) μg/mL,可作为防治草莓叶斑病的首选药剂;百菌清与代森锰锌则不适合作为此病害的有效药剂[37]。
2.3" Pestalotiopsis和Neopestalotiopsis属的菌株引发的叶斑病
2.3.1" 病害症状
拟盘多毛孢属(Pestalotiopsis)和新拟盘多毛孢属(Neopestalotiopsis)均属于孢子虫科(Sporocadaceae)的2个属。在早期研究中,新拟盘多毛孢属并不存在,直到2014年研究者根据形态特征和系统发育,才将新拟盘多毛孢属从拟盘多毛孢属中分离出来,成为孢子虫科单独的一个属[44]。这样的分类地位一直沿用至今,所以本研究将这2个属的真菌引发的叶斑病放在一起进行简述。
这2个属的真菌大多都是植物病原菌,对草莓造成的侵染在国内外均有报道。我国最早是在1994年报道了拟盘多毛孢属真菌对草莓的危害,认为此属的真菌可以造成草莓死秧[45],由于技术所限,菌株的分类地位仅仅鉴定到属。
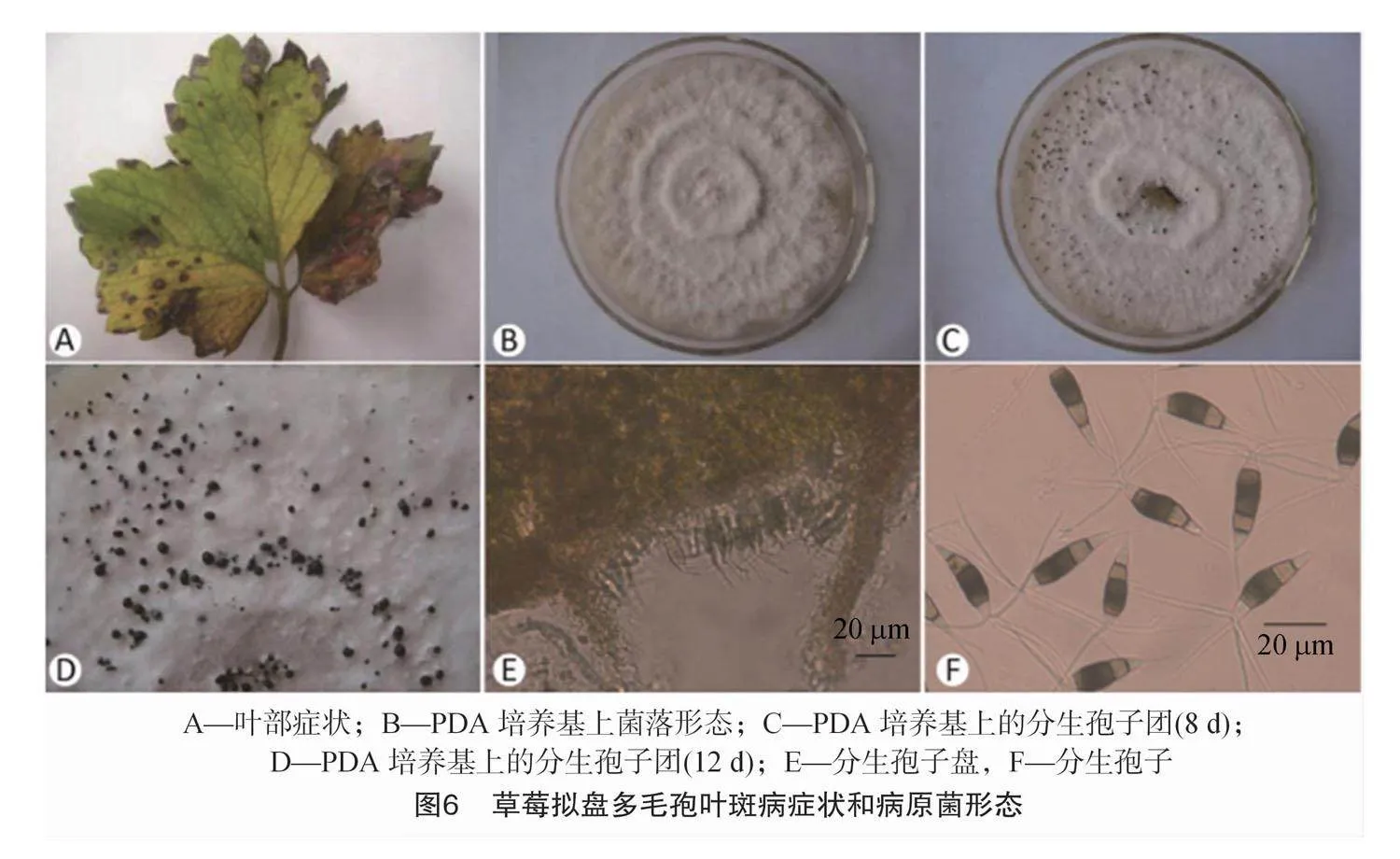
2015年在北京市房山区温室中发现草莓植株上出现了一种叶部新病害,发病早期会在叶片上产生红褐色的圆形小斑点,之后逐渐扩展为椭圆形或不规则形病斑,病斑的中央由红褐色转变为灰白色,周围褪绿变黄,形成黄色晕圈(图6)。发病后期,整个叶片会呈黄褐色,最终干枯死亡。如果环境湿度较大,可以在病斑上看见散生小黑点,即病原菌的分生孢子盘。经过鉴定,发现引发病害的病原菌为棒孢拟盘多毛孢(Pestalotiopsis clavispora)[46]。根据现在的分类,研究者认为P. clavispora 也就等同于 N.clavispora。
随后,在河南省商丘市草莓基地也发现一种叶部枯斑病害,感病初期叶片上出现紫红色小圆斑,后期病斑向四周逐渐扩散形成圆形、椭圆形或不规则形的病斑,病斑中央变成黄褐色,叶片逐步干枯死亡。鉴定试验结果表明,引发此病害的病原菌为斑污拟盘多毛孢(Pestalotiopsis maculans)[47]。
国外很早就发现拟盘多毛孢属的菌株会对草莓
造成危害,有关叶斑病的报道在近几年才逐渐开始多了起来。印度报道的N.clavispora引发的草莓叶斑病病症与国内的略有不同,发病初期叶片上病斑中心为灰色,边缘为紫棕色,散布于叶子表面,病斑慢慢扩大并相互融合,后期整个叶片的大部分面积都会被病斑覆盖,叶片由绿色变为黑色,导致死亡[48]。而墨西哥报道的由N.rosae引发的病症表现为叶片在同一时间出现1 mm左右的深棕色小圆斑,这些斑点逐步扩大,最终导致叶片枯萎死亡(图7)。患病草莓植株生命力下降,在移栽后约1个月死亡[49]。
2.3.2" 病原菌
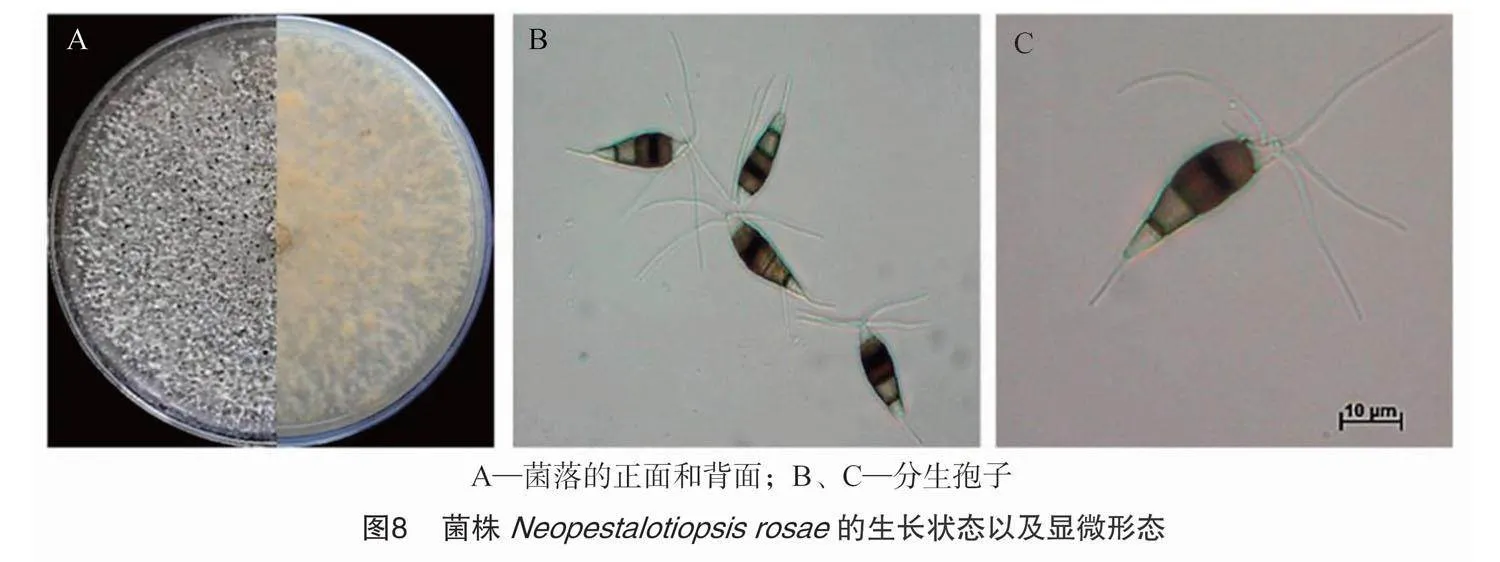
这2个属的真菌是一类广泛分布的病原菌,可侵染多个宿主。笔者以菌株N.rosae和N.clavispora(同P.clavispora)为例来进行生物学特性的介绍。墨西哥实验室分离的病原菌 N.rosae CRM-FRH在PDA培养基上形成的菌落为圆形,菌丝为白色,培养基背面为淡黄色;培养10 d后,菌落表面形成大量的黑色分生孢子盘。镜下观察分生孢子,呈梭形或者椭球形,包含5个细胞,中间3个细胞颜色较深,顶端和基部的2个细胞呈透明状,顶端的附属丝多为3根,偶尔会有4根;基部大多1根附属丝。不同菌株分子孢子大小不一,菌株的分生孢子大小为(22.34~34.12) μm×(6.00~11.07) μm(平均为27.29 μm×8.33 μm)(图8)[49]。
病原菌N.clavispora(编号CMF4)的最适培养基为PDA培养基,一般培养温度为25 ℃。该菌株菌落多呈白色丝绒状,边缘规则,表面呈波浪状或者花瓣状,菌落正面未见明显色素产生,背面呈淡橘黄色。培养8 d左右菌落上可见黑色圆形油状小点,即为分生孢子盘,后期分生孢子盘上会分泌出墨汁状黏液。镜下观察,发现分生孢子盘散生,褐色,直径为164.34~169.95 μm;分生孢子呈纺锤形或长梭形,大小为(26.54~32.74) μm×(8.1~9.5) μm,共5个细胞,4个隔膜,分隔处缢缩不明显,顶端与基部细胞颜色较淡,多数呈透明状,中间3个细胞颜色较深,多为褐色,顶端有2~4(多为 3)根不分枝的附属丝,长28.17~34.69 μm,尾部1根附属丝,长9.43~13.33 μm,附属丝均无色透明(图6)[46,50]。
这2个属的病原菌鉴定均没有特异性序列。在NCBI网站上,Pestalotiopsis有10个种获得了基因组序列,而Neopestalotiopsis仅有6个种获得了全基因组序列,其中N.clavispora和N.rosae的基因组序列分别于2020年和2022年获得。以N.rosae为例,其基因组总长度为53.78 Mbp,GC含量为49.88%,包含18个conting,平均长度为2.98 Mbp,根据序列推测的蛋白编码基因和候选分泌肽数分别为15 966个和1 822个[51]。
有关病原菌的侵染方式目前还没有深入的报道,但是已有试验结果表明,N.clavispora的寄生性或致病性较弱,可以通过伤口侵染植株,所以在生产中要避免对草莓叶片人为造成伤口[46]。室内毒力作用表明,双苯菌胺和咪鲜胺对N.clavispora的菌丝生长有很强的抑制作用,可作为防治草莓叶斑病的首选药剂,但因其作用方式主要为保护作用,建议在病害发生之前提前使用[50]。
需要注意的是,根据已有的文献报道,发现这2个属的真菌并非单独侵染草莓的叶片,在环境条件适宜的情况下,某些菌株对草莓叶片、果实、根冠部等都会造成伤害。在美国佛罗里达分离出的病原菌N.rosae等可以侵染草莓的叶片、果实、叶柄、冠和根部,使草莓产量受到严重影响,而侵染试验结果表明,菌株对于草莓的叶片和果实的侵染性要强于根冠部[52]。另外,西班牙和阿根廷均有此类报道,发现N.clavispora还会造成草莓根部和冠部的腐烂[53-54]。因此,有些研究者就将此类病害归到根腐病的范畴里面,我国研究者就根据病原菌N.rosae侵染草莓叶片和根部的病症表现,将病害命名为红叶根腐病[55]。这说明病原菌很可能由于基因突变或者环境的改变而造成其侵染方式或者范围等发生改变,那么在研究中也要根据具体情况来调整研究方向和方法,才能更贴合实际,能够为生产提供准确的科学依据。
2.4" Mycobacterium fragariae引发的草莓叶斑病
2.4.1" 病害症状
早在1885年,国外研究者就发现草莓球腔菌(Mycosphaerella fragariae)可以引发草莓常见病害叶斑病(CLS)。自此之后,很多种植草莓的国家都陆续发现了相同的草莓病害。此叶片病害主要症状就是初期在草莓叶片上会出现紫色的圆形小斑点,随着病害的发展,病斑的体积渐渐增大,形状为圆形或者不规则形,病斑中心会慢慢发生坏死,变为灰白色或灰褐色,病斑周围出现紫红色轮纹,当病斑较多时,可能会形成大型的融合斑。同时指出,如果种植的是易感病品种,又在天气和环境条件适合的情况下,病原菌还会侵染叶柄、果柄、花萼、匍匐茎和果梗,且植株间传播性强,容易造成大面积感染,给草莓生产带来巨大经济损失[56]。
由于叶片病斑从形态和颜色上与蛇的眼睛十分相似,因此1999年我国科学家在首次报道此病害时,就将其命名为草莓蛇眼病[57],但此报道中并没有明确病原菌的种类。随后几年中,我国各地陆续也有草莓蛇眼病的相关报道。到2008年,有研究报道指出,草莓蛇眼病的病原菌为草莓球腔菌 (M.fragariae)。病情严重时,叶片上病斑密布,在短时间内就会枯焦坏死;并且在环境湿度较高的环境中,病斑表面会产生白色粉状霉层,即病菌分生孢子梗和分生孢子。另外,还发现病原菌也会侵染草莓浆果上的种子,导致种子连同周围果肉形成黑色的斑点[58]。
2.4.2" 病原菌
草莓球腔菌(M.fragariae)是球腔菌属(Mycosphaerella)的真菌,后者是柱隔孢属(Ramularia)的有性型[58]。此菌的最佳培养基为燕麦培养基,PDA培养基中生长中等。菌丝生长较慢,25 ℃培养15~20 d,菌落直径为12 mm,菌落白色,略带灰色,菌落表面稍微隆起,气生菌丝浅色或者无色,平展生长呈细薄层。病原菌一般会产生分生孢子座,子座球形或半球形,由近球形或多角形细胞组织构成,褐色;分生孢子梗丛生于子座,一根一簇,很少单根着生,不分枝或细小分枝,多无隔或偶有隔,无色或淡色,等粗,直立或曲膝状;分生孢子顶生或亚顶生,圆柱形、卵形、长圆形,无色,1~3隔,双层壁,单生或短链生;孢子萌发常由一端或两端长出芽管,芽管分枝形成菌丝,偶有产生无色间生的厚垣孢子[58]。
目前,在NCBI上还没有查询到M.fragariae的全基因组序列。
M.fragariae侵染草莓叶片的能力受到多方面因素的影响。如果环境条件合适(相对湿度50%~60 %,15~25 ℃),孢子很容易通过叶片背面的气孔进入叶片内部,并迅速萌发生长,在叶片内部大量繁殖;而且幼龄叶更容易被病原菌侵染,叶芽和一些老龄叶片则相对不太容易被感染[59]。也有研究表明,如果草莓幼叶在25 ℃时(感染的最佳温度),长时间处于高湿的情况下(至少超过12 h),很容易被病原菌侵染产生病斑,时间越长,病斑数量越多,48 h后增长的速度会更快[60]。还有研究者对病原菌的产孢量进行研究,发现当培养温度从5 ℃升高到20 ℃时,病原菌的产孢量会逐渐增加,而当温度再高时,产孢量下降;而当温度在10~25 ℃的范围内时,持续时间从24~96 h内产孢量逐步增加,并趋于稳定[61]。
2.4.3" 防治措施
针对病害最有效经济的预防方法就是栽培抗性品种,研究者在2004年调查了我国种植的140个草莓品种,没有发现对蛇眼病完全免疫的品种,较为抗病的品种为鬼怒甘[62]。也有研究者称,2015年左右,在草莓栽培生产中表现较好的抗病品种有弗杰利亚、鬼怒甘、金引莓5号、章姬[63]。在国外,由于抗病品种的种植,蛇眼病曾一度消失。但是随着种植年限的增加,一些品种的抗病性逐渐降低,同时由于市场对于草莓果实的要求,从20世纪70年代末至80年代开始广泛种植的抗性或低敏感性品种逐渐被放弃,转向产量更高,浆果颜色、味道和保质期更好的品种。所以,为了预防蛇眼病的出现,在草莓生产中采用经济有效的预防手段还是十分必要的[64-65]。
传统的预防方法还要加强田间管理,挑选抗病的品种,种植健康无病的种苗,增加有机肥的施用,采取小高垄或小高畦栽培,有条件的地区可以采用合理的轮作来避免草莓蛇眼病的发生,种植间隔期为2~3年[63]。一旦发现草莓蛇眼病,在发病初期要及时摘除病叶并集中带出种植区进行处理;发病严重时,在采果后用甲基硫菌灵或者丙森锌可湿性粉剂等进行喷施,每隔7 d喷1次,连喷3次[57]。上茬草莓收获后要及时将老叶、病枯叶清理干净,不能在土壤中残留枯枝病叶,同时还要对土壤进行消毒处理。
随着大家对环保意识的增强,越来越多的研究者开始寻找更有效、更环保的生物防治措施来预防蛇眼病的发生。在拮抗菌的筛选试验中,研究者发现,酿酒酵母和蜡状芽孢杆菌对病原菌M.fragariae的杀菌效果与杀菌剂相似,可以作为生防菌株进行开发[66]。还有研究发现,采用草莓叶片挥发性物质中的萜类化合物熏蒸对草莓蛇眼病具有较好的抑菌效果,能显著抑制病原菌孢子的萌发和菌丝生长,并能使病原菌线粒体膜电位下降,从而抑制草莓球腔菌的生长且对草莓叶片无明显损伤,具有良好的应用前景[67]。还有试验表明,采前UV-C辐照后的草莓植株对蛇眼病病原菌(M.fragariae)的抗性显著增加草莓叶片内部的病程相关酶活性和基因表达上调幅度更大,酚类物质和挥发性萜类物质的积累更加显著[68]。这对于草莓生产中预防病害发生是一个良好的理论指导。
2.5" Pseudopithomyces maydicus引发的叶斑病
2.5.1" 病害症状
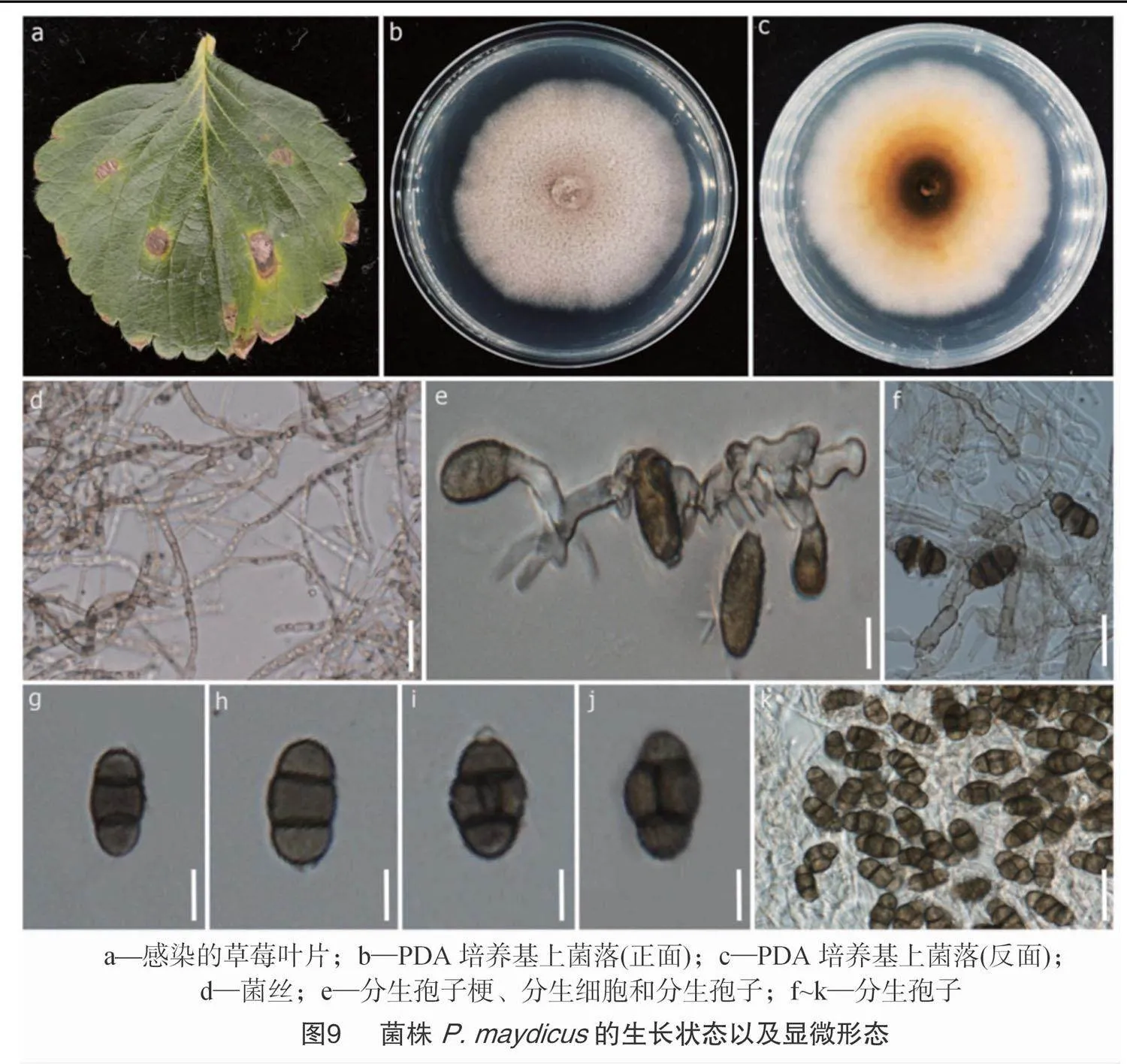
2021年夏天,在我国广东省的草莓种植地发现了一种新病害(图9),在草莓叶片表面以及叶片边缘处出现了一种中心为棕色,边缘为黄色的斑点,叶片背面也有病斑出现,但是数量较少。在高温、高湿度条件下,此病害的发病率约为15%,病害的严重程度为10%~25%。经过分离鉴定,确定引发此病害的病原菌为Pseudopithomyces maydicus。这是首次报道病原菌P.maydicus可以引发草莓叶斑病[69]。
2.5.2" 病原菌
病原菌P.maydicus属于隔孢假壳科(Didymosphaeriaceae)Pseudopithomyces。P.maydicus(菌株编号ZHKUCC22-0006)在PDA培养基上生长较快,菌落圆形,边缘清晰,25 ℃培养5 d后,菌落直径为60 mm。气生菌丝短绒毛状,白色至灰色,菌落背面产生色素,中心处为深棕色,越往外颜色越浅,最外呈黄色。菌株的分生孢子梗长为8~22 μm,宽为2~6 μm[平均长度(16±5) μm,宽度(4±2) μm],分生细胞长为7~15 μm,宽为2~3 μm[平均长度(11±3) μm,宽度(3±0.2) μm],分生孢子为棕色至深棕色,倒卵形至长圆形,共3~4个细胞,2~3个隔膜,分隔处收缩略明显,长为 8~18 μm,宽为5~11 μm[平均长为(15±2) μm,宽为(8±1) μm](图9)[69]。
NCBI网站上查询到P.maydicus(菌株SBW1)全基因组序列已在2022年获得,其序列长度为39.43 Mb。
2.6" Exserohilum rostratum引发的叶斑病
2.6.1" 病害症状
2022年,研究者在湖州大学的草莓种植园内发现草莓叶片上出现了一种病斑,此病害的发病率为45%。病害的早期症状表现为叶
片上有小的深棕色或黑色的斑点,随着病情的发展,病斑直径从2 mm扩大到6 mm,病斑周围会变为黄色;病情严重时,病斑会占据整个叶片的一半面积,最终导致叶片枯死(图10)[70]。
2.6.2" 病原菌
经过组织分离法,在发病叶片组织中分离出1株病原菌,根据序列比对将病原菌鉴定为嘴突凸脐蠕孢菌(Exserohilum rostratum),在分类学中,此菌是属于孢腔菌科(Pleosporaceae)的凸脐蠕孢属(Exserohilum)。
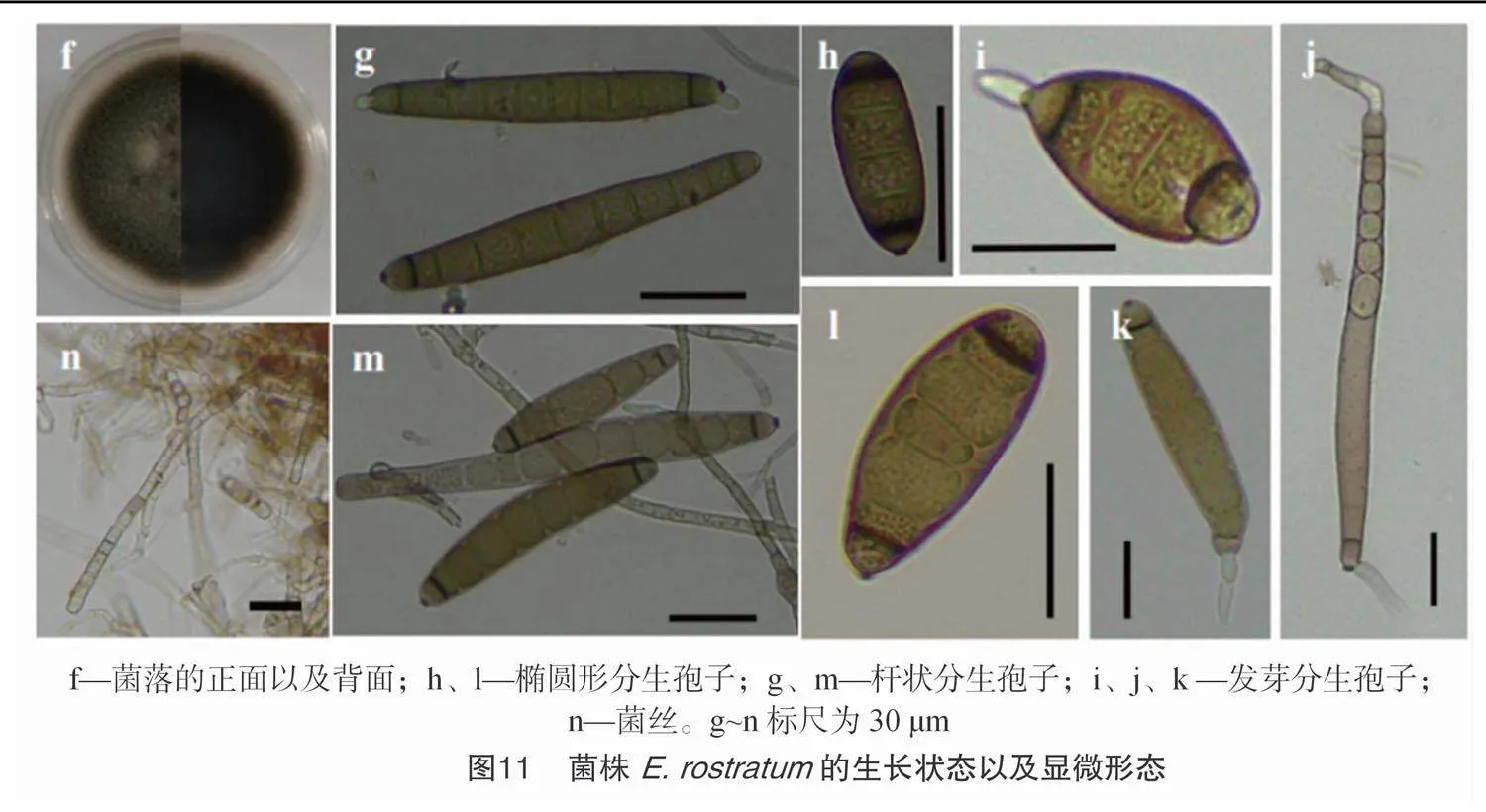
在PDA培养基上,E. rostratum 的菌落形态为圆形,表面呈现深棕色,培养基背面为黑色。气生菌丝为棉絮状,颜色为灰色,随着色素的分泌而逐渐变为深棕色。菌株的分生孢子较大,具有隔膜,颜色包括浅橄榄棕色、深橄榄棕色和浅橄榄黑色。典型的分生孢子为椭圆形或杆状,很少弯曲,基底细胞和顶端细胞被深色的隔膜隔开。椭圆形分生孢子的平均尺寸约为 18.77 μm×54.92 μm[(11.99~26.97) μm×(35.13~74.59) μm,n=20],杆状分生孢子平均尺寸约14.80 μm×103.24 μm[(11.24~24.64)×(73.11~131.51) μm,n=20](图11)。
NCBI上可以查询到4个该菌的全基因组序列,最早的序列是在2021年获得,全长为35.767 Mb(菌株编号为ER1)。
2.7" 真菌性叶斑病的防治措施
草莓真菌性病害由于病原菌的不同分为以上几种类型,其中像草莓蛇眼病发现至今已有近百年
的历史,因此在生产栽培中已经有针对性的防治措施,这个在前文中已有叙述,但是其余的几种病害发现时间不算很长,有些甚至是近一两年才发现的病害,相关的病原菌侵染机制研究、生物杀菌剂筛选以及预防病害的栽培管理方法等方面的研究还是很少,故并没有形成成熟的防治措施,那么在生产中大多是借鉴常用的有效防治手段进行病害防治。
例如,一些常用的化学药剂可以参考草莓蛇眼病的杀菌剂,甲基硫菌灵、丙森锌可湿性粉剂、苯醚甲环唑和丙环唑等,不同的杀菌剂针对不同病原菌的效果也略有不同,需要根据实际情况进行调节。
相关的栽培管理方法以及病害初期处理方法还可以参考细菌性叶斑病的一些措施:第一,要注意调节草莓种植区的温度和湿度,不给病原菌创造合适的生长环境;第二,草莓种苗要严格把关,必须清除种苗病叶及重病株,健康的种苗是预防病害的关键环节之一;第三,移栽后也要加强栽培管理,合理施肥,增加草莓抗性;第四,要找经验丰富的管理人员密切观察草莓叶片状态,一旦在田间发现有叶斑病的出现,及时处理发病植株,根据病情严重程度确定处理的范围,对病株的土壤进行消毒处理,还要对其余草莓植株喷施杀菌剂以预防病原菌感染;第五,发病植株不可随意丢弃,必须集中销毁,相关的农业用具也要做好消毒,避免人为传播病害。
总之,防治真菌性叶斑病同样需要将农业防治、物理防治、化学防治以及生物防治等多种防治手段有效结合,才能发挥更好的防治效果,但是由于病原菌的多样性,比起细菌性叶斑病防治的难度更大。未来还需要在实践中总结出针对不同病原菌的有效措施,这样才能更好地进行病害防治。
3" 草莓叶片的其他病症
在实际生产中,不仅草莓叶斑病会在叶片上形成病斑,还有一些病害也会在叶片上形成病变[71],例如常见的炭疽病和白粉病,本文将这2种病害在叶片上的病症也进行了简单的总结;同时,还将这2种病害在叶片上的症状和上述不同叶斑病的病症进行分析比较,以期为病害的早期诊断提供有效的依据,结果见表1。
3.1 "炭疽病
草莓炭疽病是被炭疽菌属(Colletotrichum)的病菌侵染所致,草莓的匍匐茎、叶柄、根冠、花及果实均可被侵染。发病时,叶片的病斑呈灰黑或黑色,大小不一,坏死斑点不扩展[72]。
3.2" 白粉病
草莓白粉病的病原菌是羽衣草单囊壳菌(Sphaerotheca aphanis)。发病初期,叶片上产生大小不等的暗色斑点,随后叶片表面形成白色粉状物,即病菌的分生孢子。后期病斑呈红褐色,叶片边缘萎缩、焦枯。
4" 总结与展望
草莓作为一种高附加值的经济作物,其全球产量与种植面积均在不断增加。自2007年之后,无论从种植面积还是草莓产量上看,我国都已经成为世界上最大的草莓生产国家。随之而来的就是各种各样的病害,然而在过去草莓叶斑病并没有得到种植者的重视,很多人认为它不会对草莓生产造成很大的影响。但是近些年来,国内外有关草莓叶斑病严重危害草莓生产的报道越来越多,同时也新发现
了很多病原菌可以引起草莓的叶斑病,而且其中某些病原菌在病情发展到严重的时候还会侵染到草莓的茎部、根部以及果实。因此,本研究从病害症状、病原菌鉴定、病原菌生物学特性、侵染机制和病害的防治方法等方面简单综述了不同病原菌(包括细菌和真菌)引发的草莓叶斑病;同时,为了能在早期将叶斑病做出诊断,本研究还将叶斑病与炭疽病、白粉病在叶片上的病症表现进行了对比。以此期望提高大家对于草莓叶斑病的重视程度,也为草莓叶斑病的防治提供有力的科学依据。
根据已有的报道分析,发现相比其他病害来说,草莓叶斑病的科学研究并不算全面,尤其是一些真菌性叶斑病,这也可能与病害发现的时间较短有关。希望在今后的相关研究中,首先要着重开展叶斑病的致病机制、病害循环过程、病原菌的侵染特性以及致死条件等方面的相关研究,将各种叶斑病的症状研究透彻;其次,要开展全面的防治研究,包括栽培管理方法的改良、天然生物农药和生物菌剂的开发利用、病害早期的处理措施以及病情暴发后的处理措施等。此外,选育抗性品种也是预防草莓叶斑病的重要途径之一,可以从源头上避免病原菌的侵染,但是引发叶斑病的病原菌有细菌也有真菌,种类较多,且我国幅员辽阔,各地的气候条件各不相同,所以无论是采用传统方法还是分子手段进行选育,在进行叶斑病抗性分析的时候都要考虑多方面影响因素,才能找到合适的抗病品种[73]。
总体来说,草莓叶斑病的防控思想未来仍然是“预防为主,综合防治”[74],以良好田间管理为基础,科学使用化学防治技术,在不影响产量和品质的前提下,提倡尽可能多地使用物理防治、生物防治和生态防治,为发展绿色农业、创建环境友好型社会做出贡献。
参考文献:
[1]陈" 哲,黄" 静,赵" 佳,等. 草莓根腐病的病原菌分离鉴定及拮抗菌CM3的抑制作用研究[J]. 生物技术通报,2018,34(2):135-141.
[2]陈" 哲,黄" 静,赵" 佳,等. 防治草莓炭疽病的芽胞杆菌组合的筛选[J]. 中国生物防治学报,2018,34(4):582-588.
[3]苏代发,童江云,杨俊誉,等. 草莓病毒病及其研究进展[J]. 云南大学学报(自然科学版),2019,41(6):1221-1237.
[4]Gigot C,Turechek W,McRoberts N. Analysis of the spatial pattern of strawberry angular leaf spot in California nursery production[J]. Phytopathology,2017,107(10):1243-1255.
[5]高" 洁,张佳环,袁美丽. 吉林省通化市发现草莓细菌性叶疫病[J]. 植物检疫,1991(5):345-346.
[6]杨万风,刘" 翔,刘天鸿. 草莓角斑病菌检测鉴定技术研究进展[J]. 植物检疫,2010,24(3):40-45.
[7]杨万风,刘" 翔,刘天鸿. 草莓角斑病菌传入中国的风险分析[J]. 植物检疫,2011,25(3):52-55.
[8]刘天鸿,杨万风. 草莓上一种新病害:草莓角斑病[J]. 中国蔬菜,2011(5):28-29.
[9]杨万风,刘" 艳,刘" 翔,等. 草莓角斑病菌室内抑菌药剂筛选[J]. 江苏农业科学,2011,39(5):161-162.
[10]努尔阿丽耶·麦麦提江,席" 昕,马占鸿. 草莓上一种新的细菌性病害的病原鉴定[C]//中国植物病理学会.中国植物病理学会2018年学术年会论文集.北京:中国农业科学技术出版社,2018:1.
[11]Wang J,Wei H L,Chang R K,et al. First report of strawberry bacterial angular leaf spot caused by Xanthomonas fragariae in Tianjin,China[J]. Plant Disease,2017,101(11):1949.
[12]孙雪梅,凤舞剑. 不同药剂蘸根处理对草莓角斑病预防与促生效果评价[J]. 农业科技通讯,2021(11):201-203.
[13]段永华,左丽娟,普继琼,等. 草莓细菌性角斑病的田间发病规律及防治措施[J]. 农业科技通讯,2020(8):325-327.
[14]Zhang J H,He Y L,Ahmed W,et al. First report of bacterial angular leaf spot of strawberry caused by Xanthomonas fragariae in Yunnan Province,China[J]. Plant Disease,2022,106(7):1978.
[15]杨振华,缑一杰,王新宁. 5种杀菌剂混配对草莓细菌性角斑病防治效果研究[J]. 西北林学院学报,2022,37(5):162-166,265.
[16]Kim D R,Gang G H,Jeon C W,et al. Epidemiology and control of strawberry bacterial angular leaf spot disease caused by Xanthomonas fragariae[J]. The Plant Pathology Journal,2016,32(4):290-299.
[17]Wu H Y,Lai Q J,Wu Y M,et al. First report of Xanthomonas fragariae causing angular leaf spot on strawberry (Fragaria xananassa) in Taiwan[J]. Plant Disease,2020,105(10):1187.
[18]Vandroemme J,Cottyn B,Baeyen S,et al. Draft genome sequence of Xanthomonas fragariae reveals reductive evolution and distinct virulence-related gene content[J]. BMC Genomics,2013,14(1):829.
[19]Henry P M,Leveau J H J. Finished genome sequences of Xanthomonas fragariae,the cause of bacterial angular leaf spot of strawberry[J]. Genome Announcements,2016,4(6):e01271-e01216.
[20]Kastelein P,Krijger M,Czajkowski R,et al. Development of Xanthomonas fragariae populations and disease progression in strawberry plants after spray-inoculation of leaves[J]. Plant Pathology,2014,63(2):255-263.
[21]Puawska J,Kauz·na M,Warabieda W,et al. Transcriptome analysis of Xanthomonas fragariae in strawberry leaves[J]. Scientific Reports,2020,10:20582.
[22]Feng J Y,Li Y L,Wang D J,et al. First report of Xanthomonas fragariae strain YL19 causing crown infection pockets in strawberry in Liaoning Province,China[J]. Plant Disease,2021,105(8):2237.
[23]Roach J A,Verma S,Peres N A,et al. FaRXf1:a locus conferring resistance to angular leaf spot caused by Xanthomonas fragariae in octoploid strawberry[J]. Theoretical and Applied Genetics,2016,129(6):1191-1201.
[24]张" 龙,粱希斌. 草莓细菌性叶斑病的发生及防治[J]. 河南农业,2021(19):43.
[25]Henry P M,Gebben S J,Tech J J,et al. Inhibition of Xanthomonas fragariae,causative agent of angular leaf spot of strawberry,through iron deprivation[J]. Frontiers in Microbiology,2016,7:1589.
[26]Lopes U P,Zambolim L,Lopes U N,et al. First report of Pilidium concavum causing tan-brown rot in strawberry fruits in Brazil[J]. Plant Pathology,2010,59(6):1171-1172.
[27]Debode J,van Hemelrijck W,Heungens K,et al. First report of Pilidium concavum causing tan-brown rot on strawberry fruit in Belgium[J]. Plant Disease,2011,95(8):1029.
[28]Golebniak B,Jarosz A. First report of tan-brown rot (Hainesia lythri) on strawberry fruits in Poland[J]. Plant Pathology,2004,31(12):57-60.
[29]Geng W L,Hu P,Ma Z,et al. First report of Pilidium concavum causing tan-brown leaf spot on strawberry in China[J]. Plant Disease,2012,96(9):1377.
[30]赵景楠,马" 喆,耿文龙,等. 新病害草莓褐色叶斑病病原菌细胞壁降解酶研究[J]. 中国农学通报,2014,30(31):261-266.
[31]熊仕俊,孙成龙,黄" 波,等. 贵州省草莓褐色叶斑病病原Pilidium lythri的鉴定[J]. 农技服务,2020,37(12):40-42.
[32]段亚冰,余真真,陈艳利,等. 营养因素与培养条件对Pilidium concavum病菌菌丝生长及产孢量的影响[J]. 北方园艺,2010(4):164-167.
[33]王田田,周海霞,赵" 静. 以Pilidium concavum为例探讨真菌培养条件的优化[J]. 甘肃科技,2018,34(1):32-34.
[34]赵新兰,李" 宁,刘爱新,等. 牡丹腔孢叶斑病及其病原物的共无性型[J]. 菌物学报,2010,29(4):475-480.
[35]王卓妮,覃艮红,王" 丽,等. 草莓病害拮抗细菌的筛选及其对草莓褐色叶斑病的防效[J]. 中国蔬菜,2023(2):63-71.
[36]Zhang M,Ma Q Z,Zhai N P,et al. Occurrence of outbreak of leaf spot caused by Corynespora cassiicola in strawberry in China[J]. Plant Disease,2018,102(10):2037-2038.
[37]温" 浩,张桂军,毕" 扬,等. 草莓棒孢叶斑病的病原菌鉴定及其对9种杀菌剂的敏感性[J]. 农药学学报,2019,21(3):279-284.
[38]Lo P H,Lai Y T,Ko Y T,et al. First report of target spot disease of strawberry caused by Corynespora cassiicola in Taiwan[J]. Plant Disease,2023,107(8):2535.
[39]蓝国兵,谭耀华,何自福,等. 黄瓜褐斑病(Corynespora cassiicola)在广东首次报道[J]. 植物保护,2012,38(5):197-200.
[40]Baiyee B,Pornsuriya C,Ito S I,et al. Trichoderma spirale T76-1 displays biocontrol activity against leaf spot on lettuce (Lactuca sativa L.) caused by Corynespora cassiicola or Curvularia aeria[J]. Biological Control,2019,129:195-200.
[41]Xue L H,Liu Y,Li C J. First report of leaf spot caused by Corynespora cassiicola on Ixeris polycephala in China[J]. Plant Disease,2017,101(8):1552.
[42]Butler S,Young-Kelly H,Raper T,et al. First report of target spot caused by Corynespora cassiicola on cotton in Tennessee[J]. Plant Disease,2016,100(2):535.
[43]薛彩英,武海燕,马庆周,等. 河南省草莓棒孢叶斑病病原菌鉴定及其生物学特性[J]. 植物保护学报,2023,50(2):402-412.
[44]Maharachchikumbura S S N,Hyde K D,Groenewald J Z,et al. Pestalotiopsis revisited[J]. Studies in Mycology,2014,79:121-186.
[45]朱杰华,樊慕贞,蔺成武,等. 草莓根病病原初步研究[J]. 河北农业大学学报,1994(2):45-48.
[46]赵景楠,马" 喆,刘正坪,等. 草莓拟盘多毛孢叶斑病的病原菌[J]. 菌物学报,2016,35(1):114-120.
[47]朱晓琴,张" 奇,郑爱珍,等. 商丘地区草莓叶斑病的分离与鉴定[J]. 北方园艺,2021(17):38-43.
[48]Mahapatra S,Banerjee J,Kumar K,et al. Leaf spot and fruit rot of strawberry caused by Neopestalotiopsis clavispora in Indo-Gangetic Plains of India[J]. Indian Phytopathology,2018,71(2):279-283.
[49]Rebollar-Alviter A,Silva-Rojas H V,Fuentes-Aragón D,et al. An emerging strawberry fungal disease associated with root rot,crown rot and leaf spot caused by Neopestalotiopsis rosae in Mexico[J]. Plant Disease,2020,104(8):2054-2059.
[50]温" 浩,魏佳爽,张桂军,等. 九种杀菌剂对新拟盘多毛孢病菌的室内毒力作用[J]. 农药学学报,2019,21(4):437-443.
[51]Hsu S Y,Lin Y C,Xu Y C,et al. High-quality genome assembly of Neopestalotiopsis rosae ML1664,the pathogen causing strawberry leaf blight and crown rot[J]. Molecular Plant-Microbe Interactions,2022,35(10):949-953.
[52]Baggio J S,Forcelini B B,Wang N Y,et al. Outbreak of leaf spot and fruit rot in Florida strawberry caused by Neopestalotiopsis spp.[J]. Plant Disease,2021,105(2):305-315.
[53]Obregón V G,Meneguzzi N G,Ibaez J M,et al. First report of Neopestalotiopsis clavispora causing root and crown rot on strawberry plants in Argentina[J]. Plant Disease,2018,102(9):1856.
[54]Chamorro M,Aguado A,de los Santos B. First report of root and crown rot caused by Pestalotiopsis clavispora (Neopestalotiopsis clavispora) on strawberry in Spain[J]. Plant Disease,2016,100(7):1495.
[55]刘艳茹,曹" 莹,孙" 琰,等. 草莓红叶根腐病病原菌分离与鉴定[J]. 植物病理学报,2022,52(1):104-108.
[56]Carisse O,McNealis V. Development of action threshold to manage common leaf spot and black seed disease of strawberry caused by Mycosphaerella fragariae[J]. Plant Disease,2019,103(3):563-570.
[57]刘金江. 草莓蛇眼病[J]. 西北园艺,1999(6):41.
[58]赵" 岩. 草莓对蛇眼病抗性中防卫相关酶的研究[D]. 长春:吉林农业大学,2008.
[59]Harrison G L,Stewart A. The effect of leaf age on susceptibility of strawberry to infection by Mycosphaerella fragariae[J]. Journal of Phytopathology,1989,124(2):112-118.
[60]Carisse O,Bourgeois G,Duthie J A. Influence of temperature and leaf wetness duration on infection of strawberry leaves by Mycosphaerella fragariae[J]. Phytopathology,2000,90(10):1120-1125.
[61]Carisse O,Peyrachon B. Influence of temperature,cultivar,and time on sporulation of Mycosphaerella fragariaeon detached strawberry leaves[J]. Canadian Journal of Plant Pathology,1999,21(3):276-283.
[62]苏家乐,钱亚明,王壮伟,等. 不同草莓品种对蛇眼病田间抗性鉴定[J]. 江苏农业科学,2004,32(6):85-86.
[63]司海燕. 草莓蛇眼病的综合防治技术[J]. 农村百事通,2015(23):36-37.
[64]Carisse O,McNealis V. Identification of weather conditions associated with the occurrence,severity,and incidence of black seed disease of strawberry caused by Mycosphaerella fragariae[J]. Phytopathology,2018,108(1):83-93.
[65]Delhomez N,Carisse O,Lareau M,et al. Susceptibility of strawberry cultivars and advanced selections to leaf spot caused by Mycosphaerella fragariae[J]. HortScience,1995,30(3):592-595.
[66]Heling A L,Kuhn O J,Stangarlin J R. Biologicl controle of Mycosphaerella fragariae in strawberry culture[J]. Scientia Agraria Paranaensis,2015,14(4):221-228.
[67]童志超,徐艳群,李" 栋,等. 草莓叶主要挥发性物质的测定及其对草莓球腔菌的抑菌效果[J]. 核农学报,2021,35(2):498-507.
[68]Xu Y Q,Charles M T,Luo Z S,et al. Ultraviolet-C priming of strawberry leaves against subsequent Mycosphaerella fragariae infection involves the action of reactive oxygen species,plant hormones,and terpenes[J]. Plant,Cell amp; Environment,2019,42(3):815-831.
[69]Samaradiwakara N P,Zou X Y,Yang Y H,et al. First report of Pseudopithomyces maydicus causing leaf spots in strawberry[J]. Crop Protection,2022,162:106081.
[70]Tang Z Y,Lou J,Mo J Y,et al. First worldwide report of Exserohilum rostratum causing leaf spot on strawberry (Fragaria×ananassa Duch.)[J]. Plant Disease,2023,107(8):2532.
[71]张晓慧. 草莓病害研究进展[J]. 安徽农学通报,2018,24(18):52-57.
[72]唐冬兰,唐" 泉,蒋立奔,等. 6种杀菌剂对2种草莓炭疽病菌室内毒力测定[J]. 江苏农业科学,2022,50(12):106-113.
[73]严聪文,苏代发,代庆忠,等. 草莓病害的生物防治研究进展[J]. 生物技术通报,2022,38(12):73-87.
[74]李文琦,孙平平,张" 磊,等. 几种草莓常见病害的防治研究[J]. 北方果树,2022(6):1-4.

