基于“四重表征”对酸碱中和反应的实验探究









摘 要: 基于“四重表征”教学模式,借助数字化传感器,从pH、离子浓度和能量变化三个角度,设计多组对比实验,对酸碱中和反应体系进行全面探究。将传感器所呈现的微观图像与指示剂的宏观变色现象相结合进行分段式数据分析,并进行符号表征,帮助学生全面理解和掌握酸碱中和反应的变化本质,旨在发展学生的科学思维、落实化学学科核心素养。
关键词: 酸碱中和反应; 四重表征; 数字化传感器
文章编号: 1005-6629(2024)11-0075-06
中图分类号: G633.8
文献标识码: B
1 问题的提出
酸碱中和反应是中学化学中的重要反应类型,反应过程中存在较复杂的物质变化与能量变化。传统的课堂教学往往只局限于宏观指示剂的变色现象,对反应的本质没有进行深入的剖析,加上由于学生自身的实验设计、分析和推理能力欠佳等问题,导致其无法正确理解酸碱中和反应的微观本质[1,2]。
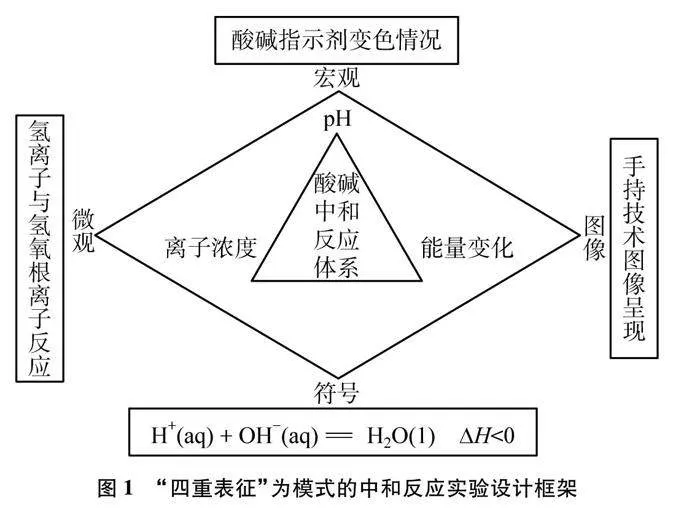
手持技术实验具有实时、准确、直观、便携等特点[3],能将实验中的微观变化以图像的形式呈现,有效解决传统实验的教学难点、突破化学知识的认知难点、提升概念认知的发展水平[4]。为了更好地发挥手持技术的作用,钱扬义等[5]提出“四重表征”教学模式,从 “宏观-微观-符号-图像”四个维度对化学反应进行表征,将化学反应的宏观现象与传感器的图像相结合,分析反应的微观本质。该模式有利于培养学生基于实验事实进行证据推理、建构模型并推测物质及其变化的思维能力。
目前,已有不少教师利用手持技术数字化实验对酸碱中和反应进行了研究。如王晓芳等[6]对手持技术在我国近20年的研究进展及现状作了分析,为数字化实验在化学中的应用提供参考;邹丽丹、马慧、李文良等[7~9]运用手持技术对酸碱中和反应体系的pH变化进行了探讨和相应的教学设计,帮助学生从微观层面理解酸碱中和反应;彭豪、陈德权等[10,11]有效运用“四重表征”的教学模式,结合手持技术对酸碱中和反应中的pH变化进行探究,进一步提升了教学效果。但现有
研究大多只从pH这一角度进行探讨,
对反应本质的分析尚不全面。
基于此,本文将以“四重表征”为教学模式,利用手持技术传感器,选择学生最熟悉的NaOH和HCl反应为研究对象,利用紫色石蕊试液提供反应时的宏观现象,从pH、离子浓度、能量变化三个角度出发,设计多组适合教师演示的对比实验,旨在让学生多角度全方位地对酸碱中和反应的本质进行理解和掌握,提升课堂教学效果。
2 实验设计
酸碱中和反应中存在较复杂的物质变化与能量变化。物质变化主要体现在氢离子与氢氧根离子结合生成水,这会导致体系的pH和离子浓度发生变化;能量变化主要体现在该反应是一个典型的放热反应。本研究将从pH、离子浓度和能量变化三个角度,设计多组对比实验,揭示该反应的本质。
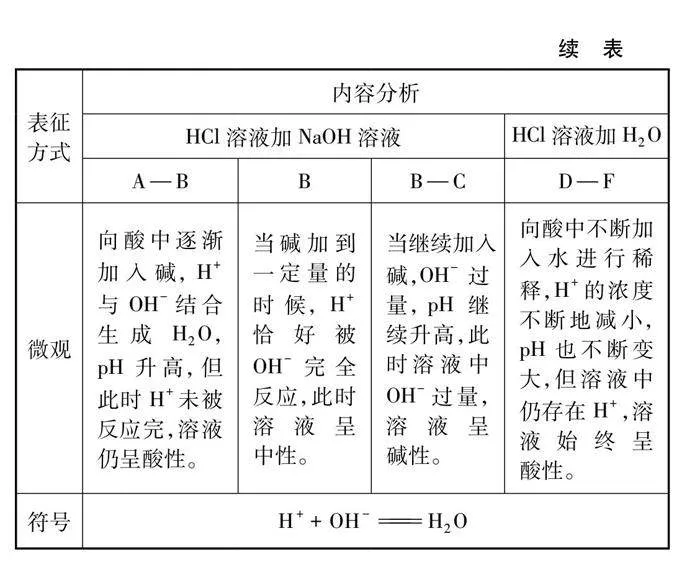
角度一:酸碱中和反应体系pH变化的探究实验设计。借助pH传感器,记录反应时pH的变化规律。同时设计酸与碱稀释时pH的变化作为对照实验,比较酸碱反应与稀释作用对体系pH影响的差异。
角度二:酸碱中和反应体系离子浓度变化的探究实验设计。溶液的离子浓度与其导电性呈正相关,利用电导率传感器可反映离子浓度的变化规律。同时设计对比实验,探究体系中水的生成以及离子的增加对溶液导电性的影响。
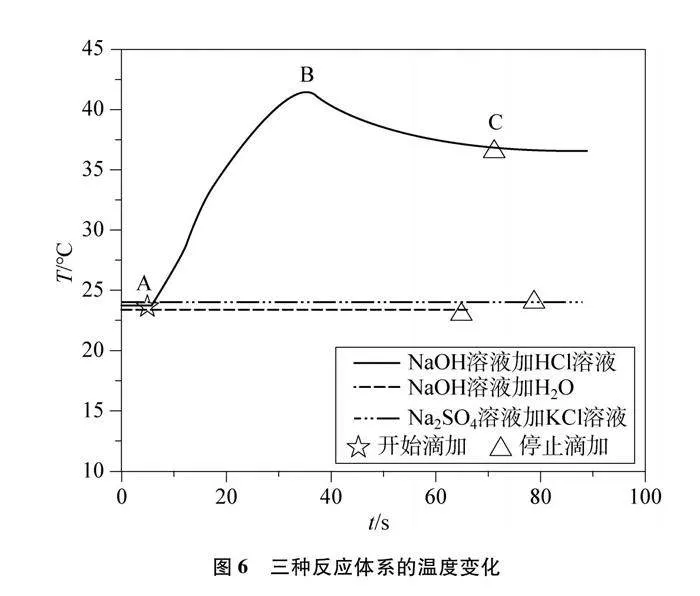
角度三:酸碱中和反应体系能量变化的探究实验设计。借助温度传感器,记录反应时温度的变化规律。同时设计对比实验,排除因稀释作用以及Na+与Cl-之间的作用而导致温度变化的可能性。
实验中,HCl与NaOH溶液的浓度均为0.1mol/L,考虑到此浓度的酸和碱反应放出热量并不明4crP3CdG84XL9yj7rhN3lQ==显,故选择溶质质量分数为10%的两种溶液来探究温度的变化。整体的实验设计以“四重表征”为教学模式,其设计框架如图1所示。
3 实验药品与装置
实验药品:0.1mol/L HCl溶液、0.1mol/L NaOH溶液、0.1mol/L NaCl溶液、10% Na2SO4溶液、10% KCl溶液、10% HCl溶液、10% NaOH溶液、紫色石蕊试剂、去离子水
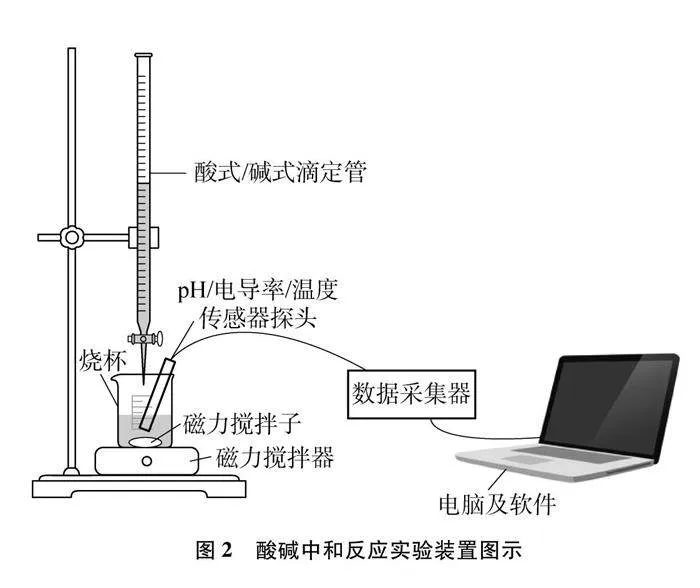
实验仪器:100mL烧杯×2、250mL烧杯×2、50mL酸式滴定管、50mL碱式滴定管、10mL量筒、50mL量筒、磁力搅拌器、磁力搅拌子、胶头滴管、朗威传感器(pH、电导率、温度)、数据采集器、电脑及配套软件(DISLab 8.0)
装置如图2所示。
4 实验步骤
按图2所示组装好实验仪器、对应的传感器、数据采集器及电脑软件,设置采样参数,添加图像坐标以及数据表格。反应过程中利用磁力搅拌装置,转速为300rpm。
4.1 酸碱中和反应体系pH的变化
4.1.1 酸碱反应pH的变化
(1) 选择pH传感器;
(2) 向烧杯中加入20mL 0.1mol/L NaOH溶液、5滴紫色石蕊试液,向滴定管中加入30mL 0.1mol/L HCl溶液;
(3) 运行软件采集数据,打开滴定管,观察pH图像变化;
(4) 将烧杯与滴定管中的物质对调,重复步骤(1)至(3)。
4.1.2 pH变化的对比实验
(1) 同4.1.1中的步骤(1);
(2) 向烧杯中加入2mL 0.1mol/L NaOH溶液;
(3) 运行软件采集数据,用量筒分多次量取50mL去离子水加入烧杯,观察pH图像变化;
(4) 待pH变化非常缓慢,用烧杯分多次量取250mL去离子水加入,观察pH图像变化;
(5) 将烧杯中换成2mL 0.1mol/L HCl溶液,重复步骤(1)至(4)。
4.2 酸碱中和反应体系离子浓度的变化
4.2.1 酸碱反应电导率的变化
选择电导率传感器,步骤与4.1.1中的步骤(1)至(3)基本相同,观察电导率图像的变化。
4.2.2 电导率变化的对比实验
(1) 选择电导率传感器;
(2) 向烧杯中加入20mL 0.1mol/L NaOH溶液、5滴紫色石蕊试液,用滴定管向烧杯中滴加30mL的去离子水,观察电导率图像的变化;
(3) 将上述步骤中20mL 0.1mol/L NaOH换成20mL 0.1mol/L NaCl溶液,30mL去离子水换成30mL 0.1mol/L HCl溶液,重复步骤(1)和(2)。
4.3 酸碱中和反应体系能量的变化
4.3.1 酸碱反应温度的变化
(1) 选择温度传感器;
(2) 向烧杯中加入20mL 10% NaOH溶液、5滴紫色石蕊试液,向滴定管中加入30mL 10% HCl溶液;
(3) 运行软件采集数据,打开滴定管,观察温度图像变化。
4.3.2 温度变化的对比实验
(1) 将滴定管中的HCl溶液换成等量的去离子水,重复4.3.1的步骤;
(2) 将4.3.1中的20mL 10% NaOH溶液换成20mL 10% Na2SO4溶液,30mL 10% HCl溶液换成30mL 10% KCl溶液,重复4.3.1的步骤。
5 实验结果与分析
实验中的宏观现象能够通过指示剂的变色情况直观地反映。将实验中采集的数据进行作图,结果如下。
5.1 酸碱反应pH的变化及对比实验
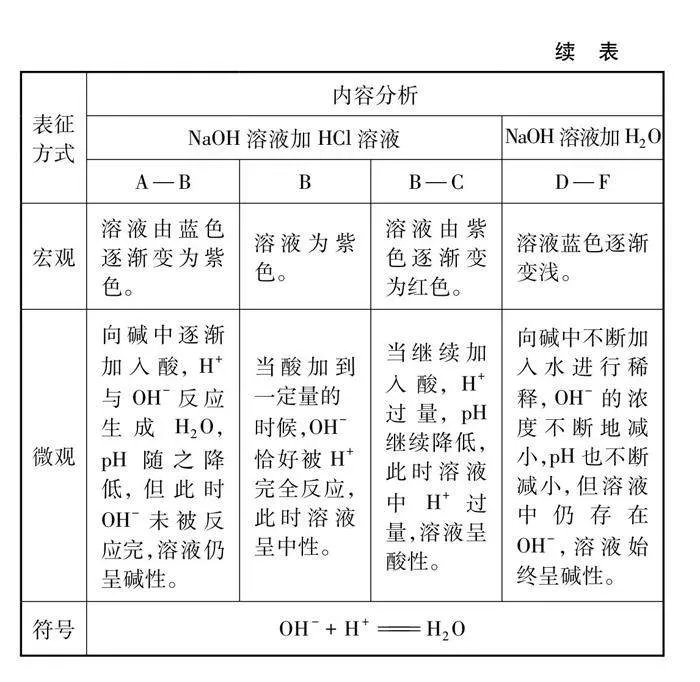
酸碱反应pH变化及对比实验如图3、图4及表1、表2所示。
5.2 酸碱反应电导率的变化及对比实验
酸碱反应电导率变化及对比实验如图5及表3所示。
5.3 酸碱反应温度的变化及对比实验
酸碱反应温度变化及对比实验如图6及表4所示。
6 小结
本文在“四重表征”教学模式框架下,借助数字传感器,从三个不同角度设计了多组对比实验,对酸碱中和反应的本质进行了探究。实验中选择了NaOH和HCl作为研究对象,利用紫色石蕊试液提供宏观变色现象,借助pH、电导率、温度传感器呈现微观变化图像,将宏观现象与变化图像相结合分析酸碱反应的微观本质,同时还设计了多组对照实验,排除反应过程中可能会对学生理解反应本质造成干扰的因素,有助于学生更好地掌握反应本质。本实验操作简单、逻辑清晰、可重复性高,便于教师演示。
参考文献:
[1]刘雁明. 基于大概念的科学探究与化学实验教学——以“酸和碱的中和反应”为例[A]. 广东教育学会2023年度学术讨论会论文集(一)[C]. 广州: 广东教育学会, 2023: 9.
[2]徐立堂, 张贤金, 郑婷婷. 基于科学推理与论证的初中化学教学实践——以“酸和碱的中和反应”为例[J]. 化学教学, 2024, (2): 53~57.
[3]钱扬义, 杜永锋, 李佳等. 掌上实验室(Lab in Hand)的特点及其功能[J]. 电化教育研究, 2003, (10): 59~62.
[4]麦裕华, 钱扬义. “中学化学手持技术数字化实验案例”的多维分析——以钱扬义工作室20年研究的期刊论文为例[J]. 化学教育(中英文), 2020, 41(19): 83~89.
[5]钱扬义, 张积家, 罗秀玲等. 化学概念与化学“学科关键词”的学习与认知[M]. 北京: 科学出版社, 2009: 168~172.
[6]王晓芳, 鹿钰锋, 夏建华. 手持技术数字化实验在我国近20年的研究进展及现状——基于CiteSpace可视化分析[J]. 化学教学, 2021, (4): 32~34.
[7]邹丽丹. 初中化学课堂数字化手持技术的应用——以“酸碱中和反应”为例[J]. 黑龙江教育(教育与教学), 2024, (2): 60~61.
[8]马慧. 化学核心素养导向下的教学设计——以基于手持技术的“酸碱中和反应”为例[J]. 新课程导学, 2023, (2): 77~80.
[9]李文良, 张丽芳. 建构基本观念丰富学生的科学素养——以基于手持技术的“中和反应”教学为例[J]. 中小学教学研究, 2017, (9): 26~29.
[10]彭豪. 基于信息技术的“四重表征”图形化教学设计——以《酸与碱之间会发生什么反应》为例[J]. 中小学信息技术教育, 2010, (9): 58~60.
[11]陈德权. 多重表征理论下初中化学酸碱中和反应教学实践[J]. 智力, 2023, (24): 111~114.
