注射用头孢西丁钠在不同配伍溶液中的稳定性研究
【摘要】目的:考察注射用头孢西丁钠和参比制剂在不同种配伍溶液中的稳定性。方法:采用注射用头孢西丁钠和参比制剂在0.9%氯化钠注射液、5%葡萄糖注射液中进行配伍试验,测定其含量、有关物质、酸度、可见异物、溶液的澄清度与颜色、不溶性微粒、5-羟甲基糠醛在各个时间点的变化,评估自制制剂与配伍溶液的稳定性与参比制剂的一致性。结果:在0 h、3 h、6 h、12 h内,自制制剂与参比制剂变化趋势基本一致。结论:注射用头孢西丁钠在不同配伍溶液中稳定性良好,符合临床用药要求。
【关键词】注射用头孢西丁钠;配伍;稳定性
【DOI编码】10.3969/j.issn.1674-4977.2024.06.010
Stability Study of Cefotaxime Sodium for Injection in Different Compatibility Solutions
HUANG Jian, ZHU Longde
(Haikou Pharmaceutical Factory Co., Ltd., Haikou 570311, China)
Abstract: Objective: To investigate the stability of cefoxitin sodium for injection and reference preparations in different compatibility solutions. Method: A compatibility test is conducted using ceftriaxone sodium for injection and a reference formulation in 0.9% sodium chloride injection and 5% glucose injection. The content, related substances, acidity, visible foreign substances, clarity and color of the solution, insoluble particles, and 5-hydroxymethylfurfural are measured at various time points to evaluate the stability of the self-made formulation and the compatibility solution, as well as the consistency with the reference formulation. Result: Within 0 h, 3 h, 6 h, and 12 h, the trend of changes between the self-made formulation and the reference formulation is basically consistent. Conclusion: Cefotaxime sodium for injection has good stability in different compatibility solutions and meets clinical medication requirements.
Keywords: cefotaxime sodium for injection; compatibility; stability
头孢西丁为头霉素类抗生素,由美国默克(Merck)公司研制,于1978年获FDA批准上市。该药对革兰氏阳性菌的抗菌性能弱,对革兰氏阴性菌作用强,具有高度抗β-内酰胺酶性质,对厌氧菌亦有良好的抗菌作用。临床上,头孢西丁主要用于治疗敏感革兰氏阴性菌的厌氧菌所致下呼吸道、泌尿生殖系统、腹腔、骨和关节、皮肤和软组织等部位感染,也可用于治疗败血症[1]。注射用头孢西丁钠上市以来,具有疗效确切,不良反应轻,有较高临床应用价值等优点。
1仪器与试药
1.1仪器
高效液相色谱仪,紫外分光光度计,澄明度检测仪,智能微粒检测仪,电子天平,pH计,色谱柱。
1.2试剂
磷酸二氢钾,磷酸氢二钠,甲酸铵,甲酸,磷酸,乙腈,甲醇。
1.3样品和对照品
注射用头孢西丁钠自制制剂(海口市制药厂有限公司),参比制剂(葛兰素史克制造公司),0.9%氯化钠注射液,5%葡萄糖注射液。
2过程与结果
2.1试验内容
2.1.1与0.9%氯化钠注射液的配伍试验
1)10 mg/mL质量浓度:取注射用头孢西丁钠1瓶(2.0 g),将20 mL 0.9%氯化钠注射液注入西林瓶内,振摇溶解,全量转移至180 mL的0.9%氯化钠注射液中,在室温条件下放置,分别在0 h、3 h、6 h、12 h取样,对考察项目进行检测。
2)40 mg/mL质量浓度:取注射用头孢西丁钠1瓶(2.0 g),将20 mL 0.9%氯化钠注射液注入西林瓶内,振摇溶解,全量转移至30 mL的0.9%氯化钠注射液中。取3瓶合并至输液瓶中,插入一次性输液器,充满配伍溶液后堵上堵头,在室温条件下放置,分别在0 h、3 h、6 h、12 h取样,对考察项目进行检测。
2.1.2与5%葡萄糖注射液的配伍试验
1)10 mg/mL质量浓度:取注射用头孢西丁钠1瓶(2.0 g),将20 mL 5%葡萄糖注射液注入西林瓶内,振摇溶解,全量转移至180 mL的5%葡萄糖注射液中,在室温条件下放置,分别在0 h、3 h、6 h、12 h取样,对考察项目进行检测。
2)40 mg/mL质量浓度:取注射用头孢西丁钠1瓶(2.0 g),将20 mL 5%葡萄糖注射液注入西林瓶内,振摇溶解,全量转移至30 mL的5%葡萄糖注射液中。取3瓶合并至输液瓶中,插入一次性输液器,充满配伍溶液后堵上堵头,在室温条件下放置,分别在0 h、3 h、6 h、12 h取样,对考察项目进行检测。
2.2测定方法
2.2.1溶液的澄清度与颜色
1)溶液的颜色测定:分别在0 h、3 h、6 h、12 h取相应浓度配伍溶液,按照《中华人民共和国药典》2020年版四部“0401紫外-可见分光光度法”[2],在430 nm的波长处测定吸光度。标准规定:吸光度不得大于0.4。
2)溶液的澄清度测定:分别在0 h、3 h、6 h、12 h取相应浓度配伍溶液进行检测,应澄清;如显浑浊,与浊度标准液比较。标准规定:与1号浊度标准液比较,均不得更浓。
2.2.2可见异物
可见异物测定:分别在0 h、3 h、6 h、12 h取相应浓度配伍溶液,可见异物检查方法进行检查。标准规定:不得检出明显可见异物,微细可见异物应不大于5个/瓶。
2.2.3不溶性微粒
不溶性微粒测定:分别在0 h、3 h、6 h、12 h取相应浓度配伍溶液,根据不溶性微粒检查法检测。标准规定:每个供试品容器中含10μm及10μm以上的微粒不得过6000粒,含25μm及25μm以上的微粒不得过600粒。
2.2.4酸度
酸度测定:分别在0 h、3 h、6 h、12 h取相应浓度配伍溶液进行测定。标准规定:pH值应为4.2~7.5。
2.2.5含量
色谱条件:Agilent ZORBAX Eclipse Plus C18,4.6 mm×250 mm,5μm。检测波长:254 nm;流速:1.0 mL/min;柱温:室温;进样量:10μL。流动相:水-乙腈-冰醋酸(81∶19∶1)。稀释液:pH=7.1磷酸盐缓冲液(取磷酸二氢钾l.0 g和磷酸氢二钠1.8 g,加水900 mL溶解,用磷酸或10 mol/L的氢氧化钠溶液调节pH值至7.1±0.1,加水至1000 mL)。对照品溶液:精密称取头孢西丁对照品约16 mg,置于50 mL量瓶中,加稀释液溶解并稀释至刻度,制得质量浓度为0.3 mg/mL对照品溶液。供试品溶液:1)40 mg/mL质量浓度:精密量取配伍溶液1 mL,置于20 mL量瓶中,加稀释液稀释至刻度,摇匀。精密量取上述溶液3 mL,置于20 mL量瓶中,加稀释液稀释至刻度,制得浓度为0.3 mg/mL溶液。2)10 mg/mL质量浓度:精密量取配伍溶液3 mL,置于100 mL量瓶中,加稀释液稀释至刻度,制得质量浓度为0.3 mg/mL的供试品溶液。标准规定:相对于0 h含量的95%~105%。
2.2.6有关物质
色谱条件:Inertsil Ph-3,4.6 mm×250 mm,3μm。检测波长:254 nm;流速:1.0 mL/min;柱温:35℃;进样量:20μL;样品室温度:8℃。流动相A:甲酸铵溶液(取甲酸铵1.0 g,加水1000 mL溶解,用甲酸调节pH值至2.7)。流动相B:乙腈。稀释液:pH=3.8磷酸盐缓冲液(取磷酸二氢钾27.2 g,加水1000 mL溶解,用稀磷酸调节pH值至3.8)。系统适用性溶液:取头孢西丁峰鉴别对照品1 mg,置于液相进样瓶中,加稀释液1 mL溶解,摇匀,即得(临用新制)。供试品溶液:1)40 mg/mL质量浓度:精密量取供试品溶液5 mL,置于200 mL量瓶中,加稀释液稀释至刻度,制得浓度为1 mg/mL溶液。2)10 mg/mL质量浓度:精密量取供试品溶液1 mL,置于10 mL量瓶中,加稀释液稀释至刻度,制得质量浓度为1 mg/mL的供试品溶液。对照溶液:分别精密量取上述供试品溶液1 mL,置于不同100 mL量瓶中,加稀释液稀释至刻度,摇匀,即得。
2.2.7羟甲基糠醛
色谱条件:Agilent ZORBAX Eclipse Plus C18,4.6 mm×250 mm,5μm。检测波长:284 nm;流速:1.0 mL/min;柱温:室温;进样量:20μL。流动相:水-甲醇(90∶10)。对照品溶液:精密称取5-羟甲基糠醛对照品约10 mg,置于100 mL量瓶中,加水溶解并稀释至刻度,摇匀,精密量取1 mL,置于10 mL量瓶中,加水稀释至刻度,摇匀,即得。供试品溶液:1)40 mg/mL质量浓度:精密量取供试品溶液1 mL,置于20 mL量瓶iVRzGmZxqWo/UM6IyjcHcZNzRw61VZK/XSt/r9OUn/s=中,加5%葡萄糖溶液稀释至刻度,制得质量浓度为2 mg/mL的供试品溶液。2)10 mg/mL质量浓度:精密量取供试品溶液2 mL,置于10 mL量瓶中,加5%葡萄糖溶液稀释至刻度,制得质量浓度为2 mg/mL的供试品溶液。标准规定:含5-羟甲基糠醛不得过葡萄糖标示量的0.02%。
2.3试验结果
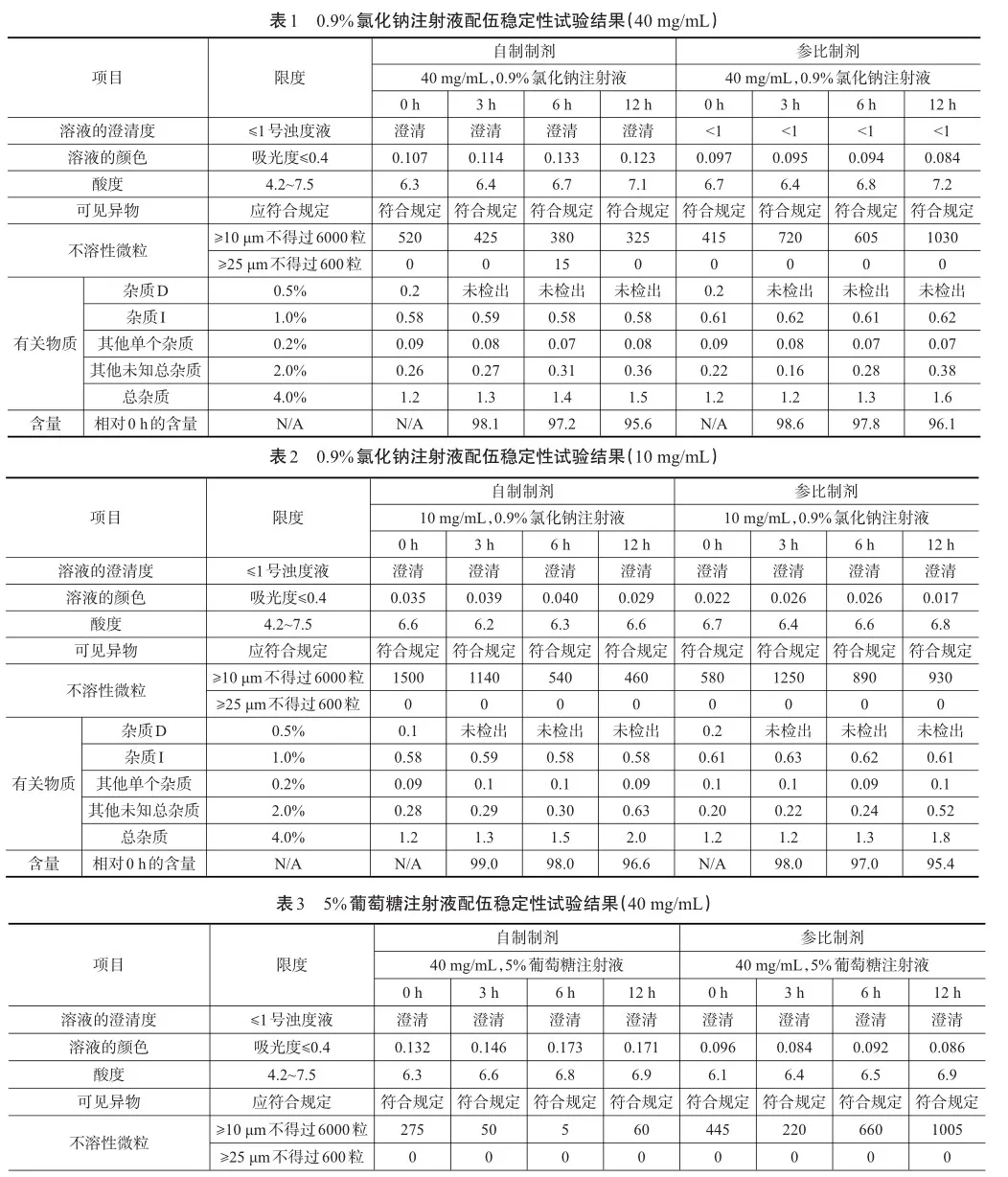
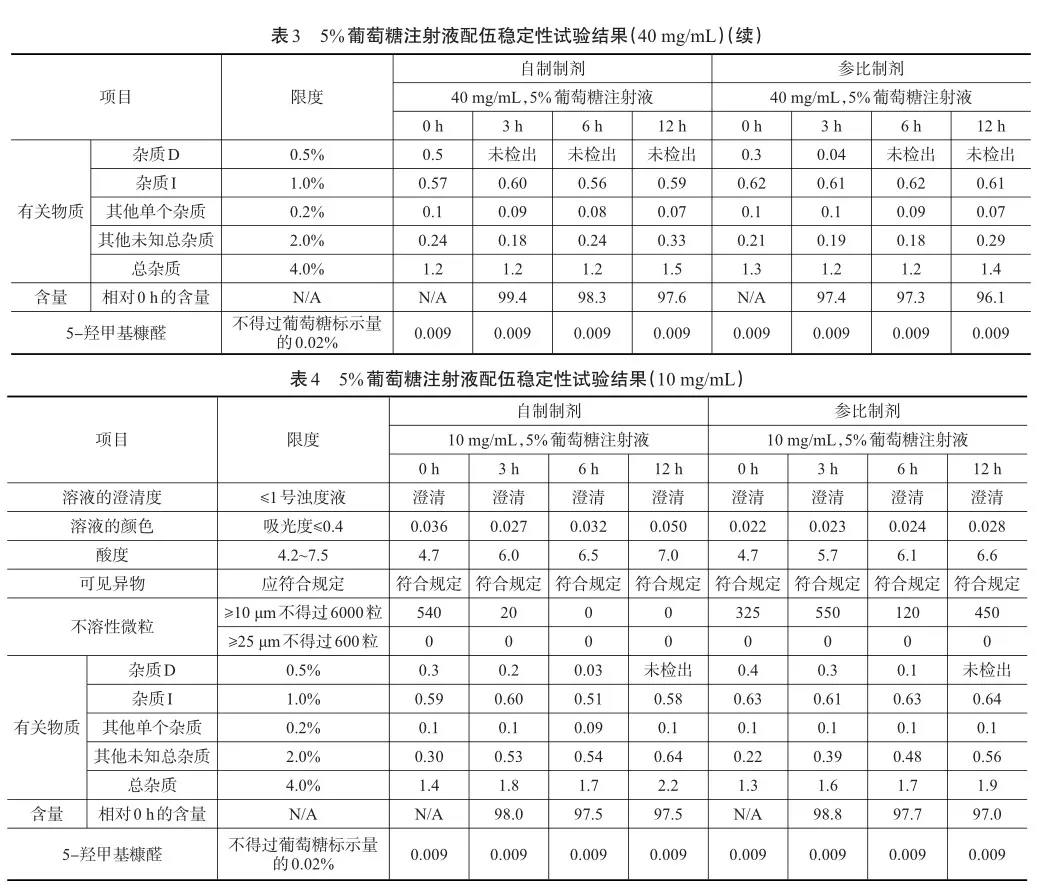
试验结果见表1、表2、表3、表4。
3结果与讨论
根据注射用头孢西丁钠国内上市说明书中的用法用量,选择1批自制样品与1批参比制剂,根据自拟的质量标准进行相应的配伍稳定性试验。在与0.9%的氯化钠溶液和5%葡萄糖注射液配伍放置12 h后,溶液的澄清度、溶液的颜色、可见异物、不溶性微粒、酸度均符合限度要求,自制样品与参比制剂的杂质D均下降至未检出,杂质I、其他单个杂质均无明显变化,其他未知总杂与总杂都呈增幅趋势,相对含量都呈下降趋势,均在合格范围内;在与5%葡萄糖注射液配伍放置12 h后,自制样品与参比制剂的5-羟甲基糠醛含量均约为0.009%,均无明显变化。结果表明,自制样品0 h与12 h各项指标与参比制剂变化趋势基本一致,说明药物配伍使用过程安全,质量可控,符合注射剂的用药要求。
【参考文献】
[1]任淑琴,宋莹,裴菊,等.注射用头孢西丁钠致迟发性血栓性静脉炎2例[J].山西医药杂志,2023,52(10):797-799.
[2]国家药典委员会.中华人民共和国药典:2020年版四部[M].北京:中国医药科技出版社,2020:39-40.
【作者简介】
黄健,女,1989年出生,工程师,学士,研究方向为药品分析。
(编辑:侯睿琪)

