菠菜粉中农药残留能力验证结果分析及检测质量控制探讨
关键词
能力验证 菠菜粉 噻虫嗪 噻虫胺 结果评价 质量控制
0 引言
能力验证作为实验室质量保证的基本元素之一,是判断和监控实验室能力的有效手段,是通过外部措施对实验室内部质量控制程序的补充。能力验证计划的主要用途之一是评价实验室进行检测的能力[1]。能力验证样品的均匀性和稳定性是保证计划有效实施的前提。在样品发放前,组织机构必须对样品进行均匀性检验和稳定性评价,确保用于能力验证的样品都是均匀一致且稳定可靠的,更真实地反应各参加机构的检测能力[2-6]。
此次能力验证的测试项目为菠菜粉中噻虫嗪和噻虫胺。噻虫嗪和噻虫胺都属于新烟碱类药物,是一类高效安全、高选择性的新型杀虫剂,既可用于茎叶处理和土壤处理,又可用于种子处理,具有杀虫谱广、活性高、作用速度快、持效期长等特点[7,8]。尽管噻虫嗪、噻虫胺属于低毒农药,易光解,在土壤中残留时间较短, 但是目前还存在着许多农民在使用农药的过程中不注意科学合理用药,为达到短期效果盲目加大使用剂量,施药后马上采收等问题,这是导致噻虫嗪、噻虫胺在农产品中含量超标的一个重要原因[9]。
GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》中规定,噻虫胺在食品中最大残留限量为0.01 mg/kg~10 mg/kg,其中叶菜类蔬菜为2mg/kg;噻虫嗪在食品中最大残留限量为0.01mg/kg~10mg/kg,其中菠菜为5 mg/kg[10]。同时,在2021年~2023年国家食品安全监督抽检细则中,蔬菜水果类中噻虫嗪、噻虫胺也是必检项目。因此在具有检测能力的实验室中开展“菠菜粉中噻虫嗪、噻虫胺测定”的能力验证非常必要。
我中心组织的“菠菜粉中噻虫嗪、噻虫胺的测定”项目中,全国共有28家机构参加,本文对此次能力验证活动的检测结果进行了统计分析,并对机构中存在的一些问题提出建议,对部分技术问题进行了讨论,可以促进实验室保持和提升相应的检测能力,更好地提升食品检测过程中质量控制水平。
1 材料与方法
1.1 能力验证样品
本次能力验证方案的设计遵循GB/T 27043—2012《合格评定 能力验证的通用要求》。采用A、B两组浓度水平的样品设计,每个实验室将随机获得A、B两组样品。在阴性菠菜糊中添加配制好预定浓度的噻虫嗪、噻虫胺标准溶液,A样品设计浓度特性值区间范围为0.08 mg/kg~0.25mg/kg,B样品设计浓度特性值区间范围为0.14mg/kg~0.45mg/kg,利用搅拌机充分搅拌均匀后,采用真空冷冻干燥工艺冻干制备样品,使用铝箔袋包装样品,每袋约10 g,共获得A样品101袋,B样品93袋。于常温保存。
1.2样品均匀性考察
根据CNAS-GL 003:2018《能力验证样品均匀性和稳定性评价指南》[11]中的要求,对样品的均匀性和稳定性进行检验。试验采用检测方法为GB 23200.39—2016《食品安全国家标准 食品中噻虫嗪及其代谢物噻虫胺残留量的测定 液相色谱-质谱/质谱法》[12],仪器为液质联用仪。
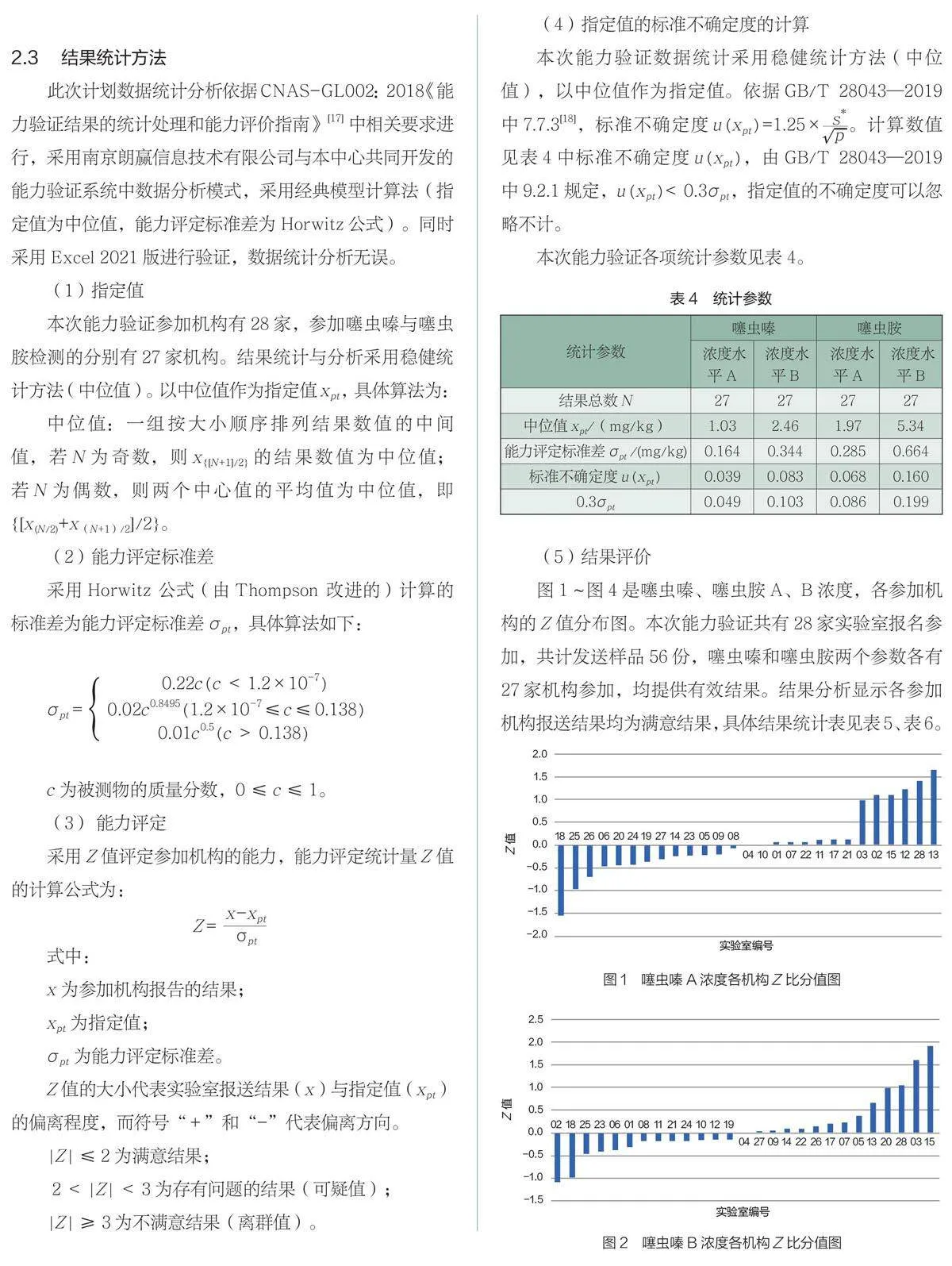
2 结果与分析
2.1 样品制备工艺
能力验证样品必须保证其均匀性和稳定性。在以往的样品制备过程中,我们发现,农药标准溶液加入蔬菜糊中,机械搅拌均匀后分装入塑料离心管中,后期蔬菜糊样品容易分层,影响样品中农药的稳定性。同时有文献显示,噻虫嗪、噻虫胺稳定性与溶液的pH、温度以及光照因素有关[13-16] 。因此,本次能力验证,样品制备采用菠菜冻干粉,铝箔袋包装模式,既避光,又可以保证样品稳定性,同时也便于快递运输。
2.2 样品均匀性和稳定性考察
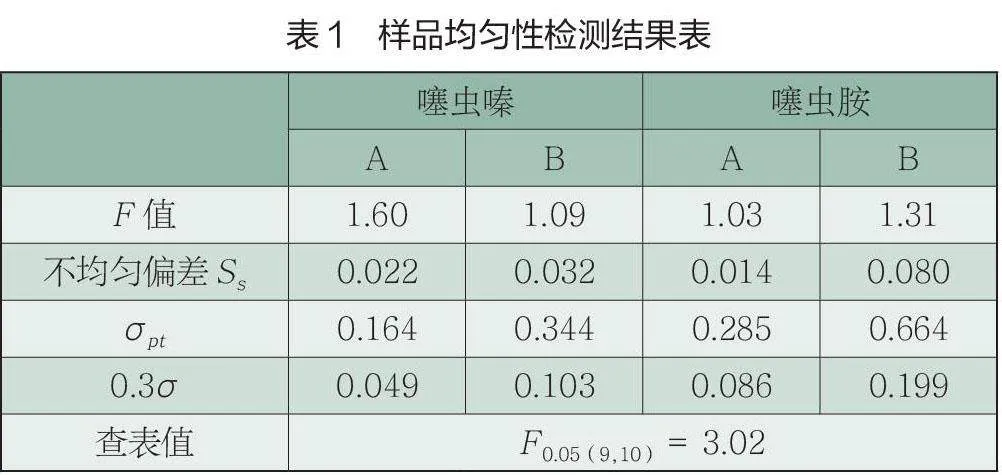
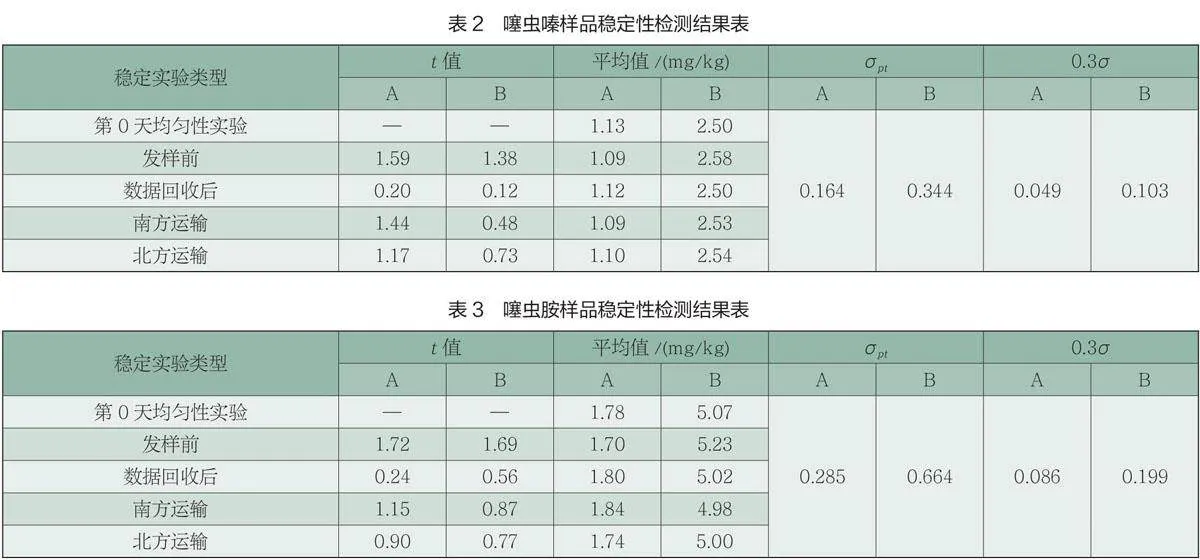
(1)均匀性分析。样品均匀性检测采用单因子方差分析法,通过F检验对样品进行均匀性检验。当测定结果的F值小于临界值时, 认为样品是充分均匀的。当参加机构检测数据回收后,采用不均匀偏差Ss≤0.3σ进行均匀性验证。若Ss≤0.3σ,则表明样品间无显著性差异,样品是均匀的。每个浓度的样品随机抽取10个样品,每个样品平行测定2次。样品均匀性检测结果见表1。
由表1可见,均匀性检测中,噻虫嗪、噻虫胺F值均小于F临界值,表明0.05显著性水平时,样品是均匀的。同时不均匀性偏差Ss验证,Ss均小于0.3σ,表明此次能力验证计划样品中噻虫嗪、噻虫胺是均匀的。
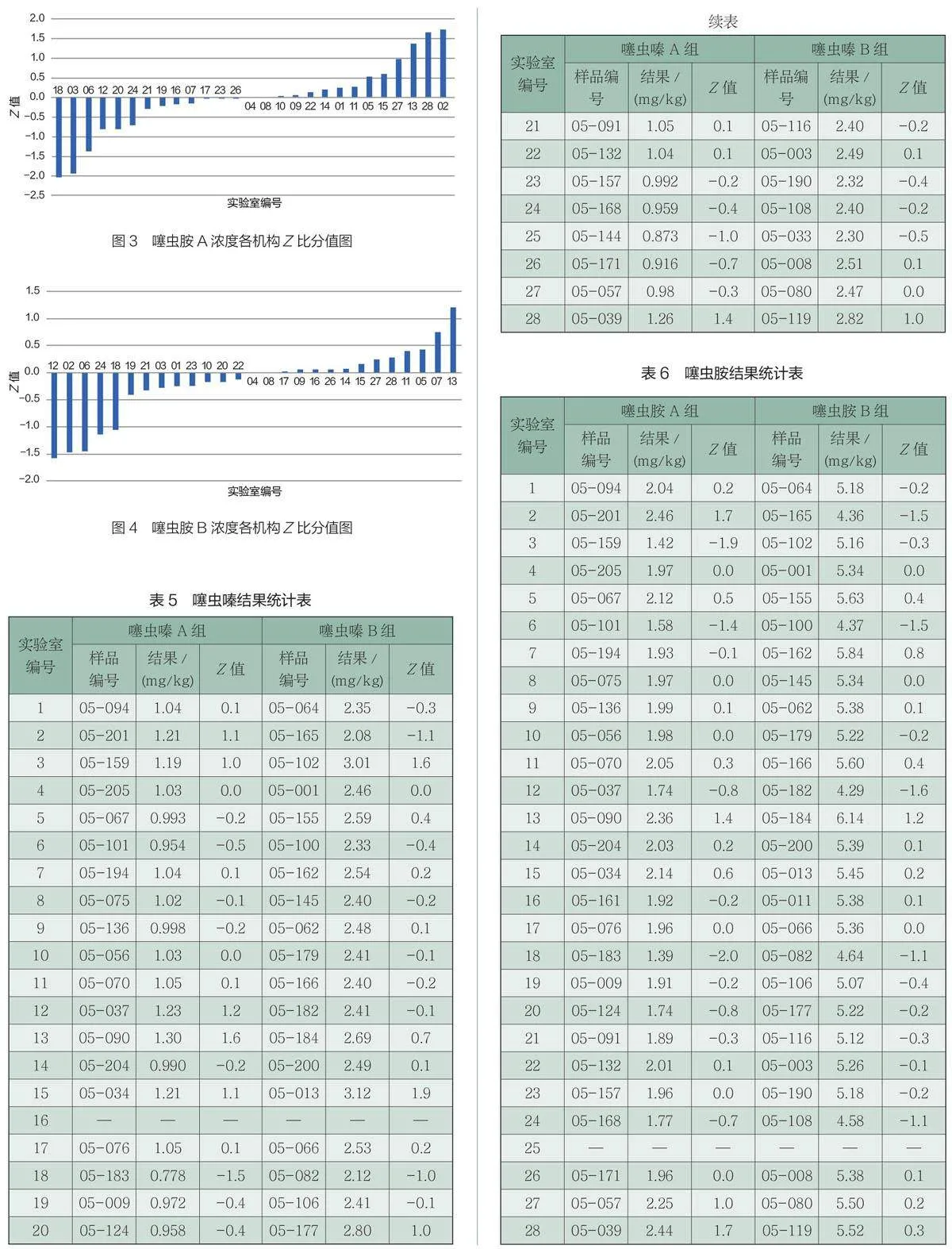
(2)稳定性分析。采用t检验法,每个浓度抽取3个样本,平行测定2次,考察样品与样品制备当天均匀性检测数值的一致性。当t值小于95%置信区间查表值时,表明样品是稳定的。本文中稳定性实验既有模拟运输的短期稳定性试验也有常温条件下长期稳定性试验,涵盖了发样前,结果回收后阶段,保证能力验证计划运行期间(共计78天),样品中被测物质是稳定的。同时,当各机构数据回收后,将统计分析得出的标准偏差σ,对每次稳定性(运输稳定性和长期稳定性)检测数据进行验证。稳定性检测获得均值̅̅,与均匀性检验的均值 ̅的差值的绝对值除以参加实验室检测数据汇总统计得出的标准偏差σ,以比值小于0.3为原则验证样品的稳定性。若|̅−̅̅|≤0.3σ则表明样品在各种稳定性考察中是稳定的。噻虫嗪、噻虫胺样品稳定性检测结果见表2、表3。
表2与表3表明,稳定性检测中,噻虫嗪、噻虫胺各浓度样品,t值均小于t0.05(24)= 2.064;同时,使用|̅−̅|≤0.3σ进行样品稳定性验证,各阶段差值的绝对值均小于0.3σ。说明样品中的噻虫嗪、噻虫胺在此次能力验证周期内是稳定的。
3 结论与讨论
3.1 存在的问题
从此次能力验证回收的图谱和方法信息单显示,有些机构检测过程中还存在一些问题。
(1)忽视基质效应,未进行相应校正
此次能力验证77.8%的机构选择检测方法为GB 23200.121—2021《食品安全国家标准 植物源性食品中331中农药及其代谢物残留量的测定 液相色谱-质谱联用》[19];18.5%的机构选择检测方法为GB 23200.39—2016《食品安全国家标准 食品中噻虫嗪及其代谢物噻虫胺残留量的测定 液相色谱-质谱/质谱》;3.7%的机构选择检测方法为GB/T 20769—2008《水果和蔬菜中450种农药及其相关化学品残留量的测定 液相色谱-串联质谱法》[20]。这三种方法使用的定量方法均为空白基质液配制的校正曲线,外标法定量。蔬菜中存在各种有机的、无机的杂质以及一些色素,以上三种方法均为几百种农残的通用方法,其前处理较为简单,针对性不强,并且,质谱作为最终的检测仪器,其基质效应受溶剂影响较大,因此在检测噻虫嗪和噻虫胺过程中,其基质效应不可避免,但部分机构使用的是溶剂配制曲线,忽视了基质效应,最终可能影响定量结果。
(2)定量校正曲线存在问题
有些机构选用的基质空白不合适,干扰严重,校正曲线低浓度点响应存在干扰,而考核样品的浓度处于低浓度点位置,可能会导致定量结果不准确。还有些机构采用单点校正方式,该点的浓度水平与考核样品浓度有较大差距,可能会导致定量结果不准确。
(3)加标回收率不符合要求
所有机构质控方式均采用了加标回收,但有些机构的加标样品响应超过校正曲线的线性范围;有些机构的加标回收率不符合GB/T 27404—2008[21]中F.1回收率范围要求(占比为37.0%);有些机构的添加量不合适,没有根据考核样品数值及时调整添加回收量,要么依据日常检测,添加低浓度水平,要么添加超高浓度水平,不能很好地利用添加回收率来校准考核样品数值。这些问题表明过程中的添加回收没有起到很好的质量控制的效果,表明检测人员不清楚质量控制规范的要求。
(4)色谱柱维护不到位
有些机构的色谱峰拖尾严重,峰宽大于1.5 min(占比25.9%),影响积分计算结果。说明在日常检测中,检验员对于色谱柱柱效下降敏感度不够,可能会导致色谱积分存在问题。
(5)记录信息问题
有些机构提供的方法信息单中,信息缺漏严重(检测标准编号、称样量、定性定量离子对信息……);还有些机构提供的原始图谱中缺少校正曲线;有的机构原始图谱与方法信息单中信息不一致(称样量、色谱柱信息、流动相流速……), 这些问题虽不会对机构的最终结果造成影响,但表明检验员对于记录信息的完整性认识不够,缺乏严谨的态度。
3.2 技术建议
(1)加强人员培训人员是检测过程的第一主体, 检测人员的能力直接关系到检测结果的准确度和可靠性[22,23]。各机构应加强人员培训,并加强检测各环节中的人员监督,确保检测人员熟悉实验室体系文件,检测方法标准原理和操作步骤,并且不能随意更改检测标准。同时,对于能力验证中的作业指导书,也需要仔细学习,数据上报过程中应严谨填写各表格。
(2)检测仪器和色谱柱的维护实验室的检测设备必须处于有效的检定/校准周期内,并处于正常工作状态中,及时发现仪器和色谱柱的异样,做好日常维护,以免影响检测结果。
(3)选择合适的质控方式农药残留检测存在着样品基质复杂,检测参数繁多等问题,日常检测过程中,面临着基质干扰等因素影响检测最终结果。很多机构会选择使用加标回收或购买质控样方式作为内部控制检测质量的手段。但需要注意建立基质校正曲线时的基质选取需合适,本底干扰不能太多;加标样品的回收率应遵循检测标准要求,过高过低都不利于校正检测结果;质控样需选取同种类别基质中的相应参数,并且需严格按其证书要求对样品进行保存,防止样品变质而影响检测结果。

