玉米自交系叶绿素代谢对热胁迫的响应特征




摘要: 【目的】阐明热胁迫下玉米叶绿素代谢的调控机制,为玉米耐热研究提供科学依据。【方法】以耐热玉米自交系HZ4 和热敏感自交系L9K 为材料,于喇叭口至开花期进行热胁迫处理,每隔5 d 取样1 次,共取样6 次,测定叶绿素及其前体物质的含量,采用RT-qPCR 测定相关基因的相对表达量。【结果】热胁迫导致HZ4 和L9K 叶片中叶绿素a、叶绿素b、总叶绿素及其合成前体物质原卟啉Ⅸ (protoporphyrin Ⅸ,Proto Ⅸ)、镁原卟啉Ⅸ (Mg-protoporphyrin Ⅸ,MgP Ⅸ) 和原叶绿素酸酯(protochlorophyllide,Pchlide) 的含量显著下降,δ-氨基乙酰丙酸(δ-aminolevulinic acid,ALA) 和单卟啉胆色素原(porphobilinogen,PBG) 的含量显著升高,且HZ4 的变化幅度小于L9K。6 个叶绿素合成相关基因(PBGD、UROD、MgPMT、POR、CHLG、CAO) 的表达量显著下调,且在HZ4 中的表达量显著高于在L9K 中的表达量;4 个叶绿素降解相关基因(CBR、CLH、PPH、PAO) 的表达量显著上调,且在HZ4 中的表达量显著低于在L9K 中的表达量。【结论】热胁迫通过下调叶绿素合成基因和上调叶绿素降解基因的表达,导致叶绿素含量下降。阻碍位点在PBG 向Proto Ⅸ转化阶段,其主要原因是PBGD 和UROD 基因下调表达。基因差异表达是耐热型和热敏感型玉米叶绿素含量存在差异的分子机制。
关键词: 玉米自交系;热胁迫;叶绿素代谢;基因
中图分类号: S513.01 文献标志码: A 文章编号: 1004–390X (2024) 05−0001−09
玉米是中国重要的粮饲兼用作物,其产量占全年粮食总产量的40%。近几十年来,全球气候变暖加速[1],中国6—8 月的极端高温天气频发,导致夏玉米因高温而严重减产[2]。高温热害已成为限制夏玉米高产稳产的主要非生物胁迫因子。叶绿素是植物光合作用的主要色素,其含量与光合作用正相关[3]。热胁迫导致玉米叶片叶绿素含量下降[4],叶绿素合成减缓、降解加速,进而影响玉米生长发育[5]。叶绿素的生物合成是一系列复杂的生化反应过程,从谷氨酸(glutamic acid,Glu) 到叶绿素a 和叶绿素b 的生成需经过15 个酶催化反应步骤[6]。叶绿素合成相关酶基因的转录调控对叶绿素的生物合成至关重要[7]。叶绿素分解代谢是绿色植物的重要生理活动,包括叶绿素b 转变为叶绿素a、脱镁反应、脱植醇基反应和卟啉开环反应,涉及多种酶的参与[8]。热胁迫通过诱导叶绿素分解基因CLH 和PAO 的上调表达,加速叶绿素降解[9]。近年来,玉米热胁迫研究多集中于热胁迫对玉米的农艺性状、生理生化、产量和品质的影响等方面,对叶绿素代谢分子机制的研究相对较少。WU 等[10]研究表明:叶绿素代谢相关基因参与了玉米对热胁迫的应急反应,且玉米自交系HZ4 的耐热性优于L9K。本研究以玉米耐热自交系HZ4 和热敏感自交系L9K 为试验材料,通过人工热胁迫试验,测定热胁迫下HZ4 和L9K 中叶绿素及其前体物质的含量变化,分析叶绿素代谢相关基因的表达特征,阐明热胁迫下玉米叶绿素代谢的分子机制,为玉米耐热机理的研究提供理论依据。
1 材料与方法
1.1 试验地概况
试验于2022 年5—7 月在安徽农业大学农萃园(31°52′28″N,117°15′27″E) 进行。试验地土壤为黄棕壤,有机质含量19.37 g/kg,全氮含量1.23 g/kg,速效磷含量11.44 g/kg,速效钾含量182.54 mg/kg。试验地点属于亚热带湿润季风气候,年均气温15.7 ℃,年均降水量1 000 mm,年日照时间约2 000 h。
1.2 试验材料
供试材料为玉米自交系HZ4 和L9K,由安徽农业大学玉米抗逆育种与栽培实验室提供。HZ4 是由唐山四平头农家种选育出的耐热型玉米自交系,L9K 是由旅大红骨子农家种选育出的热敏感型自交系[10]。这些自交系在玉米育种和抗逆性研究中具有重要的应用价值。
1.3 试验设计
试验采用随机区组设计,设置自然温度处理组(对照组,CK) 和热胁迫处理组(heat stress,HS),即:2 个玉米自交系的对照组和热胁迫组分别编号为HZ4 (CK) 和HZ4 (HS)、L9K (CK) 和L9K (HS)。各组分别种植在2 个独立的智能温室内,采用相同的田间管理模式。播种行距为0.50 m,株距为0.25 m,底肥施用氮磷钾复合肥(mN∶mP2O5∶mK2O=10∶5∶1) 600 kg/hm2, 于5叶期追肥施用尿素300 kg/hm2。试验于2022 年5 月11 日播种,6 月22 日喇叭口期开始进行热胁迫。CK 组温室通风窗始终开启,保持室内外气温一致。HS 组每日 9:0 0—16:0 0 关闭温室通风窗,进行热胁迫处理;16:0 0—次日 9:0 0 则开启通风窗, 保持室内外气温一致。试验期间每天 12:0 0 和 18:0 0 测定智能温室内的温度(图1)。在热胁迫处理的第0、5、10、15、20 和25 天 12:0 0 取样,剪下心叶以下第 2 片完全展开的叶片。样品分为2 个部分,一部分立即放入装有冰袋的保温箱中,用于测定叶绿素及其前体物质的含量;另一部分立即放入液氮速冻,带回实验室后放入−80 ℃ 冰箱保存,用于基因表达量的测定。
1.4 叶绿素及其前体物质含量的测定
(1) 叶绿素含量采用分光光度法测定[11]。称取鲜叶0.1 g,剪碎后置于25 mL 容量瓶中,用80%丙酮溶液定容,避光密封浸泡48 h,每12 h 摇匀1 次;待叶片完全褪绿后,使用紫外分光光度计测定。
(2) δ-氨基乙酰丙酸(δ-aminolevulinic acid,ALA)含量采用DEI[12]的方法测定。称取鲜叶0.3 g,用液氮研磨后加入4% 三氯乙酸提取液10.00 mL,10 000 r/min 离心10 min;取上清液5.00 mL,加入乙酰丙酮0.15 mL 和 1 mol/L 醋酸钠溶液2.35 mL,在沸水中加热10 min;冷却至室温后,取溶液1.00 mL 与 Ehrlich-Hg 显色剂1.00 mL 混合,避光放置15 min 后,使用紫外分光光度计测定。
(3) 单卟啉胆色素原(porphobilinogen,PBG)含量采用PENG 等[13]的方法测定。称取鲜叶0.5 g,液氮研磨后加入 0.6 mol/L Tris-HCl (pH 8.0) 5.00 mL和 0.1 mol/L EDTA 溶液5.00 mL,10 000 r/min 离心10 min;取上清液1.00 mL,加入 Ehrlich-Hg 显色剂1.00 mL,避光放置15 min 后,使用紫外分光光度计测定。
(4) 原卟啉Ⅸ (protoporphyrin Ⅸ,Proto Ⅸ)、镁原卟啉Ⅸ(Mg-protoporphyrin Ⅸ,MgP Ⅸ) 和原叶绿素酸酯(protochlorophyllide,Pchlide) 含量采用HODGINS 等[14]的方法测定。称取鲜叶0.5 g,液氮研磨后加入 80% 丙酮—氨水混合液5.00 mL,10 000 r/min 离心15 min,使用紫外分光光度计测定。
1.5 基因引物设计和相对表达量的RT-qPCR 测定
根据课题组前期的转录组数据[10]以及本研究的叶绿素及其前体物质测定结果,选择10 个与叶绿素代谢相关的基因进行RT-qPCR 表达量的测定。基因序列从NCBI 基因库(https://www.ncbi.nlm.nih.gov/) 下载,并使用Oligo 7 软件设计引物(表1)。将样品从−80 ℃ 冰箱中取出,剪取鲜叶100 mg,使用Trizol 法提取玉米叶片总RNA,提取总量约50 μL。RNA 质检合格后,采用反转录试剂盒(Novoprotein) 将提取的玉米叶片总RNA反转录为cDNA。使用实时荧光定量PCR 仪(BioradCFX96,美国) 进行RT-qPCR。反转录产物作为模板,使用实时荧光定量PCR 试剂盒(Novoprotein)进行扩增。反应体系总体积为20.0 μL,包括2×SYBR qPCR Mix 10.0 μL,上、下游引物各0.8 μL,cDNA 模板0.5 μL 和Rnase-free H2O7.9 μL。 反应程序为: 94 ℃ 2 min, 94 ℃ 15 s, 60 ℃15 s 和72 ℃ 20 s,循环40 次。设置溶解曲线评估引物特异性,每个样本重复检测3 次,以玉米肌动蛋白基因(Actin) 为内参基因,CK 组作为对照。基因相对表达量通过2−ΔΔCt 法计算,即ΔCt =Ct (目标基因)−Ct (内参基因),ΔΔCt = ΔCt (HS)−ΔCt (CK),基因相对表达量=2−ΔΔCt。
1.6 数据处理与统计分析
采用SPSS 23.0 进行方差分析和多重比较,显著性水平设定为Plt;0.05;使用Excel 2019 制图。
2 结果与分析
2.1 叶绿素及其合成前体物的含量
2.1.1 叶绿素
由图2 可知:HZ4 (CK) 和L9K (CK) 的叶绿素a、叶绿素b 和总叶绿素的含量在试验期间均呈近似抛物线的变化趋势,即先缓慢上升后又缓慢下降,且HZ4 (CK) 始终高于L9K (CK)。HZ4(HS) 的叶绿素a、叶绿素b 和总叶绿素的含量在热胁迫期间总体呈缓慢下降的趋势;叶绿素a 和总叶绿素的含量在热胁迫20 d 时达到最低值,之后略有回升;热胁迫25 d 时,叶绿素a、叶绿素b 和总叶绿素的含量分别较其CK 处理下降了15.84%、 22.58% 和17.42%。 L9K (HS) 的叶绿素a、叶绿素b 和总叶绿素的含量在热胁迫期间呈先小幅上升后持续下降的趋势,热胁迫25 d 时分别较其CK 处理下降了44%、53.85% 和46.53%。虽然HZ4 (HS) 和L9K (HS) 的叶绿素含量在热胁迫期间的变化趋势相似,但L9K (HS) 的叶绿素下降幅度显著大于HZ4 (HS)。
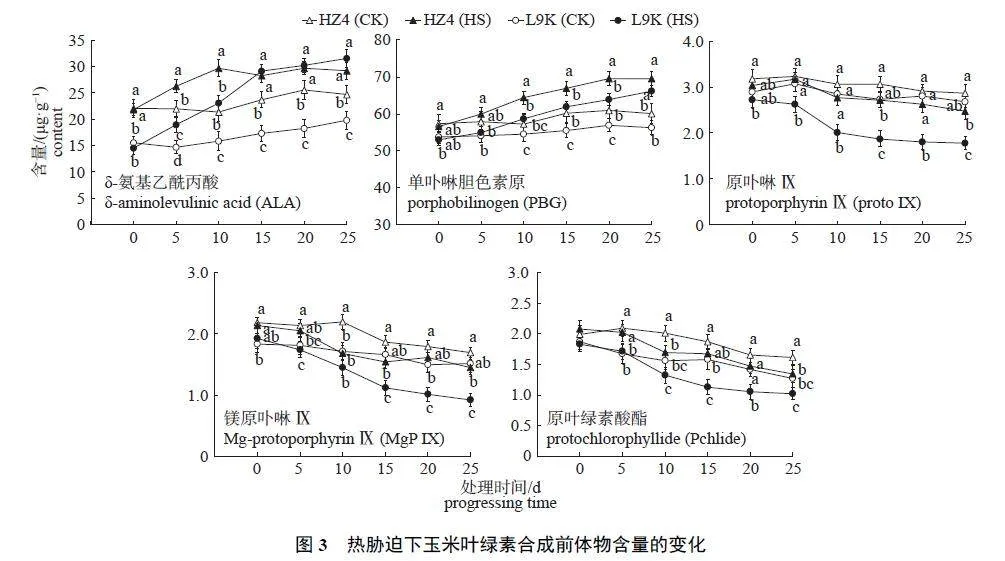
2.1.2 叶绿素合成前体物
由图3 可知:HZ4 (CK) 和L9K (CK) 的ALA含量在试验期间总体呈缓慢上升趋势,且HZ4(CK) 始终高于L9K (CK)。HZ4 (HS) 和L9K (HS)的ALA 含量在热胁迫期间均呈上升趋势;HZ4(HS) 的ALA 含量在热胁迫10 d 时达到最高值,之后保持在较高水平波动,热胁迫25 d 时较其CK 处理上升了18.26%;L9K (HS) 的ALA 含量在热胁迫15 d 时超过HZ4 (HS),热胁迫25 d 时较L9K (CK) 上升了59.15%。
HZ4 (CK) 和L9K (CK) 的PBG 含量在热胁迫期间变幅较小,HZ4 (CK) 的PBG 含量略高于L9K (CK)。HZ4 (HS) 和L9K (HS) 的PBG 含量在热胁迫期间均呈缓慢上升趋势,且HZ4 (HS) 的PBG 含量始终高于L9K (HS)。热胁迫25 d 时,HZ4 (HS) 和L9K (HS) 的PBG 含量分别较各自CK处理增加了15.73% 和17.64% (图3)。
由图3 还可知:HZ4 (CK) 和L9K (CK) 的ProtoⅨ含量在试验期间呈缓慢下降的趋势,且HZ4(CK) 的含量始终略高于L9K (CK)。HZ4 (HS) 的Proto Ⅸ含量在热胁迫期间呈先小幅上升后缓慢下降的趋势;而L9K (HS) 的Proto Ⅸ含量则表现出“慢—快—慢”的下降趋势,即在0~5 d 期间缓慢下降,5~10 d 期间快速下降,10~25 d 期间再次缓慢下降。热胁迫25 d 时,HZ4 (HS) 和L9K(HS) 的Proto Ⅸ含量分别较各自的CK 处理下降了13.64% 和33.58%。
HZ4 (CK) 和L9K (CK) 的MgP Ⅸ含量在试验期间总体呈下降趋势,HZ4 (CK) 的MgP Ⅸ含量仅在热胁迫10 d 时略有上升,且始终略高于L9K (CK)。HZ4 (HS) 和L9K (HS) 的Proto Ⅸ含量在热胁迫期间均持续下降,且L9K (HS) 的降幅大于HZ4 (HS)。热胁迫25 d 时,HZ4 (HS) 和L9K (HS) 的MgP Ⅸ含量分别较各自的CK 处理下降了14.20% 和39.07% (图3)。
图3 显示:HZ4 (CK) 的Pchlide 含量在试验期间先小幅上升后持续下降;而L9K (CK) 的Pchlide 含量总体呈持续下降趋势,且HZ4 (CK)的含量始终略高于L9K (CK)。HZ4 (HS) 和L9K(HS) 的Pchlide 含量在热胁迫期间持续快速下降,且HZ4 (HS) 的含量始终高于L9K (HS)。热胁迫25 d 时,HZ4 (HS) 和L9K (HS) 的Pchlide 含量分别较各自的CK 处理下降了16.77% 和19.69%。
2.2 玉米叶绿素代谢相关基因的表达量
2.2.1 叶绿素合成相关基因
由图4 可知:在热胁迫期间,HZ4 (HS) 和L9K (HS) 的PBGD 基因相对表达量均显著下调,且在热胁迫5~25 d 期间,L9K (HS) 的表达量始终低于HZ4 (HS)。热胁迫25 d 时,HZ4 (HS) 和L9K(HS) 的PBGD 基因相对表达量分别较各自的CK处理下调了44.55% 和66.34%,其中L9K (HS) 的下调幅度显著高于HZ4 (HS)。
在热胁迫期间, HZ4 (HS) 和L9K (HS) 的UROD 基因相对表达量均显著下调,且L9K (HS)的表达量始终低于HZ4 (HS)(图4)。热胁迫25 d时,HZ4 (HS) 和L9K (HS) 的UROD 基因相对表达量分别较各自的CK 处理下调了25.74% 和56.44%,且L9K (HS) 显著低于HZ4 (HS)。
由图4 还可知:在热胁迫期间,HZ4 (HS)和L9K (HS) 的MgPMT 基因相对表达量均显著持续下调,且L9K (HS) 的表达量始终显著低于HZ4(HS)。热胁迫25 d 时,HZ4 (HS) 和L9K (HS) 的MgPMT 基因相对表达量分别较各自的CK 处理下调了39.25% 和67.96%。
由图4 可知:在热胁迫期间,HZ4 (HS) 和L9K (HS) 的POR 基因相对表达量均显著持续下调,且在热胁迫10~25 d 期间,L9K (HS) 的表达量显著低于HZ4 (HS)。热胁迫25 d 时,HZ4 (HS)和L9K (HS) 的POR 基因相对表达量分别较各自的CK 处理下调了45.63% 和69.00%。
在热胁迫期间, HZ4 (HS) 和L9K (HS) 的CAO 基因相对表达量均显著持续下调,且L9K(HS) 的表达量始终低于HZ4 (HS)(图4)。热胁迫25 d 时,HZ4 (HS) 和L9K (HS) 的CAO 基因相对表达量分别较各自的CK 处理下调了25.74% 和51.00%。
由图4 还可知:在热胁迫期间,HZ4 (HS) 和L9K (HS) 的CHLG 基因相对表达量均持续下调,且L9K (HS) 的表达量始终显著低于HZ4 (HS)。热胁迫25 d 时,HZ4 (HS) 和L9K (HS) 的CHLG基因表达量分别较各自的CK 处理下调了24.75%和49.00%。
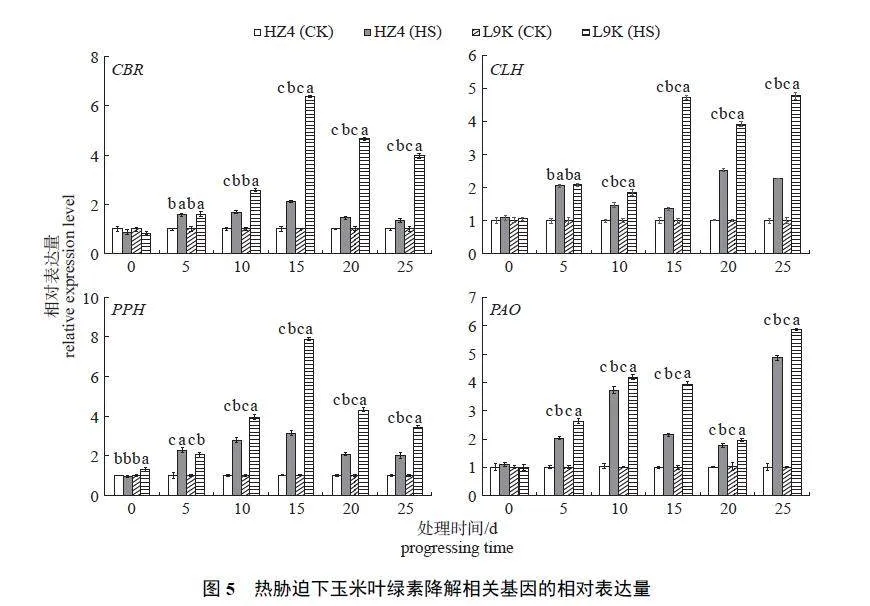
2.2.2 叶绿素降解相关基因
由图5 可知:在热胁迫期间,HZ4 (HS) 和L9K (HS) 的CBR 基因相对表达量均呈先上调后下调的抛物线形,但二者又有所不同。HZ4 (HS)的CBR 基因相对表达量在热胁迫15 d 时达到最高值,为HZ4 (CK) 的2.11 倍,之后缓慢下调;而L9K (HS) 的CBR 基因相对表达量在热胁迫15 d时迅速上调,为L9K (CK) 的6.37 倍,之后缓慢下调。在热胁迫10~25 d 期间,L9K (HS) 的CBR基因相对表达量始终显著高于HZ4 (HS)。
由图5 还可知:在热胁迫期间,HZ4 (HS) 的CLH 基因相对表达量呈波动式上调;而L9K (HS)的CLH 基因相对表达量在热胁迫0~10 d 缓慢上调,热胁迫15 d 时迅速上调至CK 处理的4.73倍,之后在较高水平波动表达。在热胁迫10~25 d期间,L9K (HS) 的CLH 基因相对表达量始终显著高于HZ4 (HS)。
在热胁迫期间, HZ4 (HS) 和L9K (HS) 的PPH 基因相对表达量均呈近似抛物线形,即先上调后下调(图5)。在热胁迫15 d 时,HZ4 (HS) 和L9K (HS) 的PPH 基因相对表达量均达到最高值,分别为各自CK 处理的3.13 倍和6.37 倍,随后均下调表达;在热胁迫10~25 d 期间,L9K (HS) 的PPH 基因相对表达量始终显著高于HZ4 (HS)。
由图5 可知:在热胁迫期间,HZ4 (HS) 和L9K (HS) 的PAO 基因相对表达量均呈波动式上调,即先上调后下调再上调。在热胁迫的5~25 d期间,L9K (HS) 的PAO 基因相对表达量显著高于HZ4 (HS)。在热胁迫25 d 时,HZ4 (HS) 和L9K(HS) 的PAO 基因相对表达量分别为各自CK 处理的4.87 倍和5.87 倍。
3 讨论
3.1 热胁迫对玉米叶绿素合成通路的影响
在热胁迫下,耐热型玉米比热敏感型玉米具有较高的叶绿素含量[15]。本研究中,热胁迫导致HZ4 (HS) 和L9K (HS) 的叶绿素a、叶绿素b 及总叶绿素含量均较对照组显著下降,且在热胁迫后期,L9K (HS) 的叶绿素含量显著低于HZ4 (HS),表明高温对L9K 叶绿素合成的影响更为严重,进一步证明HZ4 对高温具有更强的耐受性,而L9K对高温则较为敏感。叶绿素的生物合成需通过Glu→ALA→PBG→Proto Ⅸ→MgP Ⅸ→Pchlide→叶绿素a→叶绿素b 的途径,其中任一反应位点受阻,都会影响叶绿素的生物合成[16]。ALA 是叶绿素形成的关键前体物,其合成是叶绿素合成通路中的限速步骤[17-18]。PBG 合成速率受限于ALA的合成速率,MgP Ⅸ是四吡咯生物合成的关键节点[19]。本研究发现:在热胁迫过程中,HZ4 和L9K 中叶绿素合成前体物ALA 和PBG 的含量显著高于对照组,而Proto Ⅸ、MgP Ⅸ和Pchlide 的含量则低于或显著低于对照组,表明热胁迫影响了PBG 向Proto Ⅸ的转化,这与向丽霞等[20]的研究结果一致。然而,目前对于逆境胁迫下植物叶绿素合成受阻位点的认识仍存在分歧。SANTOS[21]认为:在盐胁迫下,向日葵的叶绿素含量下降是由于叶绿体基质中Glu 向ALA 转化受阻。彭倩等[22]研究表明:在UV-B 辐射胁迫下,大豆幼苗的叶绿素生物合成在ALA 向PBG 转化阶段受阻。造成这些差异的原因可能是由于逆境条件和试验作物的不同[21]。本研究表明:在热胁迫期间,HZ4 (HS) 的叶绿素含量始终高于L9K (HS),且HZ4 (HS) 的ALA 升幅小于L9K (HS),而ProtoⅨ、MgP Ⅸ和Pchlide 的降幅也小于L9K (HS),这表明HZ4 的叶绿素合成受阻程度小于L9K。
3.2 热胁迫对玉米叶绿素合成相关基因表达的影响
叶绿素合成过程中,胆色素原脱氨酶(propigmentdeaminase,PBGD) 和尿卟啉原Ⅲ脱羧酶(uroporphyrinogen decarboxylase,UROD) 共同参与PBG 向Proto Ⅸ的转化反应,对卟啉类化合物的合成至关重要[5-6]。本研究发现:HZ4 (HS) 和L9K (HS) 的PBGD 和UROD 基因相对表达量在热胁迫下显著下调,且HZ4 (HS) 中的基因相对表达量高于L9K (HS)。这表明热胁迫通过抑制PBGD 和UROD 基因表达,阻碍了PBG 向ProtoⅨ转化,从而影响叶绿素的合成。然而,在热胁迫过程中,HZ4 中PBGD 和UROD 基因较高的相对表达量帮助缓解了高温对叶绿素生物合成的负面影响。已有研究表明:热胁迫可以通过破坏类囊体膜结构,导致类囊体膜蛋白复合物解体,进而抑制叶绿素的生物合成[23-24]。本研究发现:在热胁迫下,HZ4 (HS) 和L9K (HS) 中的MgPMT、POR、CAO 和CHLG 基因相对表达量下调,这与JAHAN 等[25]的研究结果一致。尽管如此,在热胁迫后期,HZ4 的上述基因仍维持了较高的表达水平,从而表现为比L9K 更耐热。
3.3 热胁迫对玉米叶绿素分解相关基因表达的影响
叶绿素降解的起始点为叶绿素a,叶绿素b必须还原成叶绿素a 才能进一步降解,叶绿素b还原酶(chlorophyll b reductase,CBR) 催化这一还原过程;叶绿素酶(chlorophyllase,CLH) 催化叶绿素a 形成脱植基叶绿素a (Chlide a),是叶绿素分解代谢中的限速步骤;脱镁叶绿素水解酶(pheophytin hydrolase,PPH) 催化脱镁叶绿素a 形成脱镁叶绿酸a;脱镁叶绿酸a 氧化酶(pheophorbidea oxidase,PAO) 催化脱镁叶绿酸a 形成红色叶绿素降解物,这是叶绿素降解的关键步骤[26]。叶绿素含量是叶绿素生物合成与降解达到动态平衡的结果[27]。本研究表明:在热胁迫过程中,HZ4(HS) 和L9K (HS) 的叶绿素降解相关基因CBR、CLH、PPH 和PAO 都上调表达,且HZ4 (HS) 的4 个基因相对表达量均显著低于L9K (HS),表明热胁迫诱导叶绿素降解相关基因上调表达,加速叶绿素的降解代谢;同时也表明:在热胁迫过程中,耐热型自交系HZ4 通过维持较低的叶绿素降解相关基因表达水平,减少了叶绿素的非正常降解,这与ZHOU 等[28]的研究结果一致。
4 结论
热胁迫导致玉米叶绿素含量下降的原因包括:叶绿素合成相关基因下调表达及叶绿素降解相关基因上调表达。热胁迫影响了PBG 向ProtoⅨ转化阶段的叶绿素生物合成,主要是由于PBGD 和UROD 基因的下调表达。此外,耐热型和热敏感型玉米之间的叶绿素含量差异,源于其叶绿素代谢相关基因的差异性表达,这是其耐热性差异化的分子机制。
[ 参考文献 ]
[1]WEI M, QIAO F L, GUO Y Q, et al. Quantifying the importanceof interannual, interdecadal and multidecadalclimate natural variabilities in the modulation of global warming rates[J]. Climate Dynamics, 2019, 53(11): 6715.DOI: 10.1007/s00382-019-04955-2.
[2]高英波, 张慧, 单晶, 等. 吐丝前高温胁迫对不同耐热型夏玉米产量及穗发育特征的影响[J]. 中国农业科学,2020, 53(19): 3954. DOI: 10.3864/j.issn.0578-1752.2020.19.009.
[3]RUDIGER W. Chlorophyll metabolism: from outer spacedown to the molecular level[J]. Phytochemistry, 1997,46(7): 1151. DOI: 10.1016/S0031-9422(97)80003-9.
[4]ZHU X C, SONG F B, LIU S Q, et al. Effects of arbuscularmycorrhizal fungus on photosynthesis and waterstatus of maize under high temperature stress[J]. Plantand Soil, 2011, 346(1): 189. DOI: 10.1007/s11104-011-0809-8.
[5]WANG P, GRIMM B. Connecting chlorophyll metabolismwith accumulation of the photosynthetic apparatus[J].Trends in Plant Science, 2021, 26(5): 484. DOI: 10.1016/j.tplants.2020.12.005.
[6]李佳佳, 于旭东, 蔡泽坪, 等. 高等植物叶绿素生物合成研究进展[J]. 分子植物育种, 2019, 17(18): 6013. DOI:10.13271/j.mpb.017.006013.
[7]NAGATA N, TANAKA R, SATOH S, et al. Identificationof a vinyl reductase gene for chlorophyll synthesis inArabidopsis thaliana and implications for the evolutionof Prochlorococcus species[J]. Plant Cell, 2005, 17(1):233. DOI: 10.1105/tpc.104.027276.
[8]杨晓棠, 张昭其, 徐兰英. 植物叶绿素的降解[J]. 植物生理学通讯, 2008, 44(1): 7. DOI: 10.13592/j.cnki.ppj.2008.01.002.
[9]LUO L, LI Z, TANG M Y, et al. Metabolic regulation ofpolyamines and γ-aminobutyric acid in relation to spermidine-induced heat tolerance in white clover[J]. PlantBiology, 2020, 22(5): 794. DOI: 10.1111/plb.13139.
[10]WU D C, ZHU J F, SHU Z Z, et al. Physiological andtranscriptional response to heat stress in heat-resistantand heat-sensitive maize (Zea mays L.) inbred lines atseedling stage[J]. Protoplasma, 2020, 257(6): 1615. DOI:10.1007/s00709-020-01538-5.
[11]LICHTENTHALER H K, WELLBURN A R. Determinationsof total carotenoids and chlorophylls a and b ofleaf extracts in different solvents[J]. Biochemical SocietyTransactions, 1983, 11(5): 591. DOI: 10.1042/bst0110591.
[12]DEI M. Benzyladenine-induced stimulation of 5-aminolevulinicacid accumulation under various light intensitiesin levulinic acid-treated cotyledons of etiolated cucumber[J]. Physiologia Plantarum, 1985, 64(2): 153. DOI:10.1111/j.1399-3054.1985.tb02329.x.
[13]PENG Y, ZHANG Y, LYU J, et al. Characterization andfine mapping of a novel rice albino mutant low temperaturealbino 1[J]. Journal of Genetics and Genomics, 2012,39(8): 385. DOI: 10.1016/j.jgg.2012.05.001.
[14]HODGINS R, VAN HUYSTEE R B. Rapid simultaneousestimation of protoporphyrin and Mg-porphyrins in higherplants[J]. Journal of Plant Physiology, 1986, 125(3/4):311. DOI: 10.1016/S0176-1617(86)80153-5.
[15]赵龙飞, 李潮海, 刘天学, 等. 花期前后高温对不同基因型玉米光合特性及产量和品质的影响[J]. 中国农业科学, 2012, 45(23): 4947. DOI: 10.3864/j.issn.0578-1752.2012.23.023.
[16]TANAKA A, TANAKA R. Chlorophyll metabolism[J].Current Opinion in Plant Biology, 2006, 9(3): 248. DOI:10.1016/j.pbi.2006.03.011.
[17]WU W W, HE S S, AN Y Y, et al. Hydrogen peroxide asa mediator of 5-aminolevulinic acid-induced Na+ retentionin roots for improving salt tolerance of strawberries[J]. Physiologia Plantarum, 2019, 167(1): 5. DOI: 10.1111/ppl.12967.
[18]CORNAH J E, TERRY M J, SMITH A G, et al. Green orred: what stops the traffic in the tetrapyrrole pathway?[J].Trends in Plant Science, 2003, 8(5): 224. DOI: 10.1016/S1360-1385(03)00064-5.
[19]BEALE S I. Green genes gleaned[J]. Trend in Plant Science,2005, 10(7): 309. DOI: 10.1016/j.tplants.2005.05.5.
[20]向丽霞, 胡立盼, 孟森, 等. 叶面喷施亚精胺对高温胁迫下番茄叶绿素合成代谢的影响[J]. 西北植物学报,2020, 40(5): 846. DOI: 10.7606/j.issn.1000-4025.2020.05.0846.
[21]SANTOS C V. Regulation of chlorophyll biosynthesisand degradation by salt stress in sunflower leaves[J]. ScientiaHorticulturae, 2004, 103(1): 93. DOI: 10.1016/j.scienta.2004.04.009.
[22]彭倩, 周青. La(Ⅲ)对UV-B辐射胁迫下大豆叶绿素合成与降解影响的机理[J]. 中国农业气象, 2007, 28(3):285. DOI: 10.3969/j.issn.1000-6362.2007.03.012.
[23]TANAKA R, TANAKA A. Tetrapyrrole biosynthesis inhigher plants[J]. Annual Review of Plant Biology, 2007,58(1): 321. DOI: 10.1146/annurev.arplant.57.032905.105448.
[24]杨小飞, 郭房庆. 高温逆境下植物叶片衰老机理研究进展[J]. 植物生理学报, 2014, 50(9): 1285. DOI: 10.13592/j.cnki.ppj.2014.1012.
[25]JAHAN M S, HASAN M M, ALOTAIBI F S, et al. Exogenousputrescine increases heat tolerance in tomato seedlingsby regulating chlorophyll metabolism and enhancingantioxidant defense efficiency[J]. Plant, 2022, 11(8):1038. DOI: 10.3390/plants11081038.
[26]陈文峻, 蒯本科. 植物叶绿素的降解[J]. 植物生理学通讯, 2001, 37(4): 336. DOI: 10.13592/j.cnki.ppj.2001.04.027.
[27]WANG P, RICHTER A S, KLEEBERG J R W, et al.Post-translational coordination of chlorophyll biosynthesisand breakdown by BCMs maintains chlorophyll homeostasisduring leaf development[J]. Nature Communications,2020, 11(1): 1254. DOI: 10.1038/s41467-020-14992-9.
[28]ZHOU H, GUO S R, AN Y H, et al. Exogenous spermidinedelays chlorophyll metabolism in cucumber leaves(Cucumis sativus L.) under high temperature stress[J]. Acta Physiologiae Plantarum, 2016, 38(9): 1. DOI:10.1007/s11738-016-2243-2.
[28]责任编辑:何承刚
基金项目:安徽省教育厅自然基金项目(KJ2020A0119)。

