猪苓菌核形成条件优化研究



摘 要:猪苓作为一种药用真菌,在医药界备受青睐,但由于野生资源逐渐匮乏,开展猪苓人工栽培已成为一种趋势。本试验从湿度、黑曲霉ZM-8液、生物素的使用等几方面探究猪苓菌核快速形成的最佳配方。研究结果表明:黑曲霉ZM-8的加入,有助于猪苓菌核和蜜环菌菌索的形成与生长。适宜浓度的生物素对猪苓菌核的形成也有极大的促进作用。在四种主要影响因素中,湿度水平对猪苓菌核形成影响最大。控制培养基湿度50%;黑曲霉ZM-8液25 mL;三十烷醇12 mg/kg;萘乙酸15 mg/kg的条件最适宜猪苓菌核的形成。该条件下培养30 d猪苓菌核直径可达32.8 mm。
关键词:猪苓;蜜环菌;菌核;条件优化
中图分类号:R282.2" 文献标识码:A" 文章编号:0488-5368(2024)10-0052-05
收稿日期:2024-02-05 修回日期:2024-03-13
基金项目:渭南职业技术学院2023年度院级科研计划项目(WZYYZ202309)。
第一作者简介:郭楠(1988-),女,硕士,研究方向为药用真菌基础研究。
Study on Condition Optimization for Sclerotial Formation "of %Polyporus Umbellatus%
GUO Nan1, ZHANG Zongzhou2
(1.Weinan Vocational and Technical College, Weinan, Shaanxi 714026, China; 2.School of Bioengineering and Biotechnology, Tianshui Normal University, Tianshui, Gansu" 741001, China)
Abstract: %Polyporus umbellatus %is a medicinal fungus that is highly valued in the pharmaceutical industry. Due to the gradual depletion of wild resources, artificial cultivation of Polyporus umbellatus has become a trend. This study investigated the optimal formula for the rapid formation of sclerotia in %Polyporus umbellatus% from several aspects, including humidity, Aspergillus niger ZM-8 liquid concentration, and biotin supplementation. The results indicate that the introduction of %Aspergillus niger% ZM-8 significantly enhances the formation and growth of both sclerotia and %Armillaria mellea %rhizomorphs. Additionally, an appropriate concentration of biotin plays a crucial role in promoting sclerotial formation. Among the four main factors tested, the optimal conditions for sclerotial formation of %Polyporus umbellatus %were identified as: medium humidity at 50%, 25 mL of %Aspergillus niger %ZM-8 liquid, 12 ppm of 30 alkanol (specify if possible), and 15 ppm of NAA. Under these conditions, the diameter of %Polyporus umbellatus% sclerotia could reach up to 32.8 mm after 30 days.
Key words:%Polyporus umbellatus; Armillaria mellea; %Sclerotium; Condition optimization
猪苓是一种珍贵的真菌类中药材[1],属担子菌门、多孔菌科、多孔菌属[5,12]。猪苓味甘、性平,有利水、消肿的功效[2],中医临床上常用于治疗急性肾炎、全身浮肿、小便不畅、尿急尿频、急性肝炎等疾病。随着医药事业的快速发展,以猪苓为原料的成品药不断开发,保护猪苓野生资源,开展猪苓人工栽培势在必行[3]。
猪苓的生长发育需经过担孢子、菌丝体、菌核和子实体四个阶段。担孢子在适宜的条件下萌发成菌丝和次生菌丝,构成菌丝体,无数菌丝缠绕构成菌核。菌核多年生,能贮存营养,环境不适时可长期休眠,遇蜜环菌和适宜的环境能萌生菌丝,串破菌核表层[4,10],形成白苓,进而开始下一轮无性繁殖过程。猪苓菌核具有利水、渗湿、消肿等功能,其多糖对动物移植性肿瘤有抑制作用[5]。猪苓菌核国内及出口用量大,野生资源日益减少,虽然利用蜜环菌伴栽猪苓菌核人工栽培[8,9]和菌丝发酵[6]已获得成功,但由于猪苓菌核生长缓慢、繁殖率低、种苓缺乏,为此很难提供大量猪苓菌核用于人工栽培,限制了猪苓栽培的规模。
人工室内促生猪苓种,即人工培养猪苓菌核,可以为半人工栽培猪苓提供无限的种源,又能打破猪苓栽培的时空限制,推动猪苓栽培业的发展。同时,猪苓栽培的第一步也是研究猪苓菌核的形成问题,也就是如何让猪苓孢子在最适的培养条件下形成大量的菌丝,又让这大量的菌丝交织在一起快速的形成丰满的菌核,这是目前亟待解决的问题,也是猪苓人工栽培中最难解决的问题。本研究的目的是找到猪苓菌核形成的最佳外界条件,掌握猪苓菌核形成的基本规律,以推动猪苓菌核的产业化生产。
1 材料与方法
1.1 材料
1.1.1 供试菌株 猪苓原种、蜜环菌原种由天水师范学院微生物研究室提供的杂木屑原种。
1.1.2 原料 锯末、麸皮、马铃薯、玉米面、大豆面、蛋白胨、白糖、石膏粉等。
1.1.3 培养基配方 锯末75%、麦麸14%、玉米面5%、大豆面2%、蛋白胨1%、白糖1%、多维磷酸二氢钾1%、石膏粉1%、加猪苓宝2#0.3%,加水至含水55%左右。
1.1.4 器材 高压灭菌锅(上海申安医疗机械厂)电子天平、恒温培养箱(上海恒科技有限公司)、酒精灯、培养皿、电炉、量筒、500 mL三角瓶、250 mL菌种瓶、500 mL菌种瓶、滤纸、多个1 mL移液管。
1.2 方法
1.2.1 蜜环菌、猪苓栽培种培养将配料拌匀,装瓶,松紧适度,中间插一孔,用棉花做塞子,灭菌。分别接种猪苓、蜜环菌菌种,25 ℃培养30 d。后置于黑暗条件下培养30 d,注意观察。
1.2.2 猪苓菌核形成条件优化
(1)黑曲霉ZM-8对蜜环菌菌索和猪苓菌核形成的影响。
黑曲霉对猪苓菌核和蜜环菌菌索的形成有促进作用,是偶然发现的。之后我们着意用几种黑曲霉感染,取得了较好的效果。培养基配方同上。分别接种野生黑曲霉、黑曲霉UV-11、黑曲霉ZM-8各1 mL,对照不接,重复6次。其中3次接种猪苓菌种,另外3次接种蜜环菌菌种。培养30 d,取3个样的平均数。
(2)生物素对猪苓菌核的促进作用[11]。考虑到猪苓生长速度比较缓慢,一般自然界一年才能形成猪苓种,三年以上才能长成商品猪苓,为促生猪苓种,我们引入了生物素试验。
1#处理:马铃薯100 g;白糖10 g;牛肉膏5 g;KH-2PO-4 2 g;琼脂8 g;自来水500 mL(马铃薯煮化)。制成500 mL特殊的PDA培养基。灭菌,并倒成20个培养皿,每皿加灭过菌的中性滤纸一张。加生物素液0.5 mL。生物素液配方:萘乙酸5 mg/kg;10 mg/kg;15 mg/kg;20 mg/kg的浓度,分别形成1#A、1#B、1#C、1#D四个处理,每处理4个重复。对照1#CK,不加生物素,重复4个。只接种猪苓菌种,25℃培养30 d。
2#处理:培养基配方同上。加生物素液0.5 mL,生物素液配方:萘乙酸5 mg/kg;10 mg/kg;15 mg/kg;20 mg/kg的浓度,分别形成2#A、2#B、2#C、2#D四个处理,每处理4个重复。对照2#CK,不加生物素,重复4个。同时接种猪苓菌种和蜜环菌菌种,25 ℃培养30 d。
3#处理:培养基配方同上。加生物素液0.5 mL,生物素液配方:三十烷醇4 mg/kg;8 mg/kg;12 mg/kg;16 mg/kg的浓度,分别形成3#A、3#B、3#C、3#D四个处理,每处理4个重复。对照3#CK,不加生物素,重复4个。只接种猪苓菌种,25 ℃培养30 d。
4#处理:培养基配方同上。加生物素液0.5 mL,生物素液配方:三十烷醇4 mg/kg;8 mg/kg;12 mg/kg;16 mg/kg的浓度,分别形成4#A、4#B、4#C、4#D四个处理,每处理4个重复。对照4#CK, 不加生物素,重复4个。同时接种猪苓菌种和蜜环菌菌种,25 ℃培养30 d。
1.2.3 条件优化(萘乙酸、三十烷醇、黑曲霉ZM-8液、湿度)[7] 黑曲霉ZM-8液的制作方法:称取5 g黑曲霉ZM-8,加500 mL水浸泡在三角瓶中10 h,置高压蒸汽灭菌锅中灭菌后使用。
在前面实验的基础上,这次重点讨论萘乙酸、三十烷醇、黑曲霉ZM-8液、湿度等四因素对猪苓菌核形成的影响。我们设置四因素三水平正交试验。萘乙酸5 mg/kg、10 mg/kg、15 mg/kg;三十烷醇4 mg/kg、8 mg/kg、
12 mg/kg;黑曲霉ZM-8液15 mL、20 mL、25 mL;培养基湿度50%、60%、70%。设置9个处理,每处理5个重复,共1个对照。将配料拌匀,装入培养皿,每皿约10 g左右,保持皿内培养基疏松。灭菌,接种猪苓菌种,25 ℃培养30 d,统计生长结果。
2 结果与分析
2.1 黑曲霉ZM-8对蜜环菌菌索和猪苓菌核形成的影响
菌核的形成是猪苓产生的第一步,由表1可以看出:野生黑曲霉对猪苓菌核的产生有益,30d菌核平均可达13.2 mm;接种黑曲霉UV-11,菌核平均可达14.4 mm;接种黑曲霉ZM-8,菌核平均可达16.8 mm,而不接黑曲霉的对照样品在30 d根本无法产生菌核。试验结果可知接种黑曲霉ZM-8,菌核大而饱满,不接黑曲霉的对照组菌丝较白,但无菌核产生。蜜环菌菌索的生长也受黑曲霉的影响,接种野生黑曲霉,蜜环菌菌索30 d平均可达17 mm;接种黑曲霉UV-11,蜜环菌菌索30 d平均可达34 mm;蜜环菌菌索接种黑曲霉ZM-8,30 d平均可达51 mm,而不接黑曲霉的对照样品在30 d菌索长度只有8 mm。由此说明,黑曲霉不影响蜜环菌菌索的产生,但影响蜜环菌菌索的生长速度,特别是接种黑曲霉ZM-8,蜜环菌菌索的长度是对照组的6.38倍,影响相当之大。这一发现将成为猪苓生产中的一个重要措施。
2.2 生物素对猪苓菌核形成的影响
从表2可以看出,生物素—萘乙酸、三十烷醇的加入,都能在一定程度上促进猪苓菌核的形成。1#处理只接种猪苓菌种,在萘乙酸浓度10 mg/kg时达到高峰,猪苓菌核直径18.5 mm,比不加萘乙酸的处理菌核直径大
14.2 mm。2#处理接种猪苓菌种和蜜环菌菌种,在萘乙酸浓度10" mg/kg时达到高峰,猪苓菌核直径20.5 mm,比不加萘乙酸的处理菌核直径大12.5 mm。3#、4#处理加的三十烷醇,在8" mg/kg时达到高峰,菌核分别比不加三十烷醇大10.2 mm和8.5 mm。且相同加量下,生物素浓度越高,猪苓菌核生长速度越慢。同时认为加萘乙酸比加三十烷醇的效果更好。另一方面,在萘乙酸浓度10" mg/kg和三十烷醇浓度8" mg/kg时,同时接种蜜环菌和猪苓菌种的2#和4#比只接种猪苓菌种的1#和3#菌核直径大2 mm,由此说明:蜜环菌能为猪苓提供营养,也说明猪苓可以脱离蜜环菌自己吸收营养。在营养充足的情况下,猪苓是可以单独生长的,打破了猪苓必须依靠蜜环菌提供营养才能生长的定势思维。
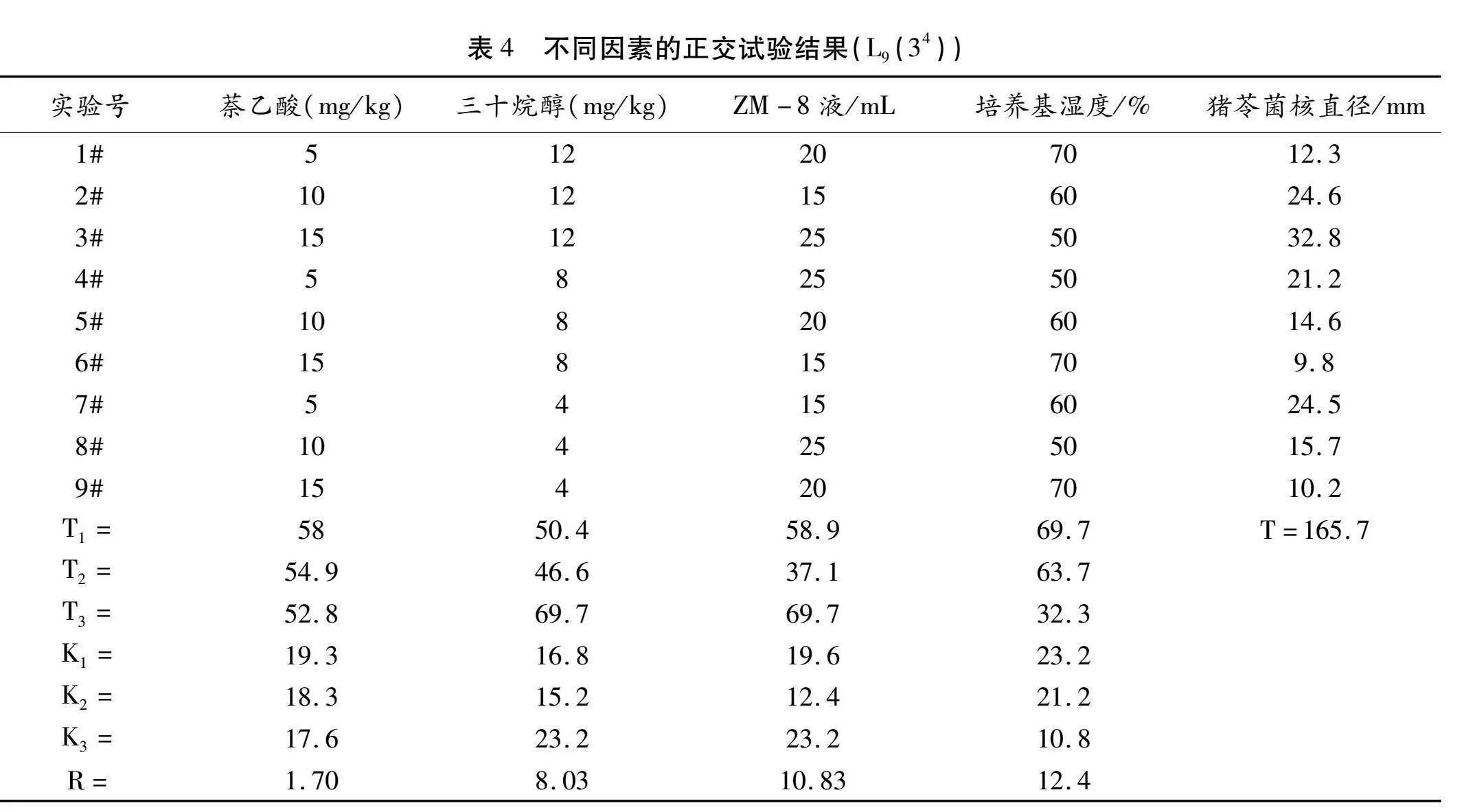
2.3 条件优化(萘乙酸、三十烷醇、黑曲霉ZM-8液、湿度、)的正交试验结果
在条件优化中,猪苓菌核形成条件的正交实验因素水平如表3,不同因素的正交试验结果(L-9(34))如表4。设计的因素与因素水平,是在原来单因素试验的基础上确定的。
从表4可以看出,培养基湿度水平的极差、ZM-8液水平的极差、三十烷醇水平的极差和萘乙酸水平的极差分别是12.4、10.83、8.03和1.7。说明在环境条件的确定中,湿度对猪苓菌核生长的影响最大,湿度的改变明显影响猪苓的生长及大小;萘乙酸水平对猪苓菌核生长的影响最小。在9个处理中,处理3的猪苓菌核直径最大,可达32.8 mm,处理6的猪苓菌核直径最小,仅9.8 mm。处理3菌核直径是处理6菌核直径的3.35倍,所以认为处理3的条件适宜猪苓菌核的形成。也就是控制空气湿度50%;黑曲霉ZM-8液25 mL;三十烷醇12 mg/kg;萘乙酸15 mg/kg的条件最适宜猪苓菌核的形成。在这个条件下30 d,猪苓菌核直径可达32.8 mm,这样大小的猪苓菌核可以直接用于猪苓生产。
3 小结与讨论
3.1 单因素试验讨论
3.1.1 黑曲霉ZM-8对蜜环菌菌索和猪苓菌核形成的影响
在自然界可能也存在促进猪苓菌核形成的因素。我们在实验中偶然发现,形成猪苓菌核的培养基被黑曲霉感染后不会阻碍猪苓菌核的形成,反而会促进猪苓菌核的形成。之后,采用几种黑曲霉去侵染,取得了较好的结果,实验结果表明黑曲霉可以促进猪苓菌核的形成,特别是黑曲霉ZM-8菌株。黑曲霉ZM-8可以促进猪苓菌核的产生和膨大,也能促进蜜环菌菌索的伸长,接种黑曲霉ZM-8蜜环菌菌索的长度是对照的6.38倍。
3.1.2 生物素对猪苓菌核形成的影响 生物素—萘乙酸、三十烷醇的加入,都能在一定程度上促进猪苓菌核的形成。仅接种猪苓菌种的处理,在萘乙酸浓度10 mg/kg达到高峰,猪苓菌核直径18.5 mm,比不加萘乙酸的处理菌核直径大14.2 mm。接种猪苓菌种和蜜环菌菌种,在萘乙酸浓度10 mg/kg达到高峰,猪苓菌核直径20.5 mm,比不加萘乙酸的处理菌核直径大12.5 mm。加三十烷醇,在8 mg/kg时达到高峰,分别比不加三十烷醇菌核大10.2 mm和8.5 mm。在生物素影响猪苓菌核形成的过程中我们还发现,猪苓可以独立吸收营养,形成菌核,也可以借助蜜环菌的菌索提供营养形成菌核,蜜环菌的存在有助于猪苓菌核的产生与生长。
3.2 条件优化(萘乙酸、三十烷醇、黑曲霉ZM-8液、湿度)的正交试验讨论
在四种主要影响因素中,培养基湿度水平对猪苓菌核形成影响最大,黑曲霉ZM-8液影响次之。培养基相对最佳湿度是50%。条件优化中认为:控制培养基湿度50%;黑曲霉ZM-8液25 mL;三十烷醇12 mg/kg;萘乙酸15 mg/kg的条件最适宜猪苓菌核的形成。在这个条件下30 d,猪苓菌核直径可达32.8 mm。黑曲霉ZM-8液的加入启发我们,它在猪苓菌核形成的培养基中可能充当着某种营养成份,有待进一步研究。
促生猪苓种,即人工培养猪苓菌核,可以为栽培猪苓提供无限的种源,又能打破猪苓栽培的时空限制,推动猪苓栽培业的发展。
参考文献:
[1] 江苏新医学院.中草药大辞典[M].上海:上海科学技术出版,1986:2 191-2 192.""""""""""""""""""""""
[2] 国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2010:299.
[3] 陈德育,李学俊,田广文.猪苓菌核代料栽培技术初探[J].食用菌,2007,29(5):43.
[4] 刘瑛颖,程显好,郭顺星.药用真菌猪苓菌丝形成菌核的人工培养研究[J].药学学报(增刊) ,2007,(41):245-248.
[5] 徐锦堂.中国药用真菌学[M].北京:中国医药大学中国协和医科人学联合出版社,1997.
[6] 陶雪娟,徐崇敬,徐凤菊,等.蕈菌液体生物发酵技术的研究现状与进展[J].上海农学院学报,1999,17(2):141-147.
[7] 孙东平,潘锋,史小丽,等.灵芝菌发酵培养基的优化与分离纯化[J].中草药,2000,31(12):941-943.
[8] 郭顺星,徐锦堂.蜜环菌侵染猪苓菌核的细胞学研究[J].植物学报,1993,35(1):44-50.
[9] 郭顺星,徐锦堂.蜜环菌侵染后猪苓菌核防御结构的发生及功能[J].真菌学报,1993,12(4):283-288.
[10] 郭顺星,王秋颖,张集慧,等.猪苓菌丝形成菌核栽培方法的研究[J].中国药学杂志,2001(36):658.
[11] 程丽娟,薛泉宏.微生物学实验技术[M].陕西:世界图书出版社西安公司,2000:38.
[12] 陈文强,邓百万.秦巴山区野生与栽培猪苓菌核主要成分的测定[J].无锡轻工大学学报,2003,22(6):96-98.

