外源赤霉素对盐碱胁迫下园林小菊生长、生理及光合特性的影响

摘要:以园林小菊绚秋粉韵为试验材料,探究外源施用赤霉素(GA3)对盐碱胁迫下园林小菊的缓解作用及适宜的施用浓度,以期为缓解盐碱胁迫提供一定参考。用100 mmol/L NaCl和Na2CO3混合溶液对园林小菊进行盐碱胁迫处理,探究不同浓度(50、100、150、200 mg/L)GA3对菊花幼苗叶片生长指标(株高、茎粗、叶长叶宽、干鲜重)和生理指标(相对含水量、叶绿素相对含量、相对电导率、丙二醛含量、有机渗透调节物质和抗氧化酶活性)及光合参数的影响。结果表明,外源喷施GA3可以有效缓解盐碱胁迫的受害症状,显著加快菊花茎的伸长并加速植株生长。当GA3浓度为100 mg/L时,总体上明显提高了园林小菊的株高、叶长、叶宽、干鲜重及相对含水量、叶绿素相对含量。在盐碱胁迫下,外源喷施不同浓度GA3均可提高菊花叶片的抗氧化酶活性和光合指标,降低丙二醛(MDA)含量,有效延缓叶片衰老,提高产量。在盐碱胁迫条件下,GA3(100 mg/L)能显著提高植物抗氧化酶活性,增强光合能力,减少MDA的产生,缓解盐碱胁迫引起的氧化损害,同时还能增加叶片相对含水量及叶绿素相对含量,从而减轻盐碱胁迫对植物的损害。
关键词:菊花;耐盐碱性;生长指标;生理特性;光合特性;外源赤霉素
中图分类号:S682.1+10.1 文献标志码:A
文章编号:1002-1302(2024)18-0169-08
收稿日期:2023-09-18
基金项目:宁夏自然科学基金(编号:2023AAC03147);宁夏重点研发计划(编号:2022BBF03035)。
作者简介:虎淘淘(1999—),女,宁夏彭阳人,硕士,主要从事观赏园艺研究。E-mail:htt1961457327@163.com。
通信作者:严 瑞,副教授,硕士生导师,主要从事观赏植物栽培生理及逆境分子育种研究。E-mail:yanrui2020@sina.cn。
菊花(Chrysanthemum morifolium Ramat.)属于菊科菊属,是一种宿根观赏植物,根据其用途可以分为园林小菊、切花菊、盆栽菊等[1-2]。由于园林小菊具有株型矮小、花色鲜艳、花枝繁密、冠形饱满等特性,目前已经成为城市和农村园林绿化的新型品种,具有较高的经济效益和广阔的应用潜力[3-4]。近年来,全球许多地区都出现了土壤盐碱渍化现象,盐碱渍化是制约植物生长发育最重要的环境因素[5]。土壤中的盐碱积累会导致渗透胁迫和离子胁迫,而渗透胁迫会导致叶片吸水性降低、气孔关闭,从而对植株的生长发育产生不利影响[6]。在盐碱胁迫下,植株体内的Na+过度富集,K+被消耗殆尽,导致细胞内离子稳态失衡,进而产生离子毒害,严重损害植物的OHSecVEvcmIzSNHTtuoDAQ==光合机制,最终影响植株的生长发育[7]。菊花在盐碱胁迫下会表现出极强的敏感性,盐碱化对其观赏性、经济效益造成了很大的影响,因而提高菊花耐盐碱性的研究刻不容缓,而外源激素的应用和推广能增强其耐盐碱能力,改善观赏效果。
GA3是五大类主要的植物激素之一,在植物和微生物中普遍存在,是一种能够促进细胞分裂和延长的化合物,在植物的生长过程中发挥了很大的作用[8]。在植物生长发育过程中,GA3具有调控植物种子发芽并促进茎伸长、叶片伸展、开花和光合作用等功能。除此之外,GA3还能促进植物的营养吸收,提高作物的抗逆能力,其功效已经在农业生产实践中广泛应用[9-10]。
目前,尽管已有很多关于植物耐盐碱性的研究,但利用外源激素增强园林小菊耐盐碱性的报道还较少。鉴于我国北方盐碱土对菊花生长的不利影响,本试验通过外源喷施GA3的方式,研究其对菊花幼苗生长、生理及光合特性的影响,并筛选出适宜的外源GA3浓度,为我国西北地区花卉资源的合理栽培奠定基础,同时也为西北地区园林小菊抗逆丰产栽培提供参考。
1 材料与方法
1.1 试验材料
试验于2023年5月10日至8月20日在宁夏回族自治区银川市西夏区的宁夏大学科技楼作物遗传育种实验室进行,供试材料为北校区国家大学科技园玻璃温室的园林小菊品种绚秋粉韵的扦插苗。取绚秋粉韵的嫩梢,采用直插法扦插于穴盘中,栽培基质是体积比为2∶3∶2的泥炭-椰糠-珍珠岩。当插条长出8~10张叶片后,选择生长良好且长势一致的扦插苗移栽于装有与扦插苗所用基质相同的11 cm口径花盆中,进行盐碱胁迫处理。在整个试验过程中,温室内的温度控制在15~30 ℃,空气湿度维持在40%~70%。扦插苗长至10 cm时进行相应的试验处理。
1.2 试验设计
为了得到园林小菊幼苗外源GA3处理的适宜浓度,进行100 mmol/L盐碱胁迫(称取NaHCO3和NaCl固体粉末,按1∶1配制成100 mmol/L复合盐碱处理液)下外源GA3喷施浓度的筛选试验,经过预试验后,设置50、100、150、200 mg/L等4个GA3浓度梯度(记为G1~G4处理),每个处理选取5株长势一致的菊花幼苗,重复3次,处理方法如下:空白对照(CK1)浇灌清水,叶面喷施蒸馏水;盐碱处理(CK2),浇灌由NaCl和Na2CO3按体积比1∶1混合配制成的100 mmol/L混合溶液,叶面喷施蒸馏水;外源喷施GA3的处理(G1~G4处理)是在盐碱胁迫处理的基础上,叶面喷施不同浓度(50、100、150、200 mg/L)GA3。喷施时间为10:00前,叶面和叶背均匀喷施,使叶片全湿但水珠不下滴为止。外源激素间隔2 d处理1次,共处理3次,每个处理设5盆,重复3次。在植物出现萎蔫现象的当天进行采样,测定各项生理指标。
1.3 试验指标的测定
1.3.1 生长指标的测定 在每个处理中随机挑选出5株幼苗,用卷尺测量植株高度,用游标卡尺测定其茎粗、叶长、叶宽度。用电子秤测量其总鲜重,再于150 ℃烘干12 h至恒重,测量其总干重并进行记录。
1.3.2 生理指标的测定 用浸泡法测定叶片相对含水量(RWC);用便携式叶绿素仪测定叶片的叶绿素相对含量(以SPAD值计);用相对电导率法(REC)测定叶片的膜透性;用硫代巴比妥酸法测定丙二醛(MDA)含量;用氮蓝四唑法测定超氧化物歧化酶(SOD)活性;用愈创木酚法测定过氧化物酶(POD)活性;按比色法测定过氧化氢酶(CAT)活性;用考马斯亮蓝G-250染色法测定可溶性蛋白(SP)含量;参照脯氨酸含量检测试剂盒(Solarbio)说明书进行脯氨酸(Pro)含量的测定和计算;用蒽酮比色法测定可溶性糖(SS)含量。
1.3.3 光合气体交换参数和叶绿素荧光参数的测定 使用Li-6800便携式光合作用系统(LI-COR,Lincoln,NE,USA)测量净光合速率(Pn)、蒸腾速率(Tr)、胞间二氧化碳浓度(Ci)、气孔导度(Gs)。每个处理随机选择5株菊花幼苗进行测定。
叶绿素荧光参数的测定:试验处理结束后,在当天20:00对幼苗叶片进行黑暗适应30 min,再用紧凑型多通道连续监测荧光仪(Micro-PAM,Zealquest Scientific Technology Co.,Ltd)对其进行荧光参数即光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)、最大光化学量子产量(Fv/Fm)的测定。
1.4 数据处理
本研究以Excel 2010、GraphPad Prism 8作为数据整理和图表绘制的工具,用SPSS 20.0进行数据分析,用Duncan’s检验法进行差异显著性检验。
605c94d0244279f1f60b21f842caa831581f0c0f1d107102a7d3d815bbc0c6362 结果与分析
2.1 外源GA3对盐碱胁迫下菊花幼苗表型和生长指标的影响
当植物遭受盐碱胁迫时,植株的表型变化最为直观。由图1可以很明显地看出,在盐碱胁迫下,菊花植株中下部叶片明显萎蔫卷曲、焦枯发黄。喷施外源GA3缓解了盐碱胁迫症状,从植株表型可以看出,外源喷施GA3能够显著加快菊花茎的伸长并加速植株的生长,其中G2、G3处理的缓解效果较好。
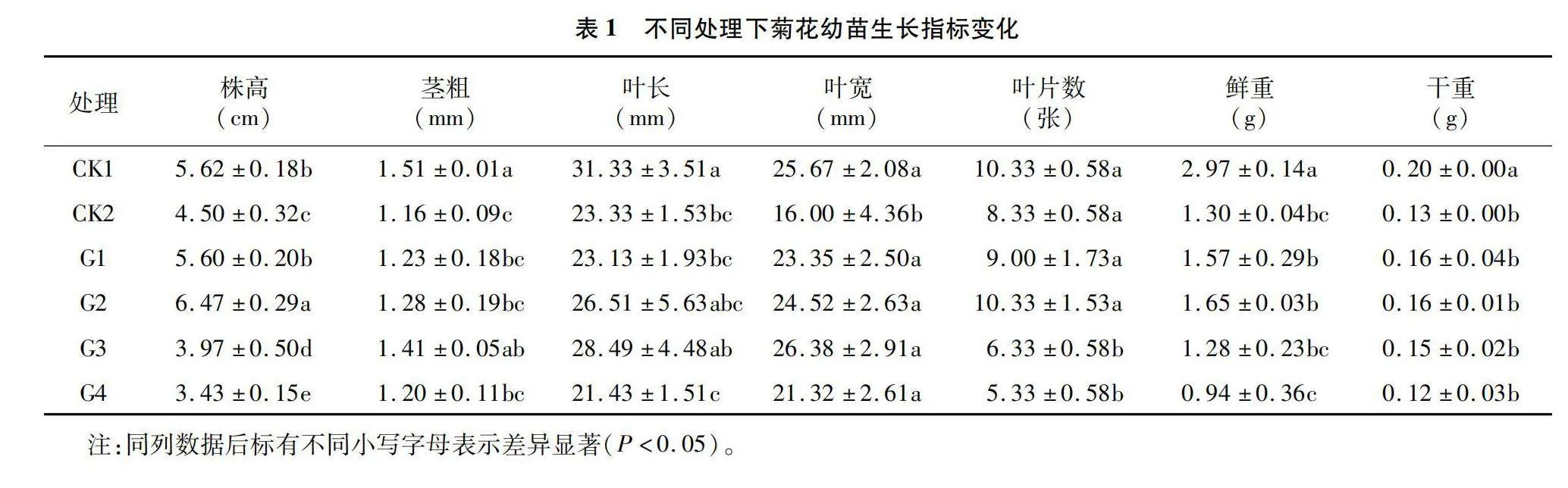
在盐碱胁迫下,菊花的生长受到抑制,主要表现在菊花株高、茎粗、叶片大小及植株干鲜重的抑制上;喷施外源GA3缓解了盐碱的胁迫症状,降低了盐碱胁迫对菊花的毒害作用,并且加快茎的伸长、叶片的舒展。在100 mmol/L盐碱胁迫下,施加一定浓度的外源GA3可以显著缓解菊花的盐碱胁迫,幼苗的株高、叶长、叶宽、叶片数、鲜重、干重明显高于盐碱处理,总体来看增幅最为明显的是G2处理(表1)。
2.2 外源GA3对盐碱胁迫下菊花幼苗生理特性的影响
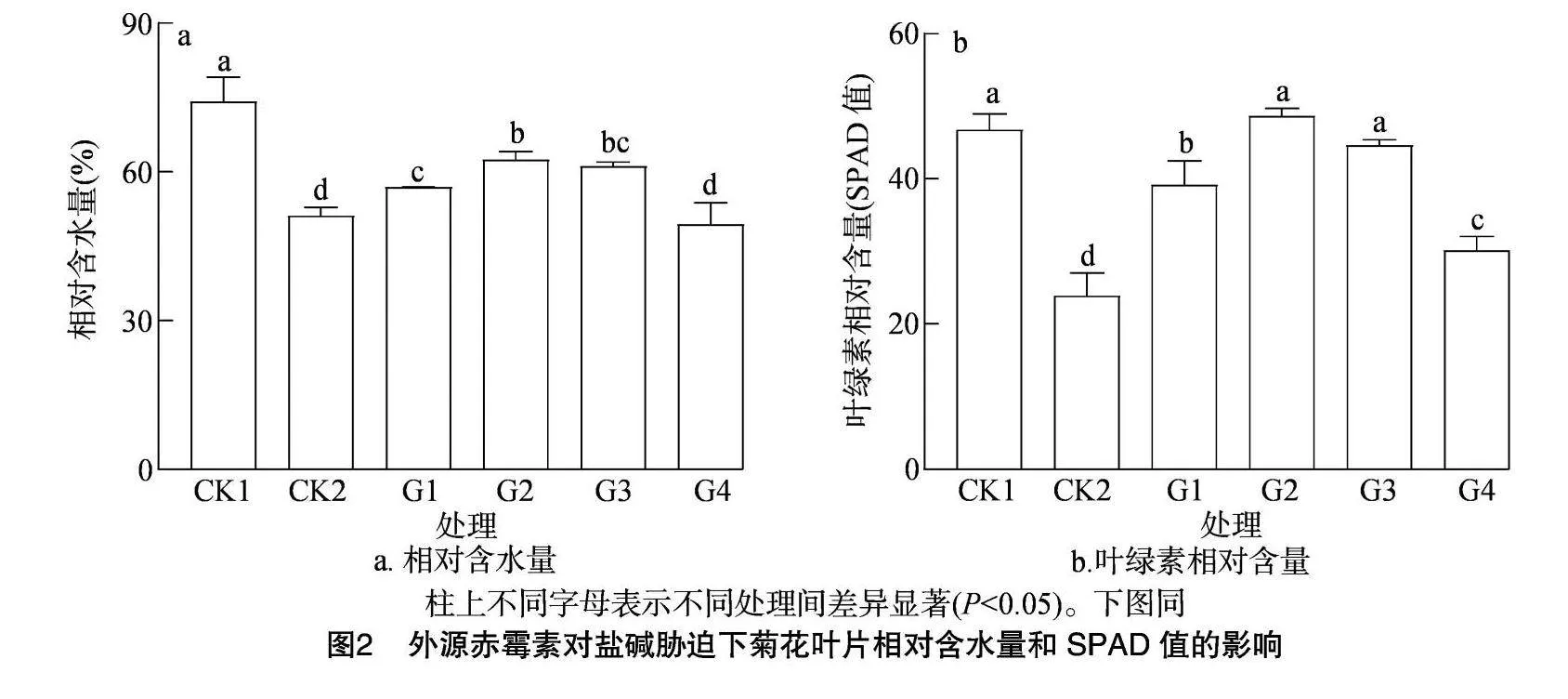
2.2.1 相对含水量和叶绿素含量 植物相对含水量能够直观地反映植物在盐碱胁迫条件下的缺水状况,是评价植物耐盐碱性的一种常用方法。由图2-a可以看出,盐碱胁迫处理使菊花叶片的相对含水量降低了31.02%,外源喷施GA3后,相对含水量均有提高。与CK2相比,G1、G2、G3处理的叶片相对含水量分别增加了11.23%、26.02%、19.56%,而G4处理叶片的相对含水量降低了3.35%。在盐碱胁迫下,菊花叶片相对含水量增幅最明显的是G2处理。
从图2-b可以看出,盐碱处理使菊花幼苗叶片的叶绿素相对含量显著下降,从46.76下降至23.87。与CK2相比,喷施不同浓度外源GA3后,G1、G2、G3、G4处理叶片的叶绿素相对含量分别从23.87升高至39.15、44.59、48.63、30.11。由此可见,喷施外源GA3可以使植株的叶片叶绿素相对含量显著升高,随着GA3施用浓度的升高,叶片叶绿素相对含量呈现先升高后下降的趋势,且最大激素浓度处理(G4处理)的叶绿素相对含量仍高于盐碱处理。
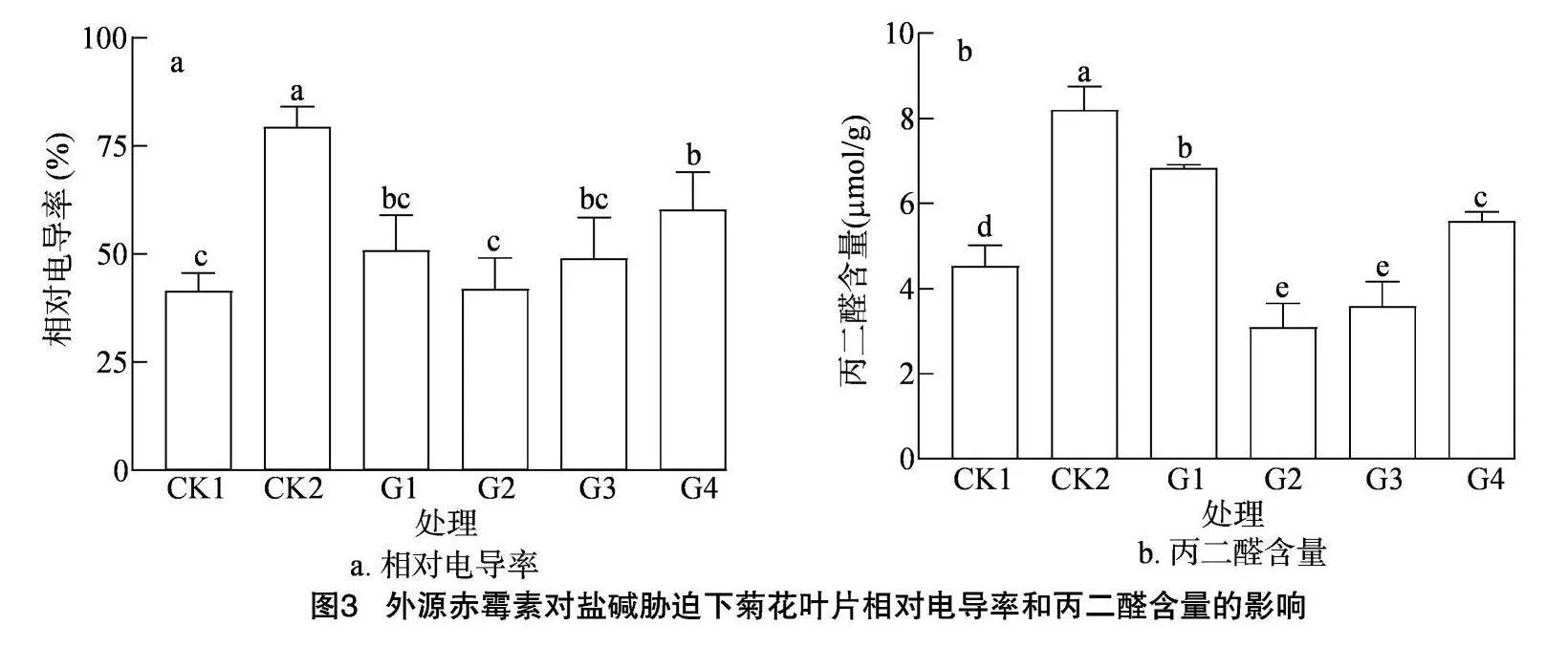
2.2.2 相对电导率和丙二醛含量 相对电导率是一项反映植物细胞膜状态的重要指标,当植物受到胁迫时,细胞膜会被破坏,从而使细胞液流出,相对电导率增大。由图3-a可以看出,在100 mmol/L盐碱胁迫下,菊花幼苗的相对电导率相较CK1明显升高。外源施用GA3后,相对电导率低于CK2,其中G2处理的相对电导率与CK2相比在0.05水平存在显著差异,与CK1无显著差异。上述结果表明,在盐碱胁迫下,外源喷施GA3可以减少植物细胞膜的破损,保持细胞膜的稳定。
如图3-b所示,与CK1相比,在盐碱胁迫条件下,菊花幼苗叶片的MDA含量显著升高。在盐碱胁迫的同时对菊花幼苗叶面进行喷施外源激素处理后,发现叶片的MDA含量明显降低,但除G2、G3处理外,其余处理的叶片MDA含量均高于CK1。在不同浓度激素处理下,叶片的MDA含量表现为先降低后升高的趋势,以G2、G3处理的MDA含量较低,降幅非常明显,相比于盐碱处理分别降低了62.36%、52.18%。总体来说,在盐碱胁迫的情况下,喷施外源GA3有效降低了MDA的积累,从而缓解了盐碱胁迫对菊花幼苗叶片造成的损伤,G2处理的缓解效果最佳。
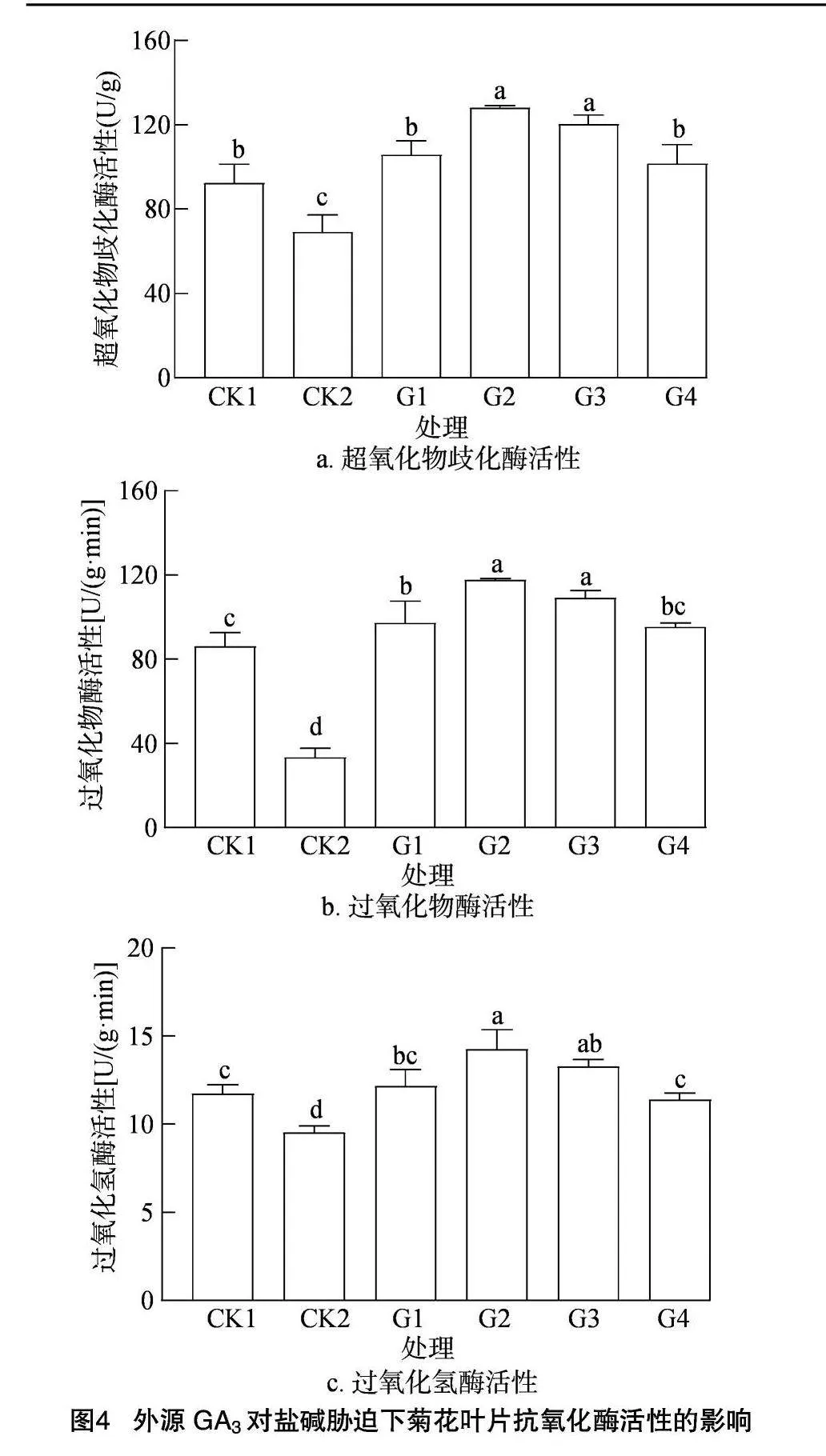
2.2.3 盐碱胁迫对菊花叶片抗氧化系统的影响 SOD、POD和CAT是植物体内主要的3种抗氧化酶,其活性可以反映植物对逆境胁迫的响应程度。SOD具有较强的催化活性,可以将超氧阴离子转化为H2O2和O2,而CAT、POD可以清除H2O2。SOD、POD和CAT三者通过协同作用,能够降低植物的氧化程度,从而实现抗氧化。
从图4可以看出,随着外源施用GA3浓度的增加,菊花幼苗叶片的3种酶活性均呈现先升高后降低的趋势,当GA3浓度增至G2处理的水平时,SOD活性最高,比盐碱处理高46.06%。由此可见,外源施用GA3显著提高了菊花幼苗叶片的SOD活性。由图4-b可知,在100 mmol/L盐碱胁迫下,G2处理菊花幼苗叶片的POD活性显著高于除G3处理外的其他处理,外源GA3使叶片POD活性提高了19.01%~253.37%。如图4-c所示,CK2的CAT活性比CK1低18.87%。喷施不同浓度GA3后,叶片的CAT活性显著上升,是CK2的1.20~1.50倍,其中G2处理的CAT活性最高,比CK2高50%。
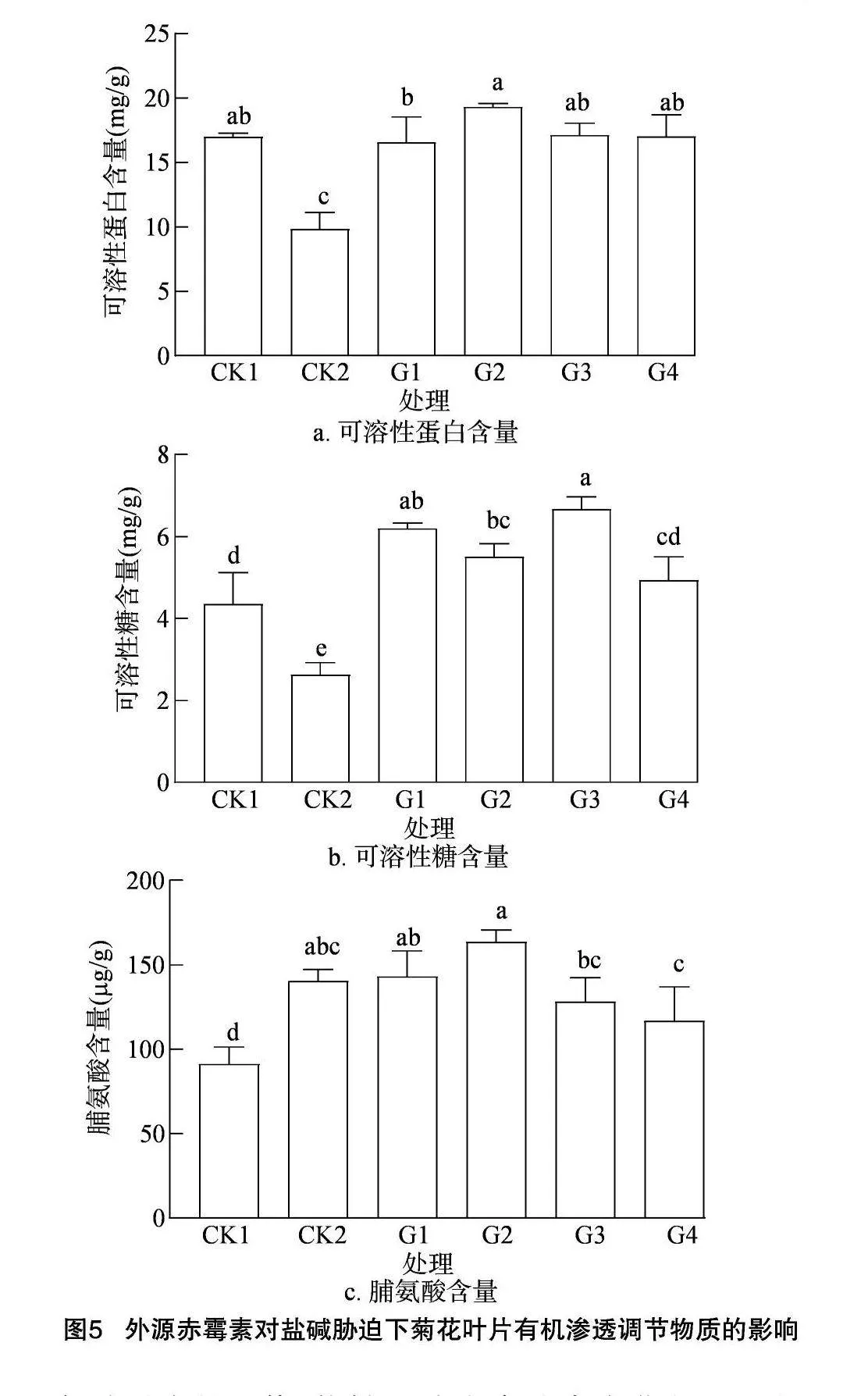
2.2.4 盐碱胁迫对菊花叶片有机渗透调节物质的影响 如图5所示,在盐碱处理后,菊花幼苗叶片的可溶性蛋白、可溶性糖含量显著降低,喷施GA3后,相较于盐碱处理可溶性蛋白、可溶性糖、脯氨酸含量均有大幅度提高,以G2处理提高的幅度最大,可溶性蛋白、可溶性糖、脯氨酸含量分别为CK1的1.97、2.54、1.10倍。由此可见,在一定浓度范围内,随着外源施用的GA3浓度的增加,菊花叶片中的可溶性蛋白、可溶性糖及脯氨酸含F8HvD54myiC+FzqnbpxvXkivsL0XBBt2Usex/BUfNZU=量有所提升,超过浓度范围,当浓度过大时相应含量会下降,说明喷施G2处理能够增强菊花对盐碱胁迫的抵抗能力。
2.3 外源GA3对盐碱胁迫下园林小菊幼苗光合的影响
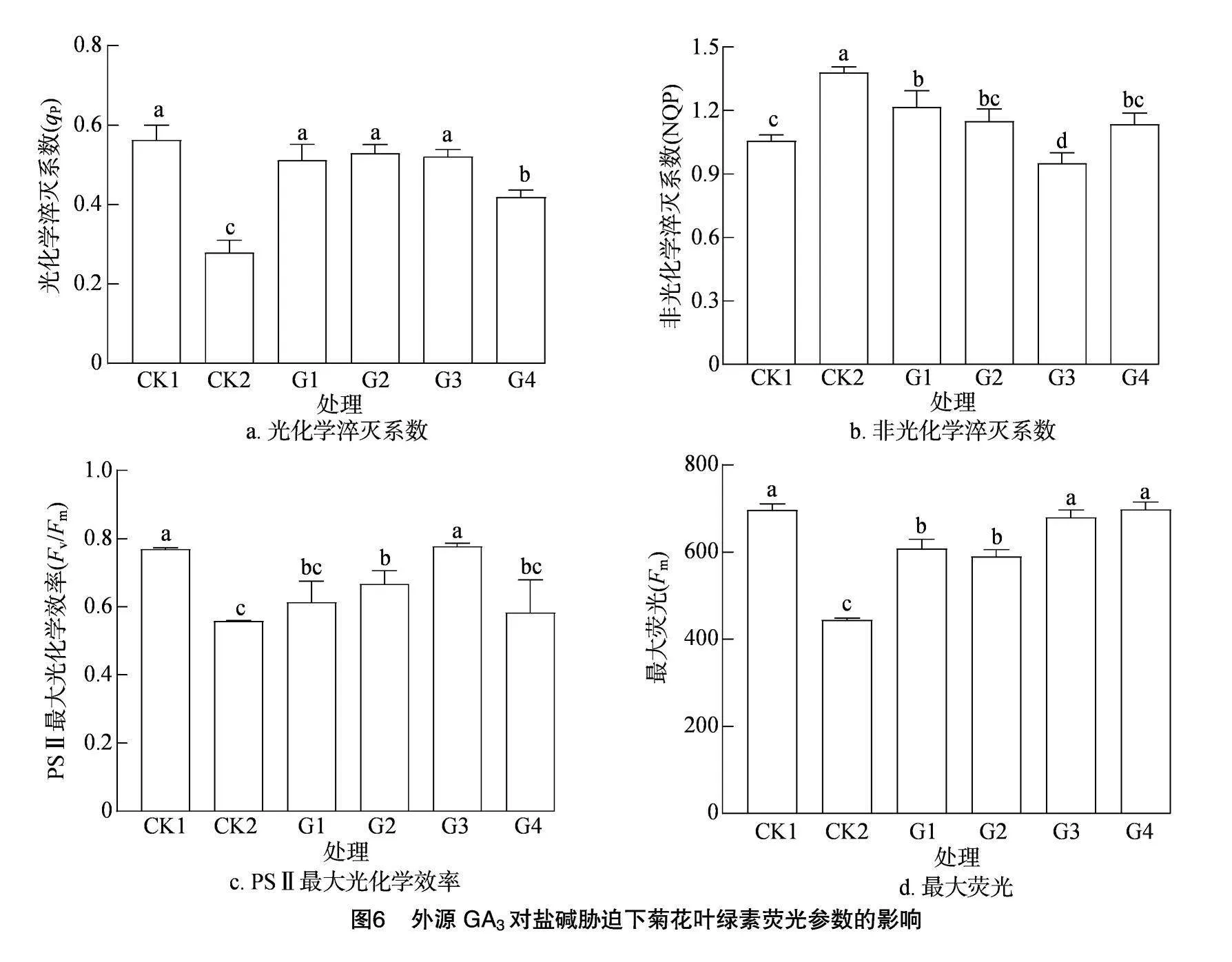
2.3.1 盐碱胁迫对菊花叶片叶绿素荧光的影响 从图6可以看出,在盐碱胁迫下,菊花叶片的PSⅡ最大光化学效率(Fv/Fm)、光化学淬灭系数(qP)和最大荧光(Fm)都显著低于CK1。外源喷施GA3后,Fv/Fm、qP、Fm显著升高。Fv/Fm值反映了PSⅡ的最大光化学量子产量,当Fv/Fm值降低时,光合效率也会降低。本研究结果表明,各处理的Fv/Fm值表现为CK1>G3处理>G2处理>G1处理>G4处理>CK2。可见,盐碱胁迫严重影响了菊花的光合器官活力。而外源喷施GA3后,各项荧光参数均显著恢复,说明在盐碱胁迫下,菊花受损的PSⅡ反应中心可在GA3的作用下恢复,其中G2处理的作用最明显,表明适宜浓度的GA3处理有利于提高盐碱胁迫下菊花幼苗对光能的捕获与利用能力。
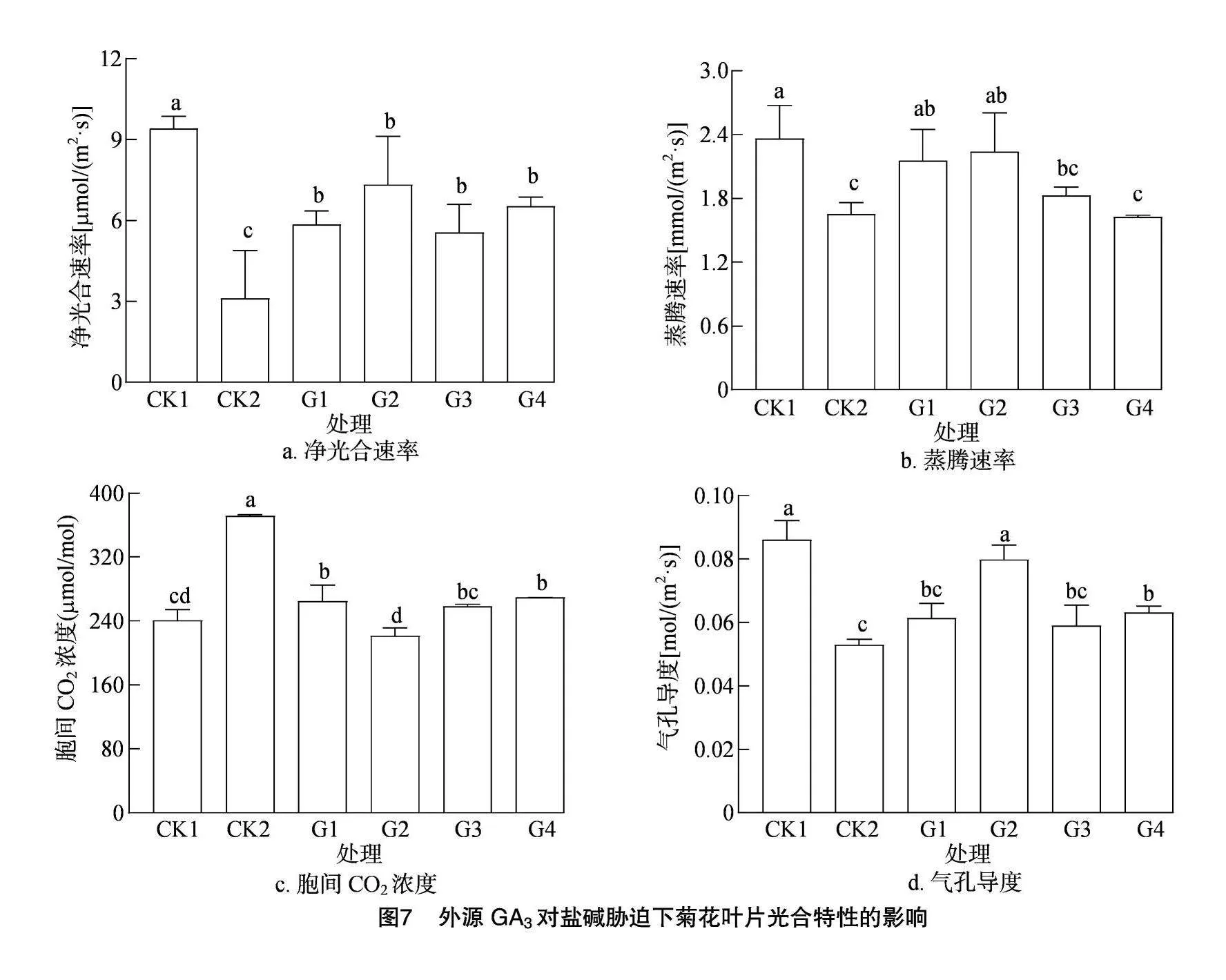
2.3.2 盐碱胁迫对菊花叶片光合参数的影响 从图7可以看出,在盐碱胁迫下,与CK1相比,菊花叶片的净光合速率、蒸腾速率及气孔导度均表现出降低的趋势,分别下降了67.02%、30.08%和38.37%。净光合速率是衡量光合作用强度的一个主要标志,用外源GA3处理后,各处理的净光合速率均显著升高,其中G2处理的增幅最大,相较于CK2增加了27.97%。气孔导度反映了植物对外界环境的响应,植物会根据不同环境条件来调节气孔的开张程度,确保植物在损失较少水分的条件下获取更多的CO2。胞间CO2浓度是CO2同化速率与
气孔导度的比值,能够反映光合速率变化的原因是否为气孔因素。由图7可以看出,当菊花受到盐碱胁迫时,气孔导度明显降低,G1~G4处理的气孔导度升高了16.16%~51.07%。
3 讨论与结论
在盐碱胁迫下,植物最直观的表现就是生长缓慢、发育受阻[11]。当菊科植物受到盐碱胁迫后,植株叶面积减小,地下、地上部分生物量降低[12]。本研究还证实,盐碱胁迫会使菊花幼苗叶片的相对含水量、叶绿素相对含量明显降低,外施GA3溶液能够明显提升菊花幼苗在盐碱胁迫下的相对含水量和叶绿素相对含量,表明施用GA3能够有效缓解盐碱胁迫对菊花幼苗生长的抑制作用。朱琨等对盐碱胁迫下紫花苜蓿、万寿菊的研究显示,外源喷施GA3能够显著增强其耐盐碱性[13-14]。而本研究在菊花苗期获得了与其吻合的结论,并证实GA3能够增强菊花对盐碱胁迫的抗性。
MDA是生物体中脂质过氧化作用的最终产物,在生物体中含量的高低可以在某种程度上反映植物受到的氧化损伤[15-16]。相对电导率也是一项能反映植物细胞膜状态的重要指标,当植物受到胁迫时,细胞膜会被破坏,进而导致细胞液流出,相对电导率增大[17]。在盐碱胁迫下,月季[18]、黄瓜[19]、小麦[20]、向日葵[21]等多种植物的相对电导率和MDA含量均有明显增加,说明盐碱胁迫会使细胞膜系统受到破坏。在本研究中,外源施用GA3后,相对电导率与MDA含量均低于盐碱处理,表明在盐碱胁迫下,施用外源激素GA3可以减少植物细胞膜的破损,保持细胞膜的稳定性。
植物在受到盐碱胁迫时,会产生大量的活性氧,并累积在细胞内,从而引起细胞膜通透性增加、增加膜脂过氧化产物MDA的含量,进而破坏植物的防御系统。SOD、POD和CAT是植物体内对抗外部不利环境的重要保护酶系统,它们能去除多余的活性氧,调节代谢的平衡,此外,它们可以清除过量的活性氧,调节代谢平衡[22-24]。本试验用100 mmol/L盐碱处理后,菊花幼苗叶片中SOD、POD、CAT活性的测定结果表明,在盐碱胁迫下,3种抗氧化酶活性均明显升高,这很有可能是在逆境中植物为了应对氧负离子含量快速升高而进行的一种自我保护响应机制[25]。在盐碱胁迫下对菊花幼苗进行不同浓度GA3处理,结果表明,随着外源激素浓度的增加,菊花幼苗叶片中的3种酶活性均呈现先升高后降低的趋势,当激素浓度增至G3处理水平时,酶活性均达到较大值,该结果与朱琨对外源赤霉素缓解紫花苜蓿幼苗盐胁迫的研究结果[13]一致,表明GA3可以通过增加SOD、POD、CAT的活性来抑制活性氧的生成,当激素浓度升高至G4处理水平时,酶活性呈现下降趋势,说明高浓度外源激素会对菊花起到抑制作用。
植物激素不但能够调控植物正常情况下的生长发育,而且能够调控植物在逆境下的生长适应性,并且适宜的外源激素和浓度可促进渗透调节物质的积累。本研究结果表明,在盐碱胁迫下,施用一定量GA3可以增强植物的渗透调节作用,使菊花叶片的可溶性蛋白、可溶性糖及脯氨酸含量有所提升,这与朱琨等对于GA3缓解盐碱胁迫的结论[13]基本一致。
在光合作用方面,除胞间CO2浓度外,盐碱15fb7910039399dc996494baddfc650b胁迫下的光合指标均降低,而用外源GA3处理后,各处理的光合指标均显著升高,其中G2处理的增幅最大。在本研究中,在盐碱处理下,菊花的净光合速率显著降低,在此过程中气孔导度、胞间CO2浓度均呈同步降低的趋势,说明叶片在短时间内的净光合速率降低是由气孔限制引起的,这与方必军对于干旱胁迫下野牡丹的研究结果[26]一致。但是用外源GA3处理后,菊花幼苗叶片的Pn、Tr和Gs显著提高。外源GA3处理很可能通过提高盐碱胁迫下菊花幼苗根系的吸水能力,更好地维持叶片的水分状态,进而减少盐碱胁迫对于菊花幼苗光合作用的气孔限制。这与江丽等用不同质量浓度赤霉素对茶树光合特性影响的研究结果[27]一致。
在本研究中,与盐碱胁迫相比,GA3处理的菊花幼苗的Fv/Fm、qP和Fm均显著升高,说明盐碱胁迫显著抑制了PSⅡ活性,而外源施用GA3后,各项荧光参数均显著恢复,这很可能与叶绿体构型的改变相关[28]。外源GA3显著提高了盐碱胁迫下菊花幼苗的Fv/Fm、qP和Fm,并显著降低了NPQ,表明GA3有利于减少盐碱胁迫下光能吸收与电子传递受到的抑制作用,从而缓解非气孔因素对菊花幼苗光合作用的限制。这与GA3处理对葡萄[29-30]、荔枝[31]影响的研究结果一致。
综上所述,盐碱胁迫影响菊花正常的生长发育,施用GA3可有效缓解盐碱胁迫对菊花生长的抑制作用,减少植株对Na+的吸收。外源喷施GA3可显著增强菊花幼苗SOD、POD和CAT等抗氧化酶活性,降低相对电导率和MDA含量,同时增加相对含水量和叶绿素相对含量,并促进可溶性糖、可溶性蛋白合成,这说明GA3能有效缓解盐碱胁迫,改善菊花幼苗的生长发育。在本试验中,100 mg/L GA3喷施处理缓解效果最明显,显著提高了菊花幼苗的耐盐碱性。
参考文献:
[1]李鸿渐,邵健文. 中国菊花品种资源的调查收集与分类[J]. 南京农业大学学报,1990,13(1):30-36.
[2]汤访评,陈素梅,陈发棣,等. 栽培菊与菊属:近缘属杂种远缘杂交的研究[J]. 园艺学报,2011,38(1):101-107.
[3]沈 瑶,王晗璇,侯海娴,等. 引进盆栽小菊品种观赏价值及园林应用的综合评价[J]. 广西植物,2021,41(8):1363-1371.
[4]郝洪波. 地被小菊的特点与园林应用[J]. 南方农业(园林花卉版),2007,1(6):38-40.
[5]管志勇,陈发棣,滕年军,等. 5种菊花近缘种属植物的耐盐性比较[J]. 中国农业科学,2010,43(4):787-794.
[6]Zhang Q,Liu Y Q,Jiang Y L,et al. OsASR6 enhances salt stress tolerance in rice[J]. International Journal of Molecular Sciences,2022,23(16):9340.
[7]Shang J X,Li X Y,Li C L,et al. The role of nitric oxide in plant responses to saltstress[J].International Journal of Molecular Sciences,2022,23(11):6167.
[8]Lee H G,Lee K,Seo P J. The Arabidopsis MYB96 transcription factor plays a role in seed dormancy[J]. Plant Molecular Biology,2015,87(4):371-381.
[9]童家赟,李韵璇,黄 欢,等. 温度、赤霉素和硝酸钾溶液浸种对毛冬青种子萌发的影响[J]. 北方园艺,2020(11):112-116.
[10]王 松,商全玉,杨秀峰,等. 赤霉素类化合物对作物的抗逆机制研究进展[J]. 现代化农业,2022(1):33-38.
[11]Chen T X,Shabala S,Niu Y N,et al. Molecular mechanisms of salinity tolerance in rice[J]. The Crop Journal,2021,9(3):506-520.
[12]范海霞,赵 飒,辛国奇,等. 外源NO对盐胁迫下菊花幼苗生理特性的影响[J]. 北方园艺,2020(19):70-77.
[13]朱 琨,刘骅峻,李 波. 外源赤霉素对缓解紫花苜蓿幼苗盐胁迫的作用研究[J]. 云南农业大学学报(自然科学),2022,37(6):926-931.
[14]韦朝妹,胡小京,莫 幻. 外源赤霉素对盐胁迫下万寿菊种子萌发与幼苗生长的影响[J]. 北方园艺,2022(16):69-75.
[15]Zaman N K,Abdullah M Y,Othman S,et al. Influence of water stress on phenological development,biomass production and yield of Malaysian aerobic and lowland rice[J]. Australian Journal of Crop Science,2019,13(12):1927-1935.
[16]李涛龙,胡笑涛,王文娥,等. 水分胁迫对玉米叶片脯氨酸和丙二醛含量的影响[J]. 节水灌溉,2017(6):34-37.
[17]刘 涛,陈海荣,汪成忠,等. 干旱和盐胁迫下百子莲的抗逆生理研究[J]. 浙江农业学报,2022,34(12):2669-2681.
[18]张凯泉,崔 艳. 盐胁迫对两种月季生理指标的影响[J]. 黑龙江农业科学,2022(11):45-50.
[19]陈浩婷,张铖锋,石 玉,等. 腐胺对等渗NaCl和Ca(NO3)2胁迫下黄瓜幼苗生长和生理特性的影响[J]. 山西农业科学,2022,50(9):1278-1289.
[20]刘贯园,李晓斌,肖玉梅,等. 五种脱落酸功能类似物对提高小麦抗盐胁迫的效应和机理[J]. 农药学学928def80a5ecaa767687838323d48989报,2022,24(5):1196-1205.
[21]邬雪瑞,李 军,武 悦,等. 盐胁迫对不同盐敏感性向日葵幼苗生长和生理特性的影响[J]. 北方农业学报,2022,50(4):18-25.
[22]MittlerR. Oxidative stress,antioxidants and stress tolerance[J]. Trends in Plant Science,2002,7(9):405-410.
[23]李文兵,王燕凌,李 芳,等. 水分胁迫下多枝柽柳体内活性氧与保护酶的关系[J]. 新疆农业大学学报,2007,30(1):30-34.
[24]李海霞,米银法,陈双臣. 干旱胁迫下6种观赏牡丹生理响应及耐旱性评价[J]. 江苏农业科学,2022,50(7):131-139.
[25]刁倩楠,蒋雪君,陈幼源,等. 外源水杨酸预处理对低温胁迫下甜瓜幼苗生长及其抗逆生理特性的影响[J]. 西北植物学报,2018,38(11):2072-2080.
[26]方必君,卓定龙,刘晓洲,等. 干旱胁迫及复水对野牡丹光合和叶绿素荧光参数的影响[J]. 热带农业科学,2023,43(2):44-49.
[27]江 丽,袁名安,李朵姣,等. 赤霉素及芸苔素内酯对茶树光合特性和茶果产量的影响[J]. 中国油脂,2022,47(7):38-44.
[28]MangabeiraP A,Ferreira A S,de Almeida A A F,et al. Compartmentalization and ultrastructural alterations induced by chromium in aquatic macrophytes[J]. Biometals,2011,24(6):1017-1026.
[29]张演义,贾海锋,赵方贵,等. 赤霉素处理夏黑葡萄果穗对叶片光合及荧光特性的影响[J]. 江苏农业学报,2014,30(6):1472-1479.
[30]李鹏程,郁松林,符小发,等. GA3对葡萄果实成熟期叶片光合及荧光特性的影响[J]. 西北农业学报,2010,19(3):144-149.
[31]李伟才,张红娜,石胜友,等. 成花诱导期喷施烯效唑和赤霉素对荔枝叶片叶绿素荧光特征的影响[J]. 热带作物学报,2014,35(12):2414-2419.

