48份小麦品种(系)抗条锈病和条锈病基因的分子标记检测及其抗性评价




摘要:为明确宁夏小麦品种(系)对小麦条锈病和赤霉病的抗病水平,采用与已知抗病基因紧密连锁的特异性标记法对48份小麦材料进行分子标记检测,并对供试小麦品种(系)进行系谱分析。通过对抗条锈病和抗赤霉病典型代表基因Yr5、Yr9、Yr10、Yr15、Yr18、Yr26、Yr30和Fhb1进行检测,并对其在宁夏小麦中的分布频率进行分析。结果表明,在48份参试品种(系)中,分别含有Yr5、Yr9、Yr10、Yr15、Yr18、Yr26、Yr30抗性基因的小麦材料有41、15、5、16、20、45、26份,占供试材料的85%、31%、1%、33%、41%、93%、54%;在所测的小麦品系中有42份供试材料携带Fhb1基因,占供试材料的87%。本研究,通过选用中国宁夏48份典型小麦品种(系)进行抗条锈病和赤霉病的分子标记检测,为作物育种和遗传研究提供有效遗传信息。
关键词:小麦;条锈病;分子标记;基因检测;种质资源;抗性评价
中图分类号:S435.121.4+2 文献标志码:A
文章编号:1002-1302(2024)18-0154-06
收稿日期:2023-10-31
基金项目:华北作物改良与调控国家重点实验室、河北农业大学引进人才项目(编号:NCCIR2021RC-6)。
作者简介:刁文达(1999—),男,河北邢台人,硕士研究生,从事玉米、小麦抗病性研究。E-mail:d16632233175@163.com。
通信作者:亢 玲,从事小麦抗病性研究,E-mail:kangling1005@163.com;闫晓翠,讲师,主要从事玉米、小麦抗病遗传育种,E-mail:yxc1234jy@163.com。
小麦(Triticum aestivum L.)是我国重要的粮食作物,对我国粮食的供给作出了重大贡献[1]。而小麦条锈病是世界上影响范围zsx+9fWw+SUeXo6v7PRE8RA8MXn+BRvdZJ3QSgZwCrI=较大的小麦病害之一,也是宁夏小麦产区主要病害之一,每年都会对宁夏小麦的产量造成严重损失,因此对宁夏小麦产区的遗传多样性进行分析,并为小麦抗病育种提供一些参考价值。小麦条锈病是一种由小麦条锈菌(Puccinia striiformis f. sp. tririci)引起的气传性真菌类病害,它的变异类型较多,分布范围较广,可降低感病品种的籽粒数量和品质,进而使产量减少40%[2-4]。小麦条锈病病原体可在种植季节的大部分生长阶段都感染小麦植株,主要是降低小麦的光合效率,进而导致植物有机物的合成减少。此外,赤霉病随气候的变化也对小麦的产量造成了严重影响。至目前为止,小麦赤霉病常发区已扩展到我国黄淮海南部麦区,且西北麦区也已日益加重,该病害已成为我国小麦产区常发性的重大小麦病害。已有研究人员发现,来源于望水白的Fhb1是目前抗性最高且应用广泛的抗赤霉病基因。利用已知分子标记对抗赤霉病基因Fhb1进行快速检测,从而筛选出获得小麦抗赤霉病的种质资源,为小麦抗赤霉病育种选择提供依据,但当前抗病资源匮乏、抗性遗传基础狭窄是我国小麦在抗病育种中面临的主要问题[5-6]。要解决以上问题,必须发掘新的抗病种质,挖掘新的抗病基因,才能丰富其遗传多样性[7]。然而,喷施农药对小麦条锈病和赤霉病进行防治,尽管能够达到一定的控制效果,但它的成本昂贵,而且还会对生态环境造成影响,而使用抗锈品种是减少各种作物病害损害的最经济和有效的方法[8-9]。
自20世纪50年代条锈病广泛流行以来,我国对该病的流行和管理进行了广泛的研究。小麦的病害防治对于小麦的产量来说至关重要,迄今,在国际上以Yr系统正式命名的主效抗条锈病基因共有84个位点,即Yr1~Yr84[10-11];其中大多数在小麦的所有生长阶段对叶锈病都有效,在苗期很容易被识别,这被称为全生育期抗性(all stage resistance,简称ASR),这种类型的抗性通常由1个在幼苗期开始表达的单一基因控制(幼苗抗性)。然而,一些Lr基因通常在成株期阶段表达,这种类型的抗性被称为成株植物抗性(adult plant resistance,简称APR),进一步分为小种专化特异性和非小种专化特异性2种类型[12-13]。由于小麦的抗病基因对品种小种的专化性很强,在生产上使用的抗病基因很容易随着毒力的频繁变化而失去抗性[14-16]。由于小麦可以在不同的地理和气候条件下种植,锈病病原体在不同的环境条件下也展现了增强的适应能力。如果气候条件适合锈病,并在大面积内种植单一抗性小麦品种,这些品种便可以产生抗性。
本研究利用分子标记检测和系谱分析方法对48份供试材料进行抗病基因筛选,其目的是通过分子标记诊断和家系分析来鉴定小麦品种(系)和改良种质的抗性。了解这些小麦品种(系)的抗性,挖掘新的抗性种质资源,对我国小麦抗锈性育种的筛选具有重要价值。
1 试验材料与方法
1.1 试验材料
48份供试宁夏小麦材料(表1)(感条锈病的对照品种Avocet S、感赤霉病对照品种Tatara以及含有已知抗赤霉病基因的品种Yr27),由宁夏农林科学院农作物研究所提供。已知条锈病抗性基因阳性对照材料包括Yr5(T.spelta Album)、Avocet S*6/Yr9、Avocet S*6/Yr10/6、Avocet S*6/Yr15/6、Avocet S*6/Yr18、Avocet S*6/Yr26、Yr30(Opata85)、Avocet S;郑州5389作为阴性对照材料;赤霉病以Tatara品种为阳性对照、郑州5389为阴性对照。条锈病和赤霉病分子标记检测于2022—2023年间在河北农业大学华北作物种质资源研究与利用省部共建教育部重点实验室完成。
1.2 小麦基因组DNA的提取与分子检测
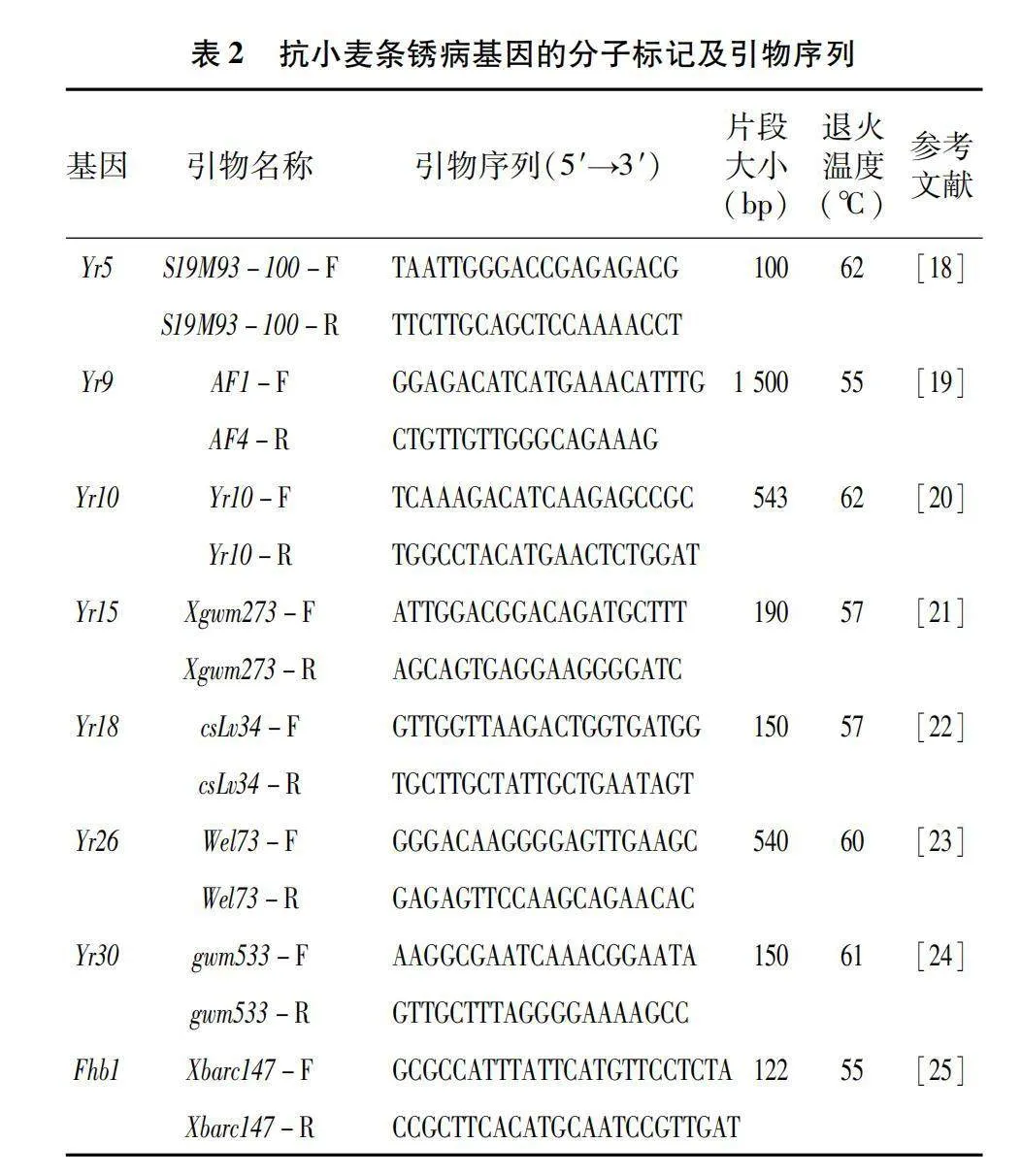
将供试小麦材料种植于育苗盘内,以营养土和蛭石3∶1的比例进行种植,播种20~25粒/盆饱满的种子,覆土,在底部浇水,使其吸收并直至土壤湿润移出,放到22~25 ℃室内培养6~8 d,待用。待幼苗长到3叶期时用CTAB法提取基因组DNA[17],然后进行Yr基因检测,用于检测分子标记引物,该引物由北京擎科生物科技股份有限公司合成(表2)。
1.3 PCR扩增
选取国际上主效抗条锈病基因Yr5[18]、Yr9[19]、Yr10[20]、Yr15[21]、Yr18[22]、Yr26[23]、Yr30[24]以及抗赤霉病基因Fhb1[25]共8个紧密连锁分子标记,对所供试的48份小麦材料进行鉴定。PCR扩增反应体系:2×Taq Master Mix 10 μL;10 μmol/L上游特异引物 0.5 μL,终浓度为0.1~0.3 μmol/L;10 μmol/L下游特异引物0.5 μL,终浓度为0.1~0.3 μmol/L;模板DNA 2 μL;补水至20 μL。PCR扩增反应程序:预变性95 ℃ 3 min;变性95 ℃ 15 s,退火55~62 ℃ 15 s,延伸 72 ℃ 15 s,35次循环;延伸72 ℃ 5 min。
2 结果与分析
2.1 已知抗条锈病基因分子标记检测结果
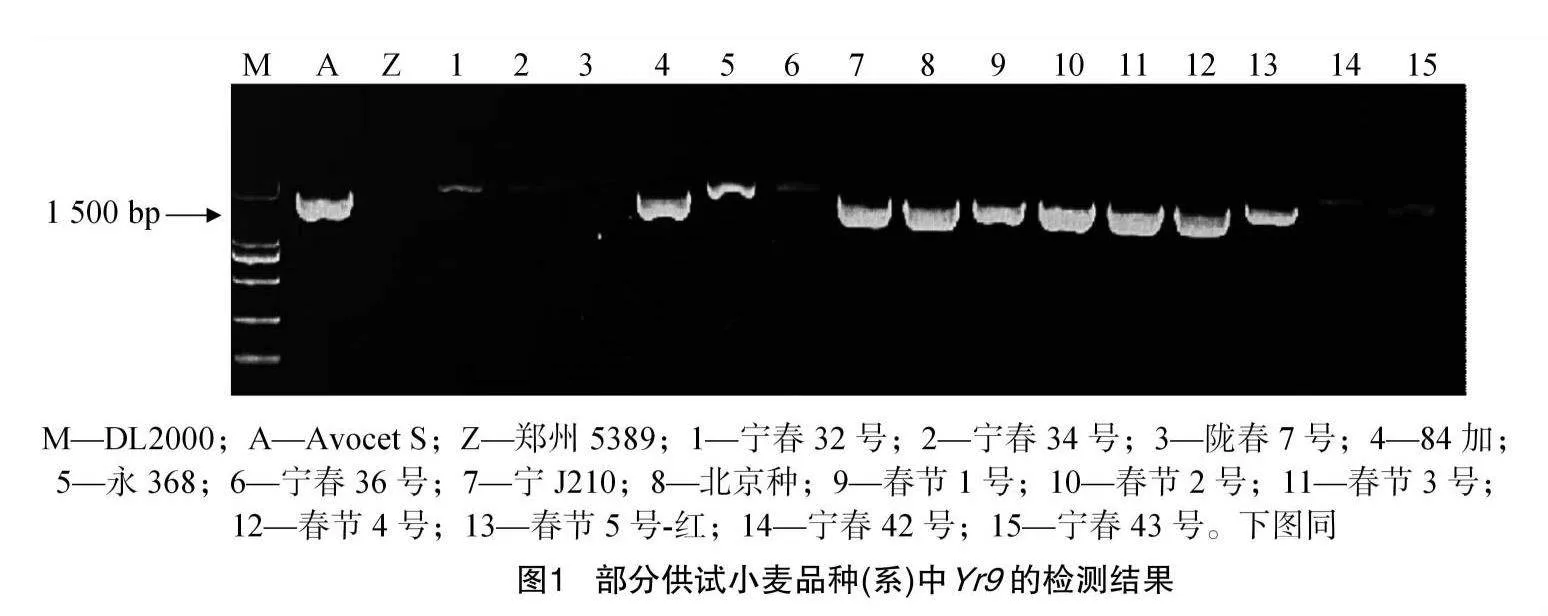
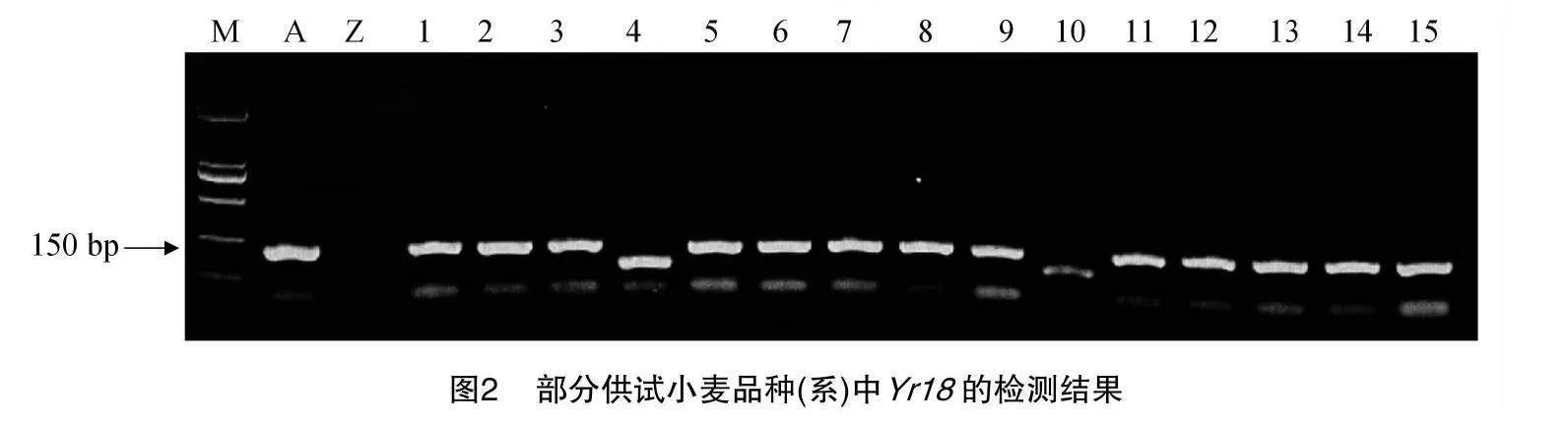
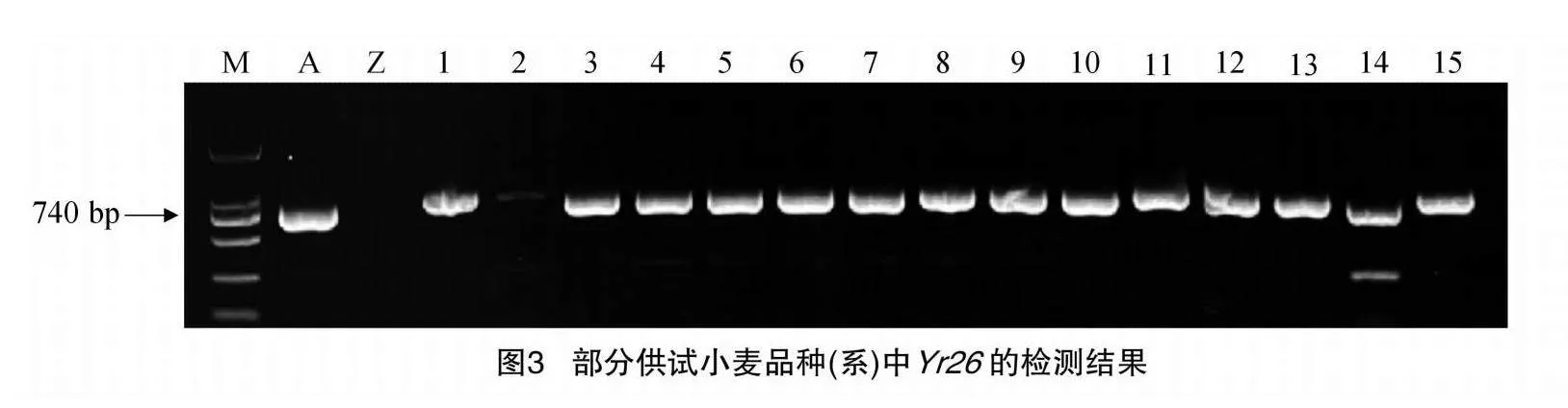
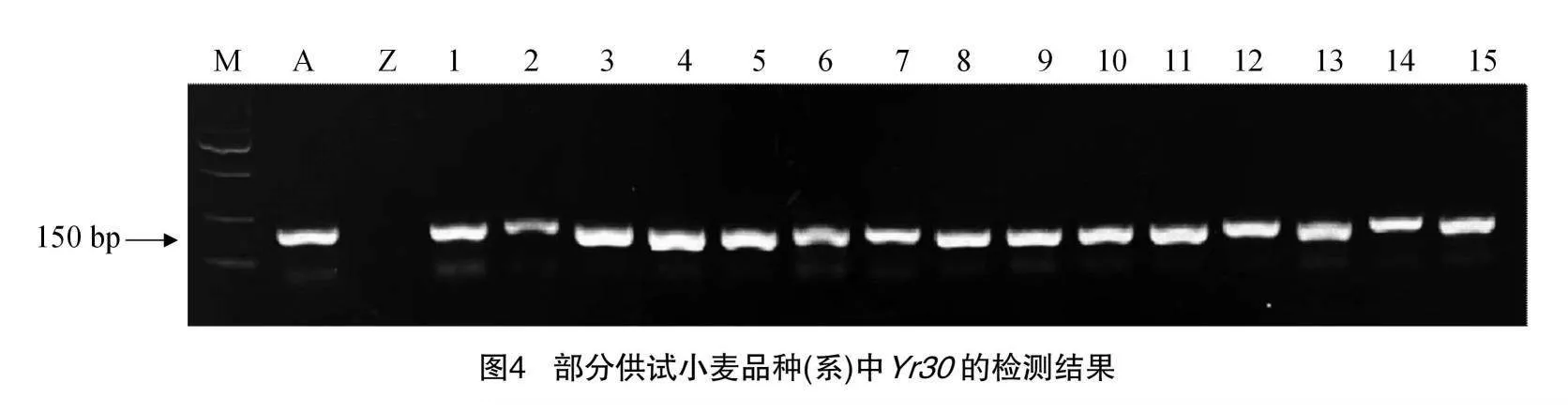
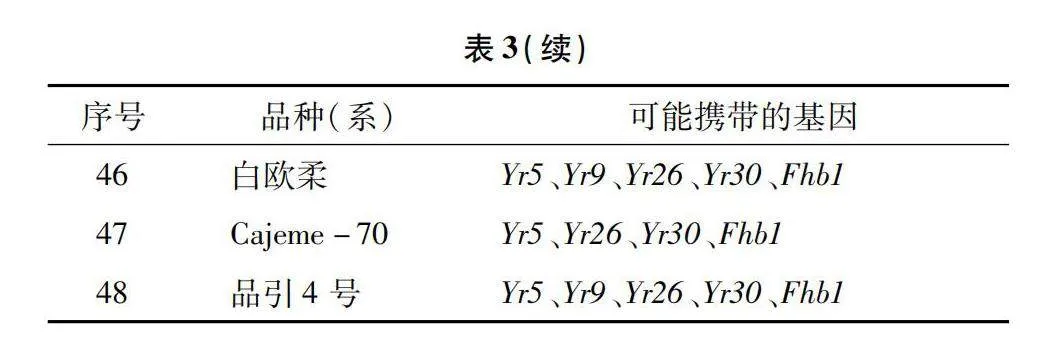
48份供试材料是来自于宁夏小麦主产区,所有供试材料可能携带的基因均列在表3。以感病材料Acocet S为阳性对照,对其供试材料的抗条锈病基因Yr5、Yr9、Yr10、Yr15、Yr18、Yr26、Yr30已知标记检测。结果(表3)显示:以Avocet S为阳性对照,在宁春32号、宁春33号和宁春35号等41份材料中,均可以扩增出100 bp的目的条带,表明这些材料中可能含有Yr5这个基因;Avocet S*6/Yr9为阳性对照,发现在15份小麦材料可以扩增出1 500 bp的抗条锈病基因Yr9目的条带(图1),说明这些供试材料中均携带有Yr9;宁春33号、34号、35号、36号和宁春39号5份材料中鉴定出含有Yr10,且目的条带为543 bp的条带;以Avocet S*6/Yr15为阳性对照,在宁春32号、陇春7号和春山4号等16份供试材料中,可以扩增出与Yr15紧密连锁的目的条带190 bp,表明在这些材料中均携带有Yr15抗病基因;用Avocet S*6/Yr18为阳性对照,在宁春32号、33号和宁春44号等20份小麦材料中,均可以扩增出150 bp的Yr18目的条带(图2),这表明这21份供试小麦材料中含有Yr18抗病基因;同理,以AvocetS*6/Yr26为阳性对照,在春山1号、索诺拉64和陇春7号等45份材料,均携带有抗条锈病基因Yr26(图3);索诺拉64、陇春7号和宁春44号等26份材料,均含有抗条锈病基因Yr30(图4)。此外,分别对这8个已知广谱抗条锈病基因在所有供试小麦材料中进行占比分析,结果表明:其携带有抗条锈病基因Yr5、Yr9、Yr10、Yr15、Yr18、Yr26、Yr30,分别占供试材料的85%、31%、1%、33%、41%、93%、54%。
2.2 抗赤霉病基因Fhb1的分子标记检测结果
对48份供试小麦品种(系)进一步利用抗赤霉病基因Fhb1的特异功能连锁SSR标记Xbarc147进行检测,且以Tatara(携带Fhb1)为阳性对照;结果表明(图5),48份供试小麦材料中可成功扩增出与Fhb1目的条带(122 bp)相一致的材料有42份(如宁春34号、35号和宁春44号等),且占比达到87%。这表明在宁夏小麦材料中普遍携带有抗赤霉病基因,且对赤霉病有一定的抗性,为抗赤霉病遗传育种的研究提供良好的供试材料。
3 讨论
分子标记为基因检测提供了一种更有效和更经济的方法[26]。本研究使用已知抗病基因紧密连锁标记来检测8个已知抗病基因在48份宁夏小麦种质资源上的分布情况。结果显示,在同一供试材料中可能均携带有2个以上抗病基因存在,其宁春38号中携带有抗条锈病基因Yr5和Yr15,该品种由永T2945与永1265(Veer后代)杂交,经宁夏永宁县
小麦育繁所育成,其具有良好的抗条锈病。至今,在国内外Yr5和Yr15仍然是少有的几乎对所有条锈病菌表现出广谱抗性[27-28],且普遍应用于西北(四川)和西南(宁夏)麦区的小麦育种中。Bastian材料中携带有抗叶锈病基因Lr26和抗赤霉病基因Fhb1,表明Bastian对叶锈病和赤霉病具有良好的抗性。宁春40号品种同时携带Yr5、Yr15、Yr26、Fhb1,该品种是宁夏大学以中宁58912和永1712进行杂交,采用杂交系谱法选育优良单株,系统选育而成,高抗锈病。
目前我国在小麦21条染色体上已经定位超过250个抗性位点[29-30],其中Fhb1是世界上公认的主效基因,这个基因已经被克隆,这为利用该基因进行分子标记辅助选择提供了便利。本研究通过对48个供试小麦材料的遗传分析,结果表明,这些标记物稳定,可用于基因检测。在所有携带有抗条锈病基因分Yr5、Yr9、Yr10、Yr15、Yr18、Yr26和Yr30中,Yr26占比最大,说明Yr26作为抗锈病源仍广泛用于生产品种中。但我们应合理利用不同类型的抗性基因,发掘优良抗源,为小麦抗病育种及病害精准防控提供参考。
参考文献:
[1]郭天财. 试论中国的小麦生产与国家粮食安全[C]//农业科技创新与生产现代化学术研讨会论文集.苏州,2001:118-123.
[2]李振岐,商鸿生. 小麦锈病及其防治[M].上海:上海科学技术出版社,1989.
[3]黄 亮,刘太国,肖星芷,等. 中国79个小麦品种(系)抗条锈病评价及基因分子检测[J]. 中国农业科学,2017,50(16):3122-3134.
[4]Wellings C R. Global status of stripe rust:a review of historical and current threats[J]. Euphytica,2011,179(1):129-141.
[5]GilliganC A. Sustainable agriculture and plant diseases:an epidemiological perspective[J]. Philosophical Transactions of the Royal Society of London(Series B:Biological Sciences),2008,363(1492):741-759.
[6]Thrall P H,Laine,A L,Ravensdale,M,et al. Rapid genetic change underpins antagonistic coevolution in a natural host-pathogen metapopulation[J]. Ecology Letters,2012,15(5):425-435.
[7]周 军,李魁印,张 立,等. 242份小麦品种(系)成株期抗条锈病鉴定及分子标记检测[J]. 河南农业科学,2020,49(6):84-97.
[8]杨文香,刘大群. 小麦抗叶锈基因的定位及分子标记研究进展[J]. 中国农业科学,2004,37(1):65-71.
[9]闫红飞,杨文香,陈云芳,等. 偃麦草属E染色体组特异SCAR标记对Lr19的特异性和稳定性研究[J]. 植物病理学报,2009,39(1):76-81.
[10]McIntosh R A,Hart G E,Gale M D. Catalogue of gene symbols for wheat:2021 supplement[J]. Annual Wheat Newsletter,2021,67:104-113.
[11]KlymiukV,Chawla H S,Wiebe K,et al. Discovery of stripe rust resistance with incomplete dominance in wild emmer wheat using bulked segregant analysis sequencing[J]. Communications Biology,2022,5(1):826.
[12]Wan A M,Chen X M,He Z H. Wheat stripe rust in China[J]. Australian Journal of Agricultural Research,2007,58(6):605.
[13]张海泉. 小麦抗白粉病分子育种研究进展[J]. 中国生态农业学报,2008,16(4):1060-1066.
[14]詹海仙,畅志坚,杨足君,等. 小麦抗白粉病基因来源及抗性评价的研究进展[J]. 中国农学通报,2010,26(10):42-46.
[15]李 欣,畅志坚,詹海仙,等. 小麦抗条锈病基因来源及染色体定位的研究进展[J]. 中国农学通报,2015,31(5):92-95.
[16]曾庆东,沈川,袁凤平,等. 小麦抗条锈病已知基因对中国当前流行小种的有效性分析[J]. 植物病理学报,2015,45(6):641-650.
[17]徐如宏,任明见,思彬彬,等. 贵农001中抗白粉病基因的RAPD标记研究[J]. 山地农业生物学报,2005,24(4):283-286.
[18]Smith P H,Hadfield J,Hart N J,et al. STS markers for the wheat yellow rust resistance gene Yr5 suggest a NBS-LRR-type resistance gene cluster[J]. Genome,2007,50(3):259-265.
[19]Francis H A,Leitch A R,Koebner R M D. Conversion of a RAPD-generated PCR product,containing a novel dispersed repetitive element,into a fast and robust assay for the presence of rye chromatin in wheat[J]. Theoretical and Applied Genetics,1995,90(5):636-642.
[20]Singh R,Datta D,Priyamvada,et al. A diagnostic PCR based assay for stripe rust resistance gene Yr10 in wheat[J]. Acta Phytopathologica et Entomologica Hungarica,2009,44(1):11-18.
[21]Peng J H,Fahima T,Röder M S,et al. Microsatellite high-density mapping of the stripe rust resistance gene YrH52 region on chromosome 1B and evaluation of its marker-assisted selection in the F2 generation in wild emmer wheat[J]. New Phytologist,2000,146(1):141-154.
[22]Lagudah E S,McFadden H,Singh R P,et al. Molecular genetic characterization of the Lr34/Yr18 slow rusting resistance gene region in wheat[J]. Theoretical and Applied Genetics,2006,114(1):21-30.
[23]Zeng Q D,Han D J,Wang Q L,et al. Stripe rust resistance and genes in Chinese wheat cultivars and breeding lines[J]. Euphytica,2014,196(2):271-284.
a19b963c2fc3320006079bd13a4fff77de650e56c509cf0b9908ae82664d12c3[24]张 悦. 中国小麦主产区305份品种抗条锈病评价及抗病基因分析[D]. 杨凌:西北农林科技大学,2022.
[25]Liu S X,Pumphrey M O,Gill B S,et al. Toward positional cloning of Fhb1,a major QTL for Fusarium head blight resistance in wheat[J]. Cereal Research Communications,2008,36(6):195-201.
[26]郭 瑞,姚维成,陈 琛,等. 镇麦品种相关品质性状基因的分子标记检测分析[J]. 江苏农业学报,2023,39(1):1-14.
[27]BuerstmayrH,Lemmens M,Hartl L,et al. Molecular mapping of QTLs for Fusarium head blight resistance in spring wheat. Ⅰ. Resistance to fungal spread (Type Ⅱ resistance)[J]. Theoretical and Applied Genetics,2002,104(1):84-91.
[28]Jia H Y,Zhou J Y,Xue S L,et al. A journey to understand wheat Fusarium head blight resistance in the Chinese wheat landrace Wangshuibai[J]. The Crop Journal,2018,6(1):48-59.
[29]Marchal C,Zhang J P,Zhang P,et al. BED-domain-containing immune receptors confer diverse resistance spectra to yellow rust[J]. Nature Plants,2018,4(9):662-668.
[30]Klymiuk V,Yaniv E,Huang L,et al. Cloning of the wheat Yr15 resistance gene sheds light on the plant tandem kinase-pseudokinase family[J]. Nature Communications,2018,9(1):3735.

