富血小板血浆治疗毛发移植术后脱落期毛发脱落的效果研究





【摘要】 目的 探讨富血小板血浆(PRP)治疗对毛发移植术后脱落期毛发脱落的影响,分析其潜在的机制。
方法 搜集2020年1月至2023年6月毛发移植联合PRP注射治疗病例进行分析。根据随机数字表将患者分为PRP组和对照组各15例,PRP组分别在术中和术后1、2、3、4个月头皮注射PRP,对照组注射生理盐水。分别在术后1、3、6、10个月计算成活率。术后10天进行取材,分析血管密度值(MVD),免疫印记实验检测细胞外信号调节激酶1/2(ERK1/2)和p38丝裂原活化蛋白激酶(p38 MAPK)通路激活水平。
结果 术后第1、3、6个月,PRP组存活率均高于对照组,差异有统计学意义(P<0.05)。术后10天PRP组MVD值和ERK1/2磷酸化水平明显高于对照组(P<0.001)。
结论 PRP治疗可有效改善毛发移植术后脱落期毛发的脱落,其机理可能是通过调控ERK1/2通路的激活来促进早期血运循环的建立,从而改善毛发生长周期。
【关键词】 毛发移植;富血小板血浆;毛发脱落;血管新生;细胞外信号调节激酶1/2;p38 丝裂原活化蛋白激酶
中图分类号:R758.71 文献标志码:A DOI:10.3969/j.issn.1003-1383.2024.09.006
Study on the effect of platelet-rich plasma in the treatment of hair loss during shedding period after hair transplantation
TENG Xiaopin, PAN Xinyuan▲
(Department of Medical Cosmetology, Guangxi Hospital Division of the First Affiliated Hospital, Sun Yat-sen University, Nanning 530001, Guangxi, China)
【Abstract】 Objective To investigate the effect of platelet-rich plasma (PRP) in the treatment of hair loss during shedding period after hair transplantation, and to analyze the potential mechanisms.
Methods Cases of hair transplantation combined with PRP injection treatment from January 2020 to June 2023 were collected and analyzed. According to random number table, patients were divided into PRP group and control group, with 15 cases in each group. The PRP group were given scalp injections of PRP during surgery and at one month, two months, three months and four months after surgery, respectively, and the control group were treated with saline injection. The survival rates at one month, three months, six months, and ten months after surgery were calculated. Samples were collected ten days after surgery to analyze microvessel density (MVD) and immunoblotting experiments were performed to detect the activation levels of extracellular regulated protein kinases 1/2 (ERK1/2) and p38 mitogen-activated protein kinase (p38 MAPK) pathways.
Results At the first, the third, and the sixth month after surgery, the survival rate of the PRP group was higher than that of the control group, and difference was statistically significant (P<0.05). Ten days after surgery, the MVD value and ERK1/2 phosphorylation level in the PRP group were significantly higher than those in the control group(P<0.001).
Conclusion PRP treatment can improve hair loss during the shedding period after hair transplantation, and its mechanism may contribute to the establishment of early blood circulation by regulating the activation of ERK1/2 pathway, thus improving hair growth cycle.
【Keywords】 hair transplantation; platelet-rich plasma (PRP); hair loss; neovascularization; extracellular regulated protein kinases 1/2 (ERK1/2); p38 mitogen-activated protein kinase (p38 MAPK)
雄激素性脱发(androgenic alopecia,AGA)是一种常见的慢性脱发疾病,发病率较高,严重影响美观。毛发移植改善脱发外观行之有效,技术成熟,术后成活率较高,一般都能达到满意的效果[1]。但目前毛发移植仍存在术后经历脱落期的问题。毛发移植术后,毛囊快速进入退行期、休止期,表现为移植的毛发脱落,生长缓慢。该过程一般出现在术后2~3周,全程经历3~6个月不等,严重影响术后外观,容易造成患者术后焦虑情绪[2]。因此如何减少术后的毛发脱落成为急需解决的问题。
富血小板血浆(platelet-rich plasma,PRP)是从全血中提取的,并富含浓缩血小板的血浆。血小板α-颗粒的活化释放多种生长因子,包括转化生长因子(TGF)、血小板源性生长因子(PDGF)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)、胰岛素样生长因子(IGF)、白细胞介素-1(IL-1)等[3]。每一种因子在促进头发生长和维持毛囊生长周期方面都发挥重要作用[4]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)参与细胞的生长、凋亡和分化,其中细胞外信号调节激酶(ERK)和p38丝裂原活化蛋白激酶(p38 MAPK)是MAPK的重要成员。研究表明,ERK是生长因子促进毛发再生的重要信号通路之一,其激活促进真皮乳头细胞和毛囊细胞的增殖,加快毛囊从休止期转化为生长期[5]。p38 MAPK的磷酸化可调控细胞的衰老和凋亡,并且调控Wnt/β-catenin信号通路,在毛发周期调控中起关键作用[6-7]。上述研究提示,MAPK信号通路与毛发生长密切相关,PRP影响毛发移植存活率的过程是否涉及MAPK信号通路的调控值得探讨。因此,本研究搜集了2020年至2023年毛发移植联合PRP注射治疗病例,观察PRP治疗对毛发移植术后脱落期毛发脱落的影响,并通过检测血管密度值的差异以及ERK1/2和p38 MAPK的激活,初步分析其潜在机制。
1 资料与方法
1.1 一般资料
选取2020年1月至2023年6月期间在我院接受毛发移植手术的患者资料作为研究基础。本研究共纳入了30名符合特定标准的毛发移植患者,根据随机数字表将患者分为两组:PRP治疗组与对照组各15例。本研究获得了我院伦理委员会的正式批准,确保所有参与研究的患者均在充分了解研究内容后,自愿选择参与,并签署了相应的知情同意书。
1.2 纳入和排除标准
纳入标准:① 符合雄激素性脱发的诊断;② 年龄在20至39岁之间;③ 移植区域位于前发际,毛囊数量在2000至3000个之间;④ 头皮无瘢痕、毛囊炎、脂溢性皮炎等疾病,术前常规体检无异常;⑤ 术前均签署知情同意书,术后能够配合复诊及治疗的患者。 排除标准:① 头皮存在瘢痕性脱发、各类皮炎等问题;② 术前体检不合格者;③ 无法配合完成相关治疗和随访者。
1.3 主要实验材料
本实验所使用的Anti-CD31 antibody(ab9498)采购自英国的Abcam公司。而Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) antibody(#9101)、p44/42 MAPK (Erk1/2) antibody(#4695)、Phospho-p38 MAPK (Thr180/Tyr182) antibody(#4511)、p38 MAPK antibody(#8690)以及GAPDH antibody(#5174)则均采购自美国的CST公司。免疫组化试剂盒则来源于中国的北京中杉金桥生物技术有限公司。此外,实验中所使用的IRDye-800CW二抗则采购自美国的LI-COR公司。
1.4 方法
1.4.1 PRP提取方法
本研究采用仪器分离(四川南格尔NGL HDS928)。仪器设置为采集血小板模式,最大循环量为5000 mL,血浆采集量为10 mL,采血速度为50~70 mL/min,抗凝剂比例为1∶10,工作系数为12,血小板容量为40 mL。采集完毕后,收集血小板制品(PRP)并进行PRP计数,每袋分装8 mL,以备后期使用。
1.4.2 手术方法
术前设计毛发移植范围,按种植密度35~45毛囊单位/cm2计算所需移植毛囊数量,术前头皮备皮,留毛干1~2 mm长。手术常规消毒后铺巾,采取局部环形阻滞浸润麻醉。手术采用毛囊单位提取术(follicular unit extraction,FUE)提取毛囊单位,具体方法为:应用内径0.9 mm的环钻,以2500~3000 r/min的转速平行于毛干向下钻取,随后用镊子拔出毛囊组织,并在0~4 ℃的林格氏液中进行体外保存。受区局部浸润麻醉后,进行常规毛发种植。所有手术由同一手术组完成,包括一名医生和两名护士。
1.4.3 PRP注射治疗及效果评估
PRP组在术中毛囊种植前2小时进行PRP注射治疗,对照组则以注射生理盐水作为对照。注射时间点选在毛发移植术中,以及术后第1、2、3、4个月,共注射5次。PRP注射区域为前发际头皮区域(毛囊种植区域及周边区域),注射层次为皮内注射。每个注射点注射0.1 mL PRP,注射点间隔为1.0 cm,每次PRP注射总量为8 mL。每次PRP注射完毕后观察20分钟,若无不适情况方可离院。对照组注射生理盐水,注射方法与PRP组相同。每位患者术后禁用非那雄安、米诺地尔、光电类生发等治疗,并在术后1、3、6、10个月评估毛发生长状态及头皮状态。随机选取3处供区头皮,每处面积为1 cm2,计算毛发存活率,毛发存活率 = (观察时间段内1 cm2毛干数量/术后即刻1 cm2毛干数量) × 100%。
1.4.4 血管密度值(microvessel density, MVD)检测
本研究所提取的组织标本经过医院伦理委员会审批,且用于科学研究时获得了患者的授权。手术后,共有12名患者同意参与本研究,其中6例为PRP治疗组,6例为对照组。在植发术后10天,使用内径3.0 mm的疤痕环钻对毛发种植区的毛囊及周边头皮组织进行取样。标本保存于10%福尔马林中,固定48小时后,依次通过50%、70%、80%、95%的酒精和无水酒精进行脱水,随后用二甲苯浸泡透明,将组织包埋于58 ℃的石蜡中制成蜡块。蜡块放置于切片机中,连续切片厚度为5 μm。脱蜡后的组织切片用3% H2O2孵育10分钟,随后应用0.01 mol柠檬酸盐缓冲液(pH 6.0)进行抗原修复。接着,滴加10%山羊血清至组织切片上,在室温下孵育10分钟以进行封闭。然后,滴加1∶500稀释的CD31抗体,在4 ℃条件下孵育过夜。抗体孵育结束后,加入适量的生物素标记二抗工作液,清洗抗体孵育液后,滴加DAB显色液进行显色,显色时间为3分钟。最后,滴加苏木素染液孵育5分钟。使用显微镜(Olympus BX53,日本)在200×倍数下观察染色结果,并随机选取每张切片毛囊附近组织的3个区域进行拍摄,记录血管数量。MVD计算公式为:血管平均个数/0.74 mm2(视野)。
1.4.5 免疫印记实验
将新鲜标本组织放入含有PMSF和磷酸酯酶抑制剂的裂解液中匀浆。匀浆液以转速为12 000 r/min离心5分钟,提取上清液中的组织总蛋白,并保存于-80 ℃冰箱中。将制好的分离胶放置在电泳槽中,加入适量的电泳缓冲液,然后上样蛋白,90 V恒压电泳2小时。接着,应用电转移法将蛋白转移至PVDF膜(转移电极恒压100 V转移120分钟)。将洗净的PVDF膜放入稀释浓度为1∶1000的一抗稀释液中,在4 ℃摇床孵育过夜。孵育结束后,应用PBST缓冲液进行清洗,然后将膜放入稀释比例为1∶10 000的IRDye-800CW二抗中,在常温下避光孵育2小时。最后,使用LI-COR扫描仪扫描显影的蛋白条带,并采用Odyssey系统分析数据。
1.5 统计学方法
使用SPSS 26.0统计软件进行数据分析。计量资料符合正态分布以均数±标准差(±s)表示,两组间比较采用独立样本t检验。检验水准:α=0.05,双侧检验。
2 结 果
2.1 一般资料比较
对照组和PRP组的研究对象年龄、受区面积、移植毛囊数、手术时间等比较差异无统计学意义(P>0.05),具有可比性。见表1。
2.2 PRP治疗缓解毛发移植术后脱落期
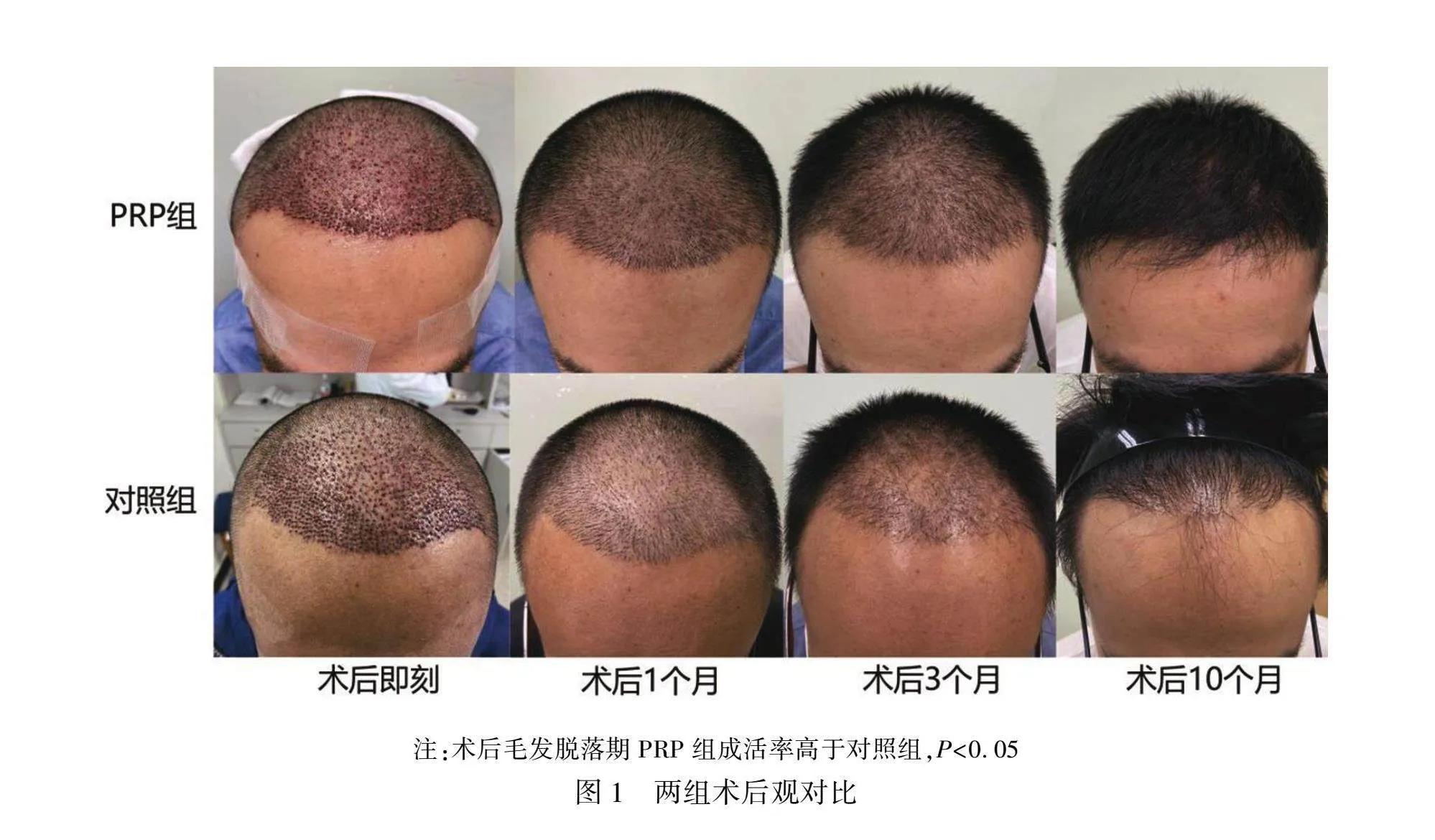
毛发移植术后,毛干长长,部分患者供区头皮潮红,所有病例未见皮疹形成、头皮坏死、感染等并发症。术后1个月,可观察到移植的毛发明显脱落,术后6个月新毛干逐渐长出,直至术后10个月趋向稳定。经计算,在毛发移植后1、3、6个月,PRP组存活率均高于对照组,差异有统计学意义(P<0.05)。术后10个月,PRP组成活率略高于对照组,但两组间比较差异无统计学意义(P>0.05)。此外,PRP组和对照组均表现在术后3个月成活率最低(组间比较差异有统计学意义,P<0.001)。数据见表2,术后观见图1。
2.3 血管密度值观察
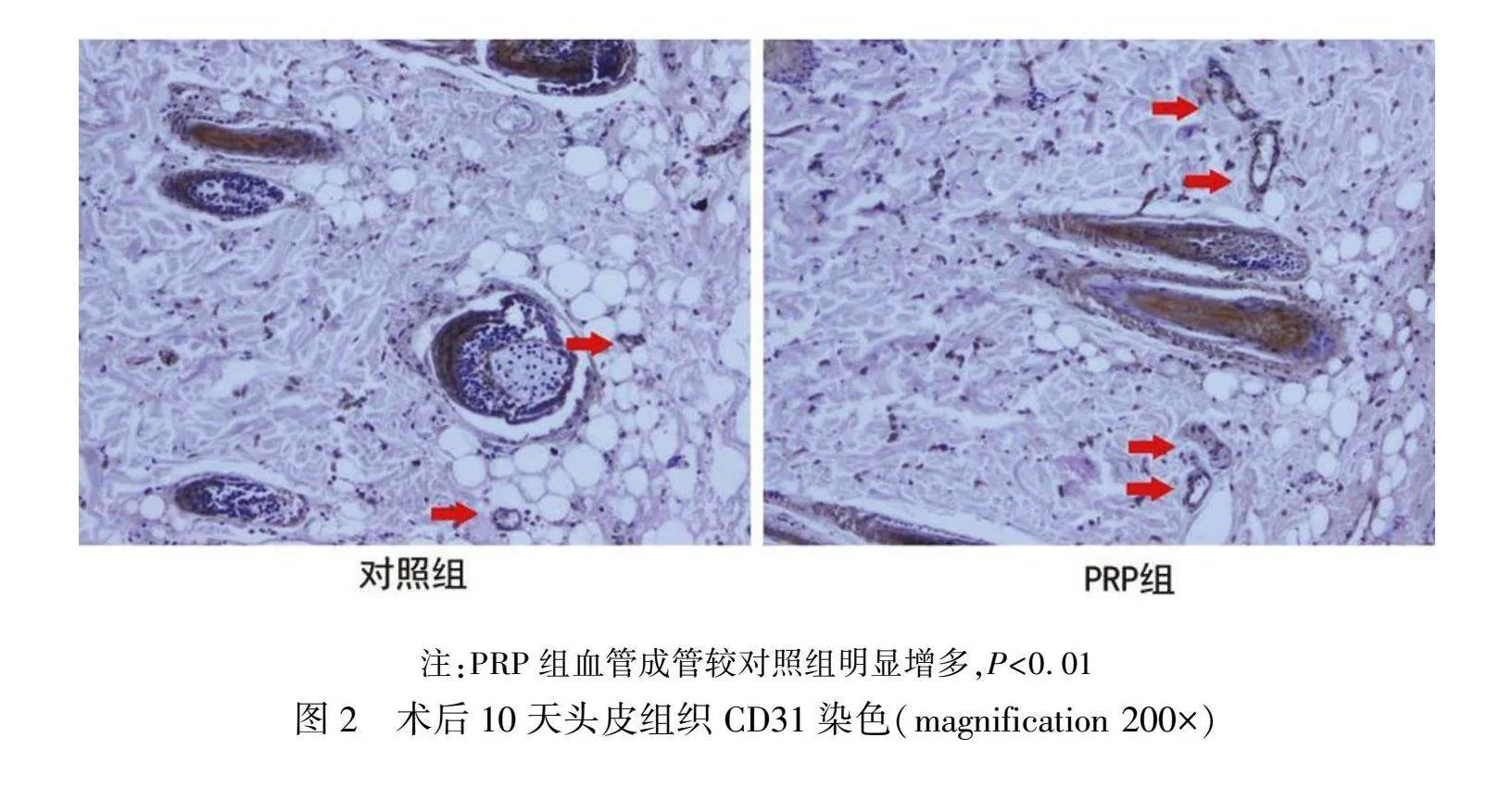
通过CD31免疫组织化学染色法对血管内皮细胞进行特异性染色,计算成管状的血管数量,分析头皮组织的MVD。切片染色后镜下可见棕褐色染色的细胞,为阳性染色,血管内皮细胞染为棕褐色并排列围成圈(图2)。在术后10天PRP组血管密度值明显高于对照组(P<0.001),见表3。
2.4 PRP治疗激活ERK1/2信号通路
应用免疫印迹实验检测治疗后头皮组织ERK1/2、p38 MAPK磷酸化水平,发现PRP治疗10天后PRP组ERK1/2高于对照组(P<0.001),而p38 MAPK磷酸化水平与对照组相比差异无统计学意义(P=0.157)。见图3、表4。
3 讨 论
在毛发移植手术过程中,毛囊从供区转移到受区,离体的毛囊没有血液供应,毛囊细胞受到一定的损伤,导致大多数毛囊在移植术后快速进入退行期,随后经历一个较长的休止期。在此期间,毛发逐渐脱落,经过3~6个月后才开始逐渐生长,部分回访患者表现出焦虑情绪[8]。术后使用米诺地尔和口服非那雄胺可能有助于缓解移植术后的毛发脱落[9]。然而,药物治疗存在副作用的风险,如头皮干燥、皮肤刺激、勃起功能障碍和睾丸疼痛等,这导致部分患者无法接受长期的药物治疗[10-11]。毛囊隆突干细胞上存在大量EGF、PDGF和TGF-α等生长因子受体[12],这些生长因子受体在毛发生长和分化中起着重要作用。PRP能够释放大量生长因子,对毛囊的角质形成细胞、黑色素细胞和成纤维细胞具有促进有丝分裂、血管生成和趋化作用[13]。目前已有多项临床研究证实PRP治疗在AGA中能够有效增加毛发密度和毛干粗细度,对毛发再生有积极作用[14]。该治疗方法已经被列入雄激素性脱发的治疗推荐项目[15]。国内外已有研究将PRP作为毛发移植术的辅助技术,以提高毛发移植的成活率[16-17],但此类临床研究报告较少,且缺乏对进一步作用机制的探索。
PRP注射后,随着时间的推移,血小板释放的各种生长因子浓度逐渐降低,其作用时间平均为8~10天[18]。因此,我课题组在注射后10天进行取材,探讨PRP减少术后毛发脱落的相关机制。本研究发现,PRP治疗使毛囊周边组织的血管密度增加,提示PRP治疗能够促进移植毛囊与供区组织之间建立血运循环。毛囊植入受区后的早期阶段,细胞依赖组织液提供营养,早期的血管化有助于移植组织的供养和存活。我们分析认为,术中注射的PRP能够在术后一定时间内持续释放多种生长因子,促进血管新生,有利于毛囊与受区组织早期建立血运循环。这种血运循环的建立改善了移植毛囊组织的供养,使得移植后的毛囊能够快速从退行期进入生长期,从而减少术后毛发的脱落。如果毛囊与受区头皮之间未能建立良好的血运循环,得不到充足的供养,则会导致毛囊进入退行期,毛干在接下来的几周内逐渐脱落。因此,在本研究中观察到的PRP治疗能够减少术后脱落期毛发脱落的现象,可能与受区组织早期建立血运循环密切相关。
毛囊组织的血管化可以促进毛发生长,改善毛发生长周期,并增加毛囊和毛干的大小[19]。PRP释放的多种生长因子作用于细胞,激活多种细胞内信号通路,从而改变细胞的生物学状态。VEGF和EGF受体的激活可靶向调控ERK1/2或p38 MAPK,这在促进血管生成和组织修复中起着关键作用[20-21]。GUPTA等人[22]通过对AGA机制模型的PRP治疗研究发现,PRP通过激活ERK信号通路刺激退行期毛囊进入生长期,并延长其持续时间。上述研究均表明,ERK在血管生成过程中起到关键的促进作用。本研究中,PRP治疗后检测到ERK1/2磷酸化水平明显增高。分析其原因,PRP注射后在头皮组织中缓慢释放各种生长因子,并向下激活ERK信号通路,该通路参与头皮组织血管化过程,促进移植物与受区血运的建立。
一般认为,p38 MAPK是调控细胞凋亡的重要信号通路。研究证实,p38 MAPK信号通路在细胞凋亡过程中对凋亡相关蛋白Bax、Bcl-2、caspase-8、caspase-9和caspase-3的表达起着关键的调控作用[23]。本研究同时检测了p38 MAPK信号通路的激活情况。虽然观察到PRP治疗组的p38 MAPK磷酸化水平低于对照组,但差异无统计学意义,这可能与样本量较少有关。PRP治疗是否通过抑制p38 MAPK通路的激活,从而调控毛囊细胞的凋亡并减少毛发脱落,尚需扩大样本量进一步验证。
综上所述,PRP治疗可以有效改善毛发移植术后脱落期毛发的脱落。其机制可能是通过调控ERK1/2通路的激活,促进早期血运循环的建立,从而改善毛发生长周期。PRP作为毛发移植术的辅助治疗手段,操作简单,能有效减少术后毛发脱落,成为一种新的临床治疗思路。由于本研究涉及有创操作,参与研究的患者数量较少,因此本实验数据仅为减少植发术后毛发脱落提供一种新的研究方向。
参 考 文 献
[1] JIMENEZ F, ALAM M, VOGEL J E, et al. Hair transplantation: basic overview[J]. J Am Acad Dermatol, 2021,85(4):803-814.
[2] GARG A K, GARG S. Complications of hair transplant procedures-causes and management[J]. Indian J Plast Surg,2021,54(4):477-482.
[3] EVERTS P, ONISHI K, JAYARAM P, et al. Platelet-rich plasma: new performance understandings and therapeutic considerations in 2020[J]. Int J Mol Sci, 2020,21(20):7794.
[4] GENTILE P, GARCOVICH S. Systematic review of platelet-rich plasma use in androgenetic alopecia compared with minoxidil
,finasteride, and adult stem cell-based therapy[J]. Int J Mol Sci, 2020,21(8):2702.
[5] KIM D, LEE E, CHOI P G, et al. Justicia procumbens prevents hair loss in androgenic alopecia mice[J]. Biomedecine Pharmacother, 2024,170:115913.
[6] CHOI M, CHOI S J, JANG S, et al. Shikimic acid,a mannose bioisostere, promotes hair growth with the induction of anagen hair cycle[J]. Sci Rep, 2019,9(1):17008.
[7] JUNG Y H, CHAE C W, CHOI G E, et al. Cyanidin 3-O-arabinoside suppresses DHT-induced dermal papilla cell senescence by modulating p38-dependent ER-mitochondria contacts[J]. J Biomed Sci, 2022,29(1):17.
[8] MALETIC A, DUMIC-CULE I, ZIC R, et al. Impact of hair transplantation on quality of life[J]. Aesthetic Plast Surg, 2024,48(9):1825-1830.
[9] GUPTA A K, TALUKDER M, WILLIAMS G. Comparison of oral minoxidil, finasteride,and dutasteride for treating androgenetic alopecia[J]. J Dermatolog Treat, 2022,33(7):2946-2962.
[10] DEVJANI S, EZEMMA O, KELLEY K J, et al.Androgenetic alopecia: therapy update[J]. Drugs,2023,83(8):701-715.
[11] SUCHONWANIT P, IAMSUMANG W, LEERUNYAKUL K. Topical finasteride for the treatment of male androgenetic alopecia and female pattern hair loss:a review of the current literature[J]. J Dermatolog Treat, 2022,33(2):643-648.
[12] AKIYAMA M, SMITH L T, HOLBROOK K A. Growth factor and growth factor receptor localization in the hair follicle bulge and associated tissue in human fetus[J]. J Invest Dermatol, 1996,106(3):391-396.
[13] PAKHOMOVA E E, SMIRNOVA I O. Comparative evaluation of the clinical efficacy of PRP-therapy, minoxidil, and their combination with immunohistochemical study of the dynamics of cell proliferation in the treatment of men with androgenetic alopecia[J]. Int J Mol Sci, 2020,21(18):6516.
[14] EVANS A G, MWANGI J M, POPE R W, et al. Platelet-rich plasma as a therapy for androgenic alopecia:a systematic review and meta-analysis[J]. J Dermatolog Treat, 2022,33(1):498-511.
[15] 胡志奇,苗勇.中国人雄激素性脱发诊疗指南[J].中国美容整形外科杂志,2019,30(1):8-12.
[16] 刘琳,张国辉.毛囊单位提取移植术联合富血小板血浆治疗继发性瘢痕秃发的临床效果[J].中国医疗美容,2023,13(9):1-4.
[17] GARG S. Outcome of intra-operative injected platelet-rich plasma therapy during follicular unit extraction hair transplant: a prospective randomised study in forty patients[J]. J Cutan Aesthet Surg,2016,9(3):157-164.
[18] FOSTER T E, PUSKAS B L, MANDELBAUM B R, et al. Platelet-rich plasma: from basic science to clinical applications[J]. 2009,37(11):2259-2272.
[19] YANO K, BROWN L F, DETMAR M. Control of hair growth and follicle size by VEGF-mediated angiogenesis[J]. 2001,107(4):409-417.
[20] LI T T, WU J, YU W S, et al. HSPA12A stimulates p38/ERK-AP-1 signaling to promote angiogenesis and is required for functional recovery postmyocardial infarction[J]. Oxid Med Cell Longev, 2022,2022:2333848.
[21] ZHENG R Z, HE Y B, YANG L R, et al. Nischarin inhibits the epithelial-mesenchymal transition process and angiogenesis in breast cancer cells by inactivating FAK/ERK signaling pathway via EGF like repeats and discoidin domains 3[J]. Mol Biol Rep, 2024,51(1):821.
[22] GUPTA A K, CARVIEL J. A mechanistic model of platelet-rich plasma treatment for androgenetic alopecia[J]. Dermatol Surg, 2016,42(12):1335-1339.
[23] WANG X X, ZHANG B, XIA R, et al. Inflammation,apoptosis and autophagy as critical players in vascular dementia[J]. Eur Rev Med Pharmacol Sci, 2020,24(18):9601-9614.
(收稿日期:2024-07-16 修回日期:2024-09-06)

