血浆无细胞线粒体外线粒体DNA与牙周炎临床指标的相关性研究


[关键词] 牙周炎; 无细胞DNA; 线粒体DNA; 横断面研究; 牙周临床指标
[中图分类号] R781.4 [文献标志码] A [doi] 10.7518/gjkq.2024044
牙周炎是一种由菌斑微生物引起的慢性感染性疾病[1],临床表现为附着丧失、牙周袋形成与牙槽骨吸收。牙周炎的发生发展受到微生物、宿主免疫炎症反应以及全身因素的影响,表达出较大的个体差异,寻找相关血浆的标志物一直是牙周病学研究的重点。
近年来无细胞线粒体DNA (cell-free mitochondrialDNA,cf-mtDNA) 在代谢疾病[2]、自身免疫病[3]、创伤[4-5]、神经退行性疾病[6]以及癌症[7-8]中广受关注。研究发现cf-mtDNA受到年龄[9]、心理压力[10]、剧烈运动[11]、昼夜节律[12]等因素的影响。在氧化应激、微生物刺激、组织损伤或是生理状态下,细胞可以主动或被动释放cf-mtDNA。cf-mtDNA可存在于多种结构中,血浆中cf-mtDNA多数存在于完整线粒体内[13-15],也可以在完整线粒体外以被或不被膜包裹的形式存在[11]:如胞外微囊泡或者外泌体[16-17], 不被膜包裹的cf-mtDNA可以通过完全游离的形式存在,也可以通过与蛋白质结合的形式存在[18]。
线粒体膜内的cf-mtDNA通常不促炎[11],甚至在被呼吸功能受损的细胞内化后可能恢复其线粒体功能[19]。被膜结构包裹的,如外泌体和微颗粒中的线粒体外cf-mtDNA,在被受体内化后可以产生促炎的作用[20],而不被膜包裹的线粒体外cfmtDNA,如完全游离的cf-mtDNA和与蛋白复合物结合的cf-mtDNA,则可以直接激活细胞膜上的Toll样受体9 (toll-like receptor 9,TLR9) 产生促炎作用[21]。本文通过二次离心法分离出cf-mtDNA中存在于线粒体外的部分,即包含在较小的微囊泡(microvesicle)、外泌体(exosome) 以及形成蛋白质复合物的cf-mtDNA。它们可以通过内化或直接与膜受体结合产生促炎作用,将其称为无细胞线粒体外线粒体DNA (cell-free extra-mitochondrialmitochondria DNA,cf-exmtDNA)。
目前对于牙周炎与体液cf-exmtDNA水平的相关性尚无定论。在动物模型中发现,牙周炎可以通过活性氧(reactive oxygen species,ROS) /线粒体通透性转换(mitochondrial permeability transitionpore,mPTP) 通路,介导线粒体DNA (mitochondrialDNA,mtDNA) 逃逸,使得小鼠血液cf-exmtDNA水平升高[22]。也有研究发现牙周炎时线粒体的生物合成功能下降[23],使得细胞内线粒体数量以及mtDNA的拷贝数减少[24]。临床研究方面仅有关于唾液的研究报道。Konečná等[25]发现:牙周探诊出血者初次离心(1 600 g) 上清中唾液cf-mtDNA含量显著高于牙周探诊不出血者,但在二次离心后(16 000 g) 上清中未观察到明显差异。目前尚无关于血浆和龈沟液中cf-exmtDNA与牙周炎相关性的研究报道。本文旨在研究全身健康者血浆中cf-exmtDNA与牙周炎临床指标的相关性。
1 材料和方法
1.1 研究对象
样本量的计算:本试验主要目的是探究18~45岁人群中牙周炎症指标与血浆cf-exmtDNA的相关性,为单组设计的横断面研究,选用直线相关分析公式(双侧)[26]计算样本量。公式如下:
从2022年4—12月于北京大学口腔医院牙周科及北京市中关村医院口腔科就诊的患者,及北京大学口腔医院在读医学生中选择受试者,共纳入受试者78人。所有受试者要求无全身系统性疾病,无吸烟史,无服用吡格列酮、环孢素、二甲双胍史,3个月内未服用抗生素,体质指数(body mass index,BMI) lt;28.0 kg/m2,女性未处于妊娠期或哺乳期;口内无种植修复体,无正畸治疗史,3个月内未接受过牙周治疗。本研究经北京大学口腔医院伦理委员会批准(编号:PKUSSIRB-202165082),每位受试者均在完全理解研究设计后签署知情同意书。
1.2 基本信息与病史
采集所有样本的基本信息和病史,包括以下4个部分。1) 一般资料:姓名、年龄、性别、民族。2) 口腔卫生习惯:刷牙频率和方式,是否使用牙线,上一次洗牙的时间。3) 口腔病史:既往口腔治疗史,是否有正畸史和牙周炎家族史。4)体格检查:身高、体重、BMI和空腹血糖(fastingblood glucose,FBG)。FBG检测方法:每名受试者晨起空腹采肘部静脉血2 mL,2 h内于检验科检测,统一采用己糖激酶法。
1.3 牙周临床检查
牙周检查主要由1位来自北京大学口腔医院牙周科的专科医师完成。研究开始前完成主要检查者与参考检查者(1位牙周科资深主任医师) 之间的一致性检验。探诊深度(probing depth,PD)、出血指数(bleeding index,BI) 的组内相关系数分别为0.88 和0.85。使用标准Williams牙周探针(Hu-Friedy公司,美国) 和尖探针对口内每颗天然牙进行检查(阻生的第三磨牙或者其他原因待拔的牙齿除外),记录牙周检查表,具体包括:口内余留牙的牙位以及修复情况,每颗余留牙6个位点的PD、临床附着水平(clinical attachment level,CAL)、颊舌侧菌斑指数(plaque index,PLI) 和BI。
按照2018年牙周炎新分类标准[27]、牙周健康标准[28]进行分组,对所有受试者均拍摄全景片,对于判断为Ⅲ、Ⅳ期牙周炎患者加拍重点牙根尖片明确诊断。分组标准具体如下。1) 牙周健康组:不存在2个或2个以上不相邻牙的邻面检测到附着丧失,或不存在2个或2个以上的牙齿有颊舌侧附着丧失≥3 mm;PD≤3 mm,探诊出血lt;10%,无影像学骨缺损。2) 牙龈炎组:不存在2个或2个以上不相邻牙的邻面检测到附着丧失,或不存在2个或2个以上的牙齿有颊舌侧附着丧失≥3 mm,探诊出血≥10%, 无影像学骨缺损。3) 牙周炎组(Ⅱ、Ⅲ、Ⅳ期牙周炎):存在超过2个不相邻牙的邻面附着丧失≥3 mm或邻面PD≥5 mm,邻面最大影像学骨缺损(骨嵴顶距釉牙骨质界的距离/根长) ≥15%。
1.4 血浆cf-exmtDNA的检测前处理
采血方法:统一于上午8—10时于采血室抽取静脉血6 mL,其中4 mL置于乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA) 抗凝采血管中,用于后续血浆cf-exmtDNA的提取;另外2 mL置于常规采血管中用于检测FBG。嘱受试者提前8 h禁食,提前10 min禁止剧烈运动。EDTA抗凝血置于4 ℃暂存,4 h内进行离心操作。
参考Hummel等[29]和Roch等[14]的分离方法分离cf-exmtDNA。该方法去除了血浆中细胞外的完整线粒体,保留了本研究所关注的cf-exmtDNA。方法如下:EDTA抗凝血液于室温下初次离心(1 200 g,10 min),取600 μL上清置于1.5 mL EP管中,暂存于4 ℃等待二次离心,剩余上清(血浆) 分装后冻存于-80 ℃。血浆二次离心:4 ℃,16 000 g,10 min,取200 μL上清于1.5 mL EP管中,用于血浆总无细胞DNA (cell-free DNA,cf-DNA) 的提取。剩余上清分装后冻存于-80 ℃。
使用外周血DNA提取试剂盒QIAamp bloodDNA mini kit(Qiagen公司,德国)提取DNA。经蛋白酶消化,无水乙醇沉淀,硅胶柱吸附和纯化后,使用50 μL缓冲液AE洗脱DNA,存于-20 ℃待用。
1.5 血浆cf-exmtDNA的检测
采用三步法实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR) 对提取的血浆总cf-DNA中的线粒体基因片段进行扩增,每个样本设置3个技术重复,以及3个空白对照。反应体系为20 μL: 模板2 μL,ddH2O 6 μL,正引物和反引物各1 μL,体系终浓度为0.5 μmol/μL,SYBR green染料10 μL。变温程序和引物序列如表1和表2所示。
标准品与标准曲线:于MeSH基因库搜索人的mtDNA序列,选择经过NCBI Blastn软件验证没有假基因存在的部分进行扩增。将3307—4262位的NADH脱氢酶亚基1 (NADH dehydrogenase" subunit1,ND1;碱基数为956 bp) 作为标准品的合成序列,载体为大肠杆菌pUC57质粒,总碱基数为3616 bp (上海生工生化科技有限公司)。母液经NanoDrop8000 (赛默飞公司,美国) 吸光度检测,标准品质量浓度为39.07 ng/μL,代入该片段的相对分子质量2.376×106计算母液的拷贝数。公式如下:核酸拷贝数(copies/μL) = (6.02×1023) ×[质量浓度(ng/μL) ×10-9] /片段相对分子质量,得出母液的拷贝数为1.007 2×1010 copies/μL。母液稀释20倍后每10 μL分装为储蓄液-20 ℃冻存待用。储蓄液加ddH2O做10倍梯度稀释,配置基因拷贝数分别为:5.00×107、5.00×106、5.00×105、5.00×104、5.00×103、5.00×102 copies/μL 的标准曲线。
使用ABS QuantStudio1 qPCR仪(赛默飞公司,美国) 进行扩增,而后根据标准曲线由软件自动计算得到模板的拷贝数。标准曲线经qPCR软件自动计算,扩增效率为91%~105%,R2均大于0.99,满足发表qPCR实验证据的最低信息要求[30],采用同一时间分装的储蓄液,保证不同批次间的可比性。
根据血浆洗脱体积与上样体积的比值,计算出原血浆样本中的cf-exmtDNA拷贝数=qPCR检测浓度×洗脱体积(50 μL) ÷上样体积(200 μL) =qPCR检测拷贝数/4。
1.6 统计学分析
本研究数据由单人录入并后期校对以保证数据真实准确,对于缺失值按照简单删除法处理。获取所有研究对象血浆换算后的原液cf-exmtDNA拷贝数,与患者的基本资料以及牙周临床检查资料进行整合,使用IBM SPSS 27.0 Mac版进行统计分析。
计算每位受检者的平均菌斑指数(mean plaque index,mPLI)、平均探诊深度(mean" probingdepth,mPD)、平均附着水平(mean clinicalattachment level,mCAL)、平均出血指数(meanbleeding index,mBI) 用于后续统计学分析中。mPLI=全口所有检查位点的PLI总和/检查位点总数,其他临床指标均值同理。
对所有计量资料进行正态性检验,正态分布的指标用均值±标准差表示, 偏态分布指标用Mdn (Q1,Q3) 表示,Mdn为中位数,Q1为第一四分位数,Q3为第三四分位数;计数资料用频数和(或) 百分比表示。
Lumley等[31]对非正态资料的统计学研究表明:在相对大的样本中,中心极限定理对任何分布都是有效的,因此t检验和线性回归在较大样本量的非正态数据中是一种方便实用的替代方法。参考SPSS的操作指南,对于样本量≥25的非正态分布数据,依赖中心极限定理,可以采用t检验、Pearson相关性检验以及线性回归分析。
本研究总样本量≥25,因此对血浆cf-exmtDNA和连续变量mPD、mCAL、mBI、mPLI、年龄、FBG、BMI值进行Pearson相关性检验和多重线性回归分析。牙周健康组、牙龈炎组lt;25人,因此对各牙周炎症状态分组行两两Mann-Whitney U非参数检验。
2 结果
2.1 整体受试者基本信息与牙周临床检查
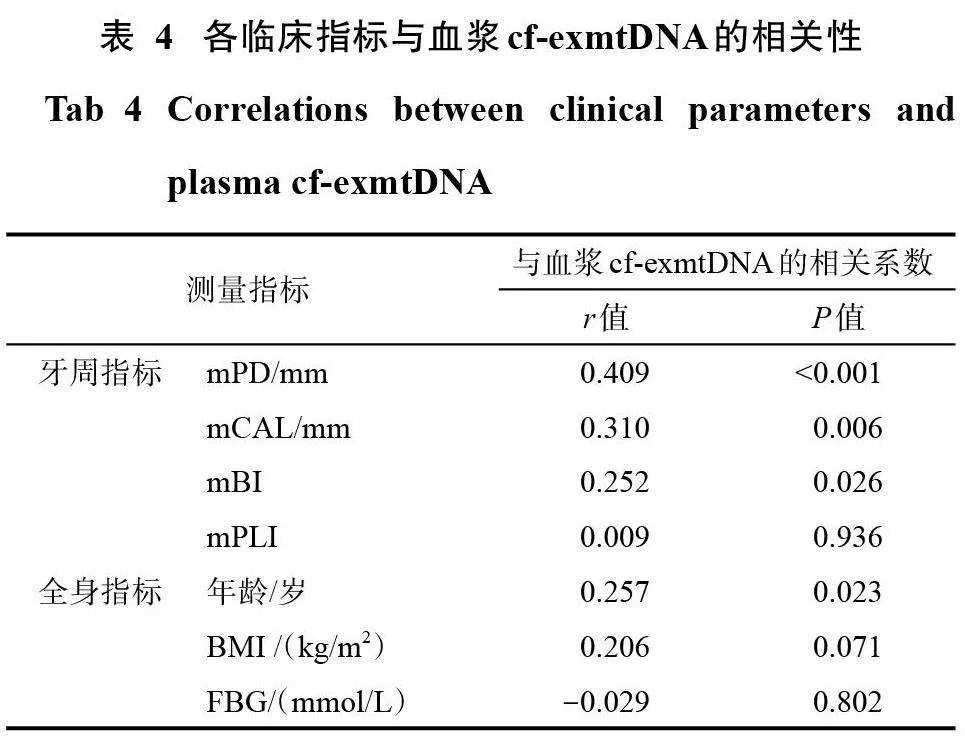
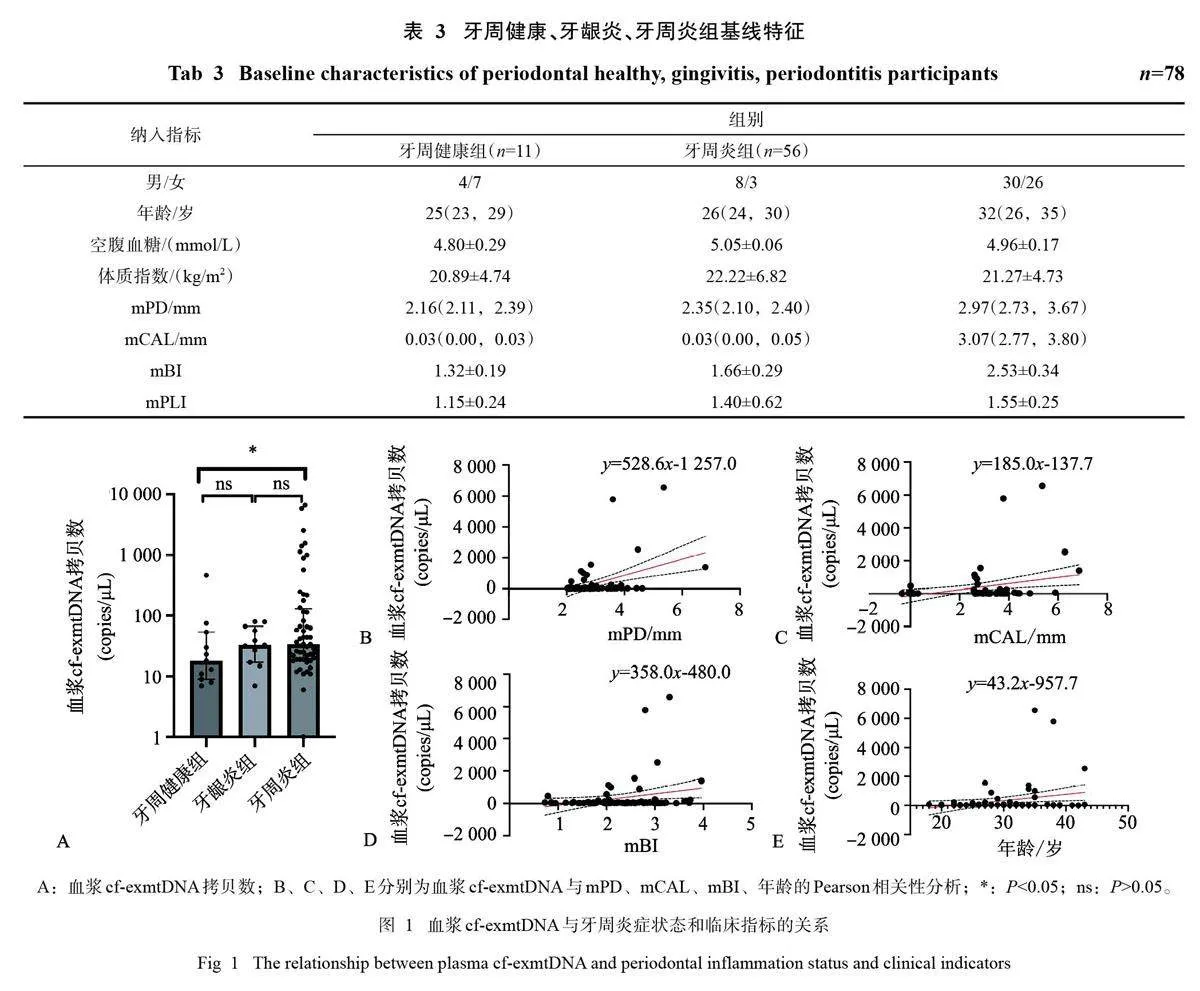
本研究共纳入受试者78名,包括11名牙周健康者、11名牙龈炎患者和56名牙周炎患者,整体基本情况与基线牙周指标见表3。
2.2 牙周炎症状态分组与血浆cf-exmtDNA
各组血浆cf-exmtDNA拷贝数(copies/μL) 水平如图1A所示:牙周健康组18(9,54)、牙龈炎组33 (17,67)、牙周炎组34 (19,130),牙周炎组显著高于牙周健康组(P=0.042),但牙周健康组与牙龈炎组,牙龈炎与牙周炎组间差异则无统计学意义(Pgt;0.05)。
2.3 血浆cf-exmtDNA 与各临床指标的Pearson相关性分析
相关性分析的各项统计结果见图1和表4。血浆cf-exmtDNA与mPD、mCAL、mBI、年龄呈显著正相关关系,与FBG、BMI、mPLI则无明显的线性相关关系。
2.4 血浆cf-exmtDNA和临床指标的多重线性回归分析
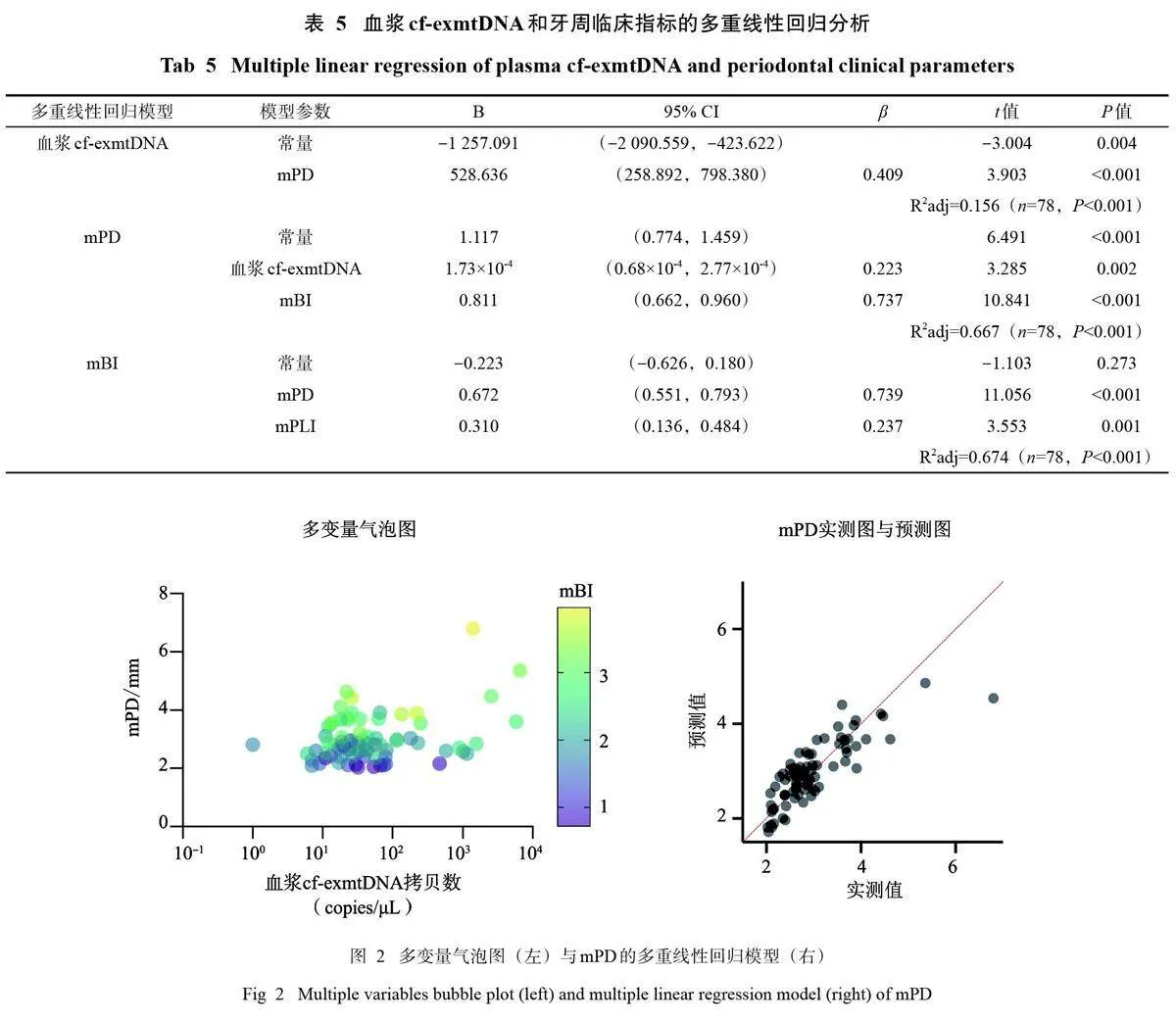
采用步进法选择相关性分析时Plt;0.1的变量进行多重线性回归分析。本试验中mCAL与mPD具有强烈的共线性(r=0.835),不宜同时纳入多因素分析,由于主要研究指标是mPD,在多重线性回归分析时剔除mCAL,分别以血浆cf-exmtDNA、mPD、mBI为因变量。3个多重线性回归模型均具有统计学意义(Plt;0.001),结果见表5。cf-exmtDNA、mPD、mBI的多变量气泡图以及mPD的多重线性回归模型的实测、预测对比见图2。
在多重回归分析中,血浆cf-exmtDNA水平主要取决于mPD (Plt;0.001),mPD水平主要取决于mBI (Plt;0.001) 和血浆cf-exmtDNA (P=0.002),mBI水平主要取决于mPD (Plt;0.001) 和mPLI (P=0.001)。
3"讨论
近年来,关于血浆cf-mtDNA组成和来源的研究发展迅速。血浆75.7%~99.5%的cf-mtDNA位于无细胞线粒体中[14]。正常的生理状态下,每毫升血浆中存在105~106个完整的无细胞线粒体,这些无细胞线粒体保持了跨膜电位[15], 使内部的cfmtDNA不能直接产生促炎效应。近年来炎症疾病的研究更多关注存在于线粒体外的cf-DNA,即本文的cf-exmtDNA。
本研究发现:血浆cf-exmtDNA水平与年龄、mPD、mCAL、mBI存在正相关关系,牙周炎组cf-exmtDNA较健康组显著升高。这可能与牙周炎激活POS/mPTP通路、促进中性粒细胞胞外陷阱(neutrophil extracellular trap,NET) 释放,或者通过细胞外囊泡(extracelluler vesicle) 释放mtDNA和线粒体内容物有关。上皮细胞在ROS增加、线粒体通透性转换等情况下,原本存在于线粒体膜内的mtDNA逃逸至细胞质。细胞质中的mtDNA在创伤、坏死、焦亡等情况下因质膜破裂而被动释放,成为循环中的cf-exmtDNA。在ROS的刺激以及其他膜受体激活的情况下,中性粒细胞可以主动释放含有mtDNA的NET[32]。此外,细胞还可以通过胞外囊泡主动释放cf-exmtDNA和线粒体内容物[18]。
mPD的多重回归模型包含血浆cf-exmtDNA,表明血浆cf-exmtDNA升高对牙周组织局部有促炎作用。血浆cf-exmtDNA可被牙周组织中的中性粒细胞、树突状细胞、B细胞、自然杀伤细胞等细胞内吞,激活TLR9-核因子κB、环状单磷酸鸟苷-单磷酸腺苷合成酶/干扰素基因刺激蛋白(cyclicGMP-AMP synthetase/stimulator of interferon genes,cGAS/ STING)、核苷酸结合寡聚结构域,富含亮氨酸重复序列和含Pyrin结构域3 (nucleotide-bindingoligomerization domain, leucine-rich repeat andpyrin domain-containing 3,NLRP3) 等通路促进牙周炎的进展[2,33-34]。此外,mPD和血浆cf-exmtDNA均与年龄呈正相关关系,但年龄并未包含在cf-exmtDNA和mPD的多重回归模型中,因此年龄可能在血浆cf-exmtDNA和mPD的关联中起到了一定的交互效应。
虽然血浆cf-exmtDNA水平与年龄、牙周炎症指标呈正相关关系,但尚不明确其是否具有成为牙周炎易感性全身标志物的潜力。研究[10,29]表明:血浆cf-exmtDNA是一种快速变化的指标,受到昼夜节律、心理压力、剧烈运动等的影响,可能像皮质醇一样会在1 d中产生较大的波动。其他因素如mtDNA片段长短、甲基化水平、氧化状态、与何种蛋白质结合,以及血浆DNA水解酶Ⅰ浓度等,也可能对cf-exmtDNA的促炎作用产生影响。
由于中国人群牙周炎发病率较高,纳入非牙周炎者较为困难,各组样本量存在一定差异,是本研究的局限性之一。同时,血浆cf-exmtDNA的影响因素较多。本研究控制了全身疾病、肥胖、高龄,但难以控制诸如心理压力、运动强度等其他混杂因素。此外,确定其他体液如龈沟液的cfexmtDNA含量,有助于明确牙周炎症状态对牙周组织局部cf-exmtDNA的影响,但面临一些困难:龈沟液cf-exmtDNA尚无明确和成熟的分离方式;龈沟液量比较少,需要进行1000~10000倍稀释才能进行DNA提取,增加了测量误差;龈沟液量受昼夜节律、雌激素影响,下午和晚间龈沟液量高于上午,女性龈沟液量高于男性[35],这会带来新的混杂因素等。在后续有关体液cf-exmtDNA和牙周炎的相关性研究中,选择合理的体液采样方法和cf-exmtDNA分离方法,控制无关变量(昼夜节律和性别等),增加其他的常见体液牙周炎症标志物进行参照,将有助于试验的测量和分析。
利益冲突声明:作者声明本文无利益冲突。

