2型糖尿病病人全身麻醉期间机械功率与术后肺部并发症的关系


摘要 目的:探究2型糖尿病病人全身麻醉期间机械功率与术后肺部并发症(PPCs)的关系。方法:采用前巢氏病例对照研究设计,纳入2022年11月1日—2023年5月31日在山西医科大学第一医院接受腹腔镜结直肠切除手术的2型糖尿病病人 164 例。收集全身麻醉机械通气期间最高吸气峰值压力(Peak)、平台压(Plat)、呼气末正压(PEEP),以及设定的潮气量(Vt)、呼吸频率(RR)参数,计算病人术中机械通气呼吸功率。主要终点指标为术后第7 天肺部并发症的发生率,次要终点指标为病人的住院时长。根据有无发生PPCs分为非并发症组和并发症组,采用倾向性评分匹配(PSM)法校正组间的混杂因素,其次用独立样本t检验分析PSM后机械功率与PPCs的相关性及PPCs的发生是否影响病人的住院时长,并通过受试者工作特征(ROC)曲线评价机械功率对PPCs的预测价值。结果:在第7 天随访时有36 例(21.95%)手术病人发生了PPCs。两组加泰罗尼亚外科病人呼吸风险评分(ARISCAT)风险分级、美国麻醉医师协会(ASA)分级差异均有统计学意义(P<0.05);PSM后,两组各有30例病人,基线资料相比差异均无统计学意义(P>0.05)。与非并发症组相比,并发症组有更高的机械功率和更长的住院时长。ROC曲线显示,机械功率预测PPCs的临界值为7.56 J/min,曲线下面积(AUC)为0.806[95%CI(0.738,0.873),P<0.001]。结论:较高的通气机械功率与2型糖尿病病人术后肺部并发症具有相关性,可显著延长病人住院时长。
关键词 2型糖尿病;术后肺部并发症;机械功率;倾向性评分匹配;机械通气
doi:10.12102/j.issn.1672-1349.2024.20.029
基金项目 山西医科大学第一医院院级基金项目(No.YJ161709)
作者单位 1.山西医科大学麻醉学院(太原 030001);2.山西医科大学第一医院(太原 030001);3.南方医科大学珠江医院
通讯作者 聂丽霞,E-mail:firsthossx@126.com
引用信息 闫乐池,赵丽媚,刘亚楠,等.2型糖尿病病人全身麻醉期间机械功率与术后肺部并发症的关系[J].中西医结合心脑血管病杂志,2024,22(20):3796-3800.
术后肺部并发症(postoperative pulmonary complications,PPCs)占手术和麻醉相关风险的很大一部分,是术后死亡率升高和住院时间延长的主要危险因素之一[1]。糖尿病是一种代谢失调的内分泌疾病,研究表明,糖尿病病人在发病之前即存在肺功能损伤,表现在限制性通气功能障碍和弥散功能障碍,相较于非糖尿病病人,PPCs的发生率更高[2]。最近提出的一个机械通气新概念机械功率(mechanical power,MP),将通气频率、潮气量(Vt)、气道峰压、驱动压整合在一起,以焦耳/分钟(J/min)为单位来估算传递到呼吸系统和肺部的能量[3],可能是通气与肺损伤关系中更重要的变量[4]。研究表明,机械功率不仅可以作为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)病人院内死亡率的预测指标[5],还可以评估全身麻醉手术病人术后呼吸衰竭风险[6]。但是有关腹腔镜结直肠切除手术2型糖尿病病人术中机械功率与PPCs之间的相关性证据还较少,因此,本研究拟通过一项巢氏病例对照研究探究机械功率与PPCs之间的关系。
1 资料与方法
1.1 研究对象
收集2022年11月1日—2023年5月31日在山西医科大学第一医院接受择期腹腔镜结直肠手术且术前明确诊断为2型糖尿病病人的临床资料。2型糖尿病的诊断标准参考《中国2型糖尿病防治指南(2020版)》[7]。纳入标准:1)美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ~Ⅲ级;2)年龄≥18岁,性别不限;3)肝、肾功能正常;4)近期无质子泵抑制剂和类固醇使用史。排除标准:1)合并肺部基础疾患及心血管系统疾病;2)合并严重神经内科、神经外科疾病;3)急性阻塞或穿孔的肿瘤;4)拒绝加入研究的病人;5)手术后12 h内出院;6)近期安排其他手术和/或麻醉。退出标准:1)术中转为开腹手术;2)术中大出血或输注血制品。本研究已通过山西医科大学第一医院伦理委员会批准,审批号:2022-K181。
1.2 PPCs诊断标准
根据2015年欧洲围术期临床结局定义[8]诊断PPCs,1)呼吸道感染:病人因疑似呼吸道感染接受抗生素治疗,并满足以下1项或多项标准,新痰或改变痰、新痰或改变肺混浊、发热、白细胞计数>12×109/L;2)呼吸衰竭:术后动脉血氧分压(PaO)<8 kPa(60 mmHg),氧合指数(PaO/FiO)<40kPa(300 mmHg或动脉血红蛋白饱和度<90%,需要氧疗;3)胸腔积液:胸片显示上膈角变钝,同侧半膈直立位置轮廓清晰,相邻解剖结构移位或(仰卧位)一半胸模糊混浊,保留血管阴影;4)肺不张:肺混浊,纵隔、肺门或半膈向受累区移位,以及邻近非肺不张性肺的代偿性过度膨胀;5)气胸:胸膜腔内有空气,内脏胸膜周围无血管床;6)支气管痉挛:新发现的用支气管扩张剂治疗的呼气性喘息;7)吸入性肺炎:吸入反流胃内容物后的急性肺损伤。当这些标准中的1个或多个在术后7 d内任何时候出现时,诊断为 PPCs,而随访结束前出院且无任何PPCs的病人被视为无PPCs。
1.3 研究方法
1.3.1 数据收集
筛选符合纳入标准的病人,签署术前知情同意书,收集基线参数,如年龄、性别、体质指数(BMI)、1个月内吸烟史、术前空腹血糖、清蛋白、尿素、肌酐、术前血红蛋白。在全身麻醉诱导插管并机控通气后,记录设定的Vt、呼吸频率(RR)、吸入氧浓度(FiO),以及通气过程中最高呼气末正压(PEEP)、平台压(Plat)、吸气峰值压力(Peak),直至手术结束病人恢复自主呼吸。术后收集加泰罗尼亚外科病人呼吸风险评分(ARISCAT)、手术时长、麻醉时长、术中顺式阿曲库铵用量、术中补充晶体液、胶体液、尿量等。
1.3.2 暴露因素
主要暴露因素为机械功率,通过全身麻醉机械通气期间Vt、RR、PEEP、Plat和Peak中位数计算得出:机械功率(J/min)=0.098×RR×Vt×[PEEP+1/2(Plat-PEEP)+(Peak-Plat)],参考国内外研究以及临床经验考虑了术中最高的Peak以及设定的RR、Vt进行计算。
1.3.3 终点指标
主要终点指标为术后第7天肺部并发症的发生率。在病人术后第7天通过查阅电子病历进行随访,包括查看术后血气分析报告、胸片、胸部CT等。次要终点指标为病人的住院时长。住院时长为病人手术当日至出院的总时间。
1.4 统计学处理
根据以往的国内外研究以及预试验的结果,将机械功率相对危险度(RR)以及术后肺部并发症的发生率引入PASS软件,设定检验水准α=0.05和检验效能1-β=0.9,计算得164例,考虑到10%的失访率,最终样本量估计为180 例。
采用Excel整理数据,采用SPSS 25.0软件进行统计学分析。根据有无发生PPCs分为并发症组和非并发症组。采用倾向性评分匹配(propensity score matching,PSM)法分析病人年龄、性别、BMI、吸烟史、术前空腹血糖、清蛋白、尿素、肌酐、术前血红蛋白等基线资料,采用近邻法对并发症组以及非并发症组进行1∶1配对,χ2值为0.02。PSM后对两组各30例病人进行分析。定量资料以均数±标准差(x±s)或中位数(四分位数)[M(P,P)]表示,定性资料以例数、百分比(%)表示。对符合正态分布的定量资料采用两独立样本t检验;不符合正态分布的定量资料及无序多分类资料采用Mann-Whitney U检验,定性资料比较采用χ2检验。以P<0.05为差异有统计学意义。采用受试者工作特征(receiver operating characteristic,ROC)曲线的最大约登指数(敏感度+特异度-1)计算预测因子的界值,并通过曲线下面积(area under curve,AUC)评估机械功率的预测效能。
2 结 果
2.1 PPCs发生情况
本研究共180例病人入组,16例失访,最终纳入164例,其中,36例(21.95%)发生PPCs(并发症组),包括呼吸道感染14例,肺不张25例,胸腔积液30例,呼吸衰竭1例,无气胸、支气管痉挛、吸入性肺炎。
2.2 PSM前后两组基线资料比较
PSM前两组性别、年龄、BMI、1个月内吸烟史、有无高血压、术前SpO、术前空腹血糖、清蛋白、尿素、肌酐、术前血红蛋白、吸氧浓度、手术时长、麻醉时长、术中顺式阿曲库铵用量、术中补充晶体液、胶体液、尿量等比较,差异均无统计学意义(P>0.05)。两组ARISCAT评分、ASA分级比较,差异有统计学意义(P<0.05)。PSM后共30对病人配对成功,两组基线资料比较差异无统计学意义(P>0.05)。详见表1。
2.3 PSM后两组病人机械功率和住院时长比较
PSM后两组机械功率比较,差异有统计学意义(P<0.05)。并发症组住院时间长于非并发症组,差异有统计学意义(P<0.05)。详见表2。
2.4 ROC曲线分析
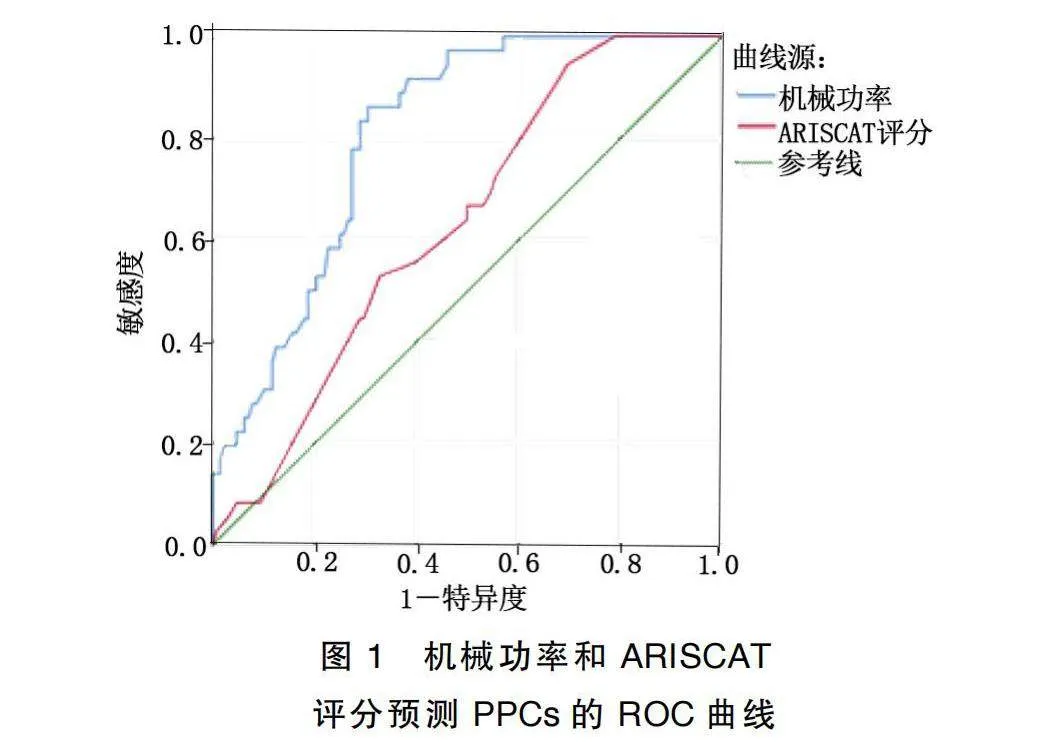
ROC曲线显示,机械功率的预测效能[AUC=0.806,95%CI(0.738,0.873),P<0.001]优于ARISCAT评分[AUC=0.631,95%CI(0.539,0.723),P=0.016]。机械功率的界值为7.56 J/min(敏感度86.1%,特异度69.5%),ARISCAT评分的界值为21分(敏感度94.4%,特异度30.5%)。详见图1。
3 讨 论
尽管肺保护性通气策略的应用能最大限度地保护病人的肺功能,减少机械通气对肺部的损伤,降低了手术病人术后肺部并发症发生率以及病死率,但发生术后肺部并发症的病人恢复和住院时间延长,严重影响病人预后[9]。本研究发现,2型糖尿病病人术后肺部并发症与全身麻醉机械通气期间较高的机械通气呼吸功有关,且这种并发症会显著延长病人的住院时长。通过倾向性评分匹配后,机械通气呼吸功率与肺部并发症的关联仍然显著。ROC曲线分析表明,机械通气呼吸功率对术后肺部并发症具有较好的预测价值。因此,建议在2型糖尿病病人腹腔镜结直肠切除手术中,应注意监测和控制机械通气参数,以降低术后肺部并发症的发生率,缩短病人的住院时长。
在危重症或围术期病人中,机械通气是改善氧合和维持通气的重要支持性治疗[10]。机械通气时,呼吸机产生的机械力对呼吸系统做功,主要能量表现形式为机械能,呼吸系统的机械功率代表单位时间内几个呼吸周期累积的总能量负荷,通常表示为呼吸系统的机械能与呼吸频率的乘积,单位为J/min[5]。2020年Chiumello等[11]验证了一个简化公式,即:机械功率=0.098×RR×Vt×(PEEP+1/2[Plat-PEEP]+[Peak-Plat]),同时适用于容积控制和压力控制通气时。Collino等[12]研究发现,在逐步增加PEEP从而选择性地升高机械功率过程中,必然伴随其他一些呼吸参数的变化。全身麻醉机械通气期间机械动力是一个统一的工具,通过调整呼吸参数降低呼吸机相关性肺损伤的发生率时,应该考虑其所有参数变化。这也是本研究将术中呼吸机参数视作一个整体并整合成单一的机械功率,作为PPCs的一个危险因素来统计验证的原因。
既往的研究主要来自重症监护室病人的有创机械通气期间。多项回顾性研究表明,机械功率与ARDS病人死亡率相关[13-15]。24 h机械功率变异率与危重症病人的死亡率相关,机械功率的早期降低可能为这一人群提供预后益处[16-17]。为了解机械功率在无肺损伤病人呼吸衰竭发展中的作用以及来自ARDS病人的证据是否适用于全身麻醉的病人,一个多中心回顾性队列研究发现术中机械通气期间应用较高的机械功率与术后呼吸衰竭风险相关[6]。一项研究对两项国际多中心随机临床试验进行了后续分析,在接受开腹手术的高危病人中,暴露于较高的机械功率与术后肺部并发症的发生独立相关[18]。
糖尿病是一种糖代谢失调的内分泌疾病,已被证明是术后并发症发生率和死亡率的危险因素[19]。研究表明,糖尿病发病之前即存在肺功能损伤,主要表现为限制性通气功能障碍和弥散功能障碍[2]。糖尿病病人具有更低的用力肺活量、第1秒用力呼气容积、肺总量、肺活量、最高呼气流量、最大吸气压力和最大自主通气量,并且肺功能损害程度与血糖控制水平和糖尿病严重程度相关[20]。尽管小Vt量、高频率的保护性机械通气策略适用于糖尿病,但糖尿病仍可增加小鼠的炎症反应和相关的肺损伤[21]。一项前瞻性研究发现,糖尿病病人全身麻醉时围术期出现吸肺顺应性下降、气道峰压升高、氧合指数降低、呼吸指数降低、肺泡-动脉氧分压差降低,总体肺功能减低,术后肺部炎症反应较非糖尿病病人明显[22]。全身麻醉机械通气期间较高的机械功率与腹腔镜手术糖尿病病人PPCs的发生是否相关还有待研究证实。
本研究结果表明,较高的机械功率与PPCs发生率相关(P<0.05),ROC曲线结果表明,机械功率7.56 J/min是预测PPCs发生的阈值。较高的机械功率更易导致PPCs发生的可能原因为:1)机械通气与能量的大量耗散有关,即机械力产生的动能和势能之间相互转换,动能转化为存储在肺和胸壁等弹性组织中的势能,或在克服阻力时转化为热能,可能导致肺组织损伤,从而导致呼吸机诱导的肺损伤[2,23]。2)呼吸机产生的机械力直接作用于肺骨骼,即细胞外基质,使锚定在其上面的上皮细胞和内皮细胞变形,从而被激活引起炎症反应[24]。一项动物实验发现,低机械功率组的肺内炎性因子水平明显低于高机械功率组[25],可见机械力不只直接通过机械运动损伤肺组织,也与肺部炎症密切相关[26]。机械功率的概念不仅有助于理解呼吸机诱导肺损伤的机制,还能提示麻醉医生评估机械通气和病人的肺状态,识别病人发生PPCs的风险。
本研究存在一定的局限性。首先,本研究为单中心队列研究,研究对象存在偏倚,结论存在局限性,不能代表其他研究中心及人群的特点。其次,机械功率最佳目标范围尚未确定,未来需扩大手术类型及病人人群,针对各类病人术中机械功率水平开展多中心高质量前瞻性研究,以深入探讨发生PPCs的病人术中机械功率的阈值。最后,本研究不能证明术中机械功率和术后肺部并发症的因果关系,尚缺乏有效的随机对照试验对术中机械通气干预或限制以观察是否影响病人的预后。
综上所述,术中较高的机械功率与腹腔镜结直肠切除手术2型糖尿病病人发生术后肺部并发症的风险增加相关,发生术后肺部并发症的手术病人住院时间延长。
参考文献:
[1] BALL L,BATTAGLINI D,PELOSI P.Postoperative respiratory disorders[J]. Current Opinion in Critical Care,2016,22(4):379-385.
[2] DAVIS W A,KNUIMAN M,KENDALL P,et al.Glycemic exposure is associated with reduced pulmonary function in type 2 diabetes:the Fremantle diabetes study[J]. Diabetes Care,2004,27(3):752-757.
[3] GATTINONI L,TONETTI T,CRESSONI M,et al.Ventilator-related causes of lung injury:the mechanical power[J].Intensive Care Medicine,2016,42(10):1567-1575.
[4] KARALAPILLAI D,WEINBERG L,NETO A S,et al.Intra-operative ventilator mechanical power as a predictor of postoperative pulmonary complications in surgical patients:a secondary analysis of a randomised clinical trial[J].European Journal of Anaesthesiology,2022,39(1):67-74.
[5] SERPA NETO A,DELIBERATO R O,JOHNSON A E W,et al.Mechanical power of ventilation is associated with mortality in critically ill patients:an analysis of patients in two observational cohorts[J].Intensive Care Medicine,2018,44(11):1914-1922.
[6] SANTER P,WACHTENDORF L J,SULEIMAN A,et al.Mechanical power during general anesthesia and postoperative respiratory failure:a multicenter retrospective cohort study[J].Anesthesiology,2022,137(1):41-54.
[7] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2020年版)(上)[J].中国实用内科杂志,2021,41(8):668-695.
[8] JAMMER I,WICKBOLDT N,SANDER M,et al.Standards for definitions and use of outcome measures for clinical effectiveness research in perioperative medicine: European Perioperative Clinical Outcome(EPCO) definitions:a statement from the ESA-ESICM joint task force on perioperative outcome measures[J].European Journal of Anaesthesiology,2015,32(2):88-105.
[9] MAZO V,SABATÉ S,CANET J,et al.Prospective external validation of a predictive score for postoperative pulmonary complications[J].Anesthesiology,2014,121(2):219-231.
[10] SUTHERASAN Y,D′ANTINI D,PELOSI P.Advances in ventilator-associated lung injury:prevention is the target[J].Expert Review of Respiratory Medicine,2014,8(2):233-24wDe4KtPLrYeQ5gzbj/F9EFV6KB6bX538CBYLU7U3KAs=8.
[11] CHIUMELLO D,GOTTI M,GUANZIROLI M,et al.Bedside calculation of mechanical power during volume- and pressure-controlled mechanical ventilation[J].Critical Care,2020,24(1):417.
[12] COLLINO F,RAPETTI F,VASQUES F,et al.Positive end-expiratory pressure and mechanical power[J].Anesthesiology,2019,130(1):119-130.
[13] ZHANG Z H,ZHENG B,LIU N,et al.Mechanical power normalized to predicted body weight as a predictor of mortality in patients with acute respiratory distress syndrome[J].Intensive Care Medicine,2019,45(6):856-864.
[14] COSTA E L V,SLUTSKY A S,BROCHARD L J,et al.Ventilatory variables and mechanical power in patients with acute respiratory distress syndrome[J].American Journal of Respiratory and Critical Care Medicine,2021,204(3):303-311.
[15] GHIANI A,PADEREWSKA J,WALCHER S,et al.Mechanical power normalized to lung-thorax compliance predicts prolonged ventilation weaning failure:a prospective study[J].BMC Pulmonary Medicine,2021,21(1):202.
[16] CHI Y,ZHANG Q,YUAN S Y,et al.Twenty-four-hour mechanical power variation rate is associated with mortality among critically ill patients with acute respiratory failure:a retrospective cohort study[J].BMC Pulmonary Medicine,2021,21(1):331.
[17] VAN MEENEN D M P,NETO A S,PAULUS F,et al.The predictive validity for mortality of the driving pressure and the mechanical power of ventilation[J].Intensive Care Medicine Experimental,2020,8(Suppl 1):60.
[18] SCHUIJT M T U,HOL L,NIJBROEK S G,et al.Associations of dynamic driving pressure and mechanical power with postoperative pulmonary complications-posthoc analysis of two randomised clinical trials in open abdominal surgery[J]. EClinicalMedicine,2022,47:101397.
[19] GOODENOUGH C J,LIANG M K,NGUYEN M T,et al.Preoperative glycosylated hemoglobin and postoperative glucose together predict major complications after abdominal surgery[J].Journal of the American College of Surgeons,2015,221(4):854-861.e1.
[20] 郑淑妹.糖尿病患者肺功能损害的特征及机制研究进展[J].大连医科大学学报,2021,43(3):263-268.
[21] XIONG X Q,WANG W T,WANG L R,et al.Diabetes increases inflammation and lung injury associated with protective ventilation strategy in mice[J].International Immunopharmacology,2012,13(3):280-283.
[22] 李路丝.腹腔镜手术对糖尿病患者围术期肺功能的影响[D].广州:南方医科大学,2019.
[23] HUHLE R,SERPA NETO A,SCHULTZ M J,et al.Is mechanical power the final word on ventilator-induced lung injury? -no[J].Annals of Translational Medicine,2018,6(19):394.
[24] CRESSONI M,GOTTI M,CHIURAZZI C,et al.Mechanical power and development of ventilator-induced lung injury[J].Anesthesiology,2016,124(5):1100-1108.
[25] SANTOS R S,MAIA L A,OLIVEIRA M V,et al.Biologic impact of mechanical power at high and low tidal volumes in experimental mild acute respiratory distress syndrome[J].Anesthesiology,2018,128(6):1193-1206.
[26] TONETTI T,CRESSONI M,COLLINO F,et al.Volutrauma,atelectrauma,and mechanical power[J].Critical Care Medicine,2017,45(3):e327-e328.
(收稿日期:2024-05-29)
(本文编辑 王丽)

