类病毒及其分类进展



摘要随着高通量测序技术的发展及其在类病毒研究中的广泛应用,近年来从不同的物种中发现了多种新类病毒以及大量的疑似类病毒的环状RNA,给类病毒的分类和命名带来了新挑战。为此,国际类病毒分类小组更新了类病毒的分类及命名的一些规则。为了使大家更清楚地了解类病毒最新的分类及命名情况,本文在简要介绍类病毒的基础上,概述了当前类病毒的分类以及不同分类阶元划分的依据以及变动的原因。
关键词类病毒;分类;命名;双名法;环状RNA;非编码RNA
中图分类号:S 432.41文献标识码:ADOI:10.16688/j.zwbh.2023499Viroid and the current status of its taxonomyTIAN Xiaxia LI Shifang ZHANG Zhixiang(1. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,
Chinese Academy of Agricultural Sciences, Beijing100193, China; 2. Citrus Research Institute,
Southwest University, Chongqing400712, China)AbstractWith the rapid development of high-throughput sequencing and its wide application in viroid research, more viroids or viroid-like circular RNA molecules were identified from different organisms, posing a new challenge to viroid taxonomy and demarcation. Viroid study group modified the rules of viroid taxonomy and demarcation to meet the requirements of classification of the increasing new viroids. Our main purpose is to clearly show the latest viroid taxonomy and demarcation. Based on a short introduction to viroids, we comprehensively summarize the principle of viroid taxonomy and offer the explanation for the recent modifications.
Key wordsviroid;taxonomy;nomenclature;binomial nomenclature;circular RNA;non-coding
RNA类病毒是一类植物病原物,可侵染马铃薯、番茄和苹果等作物,并引起多种严重病害,如马铃薯纺锤形块茎病、番茄褪绿矮缩病、苹果锈果病以及椰子死亡病等。由于基因组RNA结构简单而功能完备,类病毒还是RNA结构与功能研究常用的模式生物[12]。虽然基因组RNA仅由几百个碱基组成,并且无外壳蛋白的包裹,但依然能自主复制,甚至引起病害。
与植物病毒相比,类病毒的数量较少,仅有40余种(https:∥ictv.global/taxonomy),但仍有自己的分类和命名的规则和系统。近年来,随着高通量测序技术的发展和应用,发现了多种新类病毒。此外,随着环形RNA研究的兴起[34],人们从不同物种中鉴定出了大量的环形RNA[56]。例如,从真菌等物种中发现了很多与类病毒相似的环形RNA[710]。这些环形RNA不仅包含核酶结构,而且能自主复制,被称为类病毒样RNA(viroid-like RNA)。这些新类病毒及类病毒样RNA的发现给类病毒分类带来了新的挑战。本文将概述当前类病毒的分类,详细介绍不同分类阶元划分的依据以及变动的原因,并且讨论类病毒样RNA的分类及命名问题。
1类病毒简介
类病毒是一类特殊的单链、环状、非编码RNA;能够在高等植物体内自主复制,有的能致病,是已知最小的植物病原物。不同于普通病毒,类病毒的基因组核酸无外壳蛋白包裹,是裸露的RNA分子[11]。
1.1理化特征
类病毒的分子质量低[12],约为1.25×103~8.0×104 Mr。基因组由约250~430个碱基组成,大多数碱基可相互配对,使基因组折叠成紧凑的棒状、类似棒状或者分枝状结构[1314],长度约为50 nm。变性条件下,所有配对的碱基打开,基因组变为单链环形,周长约100 nm。基因组呈分枝状的类病毒通常不溶于2 mol/L氯化锂溶液;而基因组呈棒状的通常是可溶的。
1.2基因组及其结构
类病毒基因组RNA在寄主体内存在正链和负链,积累浓度各不相同。依惯例,浓度高的为正链。正、负链均存在线状的形式,主要是类病毒复制过程中产生的双链RNA中间体。多数类病毒的环状RNA只有正链,少数类病毒的环状RNA既有正链也有负链。若无特殊说明,类病毒一般指正链环状RNA。除了鳄梨日斑类病毒(avocado sunblotch viroid, ASBVd)的GC含量为38%外,其余类病毒的基因组的GC含量较高,为53%~60%。
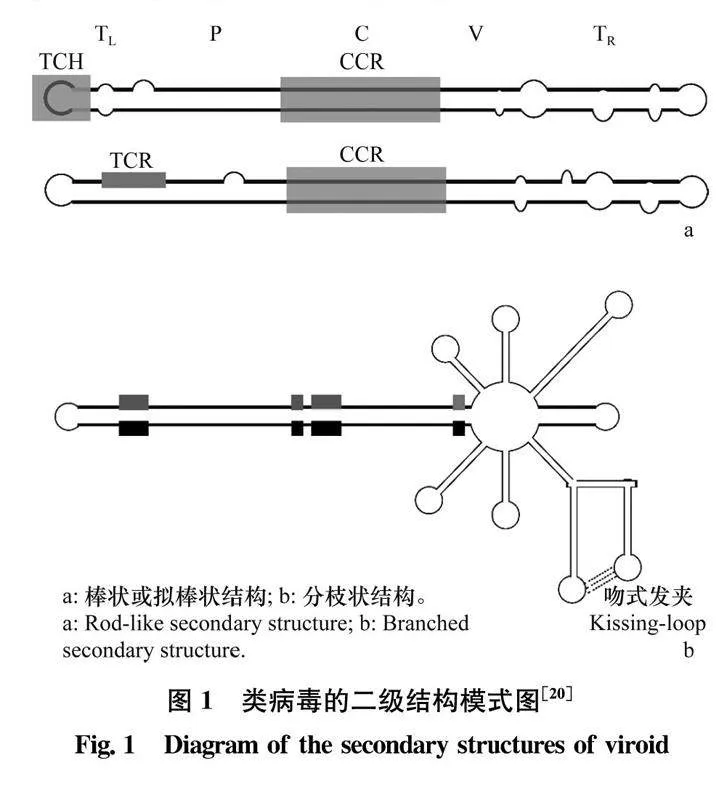
分子内的碱基互补配对,使类病毒基因组RNA折叠成紧凑的构象。大体分为两类。一类呈棒状或拟棒状(图1a),配对的双链RNA 区与未配对碱基形成的环或凸起间隔排列;一类呈分枝状(图1b),由多个长短不等的发夹结构组成。这些构象已获得体内和体外试验的证实[13, 1518]。呈棒状或拟棒状的基因组,通常被划分为5个功能结构域[1920]:左末端区(terminal left, TL),致病区(pathogenic, P),中央区(central, C),可变区(variable, V)和右末端区(terminal right, TR)。C区包含中央保守区(central conserved region, CCR)。有的类病毒的TL区包含末端保守区(terminal conserved region, TCR),而有的包含末端保守发夹结构(terminal conserved hairpin, TCH)。呈分枝状的基因组,不包含上述的结构功能区,而包含锤头状核酶结构[21],并且有的还包含三级结构,如不同发夹结构的环之间的碱基存在互补配对[2223],形成类似拟结结构的“吻式”发夹(kissing-loop)。
1.3复制
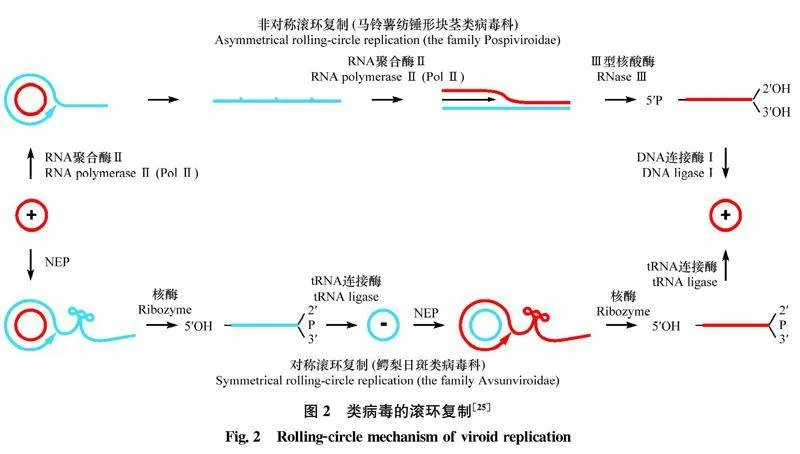
类病毒进行滚环复制[2425]。基因组为棒状或拟棒状的类病毒,一般在寄主的细胞核内进行非对称滚环复制;基因组为分枝状的类病毒,通常在寄主的叶绿体中进行对称滚环复制(图2)。无论哪种复制方式,均包含RNA的转录、剪切和连接。
非对称滚环复制过程:1)转录:在寄主RNA聚合酶Ⅱ(Pol Ⅱ)的作用下,以正链环状RNA为模板,通过滚环方式合成负链多聚RNA,然后以此为模板,合成正链多聚RNA;2)剪切:在寄主的某种Ⅲ型RNA酶(RNase Ⅲ)的作用下,将正链多聚RNA剪切成单个基因组长度的线状RNA;3)连接:在寄主DNA连接酶Ⅰ的作用下,单个基因组长度的线状RNA被连接成环状。
对称滚环复制过程:1)转录:在细胞核编码的聚合酶(nuclear-encoded polymerase, NEP)作用下,以正链环状RNA为模板,通过滚环方式合成负链多聚RNA;2)剪切:在核酶的作用下,负链多聚RNA自我剪切成单个基因组长度的线状RNA;3)连接:在tRNA连接酶的作用下,单个基因组长度的线状RNA被连接成环状;4)转录:在NEP作用下,以负链环状RNA为模板,合成正链多聚RNA;5)剪切:在核酶的作用下,正链多聚RNA自我剪切成单个基因组长度的线状RNA;6)连接:在tRNA连接酶的作用下,线状RNA被连接成环状。
1.4生物学特征
自然界中存在多种环状RNA。除类病毒外,还有与类病毒类似的卫星RNA、丁型肝炎病毒(hepatitis delta virus, HDV)[26]、基因组编码的内源环状RNA[5]以及从真菌中发现的一些环状RNA[89]。类病毒区别于其他环状RNA的特征是能够在寄主体内自主复制并建立系统侵染[11]。
1.4.1寄主范围
通常认为类病毒只侵染高等植物,包括双子叶植物和单子叶植物。不同类病毒的寄主范围不同,差别较大。在叶绿体内进行对称滚环复制的类病毒的寄主范围通常较窄。
需要注意的是,真菌可能也是类病毒的寄主,因为通过人工接种,ASBVd可在酿酒酵母Saccharomyces cerevisiae中复制[27]。此外,有研究表明,有些类病毒可以侵染植物病原真菌如栗疫病菌Cryphonectria parasitica,苹果腐烂病菌Valsa mali,禾谷镰孢Fusarium graminearum[28]。不过还有待进一步验证[29]。
1.4.2症状
类病毒引起的症状与植物病毒类似。不仅整个植株会表现出矮化、卷叶等发育异常,而且不同组织包括叶片、花、果实、茎和根等均会表现出明显的症状,如叶片的褪绿、斑驳和卷曲,花的变色,果实的变色及畸形,树皮的溃疡及开裂以及块根的畸形等。
1.4.3移动
类病毒通过胞间连丝在寄主的细胞间进行短距离移动[30],通过韧皮部在不同组织间进行长距离移动[31]。类病毒的移动受到自身基因组结构及寄主蛋白的调控。基因组中存在一些决定细胞内和细胞间移动的结构模体[32];长距离移动需要寄主蛋白质如韧皮部凝集素(phloem proteiPFKLG1cSzdss+KlJ7l+xbQ==n 2, PP2)[3334]的参与。
1.4.4传播
类病毒既可水平传播也可垂直传播[35]。水平传播的方式有无性繁殖、机械摩擦、嫁接等。在园艺作物如果树和花卉植物上,带毒繁殖材料的扩繁是主要的传播方式。自然条件下,类病毒一般极少通过昆虫传播。垂直传播主要通过种子和花粉。传播效率受类病毒自身、植物以及品种的影响,变化范围较大。
2分类
在国际病毒分类委员会(International Committee on Taxonomy of Viruses, ICTV)的分类报告中,类病毒与朊病毒、卫星病毒及其他病毒依赖性核酸一起,被归入亚病毒因子(subviral agents)。2017年4月,ICTV发布的病毒分类及命名规范条款3.32指出:“病毒的分类规则也适用于类病毒和卫星RNA”。然而,类病毒既不编码蛋白质,也无外壳蛋白包裹。病毒分类规则中的形态学特征、蛋白质特性以及抗原特征等不能用于类病毒的分类。因此,类病毒分类主要以上述理化性质、基因组结构特征和生物学特性等为依据。
2.1类病毒科的划分
根据理化性质、基因组结构、复制特点等将现有的类病毒分成两个科:马铃薯纺锤形块茎类病毒科Pospiviroidae[36]和鳄梨日斑类病毒科Avsunviroidae[37](表1)。
2.2类病毒属的划分
根据CCR的序列,将马铃薯纺锤形块茎类病毒科划分为5个属(表2),分别为苹果锈果病类病毒属Apscaviroid,椰子死亡类病毒属Cocadviroid,锦紫苏类病毒属Coleviroid,啤酒花矮化类病毒属Hostuviroid和马铃薯纺锤形块茎类病毒属Pospiviroid[36]。此外,末端保守区(TCR)和末端保守发夹结构(TCH)也是划分属的重要依据。啤酒花矮化类病毒属和椰子死亡类病毒属含有TCH,其余的3个属含有TCR。
依据锤头状核酶的结构、基因组的GC含量、在2 mol/L氯化锂溶液中的溶解性以及系统发育关系,将鳄梨日斑类病毒科划分为3个属(表2),分别为鳄梨日斑类病毒属Avsunviroid,桃潜隐花叶类病毒属Pelamoviroid和茄潜隐类病毒属Elaviroid[37]。
2.3类病毒种的确立
ICTV第9次分类报告中明确指出,类病毒种的确立必须同时满足两个条件[11, 38]:1) 与已知类病毒相比,序列相似性低于90%;2)具有独特的生物学特征,尤其是寄主范围和症状。在实际应用中,前者通常容易满足,而后者有时较难甚至短期内无法满足。例如,有的类病毒没有致病性,侵染寄主后,呈潜伏状态,不引起任何症状;有的类病毒虽有致病性,但只侵染多年生木本植物,不仅接种困难,而且症状表现所需时间较长,有的需要数年[39]。
近年来,随着高通量测序技术的快速发展及其在类病毒鉴定中的广泛应用[4041],发现了多种新类病毒及疑似类病毒的环状RNA,尤其是从一些多年生木本或藤本植物中,如苹果[4243]、葡萄[41, 43]、荔枝[44]和李子[45]等。尽管它们均能满足类病毒种确立的第1个条件,但是大多难以满足第2个条件,使得其分类地位长时间未定。为此,生物学特征不明确的类病毒的分类成了亟须解决的问题[46]。为解决该问题,最近提出了一种新的分类标准[46]。
新标准主要基于序列相似性的比较。将类病毒的所有序列变体进行两两比较,获得序列相似性矩阵(pairwise identity matrices),基于该矩阵,确定了种确立的最低序列相似性的值[46]。此前,种的确立要满足与已知类病毒的序列相似性低于90%的标准。与之不同,新标准没有设定统一的值,而是每个属设定一个值。苹果锈果类病毒属为78%、啤酒花矮化类病毒属为79%、马铃薯纺锤形块茎类病毒属为83%、椰子死亡类病毒属为79%、锦紫苏类病毒属为91%、鳄梨日斑类病毒属为92%、茄潜隐类病毒属为83%、桃潜隐花叶类病毒属为73%。先根据CCR的序列及基因组结构特征,明确待分类类病毒的属,然后查看与本属类病毒的序列相似性。如果最低值小于该属的种确立的标准值,则认定为该属的新种;否则,为该属的一种已知类病毒的序列变体。值得指出的是,这些种确立的序列相似性的标准值不是固定不变的,而是随着种类及序列数量的增多动态变化的。
新标准下的分类系统与之前的相吻合,说明适用于类病毒分类。根据新标准,11种待分类的类病毒均有了明确的分类地位,经类病毒分类小组(Viroid Study Group)讨论,提议将它们均接收为正式的种,并且已经获得了ICTV的通过。因此,与第9次分类报告相比,最新的类病毒种类列表中新增11个成员(表2)。其中,苹果锈果类病毒属新增7个成员,分别为苹果褪绿果斑类病毒Apscaviroid maculamali、葡萄潜隐类病毒Apscaviroid latensvitis、石斛类病毒Apscaviroid dendrobii、荔枝类病毒Apscaviroid litchis、李子类病毒Apscaviroid latenspruni、柿子类病毒Apscaviroid betadiospyri以及柿子类病毒2号Apscaviroid diospyri;锦紫苏类病毒属新增2个成员,分别为锦紫苏类病毒5号Coleviroid epsiloncolei和锦紫苏类病毒6号Coleviroid zetacolei;马铃薯纺锤形块茎类病毒科新增1个成员,为马齿苋潜隐类病毒Pospiviroid latensportulacae;桃潜隐花叶类病毒属新增1个成员,为苹果锤头状核酶类病毒Pelamoviroid malleusmali。至此,类病毒正式种增为44个。
虽然类病毒种确立的新标准主要依据序列相似性,但并不意味着彻底摒弃了对生物学特征的要求[46]。因为类病毒分类的前提是要先证明某个环状RNA是类病毒,而这需要证明该环状RNA能够在寄主体内自主复制[39],这就需要进行接种等生物学试验。此外,有时仅根据序列相似性难以区分不同的种。例如,番茄褪绿矮缩类病毒与马铃薯纺锤形块茎类病毒的序列相似性约为90%[38],按照新标准,该值高于马铃薯纺锤形块茎类病毒属种确立的标准(83%),应该是马铃薯纺锤形块茎类病毒的一个变体。但是,两者的生物学特征不同,相互之间不存在交叉保护作用[47]。因此,将番茄褪绿矮缩类病毒认定为种。
3命名
此前,类病毒的命名与病毒相同,一般由寄主名加症状描述组成。近年来,ICTV提议使用双名法(binomial nomenclature)命名病毒种[48],已于2021年3月投票通过了双名法命名的提议[49]。以锦紫苏类病毒属的锦紫苏类病毒5号为例,该类病毒的普通名称为colues blumei viroid-5(缩写为CbVd-5),其种名为Coleviroid epsiloncolei。书写时应注意区分类病毒普通名称和类病毒种名。类病毒普通名称为正体、小写,可缩写;类病毒种名为斜体,不可缩写。
4展望
类病毒的分类规则及系统不是固定不变的,而是随着种类的增多不断发展变化[38, 50]。现在确立类病毒种的标准也会遇到挑战,因为未来会发现更多新类病毒。一方面,不断深入的病毒生态学研究将会测定分析更多物种及生态系统中的病毒组(virome),由此应该会发现多种新类病毒。虽然已知的类病毒仅来自于高等植物,主要是由于过去的研究主要围绕着作物展开,但并不意味着其他物种中没有类病毒。有研究发现类病毒可以在真菌中复制[27],并且真菌中存在大量的疑似类病毒的环状RNA[79]。另一方面,类病毒的快速演化将会产生更多的新类病毒。突变和重组是类病毒演化的主要动力[51]。在已知的物种中,类病毒的突变率最高[52],易于产生更多的类病毒新种。不同种间会频繁发生重组[51],重组是锦紫苏类病毒属的新种产生的主要方式。此外,类病毒基因组小,复制所需时间短,繁殖速度快。总之,具有高突变率、重组率以及快速繁殖等特点的类病毒势必会演化出更多的新种。
参考文献
[1]DING Biao, WANG Ying. Viroids: uniquely simple and tractable models to elucidate regulation of cell-to-cell trafficking of RNA [J]. DNA and Cell Biology, 2009, 28(2): 5156.
[2]DING Biao. The biology of viroid-host interactions [J]. Annual Review of Phytopathology, 2009, 47: 105131.
[3]MEMCZAK S, JENS M, ELEFSINIOTI A, et al. Circular RNAs are a large class of animal RNAs with regulatory potency [J]. Nature, 2013, 495(7441): 333338.
[4]HANSEN T B, JENSEN T I, CLAUSEN B H, et al. Natural RNA circles function as efficient microRNA sponges [J]. Nature, 2013, 495(7441): 384388.
[5]WANG P L, BAO Yun, YEE M C, et al. Circular RNA is expressed across the eukaryotic tree of life [J/OL]. PLoS ONE, 2014, 9(6): e90859. DOI: 10.1371/journal.pone.0090859.
[6]JECK W R, SORRENTINO J A, WANG Kai, et al. Circular RNAs are abundant, conserved, and associated with ALU repeats [J]. RNA, 2013, 19(2): 141157.
[7]LEE B D, NERI U, ROUX S, et al. Mining metatranscriptomes reveals a vast world of viroid-like circular RNAs [J]. Cell, 2023, 186(3): 646661.
[8]FORGIA M, NAVARRO B, DAGHINO S, et al. Hybrids of RNA viruses and viroid-like elements replicate in fungi [J/OL]. Nature Communications, 2023, 14(1): 2591. DOI: 10.1038/s41467-023-38301-2.
[9]DONG Kaili, XU Chuan, KOTTA-LOIZOU I, et al. Novel viroid-like RNAs naturally infect a filamentous fungus [J/OL]. Advanced Science, 2023, 10(3): e2204308. DOI: 10.1002/advs.202204308.
[10]CHONG L C, LAUBER C. Viroid-like RNA-dependent RNA polymerase-encoding ambiviruses are abundant in complex fungi [J/OL]. Frontiers in Microbiology, 2023, 14: 1144003. DOI: 10.3389/fmicb.2023.1144003.
[11]OWENS R A, FLORES R, DI SERIO F, et al. Viroids [M]∥KING A M Q, ADAMS M J, LEFKOWITZ E J, et al. Virus taxonomy: Ninth report of the International Committee on Taxonomy of Viruses. New York: Elsevier Academic Press, 2012: 12211234.
[12]DIENER T O. Potato spindle tuber “virus”: IV. A replicating, low molecular weight RNA [J]. Virology, 1971, 45(2): 411428.
[13]MORENO M, VAZQUEZ L, LOPEZ-CARRASCO A, et al. Direct visualization of the native structure of viroid RNAs at single-molecule resolution by atomic force microscopy [J]. RNA Biology, 2019, 16(3): 295308.
[14]GROSS H J, DOMDEY H, LOSSOW C, et al. Nucleotide sequence and secondary structure of potato spindle tuber viroid [J]. Nature, 1978, 273(5659): 203208.
[15]LOPEZ-CARRASCO A, FLORES R. Dissecting the secondary structure of the circular RNA of a nuclear viroid in vivo: A “naked” rod-like conformation similar but not identical to that observed in vitro [J]. RNA Biology, 2017, 14(8): 10461054.
[16]GIGUERE T, PERREAULT J P. Classification of the Pospiviroidae based on their structural hallmarks [J/OL]. PLoS ONE, 2017, 12(8): e0182536. DOI: 10.1371/journal.pone.0182536.
[17]GIGUERE T, ADKAR-PURUSHOTHAMA C R, PERREAULT J P. Comprehensive secondary structure elucidation of four genera of the family Pospiviroidae [J/OL]. PLoS ONE, 2014, 9(6): e98655. DOI: 10.1371/journal.pone.0098655.
[18]XU Wenxing, BOLDUC F, HONG Ni, et al. The use of a combination of computer-assisted structure prediction and SHAPE probing to elucidate the secondary structures of five viroids [J]. Molecular Plant Pathology, 2012, 13(7): 666676.
[19]KEESE P, SYMONS R H. Domains in viroids: evidence of intermolecular RNA rearrangements and their contribution to viroid evolution [J]. Proceedings of the National Academy of Sciences of the United States of America, 1985, 82(14): 45824586.
[20]NAVARRO B, FLORES R, DI SERIO F. Advances in viroid-host interactions [J]. Annual Review Virology, 2021, 8(1): 305325.
[21]HERNANDEZ C, FLORES R. Plus and minus RNAs of peach lw+yFdnktYa+VAIHKArOYuA==atent mosaic viroid self-cleave in vitro via hammerhead structures [J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(9): 37113715.
[22]GAGO S, DE LA PENA M, FLORES R. A kissing-loop interaction in a hammerhead viroid RNA critical for its in vitro folding and in vivo viability [J]. RNA, 2005, 11(7): 10731083.
[23]BUSSIERE F, OUELLET J, COTE F, et al. Mapping in solution shows the peach latent mosaic viroid to possess a new pseudoknot in a complex, branched secondary structure [J]. Journal of Virology, 2000, 74(6): 26472654.
[24]WANG Ying. Current view and perspectives in viroid replication [J]. Current Opinion in Virology, 2021, 47: 3237.
[25]FLORES R, GRUBB D, ELLEUCH A, et al. Rolling-circle replication of viroids, viroid-like satellite RNAs and hepatitis delta virus variations on a theme [J]. RNA Biology, 2011, 8(2): 200206.
[26]FLORES R, OWENS R A, TAYLOR J. Pathogenesis by subviral agents: viroids and hepatitis delta virus [J]. Current Opinion in Virology, 2016, 17: 8794.
[27]DELAN-FORINO C, MAUREL M C, TORCHET C. Replication of avocado sunblotch viroid in the yeast Saccharomyces cerevisiae [J]. Journal of Virology, 2011, 85(7): 32293238.
[28]WEI Shuang, BIAN Ruiling, ANDIKA I B, et al. Symptomatic plant viroid infections in phytopathogenic fungi [J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(26): 1304213050.
[29]SERRA P, CARBONELL A, NAVARRO B, et al. Symptomatic plant viroid infections in phytopathogenic fungi: A request for a critical reassessment [J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(19): 1012610128.
[30]DING Biao, KWON M O, HAMMOND R, et al. Cell-to-cell movement of potato spindle tuber viroid [J]. Plant Journal, 1997, 12(4): 931936.
[31]PALUKAITIS P. Potato spindle tuber viroid: Investigation of the long-distance, intra-plant transport route [J]. Virology, 1987, 158(1): 239241.
[32]ZHONG Xuehua, ARCHUAL A J, AMIN A A, et al. A genomic map of viroid RNA motifs critical for replication and systemic trafficking [J]. Plant Cell, 2008, 20(1): 3547.
[33]OWENS R A, BLACKBURN M, DING Biao. Possible involvement of the phloem lectin in long-distance viroid movement [J]. Molecular Plant-Microbe Interactions, 2001, 14(7): 905909.
[34]GOMEZ G, PALLAS V. Identification of an in vitro ribonucleoprotein complex between a viroid RNA and a phloem protein from cucumber plants [J]. Molecular Plant-Microbe Interactions, 2001, 14(7): 910913.
[35]MATSUSHITA Y, YANAGISAWA H, SANO T. Vertical and horizontal transmission of pospiviroids [J/OL]. Viruses, 2018, 10(12): 706. DOI: 10.3390/v10120706.
[36]DI SERIO F, OWENS R A, LI Shifang, et al. ICTV virus taxonomy profile: Pospiviroidae [J/OL]. Journal of General Virology, 2021, 102(2): 001543. DOI: 10.1099/jgv.0.001543.
[37]DI SERIO F, LI Shifang, MATOUSEK J, et al. ICTV virus taxonomy profile: Avsunviroidae [J]. Journal of General Virology, 2018, 99(5): 611612.
[38]DI SERIO F, FLORES R, VERHOEVEN J T J, et al. Current status of viroid taxonomy [J]. Archives of Virology, 2014, 159(12): 34673478.
[39]DI SERIO F, AMBROS S, SANO T, et al. Viroid diseases in pome and stone fruit trees and Koch’s postulates: a critical assessment [J/OL]. Viruses, 2018, 10(11): 612. DOI: 10.3390/v10110612.
[40]WU Qingfa, DING Shouwei, ZHANG Yongjiang, et al. Identification of viruses and viroids by next-generation sequencing and homology-dependent and homology-independent algorithms [J]. Annual Review of Phytopathology, 2015, 53: 425444.
[41]WU Qingfa, WANG Ying, CAO Mengji, et al. Homology-independent discovery of replicating pathogenic circular RNAs by deep sequencing and a new computational algorithm [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(10): 39383943.
[42]LEICHTFRIED T, DOBROVOLNY S, REISENZEIN H, et al. Apple chlorotic fruit spot viroid: a putative new pathogenic viroid on apple characterized by next-generation sequencing [J]. Archives of Virology, 2019, 164(12): 31373140.
[43]ZHANG Zhixiang, QI Shuishui, TANG Nan, et al. Discovery of replicating circular RNAs by RNA-seq and computational algorithms [J/OL]. PLoS Pathogens, 2014, 10(12): e1004553. DOI: 10.1371/journal.ppat.1004553.
[44]JIANG Jihong, ZHANG Zhixiang, HU Bing, et al. Identification of a viroid-like RNA in a lychee transcriptome shotgun assembly [J]. Virus Research, 2017, 240: 17.
[45]BESTER R, MALAN S S, MAREE H J. A plum marbling conundrum: Identification of a new viroid associated with marbling and corky flesh in Japanese plums [J]. Phytopathology, 2020, 110(8): 14761482.
[46]CHIUMENTI M, NAVARRO B, CANDRESSE T, et al. Reassessing species demarcation criteria in viroid taxonomy by pairwise identity matrices [J/OL]. Virus Evolution, 2021, 7(1): veab001. DOI: 10.1093/ve/veab001.
[47]SINGH R P, NIE Xianzhou, SINGH M. Tomato chlorotic dwarf viroid: an evolutionary link in the origin of pospiviroids [J]. Journal of General Virology, 1999, 80: 28232828.
[48]SIDDELL S G, WALKER P J, LEFKOWITZ E J, et al. Binomial nomenclature for virus species: a consultation [J]. Archives of Virology, 2020, 165(2): 519525.
[49]ZERBINI F M, SIDDELL S G, MUSHEGIAN A R, et al. Differentiating between viruses and virus species by writing their names correctly [J]. Archives of Virology, 2022, 167(4): 12311234.
[50]FLORES R, RANDLES J W, BAR-JOSEPH M, et al. A proposed scheme for viroid classification and nomenclature [J]. Archives of Virology, 1998, 143(3): 623629.
[51]DURAN-VILA N, ELENA S F, DAROS J A, et al. Structure and evolution of viroids [M]∥DOMINGO E, PARRISH C R, HOLLAND J J. Origin and evolution of viruses. Second Edition. New York: Academic Press, 2008: 4364.
[52]GAGO S, ELENA S F, FLORES R, et al. Extremely high mutation rate of a hammerhead viroid [J/OL]. Science, 2009, 323(5919): 1308. DOI: 10.1126/science.1169202.
(责任编辑:田喆)

