4种方法脱除太子参BBWV和TuMV病毒的效果比较







摘要以太子参‘柘参1号’品种为试验材料,比较微茎尖培养、低温处理(2~4℃)结合微茎尖培养、超低温(-196℃)培养、种胚培养等4种方法对蚕豆萎蔫病毒(broad bean wilt virus,BBWV)和芜菁花叶病毒(turnip mosaic virus,TuMV)的脱除效果,结果显示采用低温处理结合微茎尖培养,太子参成活率为64.7%,BBWV和TuMV的脱毒率分别为63.6%和31.8%;采用种胚培养的成活率为56.7%,对BBWV和TuMV的脱毒率均可达100%。病毒TuMV相较BBWV更难脱除。
关键词太子参;花叶病毒;脱病毒方法;病毒检测
中图分类号:S 435.675文献标识码:ADOI:10.16688/j.zwbh.2023562Comparision of effect of four methods for the virus-free of BBWV and
TuMV viruses in Pseudostellaria heterophyllaBU Hongsong WANG Ding ZHANG Xinyue ZHOU Dan ZHENG Shengwen KUANG Yunbo YE Zuyun(1. College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou350002, China; 2. The Engineering
Technology Research Center of Characteristic Medicinal Plants of Fujian,College of Life Sciences,Ningde Normal
University, Ningde352100, China; 3. Fujian Zheshen Biotechnology Research Co., Ltd., Ningde355300, China)AbstractThe effects of four methods, including microstem tip culture, low temperature (2-4℃) treatment combined with microstem tip culture, ultra-low temperature (-196℃) culture and embryo culture, on the virus-free of broad bean wilt virus (BBWV) and turnip mosaic virus (TuMV) from Pseudostellaria heterophylla ‘Zheshen No.1’ were compared. The results showed that the survival rate of P.heterophylla was 64.7%, and the virus-free rates of BBWV and TuMV were 63.6% and 31.8%, respectively, using low temperature treatment combined with micro-stem tip culture. The survival rate of embryo culture was 56.7%, and the virus-free rate of BBWV and TuMV was 100%. P.heterophylla mosaic virus TuMV is more difficult to remove than BBWV.
Key wordsPseudostellaria heterophylla;mosaic virus;virus-free method;virus detection
太子参Pseudostellaria heterophylla (Miq.) Pax为石竹科孩儿参属多年生草本药用植物,以块根入药,富含多糖、皂苷、氨基酸、环肽等活性成分,具有益气健脾,生津润肺之功效[1]。太子参主要栽培产区在福建、贵州、安徽等地[2],是福建省道地药材。太子参多以块根进行无性繁殖,其种根容易受到病毒的侵染,使叶片出现褪绿斑、黄化斑,呈现叶片卷缩、植株矮小、块根小等症状,导致产量低、品质差,通常造成减产15%~50%[34],严重者可达到90%。感染病毒的太子参植株弱小,抗病性下降,易发生真菌类病害,种植户喷施农药防治,使农药残留和重金属超标的可能性增加。因此,培育太子参脱病毒的健康种苗,是太子参药材产业可持续发展的关键。
已报道的侵染太子参的病毒有4种,分别为芜菁花叶病毒(turnip mosaic virus,TuMV),蚕豆萎蔫病毒(broad bean wilt virus,BBWV),黄瓜花叶病毒(cucumber mosaic virus,CMV)和烟草花叶病毒(tobacco mosaic virus,TMV)[5]。在太子参道地产区福建柘荣县,侵染太子参的病毒主要是BBWV和TuMV,也是对太子参影响最大的两种病毒,染病率高达100%[67],只有极少部分的植株感染CMV,未检测出TMV[6]。
目前,已报道的太子参脱病毒的方法有微茎尖培养和超低温培养[89],存在脱毒率和成活率较低、操作繁琐等问题。因此,探寻更高效、便捷的太子参脱病毒方法,是解决太子参产业发展之所急。本课题组在多年研究太子参脱病毒培养与应用的基础上,创制出低温处理结合微茎尖培养和种胚培养2种脱病毒方法。本研究针对柘荣地区太子参感染的2种主要病毒,比较4种不同的脱病毒方法对TuMV和BBWV的脱毒效果,旨在筛选最适宜的太子参脱病毒方法。
1材料与方法
1.1供试材料
以太子参栽培品种‘柘参1号’的种子及组培苗为材料。种子从宁德市柘荣县际头村太子参农场(北纬27.2°N,东经119.9°E,海拔664 m)栽培的‘柘参1号’收集获得,用于太子参的种胚培养。太子参组培苗是以该农场栽培的‘柘参1号’植株幼嫩茎顶端为材料,经常规组培获得,作为太子参微茎尖培养、低温处理结合微茎尖培养和超低温培养3种脱病毒方法的试验材料。
仪器:数码体视显微镜(LEICA EZ4,德国徕卡显微系统有限公司)、高速冷冻离心机(3-18K,德国SIGMA)、PCR仪(ProFlex 3,美国ABI公司)、微量核酸浓度检测仪(NanoDrop,美国热电)、凝胶成像仪(JS-780,上海培清科技有限公司)等。
试剂和药品:Trizol Universal总RNA提取试剂[天根生化科技(北京)有限公司]。
1.2试验方法
1.2.1供试材料的病毒检测与培养
取6份太子参组培苗材料,使用Trizol Universal总RNA提取试剂提取其总RNA,采用1%琼脂糖凝胶电泳检测RNA完整性,利用微量核酸浓度检测仪进行定量分析,通过A260/A280和A260/A230检测RNA质量,将合格的RNA反转录成cDNA,采用双重RT-PCR分子检测技术[10]进行病毒检测,确认病毒种类,将有病毒的组培苗进行扩繁,作为对照样本,同时也作为脱病毒培养的材料。
1.2.2脱病毒培养
供试材料经病毒检测确定所携带病毒种类后分别采用微茎尖培养、低温处理结合微茎尖培养、超低温培养以及种胚培养。太子参诱导分化培养基为MS培养基+2.0 mg/L 6-BA+0.2 mg/L NAA[11]。
1.2.2.1微茎尖培养
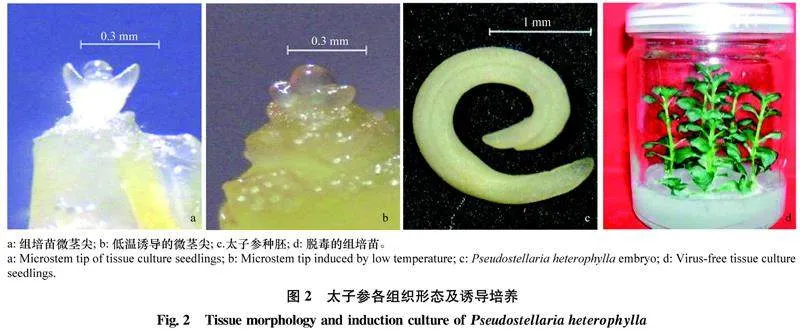
以培养室内的常规太子参组培苗为试验材料,于超净工作台上,剥取直径为0.2 mm左右的组培苗顶端微小茎尖(图2a),接入太子参诱导分化培养基,做好标记,进行暗培养,培养温度(20±2)℃,15 d后转入弱光培养,光照强度为18 μmol/(m2·s),30 d后转入常规光照培养,光照强度56 μmol/(m2·s),统计其成活率、染菌率及脱毒率。
1.2.2.2低温处理结合微茎尖培养
太子参组培苗在培养瓶内诱导形成微块根[12]后,将培养瓶放入冰箱(2~4℃)低温保存60~90 d,待微块根的芽长至279ac1422040e6246e7be14e8f7f93fbea9e7e9785662de6b1b5df4e5a6f5a364~5 cm左右时,于超净工作台上剪取芽,剥取直径为0.2 mm左右的芽顶端微小茎尖进行诱导培养(图2b),使用的培养基、培养条件及观测方法同1.2.2.1。
1.2.2.3超低温培养
参照“一种利用微茎尖与超低温脱除太子参蚕豆萎蔫病毒的方法”[9],并进行改良: 无菌剥取培养室常规组培苗幼芽1~2 mm,将其放在培养基上暗培养3 d,培养基为MS培养基+140 g/L蔗糖+7 g/L琼脂粉,培养温度为4℃;随后进行加载、玻璃化及超低温(-196℃)处理,将处理后的幼芽接入太子参诱导分化培养基,0℃下暗培养5~7 d,使用的培养基、培养条件及观测方法同1.2.2.1。
1.2.2.4种胚培养
选取饱满的太子参种子,洗净后用水浸泡12 h,随后移至超净工作台上,使用75%乙醇消毒30 s,然后用0.1%升汞溶液消毒15 min,再用无菌水荡洗4~5次,每次荡洗2 min左右,剥取太子参种子内完整的胚(图2c)进行培养,使用的培养基、培养条件及观测方法同1.2.2.1。
1.2.3脱毒组培苗的病毒检测
经过4种脱病毒方法培养,对成活的太子参脱毒组培苗(图2d)进行病毒检测,检测方法同1.a73ce848d2d2f9344935de593ce081fc8c4ef8d36b8ea469df5304a2f132009f2.1供体材料的病毒检测方法。
1.3数据处理
观察记录各项试验数据,采用Excel 2019进行统计分析。
2结果与分析
2.1供试材料的病毒检测
6份太子参组培苗样品总RNA浓度检测结果:各样品的A260/A280比值在1.933~2.095之间,A260/A230比值在1.786~2.284之间,提取的太子参总RNA电泳图谱均呈现两条清晰明亮的条带(28S、18S),满足后续反转录的要求。6份样品的病毒检测结果见图1,每份样品均含有TuMV(774 bp)和BBWV( 1 345 bp)。
2.24种脱病毒方法的培养效果
太子参脱病毒材料培养30 d后,成活及染菌情况统计结果见表1。低温处理结合微茎尖培养及种胚培养成活率较高,分别为64.7%和56.7%,微茎尖培养成活率为33.3%,超低温培养成活率最低,为16.2%;种胚培养染菌率为6.7%,微茎尖培养、低温处理结合微茎尖培养和超低温培养均未染菌。
2.34种脱毒方法的脱毒效果
2.3.1双重RT-PCR病毒检测
采用双重RT-PCR分子检测技术对太子参脱毒培养的组培苗进行病毒检测(图3~图6)。结果显示,种胚培养获得的组培苗均未检测出病毒,脱毒率为100%,其他3种脱病毒方法培养的组培苗脱毒率为14.3%~63.6%,具体结果见表2。
3结论与讨论
植物茎尖脱病毒培养时,通常剥取的茎尖大小与成活率成正比,与脱毒率成反比。为了获得较高的脱毒率,本研究中剥取的太子参微茎尖直径均为0.2 mm左右,常规微茎尖培养和低温处理结合微茎尖培养的成活率分别为33.3%和64.7%, BBWV的脱毒率分别为28.6%和63.6%,TuMV的脱毒率分别为14.3%和31.8%,低温处理结合微茎尖培养的成活率和脱毒率均大幅度提高。太子参微块根具有低温萌芽的特性[11],经低温诱导后,解除休眠,微块根的芽顶端分生组织生理特性增强,细胞的分裂、生长速度快且较一致,形成体积较大的顶端生长点(图2b),微茎尖较容易剥取,培养成活率较高,脱毒效果明显,操作方法简便,能保持品种的优良特性。因此,低温处理结合微茎尖培养是太子参脱病毒的首选方法。种胚培养成活率主要取决于剥取的种胚是否完整,种子由外种皮、内种皮、外胚乳和胚构成,其中种皮两层:外种皮呈革质,较厚;内种皮呈膜质,很薄;外胚乳与内种皮粘连较紧,位于弯曲种胚的中间及两侧,易与种胚分离。种胚侧向弯曲呈圆弧形,由胚根、胚芽、下胚轴和子叶构成。通过有性过程形成的种子一般无病毒或仅种子表面有病毒,研究表明太子参种子繁殖不传播病毒,通过常规消毒能去除种子表面的病毒,而内部无病毒,但太子参成熟种子具有休眠特性,难以用于无病毒种苗的规模化生产,因此本试验采用种胚培养脱除病毒,成活率高且易于操作。外胚乳对种子的萌发有抑制作用,外胚乳剥除不彻底或剥取的胚不完整,都会影响种胚培养的成活率。对BBWV、TuMV这2种病毒,太子参种胚培养的脱毒率均为100%。如果不考虑太子参种子变异问题,种胚培养是太子参脱病毒的最优方法。
超低温培养对两种病毒都有一定的脱毒效果,但其成活率低,且要用到液氮及其他各种药品,操作比较繁琐且成本高。 此外有报道采用热处理结合茎尖培养的方法进行太子参的脱病毒,最终脱毒率仅为5.2%[5]。由于太子参不耐高温,课题组在开展预试验时发现,培养温度超过30℃,植株生长停滞,出现休眠;超过35℃,植株开始枯萎发黄,出现死亡。因此,我们认为高温培养结合微茎尖的脱毒方法不适用于太子参。有研究表明,TuMV是病毒家族中已知寄主范围最广的病毒,具有极强的侵染能力[1315]。本研究发现,太子参微茎尖培养相关的2种脱病毒方法中,剥取的微茎尖大小相同的情况下,TuMV的脱毒率只有BBWV的脱毒率的50%左右,说明太子参TuMV相较BBWV更难脱除,可能是由于TuMV侵染力较强,在植株生长点近处也有分布。
植物生产中使用脱毒苗,产量可以提高20%~270%[1617]。目前脱毒苗已广泛应用于各种经济作物的生产,部分药用植物如怀地黄、半夏等在生产上也初步进行了脱毒苗的应用研究[1819]。花叶病毒引起的太子参种质退化、病害严重、产量和品质下降是太子参产业发展的瓶颈问题。课题组利用太子参脱病毒培养技术,对柘荣太子参主栽品种‘柘参1号’和‘柘参2号’都进行了脱病毒培养,工厂化繁育其脱毒苗,通过温室大棚水肥一体化无土栽培扩繁,提供品种优良、纯正、整齐的无病毒优质种根给种植户,通过规范化栽培,太子参产量可提高30%以上,已进行了大面积推广应用。
参考文献
[1]国家药典委员会. 中华人民共和国药典(一部) [S]. 北京: 中国医药科技出版社, 2020: 69.
[2]康传志, 周涛, 郭兰萍, 等. 全国栽培太子参生态适宜性区划分析[J]. 生态学报, 2016, 36(10): 29342944.
[3]陈菁瑛, 黄颖桢, 刘保财,auyPFY7LGSOY5GS6xcN83O3Jg1vMs7s7EmydIEx28mM= 等.福建太子参常见病害与绿色防控技术[J].安徽农业科学, 2021, 49(12): 152155.
[4]徐宏辉. 闽东山区太子参两大病害发生特点及其绿色防控技术[J].中国植保导刊, 2015, 35(1): 3942.
[5]宋荣浩, 濮祖芹. 太子参病毒病的防治途径[J]. 上海农业学报, 1995(3): 5962.
[6]王蓉, 李勇, 魏若凡, 等. 我国太子参主产区病毒病发生情况调查[J].植物保护, 2022, 48(1): 204210.
[7]朱艳, 周小华, 秦民坚. 太子参病毒病及其脱病毒研究进展[J].中国野生植物资源, 2005, 24(2): 3132.
[8]吴朝峰, 马雪梅, 林艳铨. 太子参茎尖脱毒培养及增产效果[J].福建农林大学学报(自然科学版), 2006(2): 129133.
[9]赵云青, 黄颖桢, 陈菁瑛, 等. 一种利用微茎尖与超低温脱除太子参蚕豆萎蔫病毒的方法: CN109845644A [P]. 20190607.
[10]匡云波, 陈满足, 陆伊荣, 等.太子参芜菁花叶病毒和蚕豆萎蔫病毒的双重RT-PCR检测[J].园艺学报, 2017, 44(4): 784791.
[11]叶祖云, 阮少江, 高文, 等. 太子参种子特性及种胚离体诱导培养技术研究[J].种子, 2010, 29(11): 68.
[12]叶祖云, 王雅英, 田惠桥.太子参试管微块根形成及其应用初探[J].植物生理学通讯, 2009, 45(3): 263266.
[13]LOMBARDI E M, PETERS J, JACOB L, et al. Wild and weedy Hesperis matronalis hosts turnip mosaic virus across heterogeneous landscapes in upstate New York [J/OL]. Virus Research, 2023, 323: 199011. DOI:/10.1016/j.virusres.2022.199011.
[14]刘勇, 李凡, 李月月, 等. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J].中国农业科学, 2019, 52(2): 239261.
[15]TAVOOSI M, MORADI Z, MEHRVAR M. First report of turnip mosaic virus infecting saffron in Iran [J]. Virus Disease, 2022, 33(4): 489491.
[16]MALIK A I, SOPHEARITH S, DELAQUIS E, et al. Susceptibility of cassava varieties to disease caused by Sri Lankan cassava mosaic virus and impacts on yield by use of asymptomatic and virus-free planting material [J/OL]. Agronomy, 2022, 12(7): 1658.DOI:10.3390/AGRONOMY12071658.
[17]YANG Chuanbao, YAN Keru, MA Changnian, et al. Insight into the root growth, soil quality, and assembly of the root-associated microbiome in the virus-free Chrysanthemum morifolium [J/OL]. Industrial Crops and Products, 2022, 176: 114362. DOI: 10.1016/j.indcrop.2021.114362.
[18]张晓丽, 李萍, 周彩云, 等. 怀地黄脱毒种苗大田生长性状及产量品质[J]. 植物学报, 2017, 52(4): 474479.
[19]肖颖, 商天奕. 息半夏脱毒技术研究及应用[J]. 信阳农林学院学报, 2019, 29(3): 8284.
(责任编辑:田喆)

