感染隐蔽性害虫玉米象的稻谷、糙米和大米微环境中二氧化碳浓度变化





摘要粮食中隐蔽性害虫早检早治可更好地避免粮食损失,明确粮堆中因害虫代谢产生的二氧化碳与稻米中隐蔽性害虫感染度的关系有助于隐蔽害虫快速检测。本研究分别以内含玉米象卵、1龄幼虫、2龄幼虫、3龄幼虫、蛹和粒内成虫的稻谷、糙米和大米按0、5、10头/kg和20头/kg密度混于无虫稻谷、糙米和大米中检测其中二氧化碳浓度。24 h时,无虫粮二氧化碳浓度仅为0.04%,含5、10头/kg和20头/kg卵和1龄幼虫的稻谷、糙米和大米中二氧化碳浓度为0.042%~0.055%;含2龄幼虫相应密度稻谷中二氧化碳浓度为0.127%、0.246%和0.425%,糙米中为0.145%、0.234%和0.483%,大米中为0.134%、0.246%和0.438%;含3龄幼虫相应密度稻谷中二氧化碳浓度为0.292%、0.425%和0.677%,糙米中为0.303%、0.482%和0.670%,大米中为0.292%、0.463%和0.668%;含蛹相应密度稻谷中二氧化碳浓度为0.095%、0.237%和0.381%,糙米中为0.082%、0.223%、0.430%,大米中为0.096%、0.235%和0.385%;含羽化成虫相应密度下稻谷中二氧化碳浓度为0.125%、0.215%、0.494%,糙米中为0.151%、0.235%、0.557%,大米中为0.131%、0.221%、0.503%。结果表明,稻谷、糙米和大米感染隐蔽虫态的玉米象24 h,环境二氧化碳浓度在0.15%以下为轻度感染(除蛹期外,此时玉米象多处于卵、1龄幼虫以及密度5头/kg及以下的2龄幼虫,为害虫发生初期或低密度感染状态),浓度为0.2%~0.4%时为中度感染(此时玉米象多处于2龄幼虫期,虫口密度10头/kg左右),浓度达0.55%以上时为严重感染(此时玉米象多处于3龄幼虫期,虫口密度20头/kg左右)。中度和严重感染时可在12 h检测到其显著变化。比较结果显示,糙米最容易被隐蔽的玉米象取食并产生较多气体,其次为大米和稻谷。
关键词稻谷;糙米;大米;玉米象;隐蔽虫态;二氧化碳浓度
中图分类号:S 379.5; TS 210.1文献标识码:ADOI:10.16688/j.zwbh.2023518Variation of carbon dioxide concentration in the microenvironment
of paddy rice, brown rice, and milled rice infested by hidden pest,
Sitophilus zeamais MostchulskyLIU Ziyi1,WANG Dianxuan1*,MA Xue1,LI Meng1,TANG Peian2(1. National Grain Industry (Storage Insect Pest Control) Technology Innovation Center, National
Engineering Research Center of Grain Storage and Logistics, School of Food and Strategic Reserves,
Henan University of Technology, Zhengzhou450001, China; 2. Jiangsu Collaborative
Innovation Center of Modern Grain Circulation and Safety, Nanjing210023, China)AbstractEarly detection and treatment of hidden insect pests in grain can prevent grain losses. Understanding the relationship between carbon dioxide produced by the metabolism of pests in hidden life stages and infestation levels in cereals is helpful for rapid detection. Paddy rice, brown rice, and milled rice containing Sitophilus zeamais Mostchulsky eggs, first instar larvae, second instar larvae, third instar larvae, pupae, and adults in kernels mixed into insect-free paddy rice, brown rice, and milled rice at densities of 0, 5, 10, ZvAMiiYgLIsh6+1u5E7EWEV5FBnvPFi6SkqxKF1us3M=and 20 larvae per kilogram of grain were measured for carbon dioxide concentration. The carbon dioxide concentration in insect-free cereal bulk was only 0.04%. In the stored microenviroment of paddy rice, brown rice, and milled rice containing S.zeamais at densities of 5, 10, and 20 larvae per kilogram of cereals, the carbon dioxide concentration ranged from 0.042% to 0.055% for eggs and first instar larvae infestation. For second instar larvae infestation corresponded to 5, 10, and 20 larvae per kilogram of cereals, the carbon dioxide concentrations were 0.127%, 0.246%, and 0.425% in paddy rice; 0.145%, 0.234%, and 0.483% in brown rice; and 0.134%, 0.246%, and 0.438% in milled rice, respectively. For third instar larvae infestation, carbon dioxide concentrations were 0.292%, 0.425%, and 0.677% in paddy rice; 0.303%, 0.482%, and 0.670% in brown rice; and 0.292%, 0.463%, and 0.668% in milled rice. For pupa infestation, the carbon dioxide concentrations were 0.095%, 0.237%, and 0.381% in paddy rice; 0.082%, 0.223%, and 0.430% in brown rice; and 0.096%, 0.235%, and 0.385% in milled rice. For adult infestation in kernels, carbon dioxide concentrations were 0.125%, 0.215%, and 0.494% in paddy rice; 0.151%, 0.235%, and 0.557% in brown rice; and 0.131%, 0.221%, and 0.503% in milled rice. The results indicate that when paddy rice, brown rice, and milled rice were infested by S.zeamais, carbon dioxide concentrations can be detected within 24 h, and concentrations below 0.15% correspond to light infestations of immature stages (excluding pupal stage), concentrations between 0.2% and 0.4% resulted in moderate infestation (corresponding to second instar larvae, 10 larvae per kilogram cereals), and concentrations exceeding 0.55% caused heavy infestations (corresponding to third instar larvae stage, 20 larvae per kilogram rice). Significant changes can also be detected in moderate and heavy infestations within 12 h. Brown rice was found to be the most susceptible to S.zeamais larvae, with higher carbon dioxide production, followed by milled rice and paddy rice.
Key wordspaddy rice;brown rice;milled rice;Sitophilus zeamais;hidden insect stages;carbon dioxide concentration
粮食储藏中减少虫害损失是国家粮食安全的重要组成部分。原粮储藏中首先易于感染的是蛀食性或前期性害虫,如代表性的玉米象Sitophilus zeamais Mostchulsky、米象Sitophilus oryzae Schoenherr等,这些害虫可在田间感染成熟粮粒,而后进入流通与储藏环节,期间其子代成虫羽化钻出粮粒前的各阶段均隐蔽于粮粒内,并行相应为害。通常待成虫羽化出粮粒后,对粮粒造成的危害已相当严重。常规的检测粮食中成虫或活动性虫态的方法与措施难以检测到粮粒内部的隐蔽性害虫[12]。玉米象卵于粮粒内孵化出幼虫,发育为蛹,羽化为成虫并蛀出粮粒后,整个粮粒几乎被蛀食一空,因此,玉米象在我国有“头号储粮害虫”之称。适时检测粮粒内隐蔽害虫,及时进行防治,可更好地减少粮食损失[35]。现行GB/T29890粮油储藏技术规范中玉米象被列为主要储粮害虫,在检测方法中推荐了GB/T24534.4谷物与豆类隐蔽性昆虫感染的测定 第4部分:快速方法[6]来检测玉米象类隐蔽性害虫。该方法采用了国际标准ISO6639.4的推荐方法[7],包括二氧化碳测定法[8]、茚三酮法、整粒粮漂浮法[9]、声音测定法[1011]、X射线法[12]。这些方法的研究和报道也说明其存在不够简便、不够快速、经济性不足等缺点,因此其在国内未能得到实际推广应用。在GB/T24534.4或ISO6639.4推荐的二氧化碳气体检测法中,检测二氧化碳浓度推荐的是采用较为复杂的玻璃仪器的化学试剂法定量分析和价格较高的近红外分析电位记录仪法,也提出了二氧化碳气体浓度与害虫感染度的关系[67]。50卷第5期刘秭一等:感染隐蔽性害虫玉米象的稻谷、糙米和大米微环境中二氧化碳浓度变化2024在一定密闭条件下,粮粒中隐蔽害虫的不同感染密度、不同发育阶段、感染时间、粮食品种与状态等与二氧化碳气体浓度高低与变化的关系影响到该方法的应用,关于稻谷及其加工产品与隐蔽性害虫感染程度的关系缺乏报道。相较于ISO6639.4方法中的化学检测分析,二氧化碳检测仪在便携性、成本和操作方面具有显著优势。近年来,二氧化碳气体检测仪在检测精度和经济性方面也有了显著提升[13],使得该设备在检测微环境中隐蔽害虫发生具有一定的可行性[1415]。一般认为稻谷、糙米、大米储藏特性不同,害虫感染度和发生为害程度也会不同,尤其是没有了外壳的保护,稻谷胚芽胚乳裸露后更容易受到害虫侵害[1617]。糙米受到害虫感染蛀食后,其品质会受到严重影响[18],储粮感染害虫30 d后,其脂肪酸值等相关储藏品质指标会明显下降[1920]。大米是糙米经过研磨打磨后的产品,更容易被害虫侵害[21],其中玉米象的发生率最高[2223]。目前尚缺乏不同虫态与感染程度下隐蔽性害虫对稻谷、糙米和大米为害程度的比较,更缺少不同密度、虫态时害虫发生与确定时间内二氧化碳浓度变化关系的研究,这些也影响着通过检测二氧化碳气体浓度确定隐蔽性害虫为害程度方法的推广应用。本文参考GB/T24534.4和ISO6639.4推荐的二氧化碳气体检测法中的微环境处置方法,分别采用不同发育阶段的玉米象感染稻谷、糙米、大米,使之成为感染粮粒,再以不同密度混合于稻谷样品中,采用循环取样法使用二氧化碳检测仪检测微环境中二氧化碳浓度的变化,以期为利用二氧化碳检测仪作为一种方便快速检测粮食中隐蔽性害虫的有效方法提供参考。
1材料与方法
1.1供试玉米象和稻谷
试验所用玉米象种群采自于河南省郑州某粮库,在河南工业大学储藏物昆虫研究室以洁净小麦在(28±1)℃、(70±5)% RH条件下培养。
将当年收获的稻谷(品种为‘信粳1787’,水分含量13%)在4℃存储2个月,使其中无活虫。之后,在防止害虫感染条件下在室温平衡温度。用THU35-CT型日本佐竹实验砻谷机脱壳得试验用糙米,再用TM05-C型试验碾米机将部分前述糙米碾为试验用大米。
1.2含不同虫期玉米象的稻谷、糙米和大米的准备
将羽化2周的玉米象成虫以5 000头/kg密度接入前述籽粒完整稻谷、糙米和大米中,24 h后移出成虫,得内含玉米象卵的相应粮粒。用染色法确认粮粒带有虫卵[24],再将带卵粮粒在28℃、(70±5)% RH条件下培养不同时间[8],分别于7、14、21、28 d和35 d时得到分别处于卵期、1龄幼虫、2龄幼虫、3龄幼虫、蛹和羽化在粮粒内成虫的粮粒[15]。
1.3玉米象不同发育时期鉴定
将成虫产卵1 d后的稻谷、糙米和大米使用高锰酸钾溶液染色[24]。将待测粮粒用纱布包住,放入溶液中浸泡30~60 s,捞出后放入清水中清洗并擦干,放在显微镜下观察表面是否有黑褐色卵斑,将带有卵斑的粮粒收集到一起,分别培养7、14、21、28 d和35 d至不同龄期,取样并使用手术刀进行剖粒操作,观察内部是否有虫存在并确定其龄期,确认采用上述方法带虫粮粒的染虫率达到95%以上。
1.4含不同虫期和密度的粮粒微环境中二氧化碳浓度检测分别将前述含不同虫期玉米象的稻谷、糙米和大米各以0、5、10、20头/kg的虫口密度对应混入完整无虫的稻谷、糙米和大米中,再各自装于容量750 mL的大口玻璃瓶中,装至满瓶。大口瓶底直径80 mm,瓶口直径100 mm,高140 mm。样品瓶用橡胶盖密封,盖中配置直径5 mm测气管,测气管用截止夹控制测气、密闭和连接状态。装置置于30℃环境中检测不同时间二氧化碳浓度(图1)。样品瓶测试状态下的正压500 Pa的压力半衰期大于5 min。以上每处理设3个重复。
样品分别放置12 h和24 h检测其中二氧化碳气体浓度。检测时用测气软管和固定套管密闭连接二氧化碳气体检测仪出入气口和样品瓶测气管,形成循环取样气体回路(图1)。二氧化碳检测仪型号为MS-400,量程0~30 000 mL/m3,气体流量为500 mL/min,响应时间为30 s。
1.5数据统计与分析
数据采用Microsoft Excel 2010进行统计,用IBM SPSS Statistics 20软件进行单因素方差分析、独立样本t检验和Duncan氏新复极差法进行多重比较分析。
2结果与分析
2.1稻谷、糙米和大米粮粒中玉米象代表虫态的个体大小图2显示了玉米象感染稻谷、糙米和大米后不同时间解剖得到的1龄幼虫、2龄幼虫、3龄幼虫、蛹及羽化且处于粒内的成虫图片及个体大小测量数据。图中可见玉米象不同龄期个体大小差异显著,实际上其对应取食量也在增加,故而相应产生二氧化碳量也渐增。
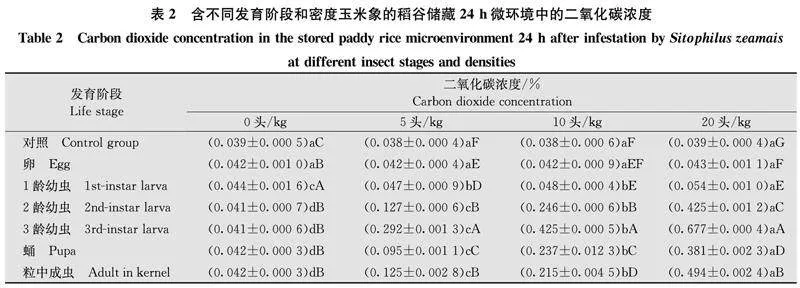
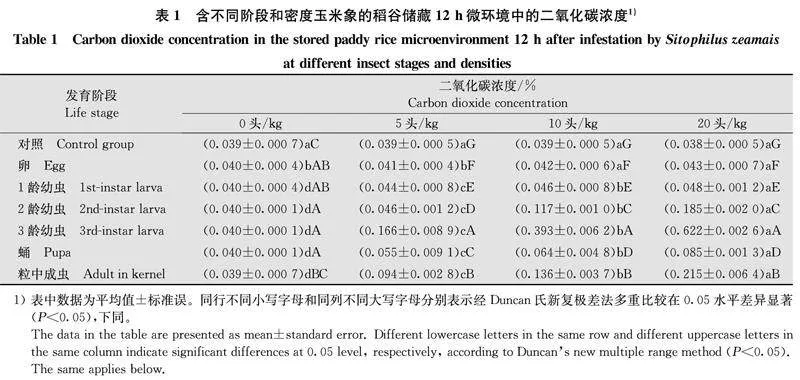
2.2含不同虫期和密度玉米象的稻谷储存环境中二氧化碳浓度表1显示,无虫样品中二氧化碳浓度近0.4%,含不同密度卵和1龄幼虫的稻谷储存12 h时环境中二氧化碳浓度有显著变化,但浓度较低。含20头/kg 1龄幼虫样品中的二氧化碳浓度仅为0.048%。12 h时含2龄幼虫5头/kg的稻谷样品中二氧化碳浓度达0.046%,10头/kg和20头/kg样品中二氧化碳浓度升至0.117%和0.185%。12 h时含3龄幼虫5、10、20头/kg稻谷样品中二氧化碳浓度升至0.166%、0.393%和0.622%。
含2龄幼虫稻谷中二氧化碳浓度大量增加,且虫口密度对二氧化碳浓度变化影响显著。含3龄幼虫稻谷中因害虫取食增加促使二氧化碳浓度增加,虫口密度的影响更显著。蛹期取食停止,因此,微环境中二氧化碳浓度变化不明显,仅略大于卵期,明显地小于含2龄幼虫和3龄幼虫的稻谷储存环境。成虫羽化暂存在于粮粒内时对二氧化碳浓度的影响明显,相应的二氧化碳浓度仍然低于含有3龄幼虫的稻谷,这应与此时间的成虫未必取食但其呼吸代谢量有所增加有关[15]。
与储藏12 h相比,含不同虫态和密度的稻谷密封储存24 h后,环境中二氧化碳浓度有所提高,带有卵、1龄幼虫和蛹的样品中二氧化碳浓度增加幅度较小,带有2龄幼虫、3龄幼虫和粮粒内成虫的样品中二氧化碳浓度增幅较大,害虫密度对二氧化碳浓度增加幅度影响更加显著(表2)。
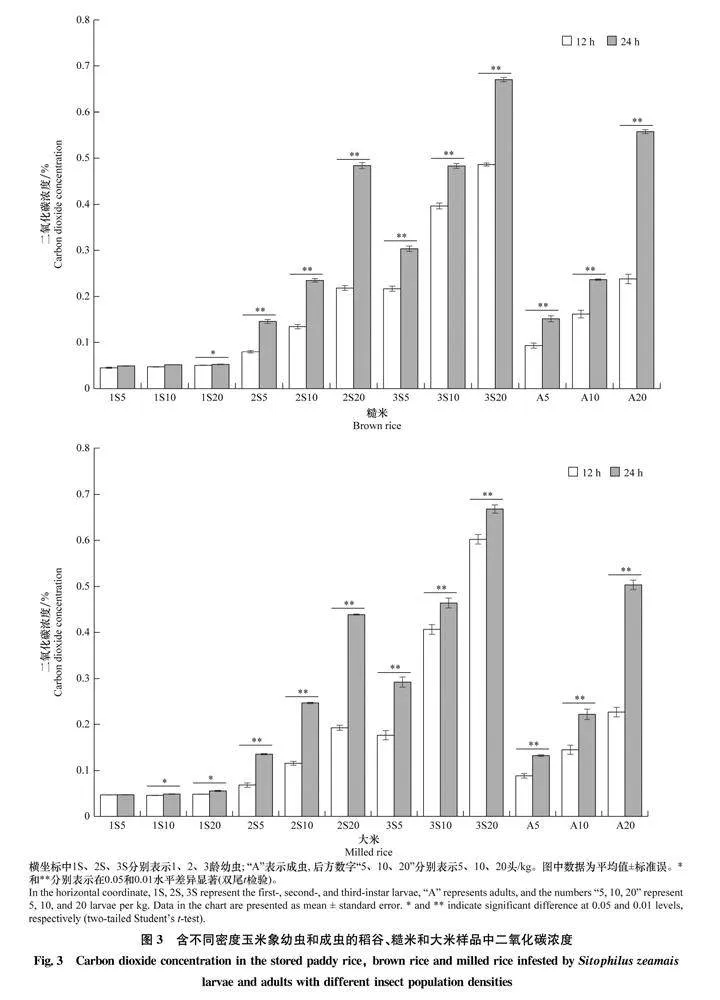
2.3含不同虫期和密度玉米象的糙米储存环境中二氧化碳浓度表3显示,与无虫糙米样品相比,含卵糙米储藏12 h环境中二氧化碳浓度随虫口密度增加有显著变化,但总体浓度较低。含1龄幼虫糙米样品中不同虫口密度样品间二氧化碳浓度差异显著,最大虫口密度20头/kg样品中二氧化碳浓度达0.049%。含2龄幼虫5头/kg糙米样品储藏12 h二氧化碳浓度即达0.079%,密度10头/kg和20头/kg糙米中二氧化碳浓度升高至0.134%和0.218%,含3龄幼虫5、10、20头/kg糙米中二氧化碳浓度达到0.216%、0.396%和0.485%。测试虫口密度下,含玉米象2龄和3龄幼虫的糙米环境中二氧化碳产生量均因虫口密度增加而增大。3龄幼虫导致微环境中二氧化碳浓度增加更为显著,说明其对糙米的为害更重。
与储藏12 h相比,同样情况下储藏24 h含虫糙米环境中二氧化碳浓度有所提高,同样表现为卵期、1龄幼虫和蛹期时二氧化碳浓度增幅较小。3龄幼虫和粒内成虫导致的二氧化碳浓度增幅较大,害虫密度对二氧化碳浓度变化影响显著(表4)。
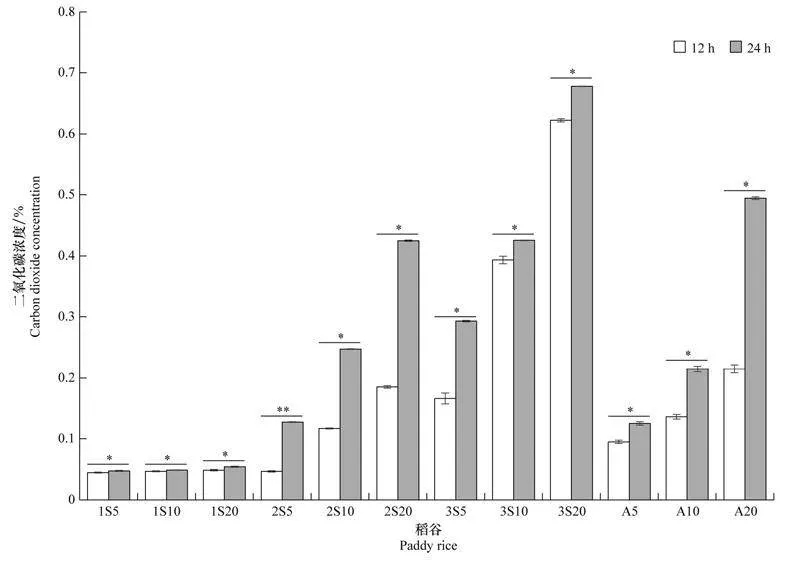
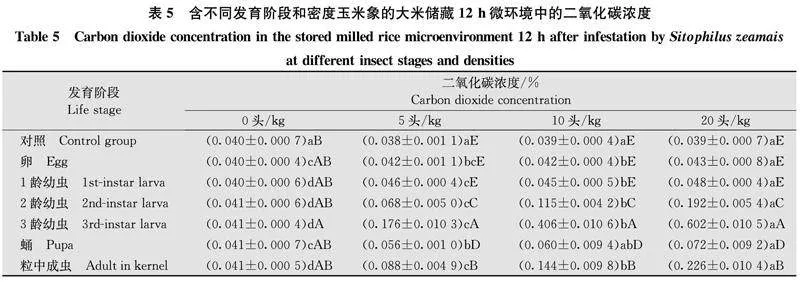
2.4含不同虫期和密度玉米象的大米储存环境中二氧化碳浓度表5显示,与无虫大米相比,含虫卵大米储藏12 h二氧化碳浓度随虫口密度增加虽有显著变化,但浓度较低。含1龄幼虫大米样品中二氧化碳浓度变化略明显,虫口密度20头/kg时二氧化碳浓度为0.048%。含2龄幼虫5、10头/kg和20头/kg的大米样品中二氧化碳浓度为0.068%、0.115%和0.192%,二氧化碳浓度增加显著。含3龄幼虫5、10头/kg和20头/kg的大米中二氧化碳浓度增至0.176%、0.406%和0.602%,同样情况下3龄幼虫对大米的为害也较为严重。
与储藏12 h相比,同样条件下含虫大米储存24 h后环境中二氧化碳浓度有所提高(表6),但含卵、1龄幼虫和蛹的大米样品中二氧化碳浓度增幅较小。含2龄、3龄幼虫和粒内成虫的大米环境,检测到的二氧化碳浓度显著增加,且虫口密度的影响也相应显著。
2.5玉米象感染的稻谷、糙米和大米中害虫发育阶段、密度与二氧化碳浓度变化比较图3显示,在粮粒内1龄幼虫取食代谢导致的稻谷、糙米和大米中二氧化碳浓度均处于0.5%以下的较低水平。稻谷、糙米和大米中含2龄、3龄幼虫或成虫5头/kg及以上时,同条件下24 h检测二氧化碳浓度(0.14%以上)显著高于12 h的检测结果。储藏12 h检测二氧化碳浓度达0.11%以上的包括2龄幼虫10头/kg以上、3龄幼虫5头/kg以上、成虫5头/kg以上等。在含相同害虫虫态和密度时,稻谷、糙米和大米样品间的二氧化碳浓度差异相对较小,玉米象2龄幼虫、3龄幼虫和粒内成虫对糙米造成危害更大,其次为大米和稻谷。
3结论与讨论
GB/T 24534.4 和ISO 6639.4将二氧化碳检测法列为快速检测谷物隐蔽性害虫的有效方法之一[67]。该方法通过测量微环境中二氧化碳气体的浓度判断害虫的感染程度,近红外分析法则以二氧化碳气体流量值判断害虫感染程度。已有报道表明,采用二氧化碳检测仪循环取样能够成功检测小麦中玉米象的发育阶段和数量变化,如30℃时储藏12 h和24 h都可以检测到微环境中含有玉米象1龄、2龄、3龄幼虫,蛹和成虫时二氧化碳浓度的变化[15]。本试验继续探究了稻谷、糙米和大米含有玉米象隐蔽虫态后微环境中的二氧化碳浓度变化,发现含玉米象卵、1龄幼虫和蛹的微环境中,储藏12 h和24 h二氧化碳浓度较低,含玉米象2龄、3龄幼虫和粒内成虫样品中,储藏12 h和24 h时二氧化碳浓度变化显著。二氧化碳检测仪循环取样法可快速、方便、经济地在12 h和24 h时检测到稻谷、糙米和大米中玉米象2龄、3龄幼虫和粒内成虫的感染,在24 h检测到稻谷、糙米和大米中较高密度的玉米象1龄幼虫和蛹。
采用二氧化碳检测仪循环取样检测与GB/T 24534.4方法相比,稻谷、糙米和大米含玉米象卵、1龄幼虫、2龄幼虫在5头/kg虫口密度下24 h检测二氧化碳浓度在0.15%以下,此时为害虫发生初期或低密度感染状态,可视为轻度感染。稻谷、糙米和大米中含有玉米象2龄幼虫、粒内成虫(包括其中的蛹),在10头/kg虫口密度下,在24 h时检测二氧化碳浓度达0.2%~0.4%,可视为中度感染。稻谷、糙米和大米中含有玉米象3龄幼虫(包括蛹和粒内成虫),密度达到20头/kg时,在24 h检测二氧化碳浓度达0.55%以上,可视为严重感染。在中度和严重感染情况下,在储藏12 h时检测二氧化碳浓度可更加快速判定稻谷、糙米和大米中的玉米象感染。从二氧化碳浓度变化量比较,玉米象为害最严重的是糙米,其次为大米和稻谷。
本文的研究结果表明,二氧化碳循环取气方法在优化检测时间、简化操作流程等方面的潜力,从而为快速检测粮食中隐蔽性害虫提供了参考。
参考文献
[1]WOODBURY N. Infanticide avoidance by the granary weevil, Sitophilus granarius (L.)(Coleoptera: Curculionidae): the role of harbourage markers, oviposition markers, and egg-plugs [J]. Journal of Insect Behavior, 2008, 21: 5562.
[2]HE P, YANG W, ALI S, et al. A solid-phase porphyrin and boron-dipyrromethene sensing platform for the infestation detection of two main hidden pests in rice [J/OL]. Sensors and Actuators B: Chemical, 2022, 364: 131843. DOI: 10.1016/j.snb.2022.131843.
[3]SHARIFI S, MILLS R B. Radiographic studies of Sitophilus zeamais Mots. in wheat kernels [J]. Journal of Stored Products Research, 1971, 7(3): 195206.
[4]BRABEC D L, PEARSON T C, MAGHIRANG E B, et al. Detection of fragments from internal insects in wheat samples using a laboratory entoleter [J]. Cereal Chemistry, 2015, 92(1): 813.
[5]DE SOUSA I G, OLIVEIRA J, MEXIA A, et al. Advances in environmentally friendly techniques and circular economy approaches for insect infestation management in stored rice grains [J/OL]. Foods, 2023, 12(3): 511. DOI: 10.3390/foods12030511.
[6]全国粮油标准化技术委员会. 谷物与豆类隐蔽性昆虫感染的测定 第4部分: 快速方法: GB/T 24534.42009 [S]. 北京: 中国标准出版社, 2009.
[7]InternationDZva91UO3ArfRDLRWGnpcg==al Organization for Standardization. Cereals and pulses-determination of hidden insect infestation part 4: Rapid methods: ISO6639.41987 [S]. France: The International Organization for Standardization, 1987.
[8]王殿轩, 徐威, 陆群. 不同玉米象感染度的小麦储存环境中二氧化碳浓度变化研究[J]. 河南工业大学学报(自然科学版), 2012, 33(2): 15.
[9]李光涛, 曹阳, 李燕羽, 等. 利用相对密度浮选法检测小麦粒内害虫的探讨[J]. 粮食科技与经济, 2009, 33(1): 4647.
[10]MANKIN R, HAGSTRUM D, GUO M, et al. Automated applications of acoustics for stored product insect detection, monitoring, and management [J/OL]. Insects, 2021, 12(3): 259. DOI: 10.3390/insects12030259.
[11]VICK K W, WEBB J C, WEAVER B A, et al. Sound detection of stored-product insects that feed inside kernels of grain [J]. Journal of Economic Entomology, 1988, 81(5): 14891493.
[12]MAGHIRANG E B, DOWELL F E, BAKER J E, et al. Automated detection of single wheat kernels containing live or dead insects using near-infrared reflectance spectroscopy [J]. Transactions of the ASAE, 2003, 46(4): 12771282.
[13]刘恒, 任洪亮. 非分散红外二氧化碳检测仪研制[J]. 华侨大学学报(自然科学版), 2017, 38(6): 854857.
[14]BRADER B, LEE R C, PLARRE R, et al. A comparison of screening methods for insect contamination in wheat [J]. Journal of Stored Products Research, 2002, 38(1): 7586.
[15]刘浩星. 微环境中隐蔽性害虫发生与二氧化碳浓度变化关系研究[D]. 郑州: 河南工业大学, 2022.
[16]郑旭, 范锦胜, 张李香. 玉米象生物生态学及防治技术研究进展[J]. 中国农学通报, 2014, 30(4): 221225.
[17]HASARANGA G, WIJAYARATNE L K W, PRASANNA P H P, et al. Effect of paddy variety, milling status and aeration on the progeny emergence of Sitophilus oryzae L.(Coleoptera: Curculionidae) [J]. Journal of Stored Products Research, 2018, 79(1): 116122.
[18]李宏洋, 王若兰, 胡连荣. 不同储藏条件下糙米品质变化研究[J]. 粮食储藏, 2007, 36(4): 3841.
[19]张玉荣, 张玉杰, 周显青. 糙米被玉米象感染后其储藏品质变化研究[J]. 河南工业大学学报(自然科学版), 2012, 33(3): 59.
[20]HORI M, MIWA M, IIZAWA H. Host suitability of various stored food products for the cigarette beetle, Lasioderma serricorne (Coleoptera: Anobiidae) [J]. Applied Entomology and Zoology, 2011, 46: 463469.
[21]张玉杰. 主要蛀食性害虫对稻米侵害后其品质变化[D]. 郑州: 河南工业大学, 2012.
[22]CARVALHO M O, PIRES I, BARBOSA A, et al. The use of modified atmospheres to control Sitophilus zeamais and Sitophilus oryzae on stored rice in Portugal [J]. Journal of Stored Products Research, 2012, 50(1): 4956.
[23]COPATTI C E, MARCON R K, MACHADO M B. Evaluation of damage by Sitophilus zeamais, Orizaephilus surinamensis and Laemophloeus minutus in stored rice grain [J]. Revista Brasileira de Engenharia Agrícola e Ambiental, 2013, 17(8): 855861.
[24]王殿轩, 刘浩, 杨毅, 等. 3种染色剂检测大米中米象虫卵感染效果比较[J]. 粮食与饲料工业, 2015(4): 1013.
[25]冀乐. 玉米象隐蔽虫态发生与粮粒电阻值关系的研究[D]. 郑州: 河南工业大学, 2019.
(责任编辑:杨明丽)

