茶树根腐病拮抗放线菌分离、鉴定及生防潜能研究




摘要为了开发对茶树根腐病菌具有拮抗作用的放线菌资源,从茶树根际土壤中筛选得到一株对根腐病具有良好防治效果的拮抗菌株JK-13,基于形态特征观察、生理生化试验及16S rRNA序列分析,确定菌株JK-13为胶样链霉菌Streptomyces gelaticus。平板对峙试验结果表明,菌株JK-13对茶树根腐病菌Fusarium cugenangense抑菌率达67.06%,对多种作物的病原真菌表现出了良好的抑菌活性。此外,该菌通过产生具有抑菌活性的挥发性与非挥发性有机物、代谢产物与淀粉水解酶、纤维素水解酶和β-1,3-葡聚糖酶等胞外酶抑制病原菌生长,对峙培养5 d后病原菌菌丝出现分枝、缢缩、扭曲、畸形、相互缠绕等现象。通过优化发酵培养条件来提升活性代谢产物的含量与病原菌抑制率,结果表明,最适生长碳源、氮源、无机盐分别为麦芽糖、(NH4)2SO4、KCl,最佳发酵培养基配方为小米10 g/L、麦芽糖10 g/L、(NH4)2SO4 5 g/L、KCl 2.5 g/L、CaCO3 3 g/L,无菌发酵滤液对病原菌抑制率为51.03%,较初始培养条件提高了12.26%。因此,胶样链霉菌JK-13在防控茶树根腐病方面具有较好的开发价值及应用潜力。
关键词茶树根腐病;Fusarium cugenangense;胶样链霉菌;生物防治
中图分类号:S 435.711; S 476文献标识码:ADOI:10.16688/j.zwbh.2023603Isolation, identification, and biocontrol potential of antagonistic
actinomycetes against tea root rot caused by Fusarium cugenangenseLI Guihua TAN Lin SHEN Chengwen DENG Yulian HUANG Hong SHI Zihan JI Jinjun4,HU Qiulong (1. The Key Laboratory of Tea Science of Ministry of Education, Hunan Agricultural University, Changsha
410128, China; 2. College of Horticulture, Hunan Agricultural University, Changsha410128, China;
3. College of Plant Protection, Hunan Agricultural University, Changsha410128, China;
4. Hunan Tea Group Company Limited, Changsha410126, China)AbstractTo discover actinomycete resources with an antagonistic effect on the root rot of Camellia sinensis, a strain JK-13 with strong antagonistic activity against the tea root rot pathogen Fusarium cugenangense was screened from rhizosphere soil of C.sinensis. Strain JK-13 was identified as Streptomyces gelaticus based on morphological, physiological, and biochemical characteristics, and 16S rRNA sequence analysis. The results of the plate confrontation test showed that JK-13 had a high inhibition rate of 67.06% against F.cugenangense, demonstrating good broad-spectrum antagonistic ability toward various pathogenic fungi. In addition, strain JK-13 inhibited the growth of pathogenic fungi by producing volatile and non-volatile organic compounds, metabolites, and extracellular enzymes such as starch hydrolase, cellulose hydrolase, and β-1,3-glucanase. Light microscopy observation revealed that the pathogenic mycelium appeared branched, constricted, distorted, deformed, and intertwined after confrontation culture for five days. Fermentation conditions were optimized to increase the content of active metabolites and the inhibition rate of strain JK-13 against pathogen F.cugenangense. The results of fermentation condition optimization showed that the most suitable carbon source, nitrogen source, and inorganic salt for growth were maltose, (NH4)2SO4, and KCl, respectively. The optimal fermentation medium formula was millet 10 g/L, maltose 10 g/L, (NH4)2SO4 5 g/L, KCl 2.5 g/L, and CaCO3 3 g/L. The inhibition rate of the sterile fermentation filtrate of strain JK-13 against F.cugenangense was 51.03%, an increase of 12.26% compared to the initial culture condition. Therefore, S.gelaticus JK-13 has good development value and application potential in the disease management of tea root rot.
Key wordstea root rot;Fusarium cugenangense;Streptomyces gelaticus;biological control茶树是我国重要的经济作物,茶叶含有茶多酚、咖啡碱、茶氨酸、茶多糖等多种特有活性物质,具有抗氧化、降血糖、防癌抗癌、增强免疫力等功效[1]。茶树病害种类较多,例如刺盘孢Colletotrichum camelliae、胶孢炭疽菌Colletotrichum gloeosporioides等引起的茶炭疽病,茶拟盘多毛孢Pseudopestalotiopsis theae引起的茶轮斑病,腐皮镰刀菌Fusarium solani引起的茶树茎腐和枯萎相关病害,对茶树的健康生长发育造成巨大危害,从而影响茶叶的产量和品质[25]。
茶树根腐病是茶树根部主要病害之一,病菌侵染茶株后导致茶树生长衰弱,或全株死亡,并逐株蔓延,造成成片茶树死亡,对茶叶生产危害很大。前期研究中,我们团队报道了一种引起茶树根腐病的病原菌Fusarium cugenangense,归属于尖孢镰刀菌物种复合物(Fusarium oxysporum species complex, FOSC)中的一个特异性菌株[6]。目前,针对尖孢镰刀菌引起的根腐病已经发现了不少生防菌,如芽胞杆菌属Bacillus spp.、短杆菌属Brevibacterium spp.、农杆菌属Agrobacterium spp.和假单胞菌属Pseudomonas spp.,对尖孢镰刀菌抑菌率为10.68%~59.02%[7];滕峥等[8]采用平板对峙法筛选对尖孢镰刀菌具有拮抗作用的菌株,结果表明,解淀粉芽孢杆菌Bacillus amyloliquefaciens的抑菌圈直径为40.17 mm;王前程等[9]研究发现拟康宁木霉Trichoderma koningiopsis菌株T-51对尖孢镰刀菌相对防效为87.5%;姚晨虓等[10]研究发现棘孢木霉T.asperellum、哈茨木霉T.harzianum和毛簇木霉T.velutinum对尖孢镰刀菌的相对盆栽防效分别为78.95%、69.73%和69.73%,均高于70%甲基硫菌灵可湿性粉剂1 000倍液处理的防效;但目前没有针对茶树根腐病病原菌F.cugenangense拮抗微生物资源挖掘和开发的报道。
目前,因为化学药剂防治对植物、周围环境都有一定的伤害,所以拮抗微生物在茶树、油茶、蔬菜、果树等病害防治中的作用越来越突出[5, 1113]。拮抗微生物及其代谢产物对茶树根部病害有良好的防治效果,如Elango 等[14]研究发现,在13个试验处理中,将灰色链霉菌Streptomyces griseus与哈茨木霉联合施用于茶树根际,能显著降低茶红根腐病的发病率;Morang等[15]研究结果表明,3株根瘤菌Rhizobium sp.菌株PM 105、PM 112和PM 43除抑制褐腐病外,还具有促进植株生长的作用。Purkayastha等[16]研究发现,黏质沙k2uOgnL6LzJZ/BpwaO8uVA==雷氏菌Serratia marcescens能产生多种细胞壁水解酶,从而通过降解病原菌的细胞壁来达到抑制作用。但没有有关放线菌拮抗茶树根腐病的研究报道,本研究通过从茶树根际土壤中筛选拮抗放线菌,通过形态学、分子生物学方法对生防菌进行鉴定,对生防菌JK-13的抑菌活性和对茶树根腐病生防潜能进行研究,并探究生防菌最佳培养条件,以期为茶树根腐病生物防治提供理论及技术支撑。
1材料与方法
1.1试验材料
1.1.1供试土壤
供试土壤采自于湖南农业大学茶学长安教学基地的根腐病菌侵染的茶树根际土壤。
1.1.2供试培养基[1720]
所用固体培养基和液体培养基分别见表1和表2。
1.1.3供试植物病原菌
茶树根腐病病原菌Fusarium cugenangense、草莓疫病菌Phytophthora fragariae、黄精炭疽病菌Colletotrichum circinans、马铃薯早疫病菌Alternaria solani、辣椒枯萎病菌Fusarium oxysporum、茭白镰刀病菌Fusarium graminearum、茄子褐纹病菌Phomopsis vexans、柑橘沙皮病菌Diaporthe citri、玉米大斑病菌Exserohilum turcicum,均由湖南农业大学实验室保存。
1.2试验方法
1.2.1拮抗菌株的分离与筛选
采用稀释涂布法分离放线菌株。称取10 g根腐病菌侵染的茶树根际土壤与90 mL无菌水混合,获得浓度为10-1的土壤液,用无菌水稀释至10-4、10-5、10-6,每个稀释梯度3次重复。分别吸取土壤稀释液200 μL,涂布于PDA培养基上,28℃培养7~14 d,待平板上长出菌落后,挑取单菌落进行纯化并保存。采用平板对峙法筛选拮抗菌,用直径5 mm的打孔器打取病原菌菌饼并接种到PDA培养基的中央,在距平板中央2 cm等距离接种土壤分离菌,以不接种分离菌为对照,于28℃恒温培养箱中培养5~7 d,每处理3次重复,待对照菌落长至接近皿边缘时,根据以下公式计算其抑菌率。
抑菌率=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%。
1.2.2拮抗菌的鉴定
将菌株JK-13分别划线接种到PDA、高氏1号、ISP-2、察氏、葡萄糖酵母膏琼脂、营养琼脂和燕麦琼脂培养基上,28℃恒温箱中倒置培养7~14 d,观察菌株的生长情况、基内菌丝、气生菌丝、菌落特征以及有无可溶性色素产生。
将菌株JK-13划线接种于高氏1号培养基上并插上灭菌盖玻片,培养14 d后,在显微镜下观察菌株基内菌丝、气生菌丝以及孢子丝等的特征。
参照《放线菌快速鉴定与系统分类》[21]以及《链霉菌鉴定手册》[22]中的方法对菌株JK-13进行碳源利用、明胶液化、甲基红试验、V-P试验、牛奶凝固与胨化、H2S产生、硝酸盐还原、黑色素产生等试验。GY液体培养基用于拮抗放线菌的NaCl耐受性和pH试验,拮抗菌株耐盐性试验的NaCl浓度调节范围为0~13%,pH试验的pH调节范围为1~14,测定方法是将粘有菌株孢子的无菌枪头打入到装有5 mL或10 mL GY液体培养基的试管中,28℃、180 r/min摇床中培养7 d,观察不同NaCl浓度和不同pH环境下菌株是否生长及生长情况。
使用细菌基因组DNA提取试剂盒提取拮抗菌株的基因组DNA,使用16S rRNA通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增目的片段并进行测序,将测序结果在NCBI网站上进行相似性比对,选取相似性较高的典型菌株利用MEGA11软件通过neighbor-joining法构建系统发育树。
1.2.3拮抗菌对茶树根腐菌的菌丝生长抑制作用
为探究拮抗菌株JK-13对茶树根腐病菌菌丝生长的抑制作用,将JK-13与茶树根腐病菌进行对峙培养5 d后,挑取抑菌圈边缘处的茶树根腐病菌菌丝,通过显微镜进行形态观察,以不接拮抗放线菌自然生长5 d的茶树根腐病菌为对照。
1.2.4拮抗菌的抗菌谱测定
选用辣椒枯萎病菌、茭白镰刀病菌、柑橘沙皮病菌、黄精炭疽病菌、马铃薯早疫病菌、草莓疫病菌、玉米大斑病菌、茄子褐纹病菌8种病原菌,采用平板对峙法,检测JK-13的抗菌谱。将直径0.5 cm的各供试病原菌菌饼置于培养皿中央,用无菌接种环挑取拮抗菌在距病原菌2 cm两侧划线,以只接种各病原菌为对照,每处理3次重复,于28℃恒温箱培养7 d后,测量病原菌菌落直径,计算抑菌率。
1.2.5拮抗菌的胞外酶检测
打取直径5 mm的拮抗菌株菌饼分别置于淀粉水解酶、纤维素水解酶、蛋白酶、β-1,3-葡聚糖酶的检测培养基中央,每种类型胞外酶检测培养基均设3次重复,所有平板在28℃恒温培养箱培养5~7 d,若有透明水解圈出现,则确定菌株分泌该胞外酶,淀粉酶观察时需要加卢哥氏碘液[2324]。
1.2.6挥发性与非挥发性有机物对病原菌的抑制作用使用双平板对扣法探究拮抗菌株挥发性有机物对茶树根腐病病原菌的抑菌效果[23]。将拮抗菌株采用划线法于高氏1号固体平板上作为下层平板,先培养48 h,再将直径为5 mm的病原菌菌块置于PDA平板中央,作为上层平板,将2个平板密封后置于28℃恒温培养箱培养。对照组为无拮抗菌株的双层平板,各设置3个重复。在对照组病原菌长满平板时十字交叉法测量PDA平板上各个处理下病原菌菌落直径(mm),计算其抑菌率。
采用玻璃纸培养法探究拮抗菌株非挥发性有机物对茶树根腐病菌的抑菌效果。参照王子晴等[25]和李叶彤等[26]的方法并加以改进,在PDA培养基上平铺无菌双层玻璃纸,于玻璃纸中央接种JK-13菌饼,培养5 d,然后用无菌镊子移去双层玻璃纸及附着的菌饼,在平板中央接种直径5 mm病原菌菌饼,以不含菌株JK-13非挥发性代谢物的平板接种病原菌菌饼作为对照,每处理设3次重复,28℃培养5 d后测量病原菌的生长直径。
1.2.7菌株JK-13无菌发酵液营养条件优化
种子液的制备:取20个直径为5 mm的菌饼置于200 mL的高氏1号培养液中,28℃、180 r/min培养7 d,即为种子液。
无菌发酵液的制备:将种子液以2%接种量接入6种常用的放线菌培养基中,28℃、180 r/min培养7 d,获得发酵液。发酵液于12 000 r/min离心15 min,取上清液用0.22 μm微孔滤膜过滤,获得无菌发酵液。
采用菌丝生长速率法[27]测定菌落生长情况:将PDA培养基融化并冷却至55℃左右,再按体积比1∶9的比例将无菌发酵滤液与PDA培养基混合,摇匀后制成含有放线菌活性成分的平板。待其冷却后在平板中央放置1个供试病原菌菌饼(直径为5 mm),置于28℃恒温培养箱中培养。以加无菌水的处理为对照,每处理重复3次。采用十字交叉法测量各真菌菌落生长直径,计算菌丝生长抑制率,确定最佳发酵培养基。
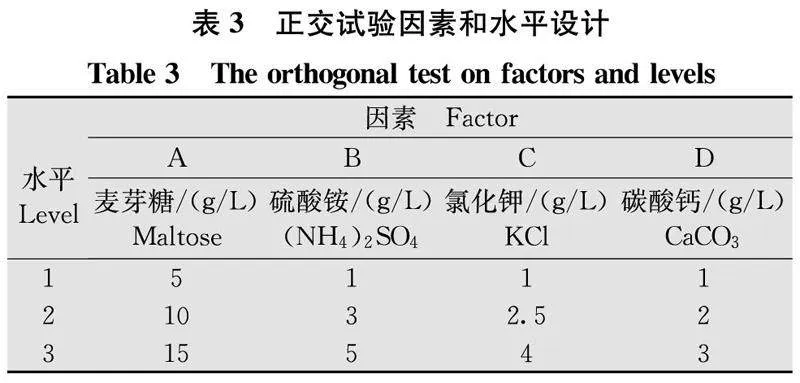
以筛选出的最佳发酵培养基为基础培养基,通过单因素试验选择最佳碳、氮源以及无机盐的种类。为精确分析培养基中碳、氮源、无机盐和碳酸钙(在培养基中起调节pH的作用)之间的相关性,利用正交设计助手[28]设计4因素3水平的正交试验(表3),确定其最佳用量,每处理重复3次。
1.3数据处理与分析
采用Microsoft Excel 2016进行数据整理,采用SPSS27中Duncan氏新复极差法进行差异显著性分析(α=0.05),使用Origin2021制图。
2结果与分析
2.1拮抗菌株的分离与筛选
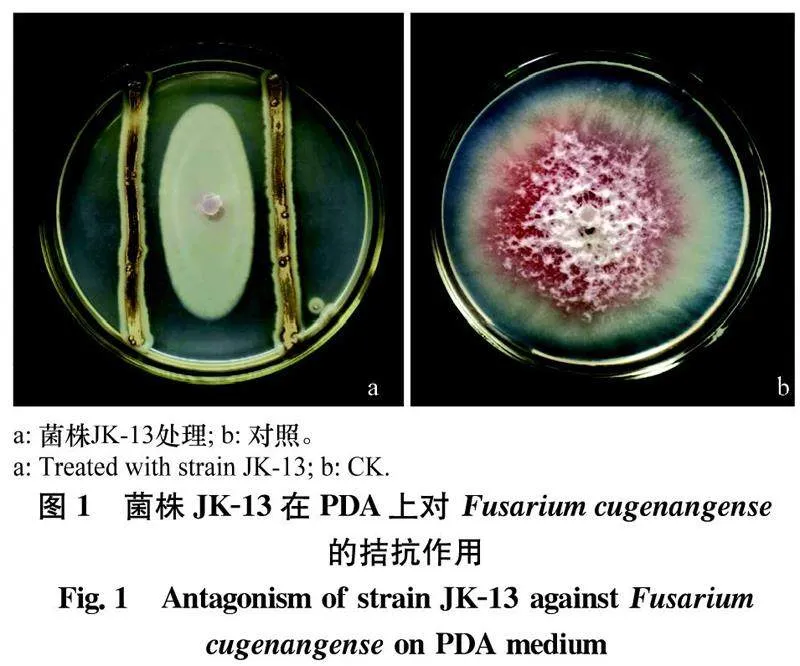
通过从感染根腐病的茶树根际土壤中分离出放线菌,采用平板对峙法获得几株对茶树根腐病菌有拮抗作用的菌株,其中菌株JK-13效果最好(图1),抑菌率为67.06%,用于后续试验。
2.2菌株JK-13的鉴定
2.2.1形态学特征
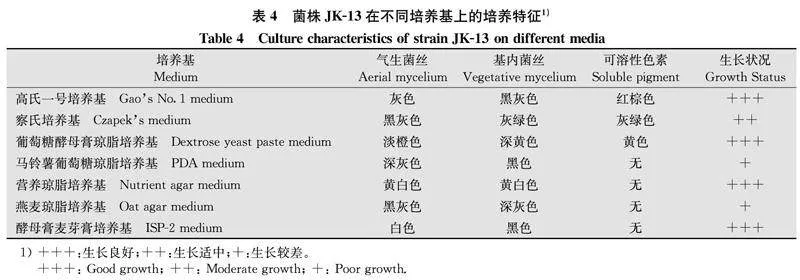
菌株JK-13在高氏1号培养基上生长良好,菌落较密,气生菌丝发达,灰黑色,基内菌丝黑色,前期不产生可溶性色素,后期产可溶性色素,颜色为红褐色(图2)。在不同培养基上生长时,除在PDA和燕麦琼脂培养基上生长较弱外,在其他培养基上均生长良好,拮抗菌株JK-13在不同培养基上的特征不同(表4)。
2.2.2生理生化特性
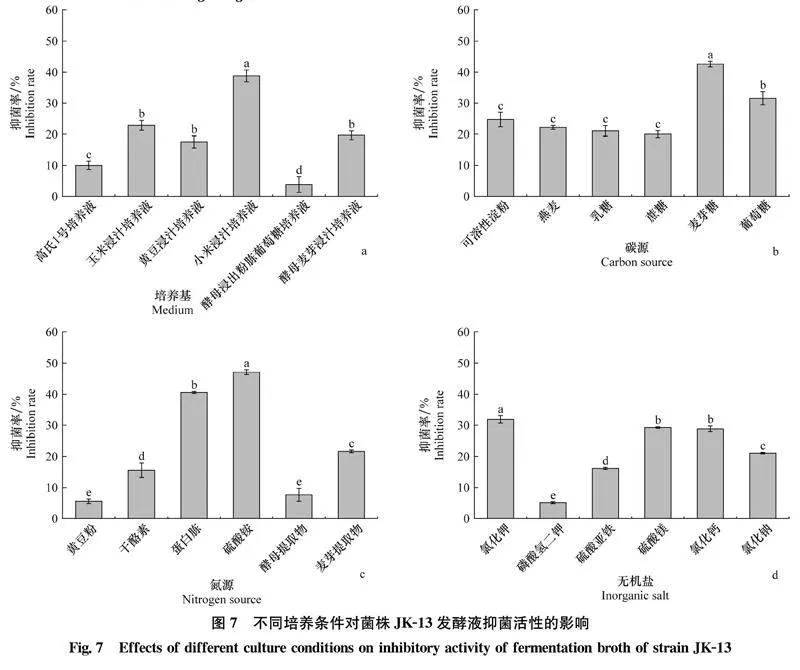
生理生化试验结果表明,菌株JK-13的明胶液化和硝酸盐还原试验均为阳性,牛奶的凝固与胨化、H2S产生、甲基红试验、V-P试验、黑色素产生试验均为阴性(表5),均能以L-半乳糖、蔗糖、D-果糖、D-葡萄糖、D-木糖、麦芽糖等为碳源,但不能利用L-阿拉伯糖、D-甘露醇、L-肌醇、D-山梨醇等碳源。NaCl耐受性和pH耐受性试验结果表明,菌株JK-13能在8% NaCl浓度下生长,pH的耐受范围为5~13,pH为13时能生长,但生长较弱。
2.2.3分子系统发育学分析
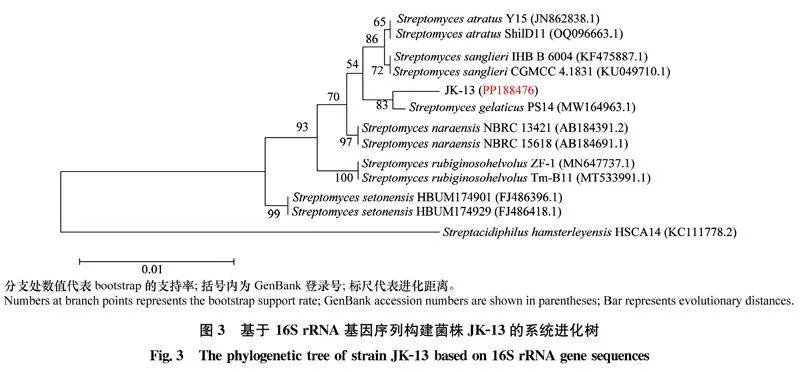
通过PCR扩增获得菌株JK-13的16S rRNA基因序列,将获得的序列在NCBI数据库进行BLAST同源性比对,发现菌株与链霉菌属的相似性较高。选择相似性较高的菌株的16S rRNA序列,使用MEGA11.0构建系统发育树,结果显示,菌株JK-13与胶样链霉菌Streptomyces gelaticus (登录号为PP188476)处于同一分支(图3)。结合菌株的形态学特征、生理生化特性,16S rRNA基因分子鉴定,将菌株初步鉴定为胶样链霉菌。
2.3菌株 JK-13 对茶树根腐菌的菌丝生长抑制作用在菌株JK-13的拮抗下,茶树根腐病菌菌丝生长会受到一定的抑制作用,与对照组相比,处理组的茶树根腐病菌菌丝出现分枝、缢缩、扭曲、畸形、相互缠绕等现象,这说明菌株JK-13对茶树根腐病菌菌丝生长具有抑制作用(图4)。
2.4拮抗菌株 JK-13抗菌能力
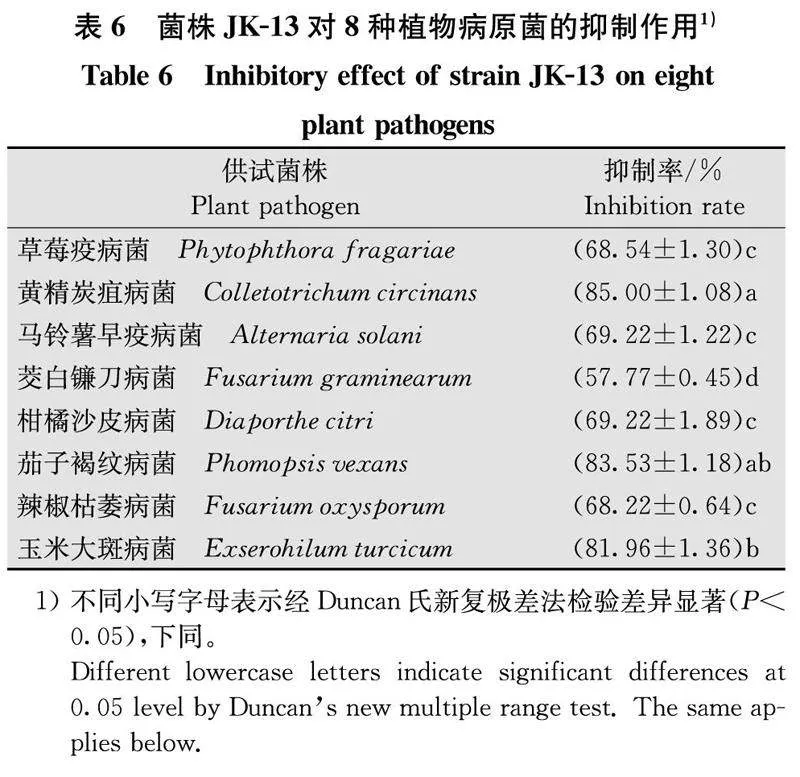
通过拮抗菌株JK-13与供试的8株不同植物病原菌的平板对峙试验发现,菌株JK-13对8株病原菌的抑菌效果均在50%以上,其中菌株JK-13对黄精炭疽病菌、茄子褐纹病菌、玉米大斑病菌的抑菌效果在80%以上(表6)。菌株JK-13可以在平板上有效抑制多种病原菌,抑菌作用较为广泛。
2.5拮抗菌的胞外酶
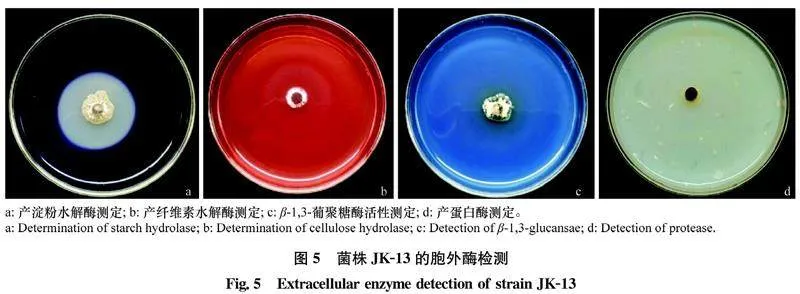
通过对菌株产胞外酶性能进行检测,结果显示,菌株JK-13在淀粉水解酶培养基、羧甲基纤维素钠培养基、β-1,3-葡聚糖酶培养基均产生透明圈,说明JK-13菌株具有分泌淀粉水解酶、纤维素水解酶、β-1,3-葡聚糖酶的活性;但其不分泌蛋白酶(图5)。
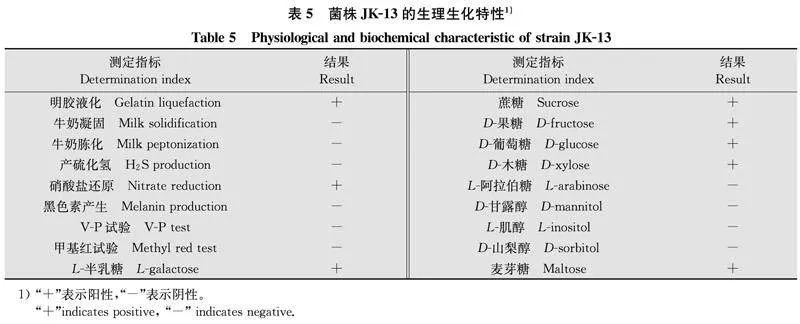
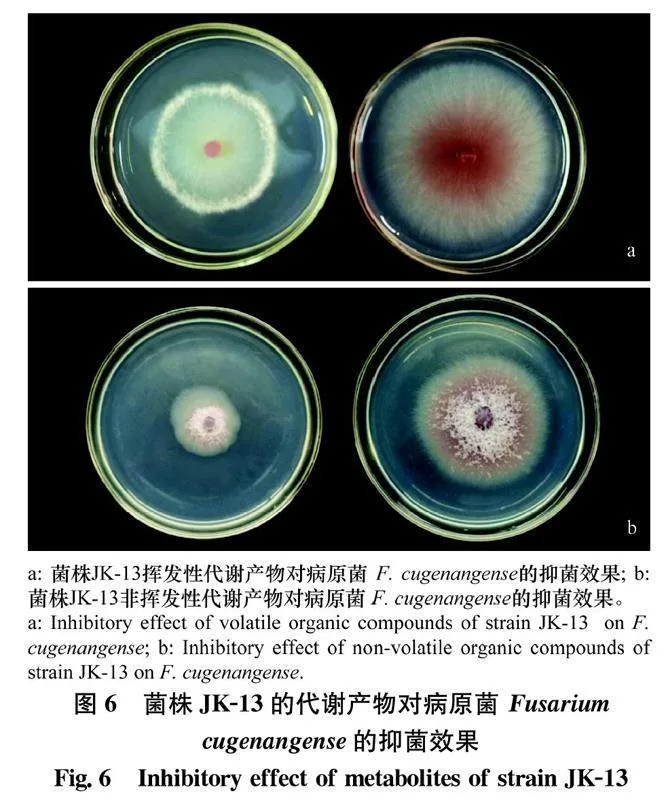
2.6菌株JK-13挥发性与非挥发性代谢产物对茶树根腐病菌的抑制作用双平板对扣试验和玻璃纸培养试验结果表明,菌株JK-13产生的挥发性与非挥发性代谢产物均能抑制病原菌F.cugenangense的生长(图6)。与对照相比,菌株JK-13产生的挥发性代谢产物对病原菌抑菌率为33.36%,非挥发性代谢产物的抑菌率为51.41%,说明该菌株的非挥发性代谢产物对病原菌F.cugenangense的菌丝生长有显著的抑制效果。
2.7菌株 JK-13无菌发酵液培养条件的优化
2.7.1不同培养液对菌株JK-13无菌发酵液抑菌活性的影响6种不同成分的培养液培养的菌株JK-13无菌发酵液对病原菌F.cugenangense的抑制作用存在一定差异,其中小米浸汁培养液的抑菌率最高,为38.77%(P<0.05,图 7a)。故选小米浸汁培养液作为JK-13的最佳发酵培养液进行后续试验。
2.7.2不同碳源、氮源和无机盐对菌株JK-13无菌发酵液抑菌活性的影响6种碳源、氮源、无机盐获得的菌株JK-13发酵液均对病原菌F.cugenangense有一定的抑制作用,其中麦芽糖作为碳源、硫酸铵作为氮源、氯化钾作为无机盐的菌株无菌发酵液抑菌率最高,分别为42.59%、47.11%、31.89%,显著高于其他碳源(图7b)、氮源(图7c)、无机盐(图7d);因此,分别选用麦芽糖、硫酸铵、氯化钾作为培养基的最佳碳源、氮源、无机盐做后续正交试验。
2.7.3营养条件的正交试验
以小米浸汁培养液为基础培养基,根据2.7.2碳源、氮源和无机盐的筛选结果,选择麦芽糖、硫酸铵、氯化钾、碳酸钙 4个因素,设计4因素3水平正交试验(表3),根据抑菌活性确定最终发酵营养配方。
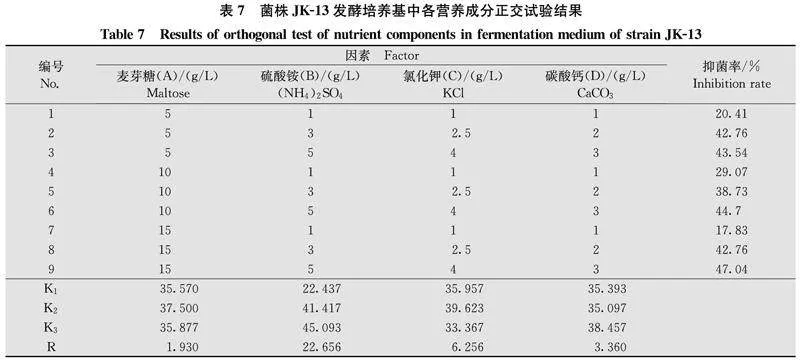
R代表极差,极差越大,影响程度越大;反之,极差越小,影响程度越小。K代表均值,K1、K2和K3分别代表水平1、水平2、水平3下抑菌率的均值。正交试验结果表明(表7),4个因素影响菌株JK-13无菌发酵液对F.cugenangense的抑菌效果顺序为:硫酸铵(B)>氯化钾(C)>碳酸钙(D)>麦芽糖(A),根据同一因素y/R05xHALfdyWSU/F+0b5w==不同水平的均值大小,可以判断出该因素的最优值,从而得出所有因素的最优组合为A2B3C2D3,但此配方并未在正交试验中出现,因此做了验证试验,JK-13按A2B3C2D3配方再次摇菌发酵,其他条件不变,测得无菌发酵滤液抑菌率为51.03%,较初始小米浸汁培养基提高了12.26%。结果证明该配方确实是最佳配方,即最佳培养基配方为小米10 g/L,麦芽糖10 g/L,硫酸铵5 g/L,氯化钾2.5 g/L,碳酸钙3 g/L。
3结论与讨论
放线菌是一类具有发展前景的微生物资源,能够产生具有生物活性的次级代谢产物,其中尤以链霉菌属最为显著[29]。本研究从茶树根际土壤中分离筛选到一株对茶树根腐病菌有显著拮抗作用的放线菌菌株JK-13,经培养、形态特征观察以及16S rRNA基因序列比对分析,鉴定该菌株为胶样链霉菌。对菌株JK-13进行生物学特性检测,发现该菌株具有良好的耐酸和盐的性能,而茶树具有喜酸耐碱的特性,这有利于保障菌株在田间应用时的生防稳定性。此外,菌株JK-13对多种作物的病原菌具有较强的抑菌活性,具有极大的开发潜力。
一般而言,拮抗菌对病原菌的抑制作用机制包括营养和空间竞争、产生抗真菌物质和产生胞外酶等。其中,抗生作用主要是指生防菌分泌某些次生代谢产物(如木霉素、抗菌肽、抗生素等)抑制病原菌生长,被认为是对抗病原菌的主要方式。链霉菌产生的挥发性代谢产物主要通过抑制病原菌菌丝的生长以及孢子的萌发。目前已报道了多种链霉菌产生的挥发性有机化合物能显著抑制病原菌的生长从而有效地防治植物病害,而关于非挥发性有机化合物抑制病原菌生长的报道以木霉研究较多。鲁妍璇等[30]的研究证实了利迪链霉菌Streptomyces lydicus K2在麦粒培养基上产挥发性物质对灰霉病菌Botrytis cinerea有较好的抑制效果;王宁等[31]发现菌株A144产生的挥发性物质对苹果树腐烂病菌Valsa mali具有一定的抑菌活性;李小杰等[32]研究发现绿木霉Trichoderma virens、拟康宁木霉T.koningiopsis和近渐绿木霉 T.paraviridescens产生的挥发性和非挥发性代谢物均对疫霉具有明显的抑制作用。本研究通过双平板对扣法和玻璃纸培养法检测,初步证明了胶样链霉菌挥发性和非挥发性代谢产物均具有抑菌活性。
病原真菌的细胞壁以几丁质、纤维素为骨架,以β-1,3-葡聚糖为主要填充物所组成,容易被胞外水解酶分解,导致病原真菌死亡。郝金辉等[33]研究发现,多黏类芽胞杆菌JE53和JE56可产生纤维素酶、蛋白酶、β-1,3-葡聚糖酶及几丁质酶,李铮等[34] 研究发现,贝菜斯芽胞杆菌NZ-4能够产生几丁质酶、果胶酶、纤维素酶、蛋白酶、酪蛋白酶,推测菌株可能以分泌多种水解酶作用于真菌细胞壁,改变或降解其细胞壁,破坏菌体的完整性从而达到抑制效果。本研究中,菌株JK-13能够产生淀粉水解酶、纤维素水解酶和β-1,3-葡聚糖酶,由此推测该菌株通过产生相关酶类水解病原菌F.cugenangense细胞壁,从而实现抑菌效果。
链霉菌不仅能够产生高活性水解酶,还可以产生多种天然活性产物,如大环内酯类、哌嗪和尾环化肽等多种次级代谢产物,从而抑制病原菌的生长[3536],通过发酵培养基和发酵条件优化可提高其代谢产物的产量。本研究以菌株JK-13的无菌发酵滤液对病原菌F.cugenangense的抑菌效果作为指标,利用培养基组分的单因素试验和正交试验明确了胶样链霉菌JK-13的最适碳源为麦芽糖(10 g/L),氮源为硫酸铵(5 g/L),无机盐为氯化钾(2.5 g/L)。通过对培养基成分优化,提高了菌株JK-13的抑菌效果,可能是因为适宜的营养成分可以促进拮抗菌株抗菌活性物质的产生。
通过显微观察进一步确定在菌株JK-13拮抗作用下病原菌F.cugenangense菌丝出现弯曲缠绕、分枝增多等现象,菌株生长受到显著影响。综上,菌株JK-13通过产胞外酶、挥发性物质、具有抑菌活性的次级代谢产物来抑制病原菌的生长,从而实现拮抗作用。但是,菌株对病原菌的田间防效、发酵条件的优化、发酵滤液的稳定性以及次生代谢产物的抑菌活性物质等问题还待进一步研究。
参考文献
[1]刘仲华, 张盛, 刘昌伟, 等. 茶叶功能成分利用“十三五”进展及“十四五”发展方向[J]. 中国茶叶, 2021, 43(10): 19.
[2]张玉丹, 谭琳, 任佐华, 等. 茶炭疽病拮抗链霉菌的筛选鉴定与拮抗能力测定[J]. 中国生物防治学报, 2023, 39(3): 646656.
[3]杨学宇, 谭琳, 张玉丹, 等. 茶轮斑病病原菌的分离鉴定及其拮抗菌筛选[J]. 湖南农业大学学报(自然科学版), 2023, 49(2): 195200.
[4]邓晓旭, 谢夏, 潘娅梅, 等. 茶树腐皮镰刀菌拮抗菌株的筛选鉴定及促生防病特性分析[J]. 茶叶科学, 2023, 43(1): 6777.
[5]赵兴丽, 张金峰, 周玉锋, 等. 一株拮抗茶炭疽病菌的木霉菌的分离、筛选及鉴定[J]. 茶叶科学, 2019, 39(4): 431439.
[6]YANG Yishuai, YANG Xueyu, ZHANG Yudan, et al. First report of Fusarium cugenangense causing root rot of tea plants (Camellia sinensis) in China [J/OL]. Plant Disease, 2023. DOI: 10.1094/PDIS-06-23-1172-PDN.
[7]王宝, 严婉荣, 肖彤斌, 等. 海南辣椒尖孢镰刀菌拮抗内生细菌的分离与鉴定[J]. 分子植物育种, 2023, 21(20): 67676775.
[8]滕峥, 杨翠凤, 刘正鲁, 等. 百香果茎基腐病拮抗菌筛选及其生物学特性[J/OL]. 分子植物育种, 2023: 18 [20231227]. http:∥kns.cnki.net/kcms/detail/46.1068.S.20230525.1404.006.html.
[9]王前程, 张迎迎, 戴陶宇, 等. 拟康宁木霉T-51菌株对番茄枯萎病的生物防治及其机理研究[J]. 西北植物学报, 2022, 42(6): 974982.
[10]姚晨虓, 李小杰, 刘畅, 等. 3株拮抗烟草尖孢镰刀菌的木霉菌筛选鉴定及促生防病效果评价[J]. 中国烟草学报, 2022, 28(4): 96105.
[11]郑世仲, 周子维, 陈晓慧, 等. 拮抗炭疽病的茶树内生菌筛选、鉴定及培养条件优化[J]. 茶叶科学, 2023, 43(2): 205215.
[12]李树江, 张韵霞, 刘羽, 等. 辣椒根腐病生防菌的筛选鉴定及生防作用[J]. 中国蔬菜, 2023(9): 6976.
[13]陈娜, 陈婧, 闵琪茹, 等. 烟草赤星病生防菌的鉴定及其抑菌机理[J]. 西北农业学报, 2023, 32(8): 12681278.
[14]ELANGO V, MANJUKARUNAMBIKA K, PONMURUGAN P, et al. Evaluation of Streptomyces spp. for effective management of Poria hypolateritia causing red root-rot disease in tea plants [J]. Biological Control, 2015, 89: 7583.
[15]MORANG P, DEVI S P, JHA D K, et al. Tea root brown-rot fungus disease reduction and yield recovery with rhizobacteria inoculation in both nursery and field trials [J]. Rhizosphere, 2018, 6: 8997.
[16]PURKAYASTHA G D, MANGAR P, SAHA A, et al. Evaluation of the biocontrol efficacy of a Serratia marcescens strain indigenous to tea rhizosphere for the management of root rot disease in tea [J/OL]. PLoS ONE, 2018, 13(2): e0191761. DOI: 10.1371/journal.pone.0191761.
[17]宋微. 油菜菌核病拮抗放线菌的筛选及Kribbella monticol多相分类鉴定[D]. 哈尔滨: 东北农业大学, 2019.
[18]周影. 万寿菊内生和根际土壤放线菌的分离鉴定和抗菌活性研究[D]. 哈尔滨: 东北农业大学, 2016.
[19]范丽霞. 放线菌Z331-A的鉴定、培养条件优化及发酵液活性研究[D]. 海口: 海南大学, 2020.
[20]孙迅. 烟草黑胫病菌生防放线菌发酵条件的优化及定殖动态[D]. 合肥: 安徽农业大学, 2023.
[21]阮继生,黄英. 放线菌快速鉴定与系统分类[M]. 北京:科学出版社, 2011.
[22]中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975.
[23]章乐乐, 王冠, 柳凤, 等. 芒果炭疽病拮抗菌分离、鉴定及生防机制研究[J]. uJ35YQUS7NAoZfkXHqO6DJW5zdE46JJqo+lwRnY1pzg=生物技术通报, 2023, 39(4): 277287.
[24]孙玉娟. 桑树青枯病拮抗菌ZM-1的分离鉴定、发酵优化及其生防效果研究[D]. 泰安: 山东农业大学, 2023.
[25]王子晴, 卢宝慧, 田义新, 等. 拮抗北细辛菌核病木霉菌的分离、鉴定及生防效果[J]. 微生物学通报, 2021, 48(12): 46244635.
[26]李叶彤, 马玉坤, 杨仕佳, 等. 抗辣椒炭疽病菌盘长孢状刺盘孢的木霉菌的筛选[J]. 菌物学报, 2023, 42(12): 23742387.
[27]郑豆豆. 黄芪根腐病复合生防放线菌的防治作用及其菌剂初步制备[D]. 兰州: 西北师范大学, 2022.
[28]曾涛,宋国际.“正交设计助手”软件在银镜反应实验中的应用[J].化学教学,2005(5):5051.
[29]OLANREWAJU O S, BABALOLA O O. Streptomyces: implications and interactions in plant growth promotion [J]. Applied Microbiology and Biotechnology, 2019, 103(3): 11791188.
[30]鲁妍璇, 曹毅, 李博雅, 等. 利迪链霉菌K2对灰霉病菌的抑菌效果及抑菌物质鉴定[J]. 微生物学报, 2023, 63(5): 19912006.
[31]王宁, 黄伟, 鲁致远, 等. 苹果树腐烂病生防链霉菌A144的鉴定及其代谢产物的抑菌活性[J]. 西北农业学报, 2023, 32(3): 440449.
[32]李小杰, 李成军, 姚晨虓, 等. 拮抗烟草疫霉菌的木霉菌株筛选鉴定及防病促生作用研究[J]. 中国烟草科学, 2020, 41(3): 6570.
[33]郝金辉,林胜楠,吴梓菲, 等.多粘类芽胞杆菌JE53对香梨采后黑斑病菌抑制效果及贮藏品质的影响[J].中国生物防治学报,2023,39(5):12661274.
[34]李铮,王金辉,丁丽丽, 等.贝莱斯芽孢杆菌菌株NZ-4生防潜能及基因组学分析[J].江苏农业科学,2023,51(2):117125.
[35]WANG Chen, AHSAN T, DING Ao, et al. Whole genome analysis of Bacillus amyloliquefaciens TA-1, a promising biocontrol agent against Cercospora arachidicola pathogen of early leaf spot in Arachis hypogaea L [J/OL]. BMC Plant Biology, 2023, 23(1): 410. DOI: 10.1186/s12870-023-04423-4.
[36]WANG Zhiyan, GAO Congting, YANG Jingquan, et al. Endophytic Streptomyces sp. NEAU-ZSY13 from the leaf of Perilla frutescens, as a promising broad-spectrum biocontrol agent against soil-borne diseases [J/OL]. Frontiers in Microbiology, 2023, 14: 1243610. DOI: 10.3389/fmicb.2023.1243610.
(责任编辑:杨明丽)

