寄生番茄的拟禾本科根结线虫的鉴定及对番茄不同品种的趋性



摘要2019年福建省莆田市番茄‘农科180’品种发生严重的根结线虫病, 根尖处根结多呈“靴”状。本研究通过形态学、线虫rDNA-ITS、28S rDNA D2-D3序列分析与特异性引物检测,明确病原线虫种群为拟禾本科根结线虫Meloidogyne graminicola。这是在福建省番茄上首次报道拟禾本科线虫危害番茄。为探讨不同番茄品种对拟禾本科根结线虫的感、抗性,在Pluronic F-127胶体介质中测定该种群2龄幼虫(J2)对5个番茄品种(农科180’ ‘仙客1号’ ‘仙客6号’ ‘红美人’和‘硬粉8号’)根尖的趋性,结果表明,趋向于‘农科180’的J2数量显著大于其他4个番茄品种,品种有无Mi基因与J2趋性无关;室内致病性试验表明,接种后35 d调查,‘农科180’发病率为100%,病情指数为60;‘仙客1号’ ‘仙客6号’ ‘红美人’和‘硬粉8号’的发病率分别为53%、40%、33%和27%,病情指数均低于11。研究表明,番茄‘农科180’根尖对J2具有强烈的吸引性是其感病的原因之一。生产中应重视番茄品种对拟禾本科根结线虫的感抗性差异。
关键词番茄;拟禾本科根结线虫;鉴定;趋性;致病性
中图分类号:S 435.2文献标识码:ADOI:10.16688/j.zwbh.2023532Identification of Meloidogyne graminicola on tomato and it’s taxis to
the different tomato cultivarsCHEN Jingwei HUANG Hongjing LI Shuo WU Huaxiang CHENG Xi1,XIAO Shun1,LIU Guokun1*(1. Key Laboratory of Biopesticide and Chemical Biology, Ministry of Education, Fujian Agriculture and Forestry
University, Fuzhou350002, China; 2. Xuzhou Institute of Agricultural Sciences in Xuhuai Region, Jiangsu
Province, Key Laboratory of Biology and Genetic Breeding of Sweetpotato, Ministry of Agriculture
and Rural Affairs,Xuzhou221131, China)AbstractSerious root-knot nematode disease of tomato (Solanum lycopersicum cv. ‘Nongke 180’) with typically hooked-shaped galls at the root tip was found in the Putian region, Fujian province. Based on the morphological and molecular analyses of rDNA-ITS and 28S rDNA D2-D3 sequences, and detection using species-specific primers, the nematode was identified as Meloidogyne graminicola. This is the first report of a natural infection of M.graminicola on tomato in Fujian province. Taxis assays of second stage juveniles (J2s) of M.graminicola to root tips of five tomato cultivars, including ‘Nongke 180’ ‘Xianke 1’ ‘Xianke 6’ ‘Hongmeiren’ and ‘Yingfen 8’ were tested using the Pluronic F-127 gel system. Greater numbers of J2s were significantly attracted to ‘Nongke 180’ than to the other four cultivars. There no association existed between attractive ability and the presence of Mi-resistance gene in the five cultivars. Pathogenicity of the nematode to the five tomato cultivars was conducted and compared, the results showed that the incidence of ‘Nongke 180’ was 100% incidence with a disease index of 60, while the incidence of ‘Xianke 1’ ‘Xianke 6’ ‘Hongmeiren’ and ‘Yingfen 8’ were 53%, 40%, 33%, and 27%, respectively, with all disease indexes being less than 11. The research showed that tomato cv. ‘Nongke 180’ was a susceptible host for M.graminicola, with strong attraction to J2s of the nematode.
Key wordsSolanum lycopersicum; Meloidogyne graminicola; identification; taxis; pathogenicity番茄Solanum lycopersicum是全世界最广泛种植及消费最多的蔬菜种类,中国的番茄种植产量约占全球产量的32%[1]。根结线虫Meloidogyne spp.是番茄上重要的病原物,侵染番茄根系导致大小不等的根结,影响植株的生长发育与营养吸收,田间发病一般可导致番茄产量损失10%~20%,严重的超过60%[23]。番茄是许多根结线虫种的良好寄主,生产中危害严重的主要种类为南方根结线虫M.incognita、爪哇根结线虫M.javanica、花生根结线虫M.arenaria、北方根结线虫M.hapla和象耳豆根结线虫M.enterolobii[3]。拟禾本科根结线虫M.graminicola是水稻重要病原线虫之一,主要侵染禾本科Poaceae、十字花科Brassicaceae、豆科Fabaceae等9个科19个属90多种植物[45],但通常认为拟禾本科根结线虫不能危害番茄[67]。2022年在我国海南三亚市首次发现拟禾本科根结线虫危害番茄[8]。作者在福建省莆田市荔城区番茄种植区发现了严重的根结线虫病害,通过形态学和分子生物学鉴定,明确其为拟禾本科根结线虫,并就该种群2龄幼虫对番茄不同品种的根尖趋性进行了初步研究,现报道如下。
1材料与方法
1.1番茄根结线虫样本采集、分离与种群繁育
样本采集:番茄根结线虫病害样本(20份)于番茄采收期采自福建省莆田市荔城区东阳村基地(25°26′N,119°03′E),并随机调查田间番茄根结线虫病的发病率,记述根结症状特点。番茄品种为‘农科180’,由福建省农业科学院选育。
线虫的分离[9]:在体视显微镜下直接剖离雌虫,挑取番茄根结处卵囊,置于无菌水中孵化获得2龄幼虫(J2);利用根孵育法获得雄虫。分离的线虫用于形态学与分子生物学鉴定。
线虫种群繁育:挑取单卵囊接种于灭菌沙土中培植的3叶期水稻(品种‘怪异2号’)根部进行种群繁育,正常水肥管理。纯化的种群用于线虫趋性研究。
1.2根结线虫的鉴定
1.2.1形态鉴定
线虫的杀死、临时玻片制作等均参照张绍升[9]的方法。通过配备Nikon相机(DS-Ri1)的显微镜(Eclipse Ni-U 931609,尼康仪器株式会社)进行观测与拍照。形态测量值按照De Man公式进行测量和计算。
1.2.2rDNA-ITS和28S rDNA D2-D3序列鉴定
采用冻融裂解法提取单条线虫的DNA[10]:挑取单条J2幼虫经灭菌水清洗2遍后,转移至装有8 μL ddH2O、1 μL 10×PCR buffer的PCR管内,PCR管置于液氮中30 s后取出,加1 μL蛋白酶K(1.2 mg/mL),65℃温育1.5 h,95℃ 10 min,-20℃保存备用。
采用rDNA-ITS区通用引物TW81(5′-GTTT-CCGTAGGTGAACCTGC-3′)/AB28(5′-ATATGC-TTAAGTTCAGCGGGT-3′)[11];28S rDNA D2-D3区通用引物D2A(5′-ACAAGTACCGTGAGGGAA-AGTTG-3′)/D3B(5′-TCGGAAGGAACCAGCTA-CTA-3′)[12]进行鉴定。引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系(25 μL):模板DNA 2 μL,上、下游引物(10 μmol/L)各1 μL,PCR Mix(Premix TaqTM,TaKaRa)12.5 μL,ddH2O 8.5 μL。PCR反应程序:94℃预变性4 min;94℃ 30 s,55℃(ITS区)或54℃ (28S rDNA D2-D3区)30 s,72℃ 40 s,35个循环;72℃ 10 min,4℃保存。
扩增产物经1%琼脂糖凝胶电泳检测合格后送生工生物工程(上海)股份有限公司进行双向测序,获得的序列上传GenBank获得序列号。将所得序列在NCBI进行BLAST比对,选取序列相似度最高的类群构建发育树,在CIPRES Science Gateway (www.phylo.org)[13]运算平台上进行序列分析。运用程序MrBayes on XSEDE,采用GTR+I+G模型构建贝叶斯树[14];运用程序RAxML-HPC2 on XSEDE,采用GTRCAT模型构建极大似然树[1516]。运算运行设定500万代,最大似然法的自展重复设定为1 000次。最后采用FigTree v 1.4.3和Adobe Illustrator CC在贝叶斯50%多数原则一致树上标注后验概率和ML自展值, 拓扑结构不支持的自展值不标出。
1.2.3特异性引物检测
随机采集8株发病番茄(品种:‘农科180’)的病根,随机挑取单条雌虫,经冻融裂解法提取DNA。采用拟禾本科根结线虫特异性引物Mg-F (5′-TTATCGCATCATTTTATTTG-3′)/Mg-R (5′-CG-CTTTGTTAGAAAATGACCCT-3′)进行扩增[17]。以南方根结线虫DNA为阴性对照。反应程序:94℃ 5 min;94℃ 30 s,51℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min;4℃保存。扩增产物经1%琼脂糖凝胶电泳检测。
1.3拟禾本科根结线虫对番茄根系的趋性观察
1.3.1供试番茄品种及育苗
将 ‘农科180’ ‘仙客1号’ ‘仙客6号’ ‘红美人’和‘硬粉8号’番茄种子分别用纱布包好,在45℃温水中浸泡50 min,放入28℃恒温培养箱中催芽。出芽2 mm后将种子播种于盛放灭菌土的育苗盘内,幼苗长出1片真叶后分别转入营养钵内,在温室25℃条件下培养备用。
1.3.2拟禾本科根结线虫对番茄离体根的趋性观察Pluronic F-127胶体配制参考Wang等[18]的方法。在4℃条件下,配制成含拟禾本科根结线虫2龄幼虫20条/100 μL的 Pluronic F-127胶体液,吸取含线虫的胶体液2 mL加到直径3.5 cm的无菌塑料培养皿内,轻轻摇动混匀。设置2种处理:1)每个皿摆放1条长度0.5 cm的番茄根尖,每个品种重复4次,用封口膜封住培养皿后转移至25℃恒温培养箱,分别于3、6、9 h和12 h时观测根尖2 mm处聚集的J2数量。2)在无菌塑料培养皿内摆放5个品种的根尖(长度1 cm),每个品种1条根尖,围绕中心置放,分别在0、9、18 h时观测不同品种根尖对线虫的趋引,记录根尖周围2 mm处聚集的J2数量;试验重复4次。数据采用Duncan氏新复极差法(α=0.05)进行统计分析。
1.45个番茄品种Mi基因检测
参考Williamson等的方法[19]分别提取5个品种番茄种子的DNA,提取的DNA立刻用于PCR或于-20℃保存。参考Garcia等[20]和戴均涛等[21]的方法,利用共显性序列特征扩增区引物对Mi23F(5′-TGGAAAAATGTTGAATTTCTTTTG-3′)/Mi23R(5′-GCATACTATATGGCTTGTTTACCC-3′)扩增各番茄品种的Mi基因。若扩增得到430 bp的单一条带,判定其不含Mi基因;若扩增得到380 bp的单一条带,或同时扩增得到380、430 bp和500 bp 3个条带判定其含Mi基因。反应程序为:94℃ 4 min;94℃ 1 min,52℃ 45 s,72℃ 1 min,35个循环;72℃ 10 min;4℃保存。扩增产物经1%琼脂糖凝胶电泳检测。
1.5拟禾本科根结线虫对番茄致病性测定
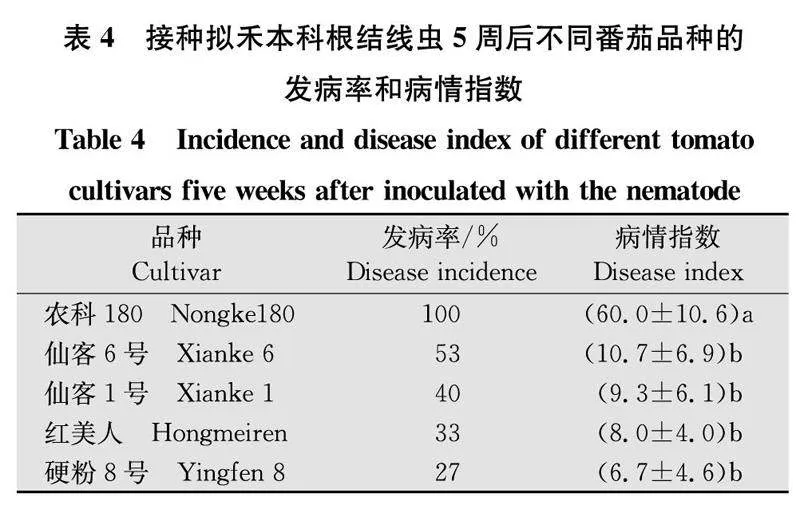
将新鲜收集的2龄幼虫制作成500条/mL的线虫悬浮液。待番茄苗长至6叶期时进行根系接种试验,每盆种植1株番茄,每株番茄接种1 000条线虫。每个品种接种5株,设置空白对照。接种后将番茄苗置于温室正常生长管理。5周后检查番茄根系,参考张绍升的分级标准[9]进行分级,计算每个品种的发病率和病情指数。0级:根系健康,没有被侵染;1级:严格检查,可见极少数小结瘿;2级:根系可见明显的小根瘿,根功能受损不重;3级:根系有大量小根瘿和部分大根瘿,20%根系严重结瘿和丧失功能;4级:75%根系严重结瘿,丧失功能;5级:根系全部结瘿,变色枯黄。
发病率=感病株数/调查株数×100%;
病情指数=∑(各级病株数×相应级值)/调查总数×最高级值×100。
2结果与分析
2.1番茄根结线虫病症状及线虫主要形态学特征
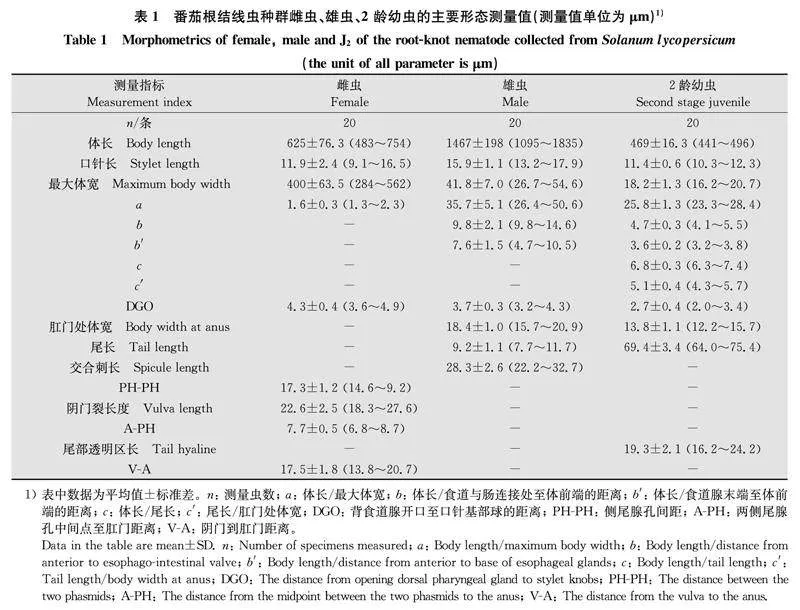
通过田间随机调查100株番茄,发现番茄根结线虫病发病率超过90%。番茄植株叶片黄化,将病株拔起可见明显的根结症状,发病根系交织成团,根系呈不同程度的肿胀,有的似萝卜状,根瘤处可继续长出新根,根尖处的根结多呈“靴”状或棒槌状(图1 a)。线虫卵囊包裹在根系表皮内,体视镜下解剖肿胀根可见病组织内有多头乳白色雌虫、大量幼虫和卵粒,在多数根结内可解剖到雄虫。雌虫呈梨形,乳白色,虫体尾部有明显突起,会阴花纹整体近似圆形,背弓较低,整体线纹连续且较为平滑,但在侧区可见细碎纹路,形成不规则的条沟。多数会阴花纹腹线连续平滑,尾端阴门区,无或有少量线纹(图1 b,c)。2龄幼虫尾部细长,可见狭长的透明区,有明显缺刻(图1 d)。雌虫、雄虫和J2形态测量值见表1,形态特征与拟禾本科根结线虫原始描述种一致[22]。
2.2分子生物学鉴定
2.2.1系统发育树的构建与分析
利用通用引物TW81/AB28扩增番茄根部根结线虫种群的rDNA-ITS,获得了580 bp左右的条带,序列上传至GenBank获得序列号MT159686和MT159687,序列比对结果显示,所得的rDNA-ITS区序列与GenBank中其他拟禾本科根结线虫种群的相似性在99%以上。以尖细潜根线虫Hirschmanniella mucronata为外群构建系统发育树,可见,该种群与NCBI上登录的拟禾本科根结线虫种群均聚在同一分支,后验概率为0.98,自展值为100,与其他根结线虫种处于不同分支(图2a);利用图2利用通用引物D2A/D3B扩增番茄根部根结线虫种群的28S rDNA D2-D3区序列,获得了780 bp左右的条带,序列上传至GenBank获得序列号MT159669和MT159670,序列比对结果显示,所得D2-D3区序列与其他拟禾本科根结线虫种群的相似性在99%~100%。以肥尾短体线虫Pratylenchus pinguicaudatus为外群构建系统发育树,可以看到本研究获得的种群与NCBI上登录的拟禾本科根结线虫种群均聚在同一分支,后验概率为1,自展值为70,与其他根结线虫种处于不同分支(图2b)。
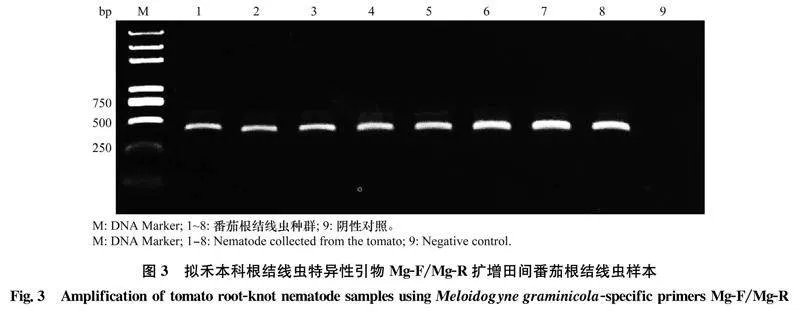
2.2.2特异性引物检测
利用拟禾本科根结线虫特异性引物Mg-F/Mg-R进行检测,8个样本均获得长度约300 bp 的特异条带,空白对照无扩增条带(图3)。结合形态学鉴定结果,确定危害番茄的根结线虫种群为拟禾本科根结线虫。
2.3不同番茄品种根尖对拟禾本科根结线虫趋性的影响在Pluronic F-127胶体系统中含有单个品种的单条根系时,0 h,J2随机均匀分布于胶体内,5个品种根尖处未观察到线虫聚集现象;3 h, ‘农科180’‘仙客6’和‘仙客1号’根尖周围聚集的线虫数量较多,且数量基本维持在12~15条,‘硬粉8号’和‘红美人’根尖周围聚集的线虫数量在6~7条;6 h,5个品种根尖吸引线虫的数量都有小幅提升,其中‘农科180’根尖聚集的J2数量(约37条)显著多于‘仙客1号’ ‘红美人’‘硬粉8号’;9 h,5个品种吸引线虫的数量有较大的提升,其中‘农科180’ (约98条)和‘仙客6号’(约91条)最为明显,显著多于其他3个品种;12 h,‘农科180’吸引线虫数量达到201条左右,显著多于其余4个品种(表2)。
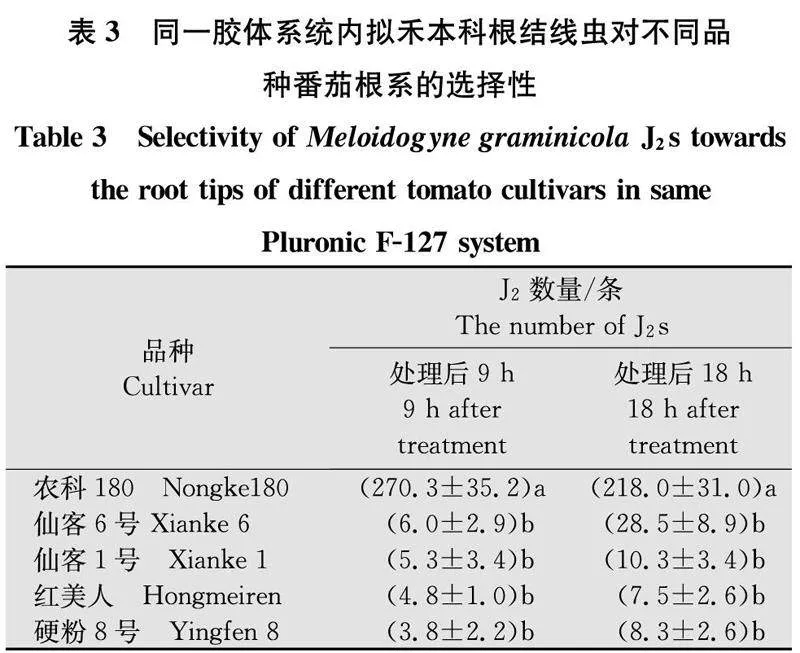
将5个番茄品种的根尖同时放在Pluronic F-127胶体系统中时, 0 h,线虫随机均匀分布在胶体中;9 h,J2s主要聚集于‘农科180’根尖处(图4)数量显著多余其余4个品种(表3);18 h,‘农科180’根尖处聚集线虫数量有所减少,可能与侵入根系内有关,但仍然显著多于其余4个品种(表3)。
2.45个番茄品种的Mi基因检测结果
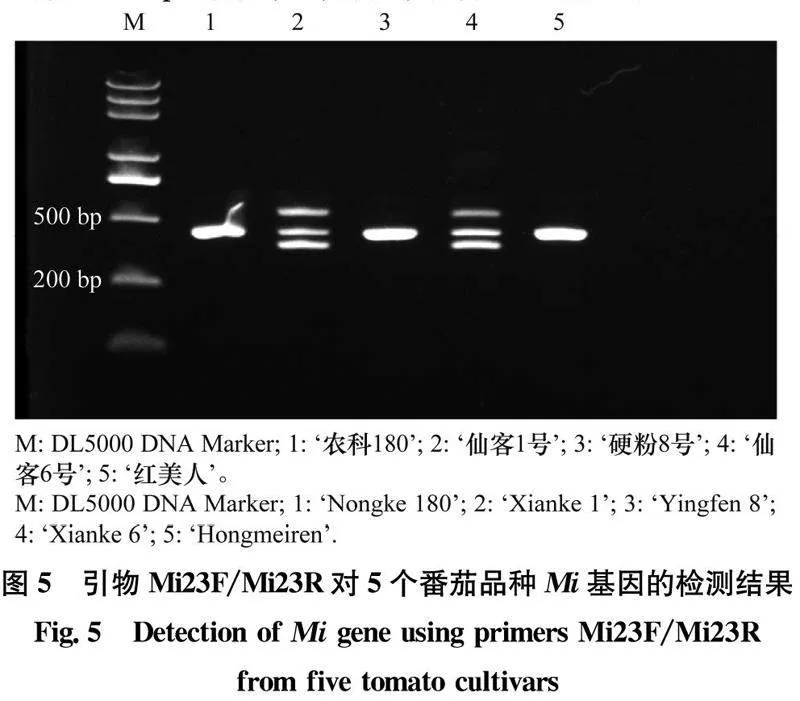
采用引物Mi23F/Mi23R检测5个番茄品种的Mi基因,结果表明:‘仙客1号’和‘仙客6号’扩增出500、430 bp和380 bp 3条带,即为Mi/mi杂合基因型,‘农科180’‘硬粉8号’和‘红美人’扩增出1条430 bp的条带,表明均不含Mi基因(图5)。
2.5拟禾本科根结线虫对5个番茄品种的致病性
将拟禾本科根结线虫2龄幼虫分别接种到番茄根系,5周后检查根系根结,结果见表4。5个番茄品种根系均发现有根结症状,‘农科180’株发病率为100%,病情指数为60,受害最严重,显著高于其余4个含或不含Mi基因的番茄品种。所有对照植株根系均未发现根结症状。
3结论与讨论
本文通过形态学与分子生物学鉴定方法,明确侵染番茄‘农科180’的根结线虫为拟禾本科根结线虫。番茄是许多常见根结线虫种的良好寄主,但对于拟禾本科根结线虫,大多数研究表明其无法侵染番茄或能侵染却不能在番茄中繁殖[6],说明大多数番茄品种不是拟禾本科根结线虫的良好寄主。本研究调查发现,拟禾本科根结线虫侵染‘农科180’后,受害植株根部有严重的根结症状,地上部生长不良,导致产量与品质大幅下降。这是继中国海南地区首次发现拟禾本科根结线虫侵染大田番茄(品种:‘Jinsheng’)[8]后的再次发现,表明一些番茄品种是拟禾本科根结线虫的良好寄主。受拟禾本科根结线虫侵染的番茄根尖呈现典型的肿胀倒勾状,这与水稻等禾本科寄主的受害症状类似[23],但与其他根结线虫种侵染番茄引起的根结症状有明显的区分度,可作为田间识别的重要特征。拟禾本科根结线虫是水稻上最重要的病原线虫之一,在国内多个省份水稻产区发生且日趋扩散,特别是在直播稻上发生严重[23]。拟禾本科根结线虫在福建省最早发现于南平市政和县水稻以及周边沟渠的油芒Spodiopogon cotulifer等杂草寄主上[24],随后发现香蕉Musa acuminata[25]、韭菜Allium tuberosum[26]等新寄主。本次发现拟禾科根结线虫的番茄田为稻菜轮作田,其初侵染源可能来自前季水稻。加强拟禾本科根结线虫的生理小种、寄主范围,以及对番茄品种的感抗性测定对生产具有重要意义。
利用寄主抗性是防治番茄根结线虫病的最经济有效的措施。目前Mi-1基因是番茄中唯一被商业化利用的抗根结线虫基因,国际上抗根结线虫的番茄品种基本都携带该基因,携带该基因的品种能有效地抵抗南方根结线虫Meloidogyne incognita、爪哇根结线虫M.javanica和花生根结线虫M.arenaria[27]。研究表明,番茄‘仙客6号’和‘仙客1号’含有Mi基因[28],本研究证实, ‘农科180’ ‘红美人’和‘硬粉8号’不含有Mi基因。在Pluronic F-127胶体系统中,拟禾本科根结线虫J2对‘农科 180’的趋性显著大于其他4个品种,表明,品种是否含有Mi-1基因与拟禾本科根结线虫的趋性并没有关系。致病性试验表明,拟禾本科根结线虫只导致‘农科180’根系出现严重的根结症状且造成明显损害,其余4个番茄品种虽可产生根结,但是根结的症状极其轻微。‘农科180’根尖对J2的吸引力显著高于其他4个品种,这可能是‘农科180’高感拟禾本科根结线虫的一个重要因素,感病的具体原因还需进一步地深入研究。
参考文献
[1]霍建勇. 中国番茄产业现状及安全防范[J]. 蔬菜, 2016(6): 14.
[2]张洁,朱文倩,夏明聪,等. YB-04生物菌肥防治番茄根结线虫的效果评价[J]. 植物保护, 2022, 48(2): 1623.
[3]PHILBRICK A N, ADHIKARI T B, LOUWS 7y124KA7uL2OLsNn/nc3EA==F J, et al. Meloidogyne enterolobii, a major threat to tomato production: current status and future prospects for its management [J/OL]. Frontiers in Plant Science, 2020, 11: 606395. DOI: 10.3389/fpls.2020.606395.
[4]RUSINQUE L, MALEITA C, ABRANTES I, et al. Meloidogyne graminicola -A threat to rice production: review update on distribution, biology, identification, and management [J/OL]. Biology, 2021, 10(11): 1163. DOI:10.3390/biology10111163.
[5]黄文坤, 向超, 刘莹, 等. 水稻拟禾本科根结线虫发生与防治[J]. 植物病理学报, 2018, 48(3): 289296.
[6]POKHAREL R R. Characterization of root-knot nematodes from rice-wheat fields in Nepal and search for source of resistance [D]. New York: Cornell University, 2007.
[7]DUTTA T K, POWERS S J, KERRY B R, et al. Comparison of host recognition, invasion, development and reproduction of Meloidogyne graminicola and M.incognita on rice and tomato [J]. Nematology, 2011, 13(5): 509520.
[8]PAN Song, LIU Chen, ZHANG Feng, et al. First report of Meloidogyne graminicola on tomato (Solanum lycopersicum) in Hainan of China [J]. Plant Disease, 2022, 106(7): 2000.
[9]张绍升. 植物线虫病害诊断与治理[M]. 福州: 福建科学技术出版社, 1999: 9798.
[10]王江岭, 张建成, 顾建锋. 单条线虫DNA提取方法[J]. 植物检疫, 2011, 25(2): 3235.
[11]MAAFI Z T, SUBBOTIN S A, MOENS M. Molecular identification of cyst-forming nematodes (Heteroderidae) from Iran and a phylogeny based on ITS-rDNA sequences [J]. Nematology, 2003, 5(1): 99111.
[12]SUBBOTIN S A, STURHAN D, CHIZHOV V N, et al. Phylogenetic analysis of Tylenchida Thorne, 1949 as inferred from D2 and D3 expansion fragments of the 28S rRNA gene sequences [J]. Nematology, 2006, 8(3): 455474.
[13]MILLER M A, PFEIFFER W T, SCHWARTZ T. Creating the CIPRES science gateway for inference of large phylogenetic trees [C]∥2010 Gateway Computing Environments Workshop (GCE), 2010: 18.
[14]RONQUIST F, HUELSENBECK J P. MrBayes3: Bayesian phylogenetic inference under mixed models [J]. Bioinformatics, 2003, 19(12): 15721574.
[15]FELSENSTEIN J. Evolutionary trees from DNA sequences: A maximum likelihood approach [J]. Journal of Molecular Evolution, 1981, 17(6): 368376.
[16]ALEXANDROS S, HOOVER P, ROYGEMONT J. A rapid bootstrap algorithm for the RAxML web servers, systematic biology [J]. 2008, 57(5): 758771.
[17]HTAY C C, PENG Huan, HUANG Wenkun, et al. The development and molecular characterization of a rapid detection method for rice root-knot nematode (Meloidogyne graminicola) [J]. European Journal of Plant Pathology, 2016, 146(2): 281291.
[18]WANG Chongli, BRUENING G, WILLIAMSON V M. Determination of preferred pH for root-knot nematode aggregation using pluronic F-127 gel [J]. Journal of Chemical Ecology, 2009, 35(10): 12421251.
[19]WILLIAMSON V M, HO J Y, WU F F, et al. A PCR-based marker tightly linked to the nematode resistance gene, Mi, in tomato [J]. Theoretical and Applied Genetics, 1994, 87(7): 757763.
[20]GARCIA B E, MEJIA L, SALUS M S, et al. A co-dominant SCAR marker, Mi23, for detection of the Mi-1.2 gene for resistance to root-knot nematode in tomato germplasm [J]. Applied Mechanics and Materials, 2013, 486: 323326.
[21]戴均涛, 张慎璞, 王暄, 等. 3种检测番茄抗根结线虫Mi基因分子标记法的比较[J]. 南京农业大学学报, 2018, 41(5): 848853.
[22]GOLDEN A M, BIRCHFIELD W. Meloidogyne graminicola (Heteroderidae), a new species of root-knot nematode from grass [J]. Proceedings of the Helminthological Society of Washington, 1965, 32(2): 228231.
[23]柯叶鑫, 陈晶伟, 肖顺, 等. 福建省直播稻根结线虫病的病原种类鉴定[J]. 生物安全学报, 2021, 30(4): 292298.
[24]刘国坤, 王玉, 肖顺, 等. 水稻根结线虫病的病原鉴定及其侵染源的研究[J]. 中国水稻科学, 2011, 25(4): 420426.
[25]ZHOU Xia, LIU Guokun, XIAO Shun, et al. First report of Meloidogyne graminicola infecting banana in China [J]. Plant Disease, 2015, 99(3): 420.
[26]CHEN Jingwei, CHEN Siyi, NING Xulan, et al. First report of Meloidogyne graminicola infecting Chinese chive in China [J]. Plant Disease, 2019, 103(11): 2967.
[27]CORTADA L, SORRIBAS F J, ORNAT C, et al. Response of tomato rootstocks carrying the Mi-resistance gene to populations of Meloidogyne arenaria, M.incognita and M.javanica [J]. European Journal of Plant Pathology, 2009, 124(2): 337343.
[28]魏偲, 史倩倩, 茆振川, 等. Mi基因家族番茄对南方根结线虫的抗性鉴定及评价[J]. 中国蔬菜, 2016(6): 2933.
(责任编辑:杨明丽)

