青海草原毛虫成虫触角感器观察及GqinOBPs表达分析


摘要为明确青海草原毛虫Gynaephora qinghaiensis触角感受器的类型、分布及GqinOBPs基因在嗅觉识别过程中的功能,本研究利用扫描电镜对其触角进行观察,并通过RT-qPCR测定GqinOBPs基因在雌雄成虫组织中的表达情况。在青海草原毛虫雌雄成虫触角上发现分泌孔及8种感器,包括刺形感器、毛形感器、Böhm氏鬃毛、单孔栓感器、鳞形感器、锥形感器、柱形感器和腔锥形感器。其中刺形感器、毛形感器、Böhm氏鬃毛和锥形感器分别有6、3、2和3种亚型。GqinOBPs的组织表达结果显示,GqinOBP6、GqinOBP8、GqinOBP9和GqinOBP16在雄成虫触角中的相对表达量显著高于其他组织,GqinOBP4、GqinOBP10、GqinOBP13~ GqinOBP15和GqinOBP17在雄成虫翅中的相对表达量最高。GqinOBP2、GqinOBP12和GqinOBP17在雌虫组织中的整体表达情况较好且GqinOBP17的表达具雌性偏好(P<0.05)。本研究为深入了解青海草原毛虫化学感受机制奠定基础,同时也为寻找青海草原毛虫绿色防治的分子靶标提供理论依据。
关键词青海草原毛虫;触角感器;扫描电镜;气味结合蛋白;组织表达
中图分类号:S 812文献标识码:ADOI:10.16688/j.zwbh.2023602Observations on the ultrastructure of adult Gynaephora qinghaiensis
antennal sensilla and tissue expression analysis of GqinOBPsNAN Yanbin,LIU Zhanling,KOU Guixiang,WANG Kexin,LI Rongrong,ZHOU Yuantao*(College of Agriculture and Animal Husbandry, Qinghai University, Xining810016, China)AbstractTo determine the types and distribution of antennal sensilla and the function of GqinOBP genes in the process of olfactory recognition, adult antennae of Gynaephora qinghaiensis were observed using a scanning electron microscope. The expression of GqinOBP genes in the tissues of female and male adults was determined by RT-qPCR. The antennae of G.qinghaiensis exhibited smell pores and eight types of sensilla: sensilla chaetica, sensilla trichodea, Böhm’s bristles, uniporous peg sensilla, sensilla squamous, sensilla basiconica, sensilla cylindric, and sensilla coeloconica. Notably, sensilla chaetica, sensilla trichodea, Böhm’s bristles, and sensilla basiconica had six, three, two, and three subtypes, respectively. Tissue expression analysis of GqinOBPs showed that the relative expression levels of GqinOBP6, GqinOBP8, GqinOBP9, and GqinOBP16 in the antennae of male adults were significantly higher than in other tissues. In contrast, GqinOBP4, GqinOBP10, GqinOBP13 to GqinOBP 15, and GqinOBP17 showed highest expression levels in the wings of male adults. Furthermore, the expressions of GqinOBP2, GqinOBP12, and GqinOBP17 were higher in female tissues, with GqinOBP17 showing a preference for females (P<0.05). This study provides foundational insights into the chemosensory mechanisms of G.qinghaiensis and offers a theoretical basis for finding molecular targets for the green control of G.qinghaiensis.
Key wordsGynaephora qinghaiensis;antennal sensilla;scanning electron microscope;odorant binding protein;
tissue expression昆虫感受器是一种特殊的表皮结构,介导昆虫对各种环境刺激的感知。昆虫触角上分布有许多感受器,在宿主定位、栖息地选择、伴侣识别、觅食、交配等过程中发挥着重要作用[13]。研究表明,触角中感受器的类型、分布与昆虫性别[45]、觅食[6]以及种类等[7]有关。明确昆虫触角感受器的类型有助于阐明其在生物进化和嗅觉识别行为调控中的价值[810]。目前,大量的昆虫触角感器被发现。例如,长索跳小蜂Anagyrus vladimiri雌虫触角中发现了8种形态不同的感器类型[11];黑跗眼天牛Bacchisa atritarsis触角上共发现7类12种感器,其中刺形感器Ⅱ型在其雄成虫触角上呈现特异性分布,可能在雄虫的某些行为中发挥主导作用[12]。阿小花尺蛾球果亚种Eupithecia abietaria debrunneata成虫触角上发现的感器类型为10类17种,且首次发现耳形感器Ⅲ,这是在鳞翅目昆虫触角感器研究中第一次报道[13]。昆虫的嗅觉感知过程需要各种嗅觉蛋白的参与,包括气味结合蛋白(odorant-binding proteins, OBPs)、化学感受蛋白(chemosensory proteins, CSPs)、气味受体(olfactory receptors, ORs)、离子型受体(ionotropic receptors, IRs)和气味降解酶(odorant degrading enzymes)等[14]。作为接收和感知化学信号的第一道屏障,OBPs在配体识别和气味感知中起着至关重要的作用[15]。昆虫OBPs属于水溶性小分子蛋白家族,它们在昆虫的化学感受器淋巴液中大量分布,被认为是昆虫化学感受过程中气味和信息素的载体[1617]。根据保守半胱氨酸残基的数量及其分子结构,OBPs主要分为5个类型:Classic OBPs, Dimer OBP, Plus-C OBPs, Minus-C OBPs, Atypical OBPss[1819]。OBPs作为昆虫体内最早被发现并开始研究的嗅觉蛋白,已经在双翅目Diptera、鳞翅目Lepidoptera、鞘翅目Coleoptera等昆虫中被发现,目前被鉴定的OBPs超过600多个[20]。OBPs的功能已经通过分子生物学、生物化学、生物物理学、结构生物学、动力学和电生理学等手段逐步解析[2123]。大量研究表明,昆虫OBPs蛋白基因主要在触角中特异性表达,也在翅、生殖系统、下颌腺和唾液腺等非感觉组织和器官中表达[21,24]。由于昆虫个体在不同性别、不同发育阶段下进行的生命活动不同,因此与其相关的OBPs的表达情况也会随之变化[25]。
青海草原毛虫Gynaephora qinghaiensis(鳞翅目毒蛾科Lymantriidae)是为害高寒草甸最重要的害虫之一,重点分布在青海门源、海晏、天俊、泽库、玛多、甘德、祁连、杂多和治多等地区[2627]。青海草原毛虫幼虫具有7个龄期,雌雄成虫形态差异明显,其雌成虫翅、触角、胸足皆退化,雄成虫迁飞能力较强且具有发达的羽状触角[2829]。幼虫背部有毒腺,可导致家畜和野生动物的口腔溃疡和断舌病,对人类和牲畜的健康构成严重威胁[3031]。自20世纪60年代以来,在青海草原毛虫的预防方面投入了巨大的努力,特别是在化学和生物杀虫剂的研究和生产方面[3234]。然而,这仍未能从根本上有效地减轻其危害。伴随着生物技术的快速发展,对青海草原毛虫的研究开始涉及线粒体全基因组序列测定与分析[35]、线粒体基因的序列变异和表达模式[36]及转录组生物信息分析[26]等方面,目前尚未发现对其化学感器超微结构和化学感受机制的研究。
研究昆虫触角感器类型、数量和分布是了解其嗅觉感器功能及感受机制的基础。在害虫生物防治过程中,可以利用昆虫的嗅觉识别机制。对靶标害虫嗅觉识别系统进行干扰可以实现对其的有效控制。因此,解析青海草原毛虫嗅觉识别的分子机制,对于制定有效的绿色防控措施具有重要意义。基于此,本研究通过扫描电镜技术观察并分析青海草原毛虫成虫触角感器类型及分布状况,同时利用实时荧光定量PCR技术检测前期通过转录组数据鉴定出的15个气味结合蛋白基因(GqinOBP2~GqinOBP6、GqinOBP8~GqinOBP17)[26]在成虫不同组织中的表达情况,旨在为深入研究气味结合蛋白在青海草原毛虫嗅觉识别机制中的作用及基于嗅觉的青海草原毛虫防治提供理论依据。
1材料与方法
1.1供试昆虫
供试青海草原毛虫成虫于2023年5月-8月采自青海省海北州(36°59′ N,100°52′ E,海拔3 095.1 m)野外。收集青海草原毛虫雄成虫的触角、头(去除触角)、胸、腹、翅和足,获得雄成虫共6个部位的样品。由于青海草原毛虫雌成虫触角、翅和足发生退化,收集头、胸、腹共3个部位的样品。每个部位样品取3个生物学重复。每个样品的重复数量根据组织或个体大小从3~30个不等,用液氮速冻分装储存在-80℃冰箱中备用[21]。
1.2触角扫描电镜样品的制备与超微结构观察
将青海草原毛虫雌雄成虫各9头于-20℃冷冻1 min,在体视镜下将雄成虫的触角从头部分离,由于雌成虫的触角退化为肉突,无法与头部分离,故取整个头部。之后用30%、50%、70%、80%、90%、100%乙醇对雄成虫触角及雌成虫头部分别进行逐级脱水,每个浓度连续3次,每次脱水20 min;随后将雄成虫触角及雌成虫头部用昆虫针固定于泡沫板上,置于超净工作台中打开风扇吹干12 h;干燥后的样品于实验台上放置12 h。将干燥后的处理样品用导电胶固定在样品台上;放入小型离子溅射仪(SBC-12)喷金1 min;之后在青海大学三江源国家重点实验室进行扫描电镜(JSM-7900F)拍摄。
1.3扫描电镜数据统计分析
感器的长度及宽度根据拍摄照片,借助Image J(U.S National Institute of Health)进行测量,运用IBM SPSS 26.0进行7c1191580e64e98ed15894e81b3b1bbebb154988c2816457bead2567c24f485e统计分析。利用Adobe Photoshop CS6(Adobe Systems)对感器类型进行标注并进行图片的排版;感器的鉴定参考Schneider[37]和Zacharuk[38]。
1.4总RNA提取及cDNA合成
通过TRIzol法提取1.1节收集的青海草原毛虫各部位样品的RNA。用1%琼脂糖凝胶电泳分析样品RNA完整性及是否存在DNA污染。利用超微量分光光度计检测RNA纯度,当OD260/OD280为1.8~2.2,表明提取的RNA合格。对纯度合格的RNA样品利用TRUEscript 1st Strand cDNA Synthesis Kit(艾德莱,北京)合成cDNA第一链并置于-20℃冰箱中保存备用。
1.5引物设计与合成
本课题组前期根据青海草原毛虫转录组数据鉴定出17个青海草原毛虫OBPs基因序列[26]。由于引物的长度问题我们最终利用Oligo7软件设计出15对引物(表1),内参基因(EF-1α)参考张棋麟等[39],引物委托北京睿博兴科生物技术有限公司合成。
1.6青海草原毛虫OBPs基因的qPCR检测
以1.4节合成的cDNA为模板,每个样品含3个生物学重复,每个生物学重复进行3次技术重复,通过熔解曲线评估引物的特异性。扩增体系为20 μL:SYBR Green Real-time PCR Master Mix 10 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA 1 μL (100 ng),超纯水7.4 μL。在ABI 7500型实时荧光定量PCR仪中进行qPCR反应,运行程序:95℃ 1 min;95℃ 15 s,60℃ 15 s,循环40次;72℃ 45 s。每个OBP基因在成虫各组织中的表达量以在雌性头部中的表达量为基准。
1.7数据分析
基因在不同组织中的相对表达量利用2-ΔΔCt法进行计算,其中:ΔCt=Ct(目的基因)-Ct(内参基因);ΔΔCt=ΔCt(样品)-ΔCt(对照)[40]。通过SPSS 26.0进行统计学分析,对各基因在不同组织中的表达量差异进行单因素方差分析(One-way ANOVA),同时利用Duncan氏新复极差法进行多重比较;最后使用Graphpad prism绘制基因的组织表达谱。
2结果与分析
2.1青海草原毛虫成虫触角形态
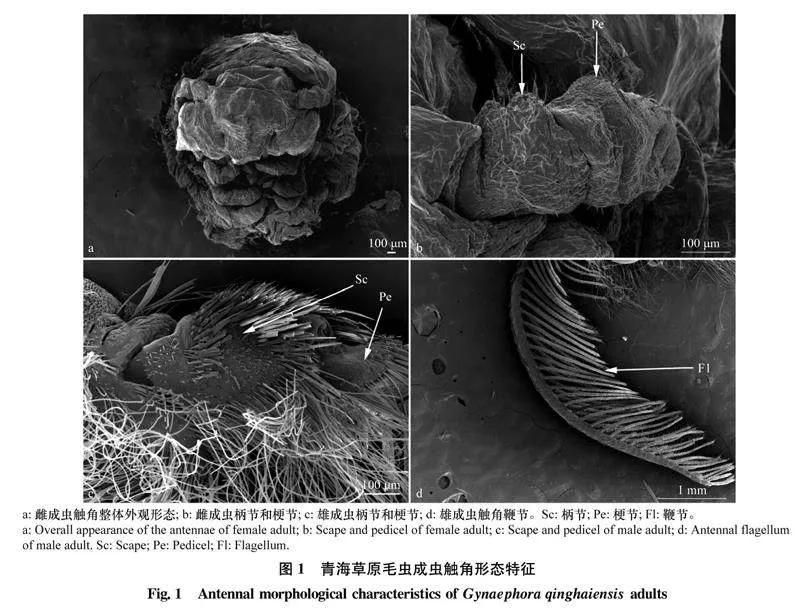
青海草原毛虫雄虫触角由鞭节(flagellum, Fl)、梗节(pedicel, Pe)和柄节(scape, Sc)组成;雌虫触角退化,无鞭节(图1a, b)。鞭节是雄虫触角的端节,由33个亚节组成(F1~ F 33),柄节和梗节上分布有大量绒毛(图1c, d)。鞭节的第1亚节长度为(131.36±1.12) μm,基部直径为(83.61±1.72) μm;第33亚节长度为(56.33±1.53) μm,基部直径为(59.00±2.65) μm。雄虫触角全长(1 383.72±15.19) μm,显著长于雌虫触角全长[(772.71±6.47) μm](P<0.05)。雄虫触角梗节、柄节的长度和基部直径均显著大于雌虫触角(P<0.05)(表2)。
2.2青海草原毛虫触角感器类型
2.2.1刺形感器 (sensilla chaetica, Sch)
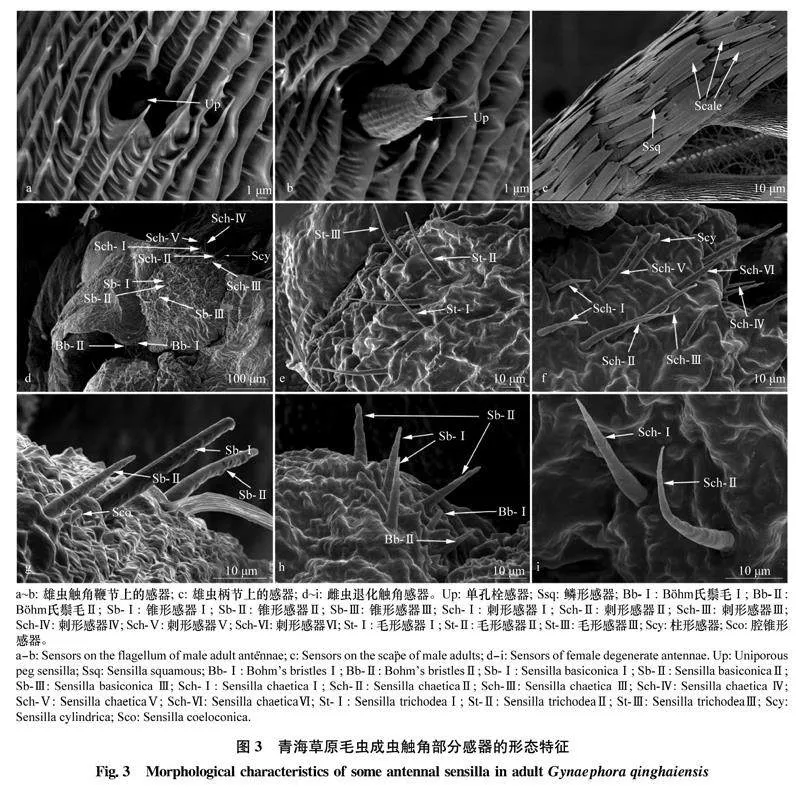
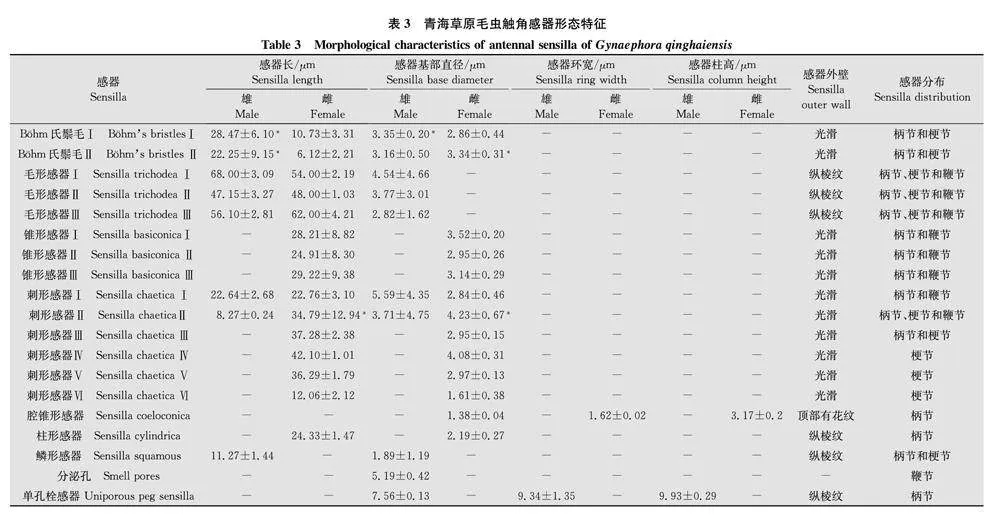
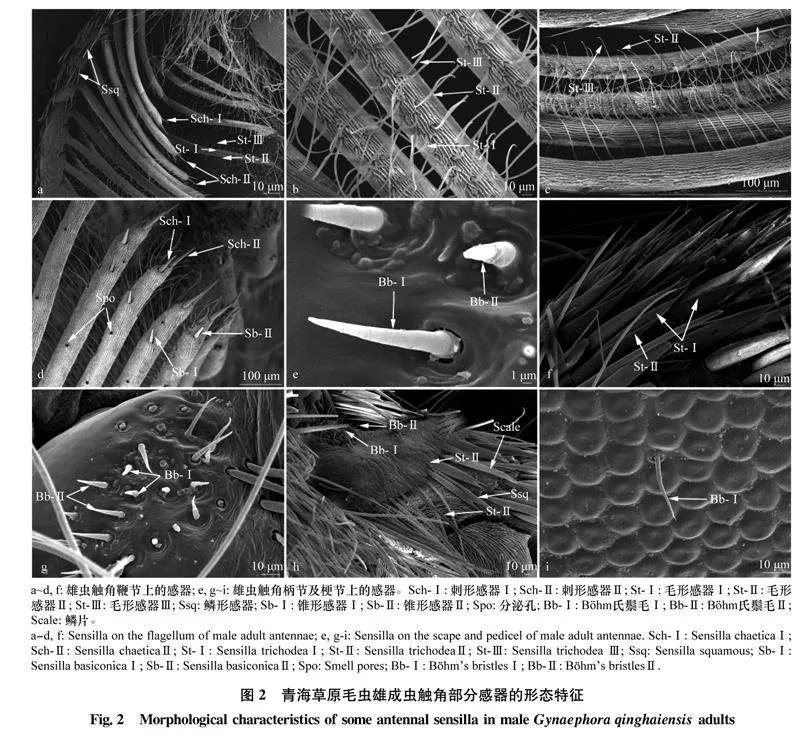
刺形感器数量较少,表面光滑,末端极尖。根据长度、是否着生于臼状感器窝、有无纵裂纹、有无弯曲、是否从基部到末梢逐步变细,将青海草原毛虫的刺形感器分为6个亚型(图2a,2d,3d,3f,3i)。青海草原毛虫的刺形感器主要分布在雄虫触角鞭节羽状分支端部(图2a, d)。Sch-Ⅰ在雄虫触角鞭节分布较密,长度和基部直径为(22.64±2.68) μm和(5.59±4.35) μm,雌雄成虫间Sch-Ⅱ的长度和基部直径差异显著(P<0.05)(表3)。SchⅢ~ SchⅥ在雄虫触角没有发现,广泛分布于雌虫触角(图3d,f,i)。
2.2.2毛形感器(sensilla trichodea, St)
青海草原毛虫雄成虫触角上毛形感器数量最多,分布最广,在触角鞭节羽状分支上分布尤为密集(图2b, c, f),在雌虫退化触角上也发现该种感器(图3e)。毛形感器是一种细长、径直或略有弯曲,从基部到末梢逐步变细的感器,其呈毛发状,表面有纵向分布的纹路。根据有无臼状感器窝、有无弯曲或分叉将青海草原毛虫的毛形感器分为3个亚型。St-Ⅰ、St-Ⅱ和St-Ⅲ外形类似,但St-Ⅰ的长度与基部直径明显大于St-Ⅱ和St-Ⅲ(表3)。
2.2.3Böhm氏鬃毛(Böhm’s bristles,Bb)
Böhm氏鬃毛大多直立于触角表面,感器表面光滑。Bb主要着生在青海草原毛虫触角的柄节和梗节基部,在雌、雄成虫触角上的分布无差异。青jy/MdPYHNpSSAEugMepcNIJnHAkZ0EyOo2CeHZX6K0Q=海草原毛虫触角的Böhm氏鬃毛有2种亚型,分别为Böhm氏鬃毛Ⅰ (Bb-Ⅰ)和Böhm氏鬃毛Ⅱ(Bb-Ⅱ)(图2e)。Böhm氏鬃毛Ⅰ似刺形,基部较宽,端部尖细,表面无孔。青海草原草原毛虫雄虫Bb-Ⅰ的长度和基部宽度分别是(28.47±6.1) μm和(3.35±0.2) μm均显著大于雌虫的Bb-Ⅰ。Böhm氏鬃毛Ⅱ较短小,呈三角锥形,表面光滑,通常与Böhm氏鬃毛Ⅰ伴生(图2g, h, i)。雌雄虫间Bb-Ⅱ的长度和基部直径差异均显著(P<0.05,表3)。
2.2.4分泌孔(smell pores, Spo)
青海草原毛虫的分泌孔主要分布在雄虫触角鞭节羽状分支上(图2d),且数量较少,雄虫分泌孔的直径为(5.19±0.42) μm(表3)。雌虫触角未发现该感器。
2.2.5鳞形感器(sensilla squamous, Ssq)
仅在青海草原毛虫的雄虫触角发现该感器。鳞形感器是触角柄节、梗节上的一种感器,着生于臼状感器窝内,中间较粗,基部、梢部均比中间部位细,呈狭长的鳞片形,表面具有纵裂纹,末梢端圆钝(图2a, 图3c)。雄虫鳞形感器长度和基部直径分别为(11.27±1.44) μm、(1.89±1.19) μm(表3)。
2.2.6单孔栓感器 (uniporous peg sensilla, Up)
单孔栓感器由表皮特化形成,着生在深坑中,基部膨大,端部有1个小孔。其分布数量较少,在青海草原毛虫雄成虫触角上仅发现2个,主要着生在触角鞭节亚节的分支上(图3a, b)。单孔栓感器基部直径是(7.56±0.13) μm,感器环宽是(9.34±1.35) μm,感器柱高为(9.93±0.29) μm(表3)。
2.2.7锥形感器(sensilla basiconica, Sb)
锥形感器主要分布在青海草原毛虫雌虫触角上(图3d, g, h),雄虫触角上未发现。青海草原毛虫的锥形感器比毛形感器粗,从基部到端部逐渐变细,基部有臼状窝,末端较钝,表面有纵向凹槽,根据长度和顶端形态将青海草原毛虫的锥形感器分成3个亚型,即SbⅠ、SbⅡ和SbⅢ。
2.2.8柱形感器(sensilla cylindric, Scy)
青海草原毛虫的柱形感器仅在雌虫柄节部位发现,散生在柄节末端,数量较少。感器呈柱状,端部有钝圆状微突,整体与触角垂直(图3d,f)。其长度和基部直径分别为(24.33±1.47) μm、(2.19±0.27) μm(表3)。
2.2.9腔锥形感器(sensilla coeloconica,Sco)
只在青海草原毛虫雌虫触角发现腔锥形感器。位于触角柄节或梗节钩状突起上,腔中央的锥形变异较大, 略高于触角表皮,周围伴生锥形感器(图3g)。其基部直径为(1.38±0.04) μm。感器环宽和感器柱高分别是(1.62±0.02) μm和(3.17±0.2) μm。
2.3青海草原毛虫OBP基因的组织表达分析
采用RT-qPCR技术测定已鉴定的OBP基因在青海草原毛虫雄虫头、胸、腹、足、翅、触角6个部位及雌虫头(包含退化触角)、胸、腹3个部位的表达水平。结果表明:青海草原毛虫15个OBP基因在成虫各组织中表达量明显不同(图4)。雄成虫中,GqinOBP6、GqinOBP8、GqinOBP9和GqinOBP16在触角中的相对表达量显著高于其他组织,分别是头部中相对表达量的76.03、28.31、106.67和40倍,GqinOBP4、GqinOBP10、GqinOBP13~GqinOBP15和GqinOBP17在翅中的相对表达量显著高于其他组织,分别为头部相对表达量的2.42、5.82、5.21、2.35、31.71倍和2.06倍。GqinOBP11在触角和翅中的相对表达量显著高于其他组织(P<0.05)。大部分GqinOBPs在雌成虫的头、胸和腹部几乎不表达。GqinOBP2、GqinOBP12和GqinOBP17在雌虫组织中的整体表达情况较好。GqinOBP4和GqinOBP17在雌虫腹部的表达量最高,分别是头部表达量的7.5和7.1倍,GqinOBP12在胸部的表达量最高,是头部表达量的3.8倍,均达显著水平(P<0.05)。GqinOBP6、GqinOBP8、GqinOBP11和GqinOBP17在雌雄成虫的头、胸和腹中的表达存在显著差异,且GqinOBP17在组织中的表达具雌性偏好(P<0.05)。
3讨论
鳞翅目成虫主要通过触角上的各种感器感受外界的化学信号和机械刺激, 明确感器的类型和分布是阐明功能和机制的前提[41]。我们发现青海草原毛虫触角上分布着8种类型的感器,分别为刺形感器、毛形感器、Böhm氏鬃毛、单孔栓感器、鳞形感器、锥形感器、柱形感器和腔锥形感器。与报道的其他鳞翅目昆虫,如豆卜馍夜蛾Bomolocha tristalis[42]、小菜蛾Plutella xylostella[43]、草地贪夜蛾Spodoptera frugiperda[44]等感器类型基本一致。其中刺形感器、毛形感器、Böhm氏鬃毛和锥形感器分别有6、3、2和3种亚型,丰富的感器类型使青海草原毛虫拥有广阔的栖息环境、强大的生存能力和更强的繁殖力[45]。
昆虫触角的刺形感器主要感知外界的机械刺激[46]。青海草原毛虫的刺形感器主要分布在雄虫触角鞭节羽状分支端部,未发现顶孔,在木毒蛾Lymantria xylina的感器研究中发现该类感器在其活动中可以起到保护触角的作用,因此推测青海草原毛虫的刺形感器具有相似功能[47]。毛形感器一般在鳞翅目蛾类触角上普遍存在,分布广,数量多,青海草原毛虫也不例外,其雄虫触角上的毛形感器具有3种亚型。在青海草原毛虫的雄虫触角感器中以毛形感器的数量最多,分布最广且具有多种亚型,这与毛形感器在鳞翅目昆虫触角上的分布特点一致[4849]。该类感器被证实具有嗅觉和感受性信息素的功能,青海草原毛虫雄虫的毛形感器较发达,推测其对雌虫释放的性信息素具有辨向功能[50]。当昆虫遇到机械刺激时,Böhm氏鬃毛能缓冲重力的作用力,从而控制昆虫下降速度[4]。因此,推测Böhm氏鬃毛可能刺激了与大脑相连的底层神经元,从而使青海草原毛虫能够主动控制飞行时的触角定位[51]。青海草原毛虫雄虫触角发现单孔栓感器,数量较少。研究发现,美国白蛾Hyphantria cunea雄成虫触角上都着生有单孔栓感器[52],其分布状况与青海草原毛虫雄虫触角上单孔栓感器的分布具有相似性。该感器对任何信息素以及植物挥发物没有反应,推测其功能可能是感受湿度或对二氧化碳敏感[5354]。鳞形感器在草地贪夜蛾中也有发现,通常认为其有机械感知的功能[44]。感器除了能感受气味外,还能感受外界的温、湿度[47,55],因此推测该类感器在青海草原毛虫寄主选择上发挥作用。锥形感器可感知植物的气味和信息素。目前已经报道的鳞翅目昆虫触角感器中,几乎没有发现柱形感器,其功能有待进一步研究。
基因表达分析是预测基因功能的重要手段,目前大量的研究证明参与嗅觉识别的OBPs主要在触角中特异性表达,而在其他组织中表达的OBPs可能参与其他的生理功能[25,56]。本研究中GqinOBP6、GqinOBP8、GqinOBP9和GqinOBP16在雄触角中的相对表达量显著高于其他组织。表明其对应的4个GqinOBPs可能是参与青海草原毛虫多种嗅觉识别过程的重要蛋白。虽然大部分OBPs存在于昆虫触角中, 被称作触角特定蛋白 (antennal-specific protein),但是, 越来越多的OBPs被发现在其他组织中也有表达, 如头部、口器、足、翅、胸部和腹部等, 在不同的器官组织中可能发挥着不同的功能[5759]。青海草原毛虫部分OBP基因在触角以外的组织中均有一定的表达量,如GqinOBP4、GqinOBP10、GqinOBP13~GqinOBP15和GqinOBP17在翅中的相对表达量较高。这与前人报道的昆虫翅部也分布有嗅觉感器相一致[60]。然而,目前对于在翅中高表达的OBPs基因的功能尚缺乏研究。GqinOBP2、GqinOBP12和GqinOBP17在雌虫组织中的整体表达情况较好且GqinOBP17在组织中的表达具雌性偏好(P<0.05)。该结果与甘薯蚁象Cylas formicarius[61]的CforOBP1~3基因表达谱类似,这可能与雌雄成虫在生命活动中各自承担的角色不同有关[62]。
青海草原毛虫成虫通过嗅觉感受系统完成寻找配偶、寄主定位及产卵地选择等行为,气味结合蛋白在此过程中发挥着重要作用。表达于雄虫触角的OBP基因对性信息素的识别很重要,除触角外,其他部位的OBP基因表达量在雌雄成虫间也存在一定差异。这些基因可能在雌雄之间交配时,或是与寄主互作的过程中发挥重要作用[25]。因此,深入研究青海草原毛虫嗅觉识别的分子机制,将为高效、特异性的昆虫行为调节剂研发提供理论基础。
4结论
本研究从青海草原毛虫雌雄虫触角上发现分泌孔和8种感器,分别为刺形感器、毛形感器、Böhm氏鬃毛、单孔栓感器、鳞形感器、锥形感器、柱形感器和腔锥形感器。作为了解基因功能的关键第一步,使用RT-qPCR对这些GqinOBPs基因在不同组织中的表达情况进行检测。我们鉴定出4个在雄虫触角中高表达,6个在翅中高表达及3个在雌虫组织中整体表达情况较好的GqinOBPs基因。我们的研究结果将为进一步阐明青海草原毛虫的嗅觉机制奠定基础,同时也为寻找青海草原毛虫绿色防治的分子靶标提供理论依据。
参考文献
[1]ZHU Wenli, YANG Lin, LONG Jiankun, et al. Morphology of the antennal sensilla of the nymphal instars and adults in Notobitus meleagris (Hemiptera: Heteroptera: Coreidae) [J/OL]. Insects, 2023, 14(4): 351. DOI: 10.3390/insects14040351.
[2]REN Lili, SHI Juan, ZHANG Yinan, et al. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae) [J]. Micron, 2012, 43(9): 921928.
[3]XU Wentian, LIU Genting, WANG Qike, et al. Ultrastructure of antennal sensory organs in nine flesh flies (Diptera: Sarcophagidae): New insight into the definition of family Sarcophagidae [J/OL]. Insects, 2022, 13(7): 602. DOI: 8118/10.3390/insects13070602.
[4]BABU M J. Antennal sensilla of the weaver ant Oecophylla smaragdina (F.)-males and females sense differently? [J]. Indian Journal of Entomology, 2019, 81(3): 418422.
[5]OLSSONP C, ANDERBRANT O, LOFSTEDT C, et al. Electrophysiological and behavioral responses to chocolate volatiles in both sexes of the pyralid moths Ephestia cautella and Plodia interpunctella [J]. Journal of Chemical Ecology, 2005, 31(12): 29472961.
[6]POLIDORI C, GARCIA A J, NIEVES-ALDREY J L. Antennal sensillar equipment in closely related predatory wasp species (Hymenoptera: Philanthinae) hunting for different prey types [J]. Comptes Rendus Biologies, 2012, 335(4): 279291.
[7]那杰,于维熙,李玉萍, 等.昆虫触角感器的种类及其生理生态学意义[J].沈阳师范大学学报(自然科学版), 2008(2): 213216.
[8]REN Changshi, CHANG Zhimin, ZU Zhiyun, et al. Comparison of morphological characteristics of antennae and antennal sensilla among four species of bumblebees (Hymenoptera: Apidae) [J/OL]. Insects, 2023, 14(3): 232. DOI: 10.3390/insects14030232.
[9]GALVANI G L, GONZALEZ-VAQUERO R A, GUERRA-NAVARRO C, et al. Antennal sensilla of cleptoparasitic and non-parasitic bees in two subfamilies of Apidae [J]. Apidologie, 2017, 48(4): 437449.
[10]张方梅, 金银利, 张丽丽, 等. 灰茶尺蠖成虫触角及幼虫头部感器超微结构 [J]. 昆虫学报, 2019, 62(6): 743755.
[11]SEVARIKA M, GIANNOTTI P, LUCCHI A, et al. The antennal sensory structures of female Anagyrus vladimiri (Hymenoptera: Encyrtidae) [J/OL]. Insects, 2022, 13(12): 1138. DOI: 8118/10.3390/INSECTS13121138.
[12]罗鹏, 吴家展, 王广利. 油茶蓝翅天牛触角感器扫描电镜观察[J]. 植物保护, 2023, 49(1): 271277.
[13]王京枫, 庄宇彤, 罗雨昕, 等. 小花尺蛾触角感器扫描电镜观察[J]. 植物保护, 2022, 48(5): 174182.
[14]CHANG Xuefei, BI Yaluan, CHI Haipeng, et al. Identification and expression analysis of odorant-binding and chemosensory protein genes in virus vector Nephotettix cincticeps [J/OL]. Insects, 2022, 13(11): 1024. DOI: 10.3390/insects13111024.
[15]BRITO N F, MOREIRA M F, MELO A C A. A look inside odorant-binding proteins in insect chemoreception [J]. Journal of Insect Physiology, 2016, 95(6): 5165.
[16]朱宇, 刘洋. 菜粉蝶气味结合蛋白和化学感受蛋白生物信息学分析[J]. 浙江农业学报, 2019, 31(1): 104112.
[17]ANDERSSON M N, GROSSE-WILDE E, KEELING C I, et al. Antennal transcriptome analysis of the chemosensory gene families in the tree killing bark beetles, Ips typographus and Dendroctonus ponderosae (Coleoptera: Curculionidae: Scolytinae) [J/OL]. BMC Genomics, 2013, 14(1): 198. DOI: 8118/10.1186/1471-2164-14-198.
[18]PELOSI P, CALVELLO M, BAN L P, et al. Soluble proteins in insect chemical communication [J]. Cellular and Molecular Life Sciences, 2006, 63(14): 16581676.
[19]杜亚丽, 徐凯, 赵慧婷, 等. 昆虫气味结合蛋白的研究进展[J]. 昆虫学报, 2020, 63(3): 365380.
[20]ZHOU Jingjiang. Odorant-binding proteins in insects [J]. Vitamins and Hormones, 2010, 83: 241272.
[21]李凯旋, 李艳艳, 王树娟, 等. 桃小食心虫成虫期高表达气味结合蛋白基因的克隆与表达谱分析[J]. 昆虫学报, 2022, 65(11): 14261436.
[22]ZHANG Ruibin, WANG Bing, GERARDA G, et al. Molecular basis of alarm pheromone detection in aphids [J]. Current Biology, 2017, 27(1): 5561.
[23]ZHU Jiao, ARENA S, SPINELLI S, et al. Reverse chemical ecology: Olfactory proteins from the giant panda and their interactions with putative pheromones and bamboo volatiles [J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(46): E9802-E9810.
[24]丰国蕊, 魏洪媛, 许鑫, 等. 角倍蚜气味结合蛋白和化学感受蛋白基因的鉴定及表达谱[J]. 昆虫学报, 2023, 66(3): 292302.
[25]王宏民, 张静, 张冲, 等. 绿豆象气味结合蛋白基因的克隆及表达分析[J]. 昆虫学报, 2021, 64(8): 920928.
[26]南彦斌, 张月, 何啟玥, 等. 青海草原毛虫气味结合蛋白基因与生物信息学分析[J]. 草地学报, 2023, 31(3): 688689.
[27]WANG Haizhen, ZHONG Xin, LIN Huafeng, et al. Genetic diversity and population structure of Gynaephora qinghaiensis in Yushu prefecture, Qinghai province based on the mitochondrial COⅠgene [J]. Biochemical Genetics, 2021, 59(6): 117.
[28]严林. 草原毛虫属的分类、地理分布及门源草原毛虫生活史对策的研究[D]. 兰州: 兰州大学, 2006.
[29]包明慧. 青藏高原草原毛虫物种界定及谱系地理学研究[D]. 兰州: 兰州大学, 2023.
[30]YUAN Minglong, ZHANG Qilin, WANG Zhaofeng, et al. Molecular phylogeny of grassland caterpillars (Lepidoptera: Lymantriinae: Gynaephora) endemic to the Qinghai-Tibetan plateau [J/OL]. PLoS ONE, 2015, 10(6): e0127257. DOI: 8118/10.1371/journal.pone.0127257.
[31]王海贞, 刘昕. 玉树州境内草原毛虫种群分布及其对生境草场植被的影响[J]. 环境昆虫学报, 2022, 44(4): 891902.
[32]涂雄兵, 杜桂林, 李春杰, 等. 草地有害生物生物防治研究进展[J]. 中国生物防治学报, 2015, 31(5): 780788.
[33]杨志荣, 伍铁桥, 刘世贵, 等. V.B草原毛虫生物防治剂的应用技术研究[J]. 草地学报, 1995(4): 317323.
[34]LÜ Yanyan, ZHANG Jianguo, CHEN Wei, et al. Mapping of Gynaephora alpherakii inhabitability area in the National Park of Qilian Mountain, China [J/OL]. Agronomy, 2023, 13(2): 594. DOI: 8118/10.3390/agronomy13020594.
[35]YUAN Minglong, ZHANG Qilin, GUO Zhonglong, et al. The complete mitochondrial genome of Gynaephora alpherakii (Lepidoptera: Lymantriidae) [J]. Mitochondrial DNA. Part A, DNA Mapping, Sequencing, and Analysis, 2016, 27(3): 22702271.
[36]ZHANG Qilin, ZHANG Li, ZHAO Tianxuan, et al. Gene sequence variations and expression patterns of mitochondrial genes are associated with the adaptive evolution of two Gynaephora species (Lepidoptera: Lymantriinae) living in different high-elevation environments [J]. Gene, 2017, 610: 148155.
[37]SCHNEIDER D. Insect antennae [J]. Annual Review of Entomology, 1964, 9(1): 103122.
[38]ZACHARUK Y R. Ultrastructure and function of insect chemosensilla [J]. Annual Review of Entomology, 1980, 25(1): 2747.
[39]张棋麟. 两种草原毛虫的比较线粒体基因组学研究[D]. 兰州: 兰州大学, 2014.
[40]张方梅, 刘杨, 李祥瑞, 等. 马铃薯甲虫气味结合蛋白的序列和基因表达谱分析[J]. 昆虫学报, 2019, 62(4): 428441.
[41]田彩红, 黄建荣, 王亚楠, 等. 草地贪夜蛾成虫触角感器的超微结构观察[J]. 植物保护, 2021, 47(5): 216221.
[42]徐伟, 董亚南, 崔娟, 等. 豆卜馍夜蛾触角感器的超微结构与分布[J]. 植物保护, 2019, 45(5): 190196.
[43]赵欣阳, 黄星, 葛思妍, 等. 小菜蛾触角感器的扫描电镜观察[J]. 吉林农业大学学报, 2018, 40(1): 5862.
[44]雷婷, 郭峰, 陈思蓉, 等. 草地贪夜蛾成虫触角感器超微结构观察[J]. 生物安全学报, 2021, 30(3): 183188.
[45]南彦斌, 王克鑫, 潘学能, 等. 青海草原毛虫幼虫感器类型及GqinOBPs表达分析[J]. 草地学报, 2023, 31(12): 36263635.
[46]LONG Ma, LEI Bian, ZHAO Qunli, et al. Ultrastructure ofsqkmR1glR68YVw4J+rMIsg== chemosensilla on antennae and tarsi of Ectropis obliqua (Lepidoptera: Geometridae) [J]. Annals of the Entomological Society of America, 2016, 109(4): 574584.
[47]陈佳宁, 孙媛媛, 任昊杰, 等. 木毒蛾成虫触角感器超微结构观察[J]. 福建农林大学学报, 2023, 52(4): 445449.
[48]LIU Hongxia, LIU Zhixiong, ZHENG Huaxia, et al. Sensilla on the antennae and ovipositor of the carpenterworm, Streltzoviella insularis (Staudinger, 1892) (Lepidoptera, Cossidae) [J]. Oriental Insects, 2018, 52(4): 420433.
[49]杨慧, 严善春, 李杰, 等. 落叶松重要枝梢害虫松瘿小卷蛾触角感器的超微结构[J]. 林业科学, 2008(2): 9398.
[50]张健, 程彬, 周毓麟, 等.鳞翅目昆虫触角感器研究进展[J]. 安徽农业科学, 2017, 45(18): 129132.
[51]KRISHNAN A, PRABHAKAR S, SUDARSAN S, et al. The neural mechanisms of antennal positioning in flying moths [J]. The Journal of Experimental Biology, 2012, 215(17): 30963105.
[52]刘丹, 邓竣丹, 许维康, 等. 美国白蛾触角感器的超微结构[J]. 植物保护学报, 2023, 50(2): 507518.
[53]SEADA A M. Antennal morphology and sensillum distribution of female cotton leaf worm Spodoptera littoralis (Lepidoptera: Noctuidae) [J]. The Journal of Basic and Applied Zoology, 2015, 68: 1018.
[54]RANI A T, SHASHANK P R, MESHRAM N M, et al. Morphological characterization of antennal sensilla of Earias vittella (Fabricius) (Lepidoptera: Nolidae) [J/OL]. Micron, 2021, 140: 102957. DOI: 8118/101016/j.micron2020102957.
[55]席驳鑫, 尚素琴, 胡桂馨, 等.草地白刺粗角叶甲成虫触角感器的超微形态学[J].草业科学, 2023, 40(7): 19201931.
[56]RICHARD B, VANNICE K S, VOSSHALL L B. An essential role for a CD36-related receptor in pheromone detection in Drosophila [J]. Nature, 2007, 450(7167): 289293.
[57]杨海博, 胡镇杰, 李定旭, 等. 悬铃木方翅网蝽触角气味结合蛋白基因鉴定[J]. 昆虫学报, 2018, 61(10): 11211131.
[58]HE Ming, HE Peng. Molecular characterization, expression profiling, and binding properties of odorant binding protein genes in the whitebacked planthopper, Sogatella furcifera [J]. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology, 2014, 174: 18. DOI: 8118/101016/j.cbpb201404008.
[59]HULL J J, PERERA O P, SNODGRASS G L. Cloning and expression profiling of odorant-binding proteins in the tarnished plant bug, Lygus lineolaris [J]. Insect Molecular Biology, 2014, 23(1): 7897.
[60]和东风, 张雪, 黄聪, 等. 苹果蠹蛾气味结合蛋白基因CpomOBP20的克隆及表达分析[J]. 生物安全学报, 2022, 31(1): 1726.
[61]HUA Jinfeng, PAN Chao, HUANG Yongmei, et al. Functional characteristic analysis of three odorant-binding proteins from the sweet potato weevil (Cylas formicarius) in the perception of sex pheromones and host plant volatiles [J]. Pest Management Science, 2020,77(1): 300312.
[62]贾小俭, 高波, 马娟, 等. 甘薯蚁象气味结合蛋白CforOBP8的基因表达谱及配体结合特性分析[J]. 昆虫学报, 2019, 62(3): 275283.
(责任编辑:杨明丽)

