NLRP3蛋白介导乌司他丁减轻肢体缺血再灌注损伤


[摘要] 目的 观察核因子-κB(nuclear factor-κB,NF-κB)/NOD样受体家族3(NOD like receptors family pyrin domain containing 3,NLRP3)通路在乌司他丁(ulinastatin,UTI)预处理肢体缺血再灌注损伤中的作用情况。方法 采用随机数字表法将21只SD大鼠分入对照组、模型组、实验组,每组7只。对实验组采取经尾静脉注射UTI干预,另两组经尾静脉行生理盐水干预,经过10min,于一侧股部切口,借助动脉夹对股动脉行夹闭处理,同时借助橡皮筋在恒定张力下对侧支循环进行环扎阻断处理。3h后去除阻断,并再灌注2h,取大鼠血清测量肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、乳酸脱氢酶(lactate dehydrogenase,LDH)、白细胞介素(interleukin,IL)-6、肌酸激酶(creatine kinase,CK)、IL-18;取部分腓肠肌–80℃冻存,PCR、Western blot法检测NF-κB/NLRP3。另取一部分腓肠肌存储于多聚甲醛内,借助光镜查看骨骼肌形态,切取小部分腓肠肌测定湿干比。结果与对照组比较,模型组湿干比、LDH、CK、IL-6、IL-18、TNF-α、NF-κB、NLRP3明显升高,差异有统计学意义(<0.05);与模型组比较,实验组湿干比、LDH、CK、IL-6、IL-18、TNF-α、NF-κB、NLRP3明显降低,差异有统计学意义(<0.05)。结论UTI可通过NF-κB/NLRP3通路降低细胞炎症反应,从而实现对大鼠肢体缺血再灌注损伤的保护作用。
[关键词] 缺血/再灌注损伤;炎症反应;NF-κB/NLRP3通路;乌司他丁
[中图分类号] R982 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.26.017
Ulinastatin reduces ischemia-reperfusion injury mediated by NLRP3 in skeletal muscle
Department of Anesthesiology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, Zhejiang, China
[Abstract] Objective To investigate the role of nuclear factor-κB(NF-κB)/NOD like receptors family pyrin domain containing 3(NLRP3)pathway in limb ischemia-reperfusioninjury(IRI)pretreated with ulinastatin(UTI). MethodsTwenty-one SD ratswere randomly divided into Sham group, IRI group, UTI group. In UTI group, ulinastatin was injected after anesthesia. After 10 minutes, the animal model was established by claming the femoral artery and ligaturing collateral circulation. After 3h of ischemia, the clamp and tourniquet were removed and the rats underwent 2h of reperfusion. In the other groups, the homologous saline was also injected in the same time. Plasma concentrations of lactate dehydrogenase(LDH) and creatine kinase(CK), interleukin(IL)-6,IL-18, tumor necrosis factor-α(TNF-α) were measured. The gastrocnemius muscle was harvested and immediately stored at –80℃. NF-κB and NLRP3 were detected by Western blot and PCR. The other section muscle was stored in triformol for HE staining. The wet/dry was also immediately detecting. ResultsThe level ofwet/dry, LDH, CK, IL-6, IL-18, TNF-α, NF-κB, NLRP3 IRIwere higherthan those in Sham group(<0.05). The level of wet/dry, LDH, CK, IL-6, IL-18, TNF-α, NF-κB, NLRP3 IRIwere significantly lowerthan those in IRIgroup(<0.05). ConclusionUlinastatin can reduce the cellular inflammatory response through the NF-κB /NLRP3 pathway, thereby achieving a protective effect on limb IRIin rats.
[Key words]Ischemia-reperfusion injury; Inflammatory response; NF-κB/NLRP3pathway; Ulinastatin
肢体缺血再灌注损伤(ischemia-reperfusion injury,IRI)即肢体在一段时间内供血明显减少时没有出现严重损伤,反而在供血好转时肢体出现严重损伤的病理生理现象。诸多因素可引发肢体IRI,包括远端血管重建术、膝关节置换术、肢体骨折内固定术、止血带应用时间过长等[1]。关于肢体IRI的研究多涉及炎症、氧化应激和凋亡等,但在围术期预防及早期干预缺乏有效手段,且具体机制尚未明晰。探讨有效途径防范并减轻肢体IRI极具价值。
乌司他丁(ulinastatin,UTI)为丝氨酸蛋白酶抑制剂(serine protease inhibitor,SPI),属于蛋白酶家族,在蛋白合成与降解中发挥重要作用,对肿瘤与炎症起到一定抑制作用,可防止器官发生IRI[2]。近年来,对UTI与IRI间的联系已有许多深入研究,现已明确其可有效保护脑、心脏等器官的IRI[3-4]。UTI通过抑制炎性活动、抗血液凝固、抗氧化应激、调节酶活性、抗凋亡等机制实现对疾病的有效防治[5]。NOD样受体家族3(NOD like receptors family pyrin domain containing 3,NLRP3)在炎症反应中是一个潜在的治疗靶点,通过抑制NLRP3炎症小体激活可减轻炎症反应,保护器官功能,改善预后[6]。在临床上,UTI多用于治疗器官衰竭、急性胰腺炎、败血性休克等疾病[7-8]。本研究探讨UTI对大鼠肢体IRI的作用,并分析其是否通过NLRP3蛋白发挥作用,阐明其在大鼠肢体IRI中的安全有效性。
1材料与方法
1.1实验动物
21只雄性、成年SD大鼠,于SPF级环境下饲养,体质量280~320g,由温州医科大学实验动物中心提供[动物伦理编号:WYYY-AEC-2024-135,实验动物许可证号:SYXK(浙)2021-0017]。采用随机数字表法将实验动物分为对照组、模型组、实验组(UTI的用量为10000U/kg),每组7只。实验组建模前10min尾静脉注射UTI,另两组实验动物同法注入生理盐水。麻醉采取腹腔注射25%乌拉坦(5ml/kg),通过观察睫毛反射、刺激下肢确定麻醉状态,然后右下肢腹股沟区域切开,分离股动脉、股静脉并使用动脉夹夹闭,同时借助橡皮筋在恒定张力下对该侧肢体进行环扎,对照组只进行手术操作而未行夹闭。待肢体不再呈红润状态转为暗紫色时,说明缺血成功,缺血3h,恢复血供2h,然后收集骨骼肌、血清,用于后续测定。
1.2主要试剂及仪器
UTI(批准文号:国药准字H20040505,生产单位:广东天普生化医药公司,规格:1ml:5万U);HRP标记的山羊抗小鼠二抗IgG(英国Abcam公司);内参β-actin(美国Bioworld Technology公司);NLRP3单抗、核因子-κB(nuclear factor-κB,NF-κB) p65单抗(英国Abcam公司);PCR引物(上海捷瑞公司);IL-18、白细胞介素(interleukin,IL)-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),ELISA试剂盒(上海西塘公司);乳酸脱氢酶(Lactate dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)试剂盒(南京建成研究所);酶标仪、低温离心机(美国Thermo公司);显微镜(日本Olympus公司);垂直电泳系统(美国BIO-RAD公司);PCR仪(日本Bioer公司);蛋白核酸分析仪(英国Thermo fisher公司)。
1.3 检测方法
腓肠肌湿/干重(wet/dry,W/D)比值测定借助恒温干燥箱(55℃)可获得组织干重,W/D比值可反映组织水肿程度。将腓肠肌移入10%聚甲醛内固定1d,行常规脱水处理,然后依次进行透明、石蜡包埋与切片处理,再经苏木精-伊红(HE)染色,最后光镜下观察骨骼肌形态。
将大鼠血浆先于37℃下进行5min水浴处理,然后离心处理(4℃、3000转/min),采集上清。逐一把抗大鼠TNF-α、IL-18、IL-6单抗包被于酶标板上,并分别结合样品,再添加氧化抗大鼠TNF-α、IL-18、IL-6,完成免疫复合物制备,再完成与板的连接处理,把底物工作液放入其中,显示蓝色,添加硫酸终止液,450nm处测定值,此值和TNF-α、IL-18、IL-6浓度存在正向联系,基于标准曲线明确标本内各自的浓度值。
完成蛋白提取处理后,测定所提取蛋白浓度。在室温环境下,蛋白用10%SDS-PAGE进行电泳,NF-κB和NLRP3向PVDF膜湿转,结束后用5%脱脂奶粉封闭2h,用TBST进行3遍洗膜处理,10min/遍,随后将NLRP3(1:1500)、NF-κB(1:2000)、β-actin(1:500)一抗放入,4℃下进行一整夜孵育,TBST进行3遍洗膜处理,10min/遍,放入标志物为生物素二抗,于室温下孵育60min,TBST洗膜3遍,10min/遍。先充分混合增强化学发光,再将条带覆盖住,借助凝胶成像系统完成图像采集工作,再对各目标条带通过软件Image J逐一测定值。
提取RNA,同时测定浓度,对所得cDNA进行扩增处理,得到基因片段,于100V稳定电压下进行半小时电泳处理,再通过凝胶成像系统开展摄像分析,借助Image J计算电泳条带灰度值。大鼠NF-κB引物正向:5’-TTCAACATGGCAGACGA CGA-3’,反向5’-AGGTATGGGCCATCTGTTGAC-3’;NLRP3引物正向:5’-TGATGAGTGTTC GCT GCAAG-3’,反向:5’-GGATCGGAACACAGCC TTTC-3’;内参β-actin引物正向:5’-ACCGTGAAAAGATGACCCAGAT-3’,反向:5’-GCCAGGATAGAGCCACCAAT-3’。
1.4统计学方法
采用SPSS20.0统计学软件对数据进行处理分析,计量资料以均数±标准差(x±s)表示,采用one-way ANOVA检验,两两对比时,对方差齐性数据选择LSD法,对方差不齐性数据选择Dunnet’检验。<0.05为差异有统计学意义。
2结果
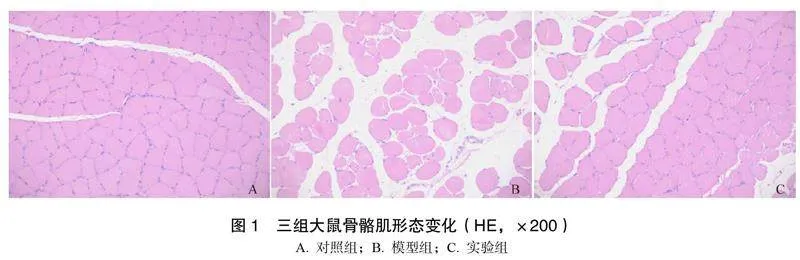
2.1三组大鼠腓肠肌形态变化
对照组分布着规则的多边形肌纤维,细胞未发
生肿胀,间质呈正常结构,血管周边无明显炎症细胞。模型组肌纤维缺乏规则性,且染色深度大幅下降,细胞明显肿胀,血管附近可观察到较多炎性细胞。实验组细胞染色深度稍显减小、界限显得模糊,可观察到血管附近有少量炎症细胞,但与模型组比较有较大改善,见图1。
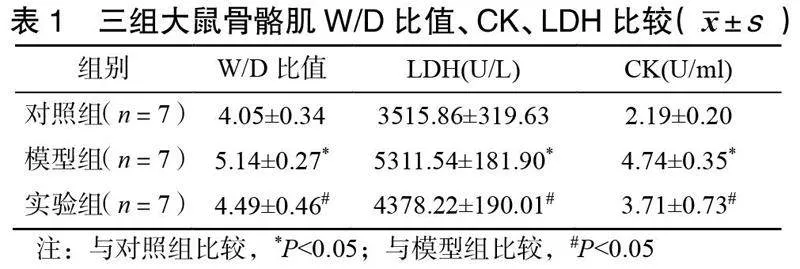
2.2三组大鼠骨骼肌W/D比值与CK、LDH比较
对照组W/D比值偏小,与对照组比较,模型组W/D比值增大,差异有统计学意义(<0.05);与模型组比较,实验组W/D比值减小,差异有统计学意义(<0.05)。与对照组比较,模型组CK、LDH含量增加,差异有统计学意义(<0.05);与模型组比较,实验组CK、LDH含量减少,差异有统计学意义(<0.05)见表1。
2.3三组大鼠血清IL-6、IL-18、TNF-α水平比较
与对照组比较,模型组IL-6、IL-18及TNF-α水平升高,差异有统计学意义(<0.05)。与模型组比较,实验组IL-6、IL-18及TNF-α水平降低,差异有统计学意义(<0.05),见表2。
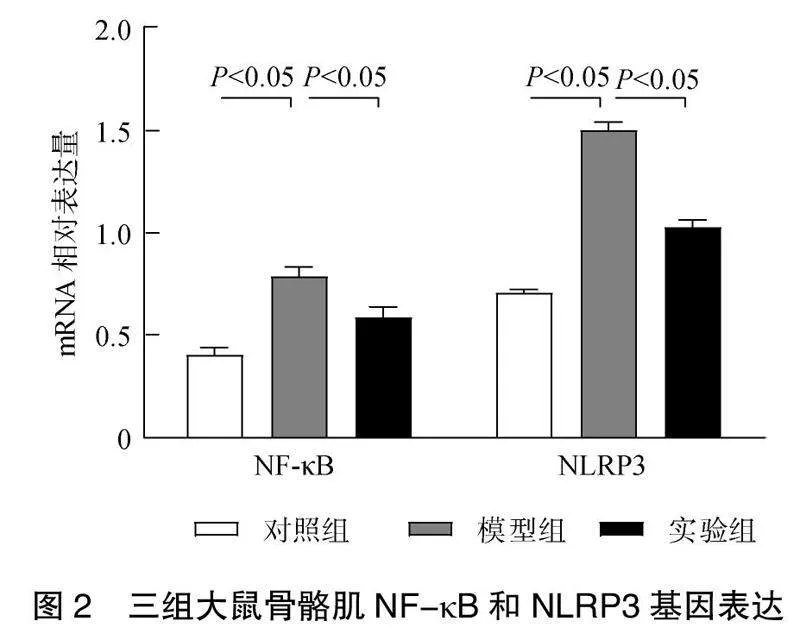
2.4 骨骼肌NF-κB和NLRP3基因表达比较
与对照组比较,模型组骨骼肌NF-κB、NLRP3表达上调(<0.05);与模型组比较,实验组骨骼肌NF-κB、NLRP3表达下调,差异有统计学意义(<0.05)。见图2。
2.5 骨骼肌NF-κB和NLRP3蛋白表达
与对照组比较,模型组骨骼肌NLRP3和NF-κB蛋白值与内参值占比增大,差异有统计学意义(<0.05)。与模型组比较,实验组骨骼肌NLRP3和NF-κB蛋白值与内参值占比减小,差异有统计学意义(<0.05),见图3。
3讨论
IRI带来的伤害不仅只有肢体,其他重要器官也会受累。活性氧学说与炎症介质学说表明,在炎症出现时,会释放一些炎性介质,绝大部分是细胞因子、激活补体与趋化因子[9-10]。TNF-α不仅具有促炎效能,还可诱发炎性活动和免疫应答,使淋巴细胞、中性粒细胞活化,有助于合成黏附分子、IL-6、IL-1等炎性因子,增加组织受损程度[11]。研究表明肢体缺血再灌注后血中IL-1、IL-6、TNF-α等炎症因子水平上调[12-13]。研究表明,下肢IRI后血中TNF-α水平在再灌注1h后达到高峰,IL-6水平与再灌注时长呈正相关[14]。本研究中肢体发生IRI时,骨骼肌细胞中释放出大量CK、LDH、IL-6、IL-18、TNF-α,经UTI干预后,各指标明显好转。既往研究表明,IRI发生后,不仅细胞层面变化明显,在组织层面也可观察到骨骼肌肌纤维排列混乱、无规则,在肌纤维周围出现炎性细胞及红细胞,组织W/D比值明显升高[15]。本研究实验光镜下,肌纤维在每组表现不同,经UTI处理后,肌纤维破坏有所减轻。
研究表明NF-κB/NLRP3通路在各器官IRI所致的炎性活动中普遍存在,NF-κB属于NF-κB/Rel家族,且起着关键性作用。在炎性活动网格中,NF-κB激活发挥核心作用,激活态NF-κB向胞核中转移,增强促炎因子的转录活动[16]。细胞焦亡是与炎症相关的一类程序性细胞坏死,待其遭受攻击后,激活NLRP3炎症小体,促进相关因子IL-1β和IL-18的释放[17-18]。细胞焦亡作为缺血再灌注进展的原因之一,被认为是最常见的炎症细胞死亡途径,其激活方式可分为经典途径和非经典途径[19]。经典途径中NLRP3是NF-κB的下游通路分子,若其为活化状态,凋亡相关斑点样蛋白释放自身效能,通过其N端效应结构联合未成熟caspase-1前体产生复合物,使得caspase-1前体呈活化状态,再经由切割效应,使IL-1β、IL-18前体向成熟状态发展,细胞的胞外水分进而发生内流,胞膜随之失去完整性,其内部炎症因子被释放,造成IRI[3]。细胞焦亡的发生依靠NLRP3的激活,并通过正反馈调节IL-1β、IL-18等细胞因子的释放,这些因子可加重炎症反应,造成IRI。因此NF-κB/NLRP3相互关联相互作用加重炎症反应。
研究表明,在肢体缺血再灌注引起的肺损伤中,靶向下调NLRP3含量,可减慢IRI进展,肺功能受到保护[20]。UTI作为SPI蛋白酶家族的主要成员,与蛋白合成、降解活动存在主要联系,同时和炎症、肿瘤受抑制有关,具有保护器官IRI能力,且被证实可有效抵抗急、慢性炎症,其机制在于抑制NF-κB途径,下调NF-κB/NLRP3通路中相关蛋白表达,进而减轻炎症[16]。本研究中,与对照组比较,模型组NF-κB/NLRP3蛋白明显升高,经UTI干预后相关蛋白大幅下调。与对照组比较,模型组各指标均上调。可见在机体处在缺血再灌注环境时,可释放众多炎症相关因子,给予UTI干预,各项指标均下调。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] MAS E, BARDEN A E, CORCORAN T B, et al. Effects of spinal or general anesthesia on F(2)-isoprostanes and isofurans during ischemia/reperfusion of the leg in patients undergoing knee replacement surgery[J]. Free Radic Biol Med, 2011, 50(9): 1171–1176.
[2] ZHAO Y M, CAI H B, ZHOU P G, et al. Protective effect of ulinastatin on hepatic ischemia reperfusion injury through autophagy activation in Chang liver cells[J]. J Cell Biochem, 2019, 120(9): 14960–14970.
[3] QIU J J, XIAO X G, GAO X, et al.Ulinastatin protects against sepsis-induced myocardial injury by inhibiting NLRP3 inflammasome activation[J]. Mol Med Rep, 2021, 24(4): 730.
[4] LIU T, LIAO X Z, ZHOU M T. Ulinastatin alleviates traumatic brain injury by reducing endothelin-1[J]. Transl Neurosci, 2021, 12(1): 1–8.
bCcAcoW2iGGhBGTn98ATUg==[5] ATAL S S, ATAL S. Ulinastatin-A newer potential therapeutic option for multiple organ dysfunction syndrome[J]. J Basic Clin Physiol Pharmacol, 2016, 27(2): 91–99.
[6] HE W F, DONG H Y, WU C F, et al. The role of NLRP3 inflammasome in sepsis: A potential therapeutic target[J]. Int Immunopharmacol, 2023, 115: 109697.
[7] LIU S Y, XU J F, GAO Y Z, et al. Multi-organ protection of ulinastatin in traumatic cardiac arrest model[J]. World J Emerg Surg, 2018, 13: 51.
[8] LI S Y, YANG W X, ZHOU L L, et al. Vascular permeability and hemodynamic effects of ulinastatin on organs affected by shock during early burn injury[J]. Am J Emerg Med, 2019, 37(2): 249–253.
[9] BUFFIN-MEYER B, CRASSOUS P A, DELAGE C, et al.EGF receptor transactivation and PI3-kinase mediate stimulation of ERK by α2aadrenoreceptor in intestinal epithelial cells: A role in wound healing[J]. Eur J Pharmacol, 2007, 574(2-3): 85–93.
[10] KARKOULIAS G, MASTROGIANNI O, LYMPERO- POULOS A, et al. α2-Adrenergic receptors activate MAPK and Akt through a pathway involving arachidonic acid metabolism by cytochrome P450-dependent epoxygenase, matrix metalloproteinase activation and subtype-specific transactivation of EGFR[J]. Cell Signal, 2006, 18(5): 729–739.
[11] AMANTEA D, TASSORELLI C, PETRELLI F, et al. Understanding the multifaceted role of inflammatory mediators in ischemic stroke[J]. Curr Med Chem, 2014, 21(18): 2098–2117.
[12] LI Y J, ZENG M T, CHEN W Q, et al. Dexmedetomidine reduces isoflurane-induced neuroapoptosis partly by preserving PI3K/Akt pathway in the hippocampus of neonatal rats[J]. PLoS One, 2014, 9(4): e93639.
[13] CAI Y, XU H, YAN J, et al. Molecular targets and mechanism of action of dexmedetomidine in treatment of ischemia/reperfusion injury[J]. Mol Med Rep, 2014, 9(5): 1542–1550.
[14] O'NEILL S, ROSS J A, WIJMORE S J, et al. The role of heat shock protein 90 in modulating ischemia-reperfusion injury in the kidney[J]. Exp Opin Investig Drugs, 2012, 21(10): 1535–1548.
[15] 袁培根, 陈顺利, 单鸳露, 等. 艾司氯胺酮减轻大鼠骨骼肌缺血再灌注损伤[J]. 基础医学与临床, 2023, 43(12): 1822–1826.
[16] GUO R, GAO S, FENG Y, et al. Ulinastatin attenuates spinal cord injury by targeting AMPK/NLRP3 signaling pathway[J]. J Chem Neuroanat, 2022, 125: 102145.
[17] BAROJZ‑MAZO A, MARTIN‑SANCHEZ F, GOMEZ A I, et al. The NLRP3 inflammasome is released as a particulate danger signal that amplifies the inflammatory response[J]. Nat Immunol, 2014, 15(8): 738–748.
[18] FRANKLIN B S, BOSSALLER L, NARDO D D. The adaptor aSc has extracellular and ‘prionoid’ activities that propagate inflammation[J]. Nat Immunol, 2014, 15(8): 727–737.
[19] XIA W, LI Y, WU M Y, et al. Gasdermin E deficiency attenuates acute kidney injury by inhibiting pyroptosis and inflammation[J]. Cell Death Dis,2021, 12(2): 139.
[20] YU L, LUO Q, FANG H. Mechanism of ulinastatin protection against lung injury caused by lower limb ischemia-reperfusion[J]. Panminerva Med,2014, 56(1): 49–55.
(收稿日期:2024–06–01)
(修回日期:2024–07–16)

