藜麦抗性淀粉的制备及性质研究



摘 要:采用微波法制备藜麦抗性淀粉,并比较藜麦淀粉与抗性淀粉的理化性质。结果显示:微波法制备的藜麦抗性淀粉与藜麦淀粉相比,结构发生改变,拥有更多的双螺旋结构;藜麦淀粉与抗性淀粉的溶解度都随温度的升高而增大,两者的膨胀度也随温度的升高快速增大,但抗性淀粉膨胀度的增大趋势较为平缓。凝沉稳定性实验说明抗性淀粉晶体结构更为稳定,抗性淀粉的透明度高于藜麦淀粉。这表明藜麦抗性淀粉具有更好的理化性质。
关键词:藜麦抗性淀粉;理化性质;制备过程
中图分类号:TS231 文献标志码:B 文章编号:2095–3305(2024)08–00-03
近年来,随着社会经济的发展和生活质量的提高,人们的饮食习惯和结构发生了显著变化,这也促使了“三高”(高血压、高血脂、高血糖)、糖尿病等疾病发病率逐年攀升[1]。作为食品工业中的核心原料之一,淀粉在人体内被消化、分解为葡萄糖后,被迅速吸收,这一特性常导致餐后血糖急剧上升,进而可能诱发肥胖、高血糖等慢性健康问题。然而,淀粉在提高食品加工性能、优化食品口感和质构方面发挥着不可替代的作用。鉴于此,对淀粉进行改性处理,减缓其消化吸收速度,成为当前研究的重点。1982年,Englyst等[2]发现了包埋在不溶性膳食纤维中的淀粉成分,因其具有良好的抗酶解性能,故将其命名为抗性淀粉(Resistant Starch,RS)。抗性淀粉是改性淀粉的一种,能够降低人体胰岛素分泌,减少热量产生及脂肪的形成,对人类健康具有重要意义。
藜麦是原产自印第安地区的一种苋科藜亚科藜属一年生双子叶植物,籽粒呈扁圆形,颜色以红色、黑色、白色和灰色为主。淀粉是藜麦的主要组成成分,占藜麦干物质总量的50%以上[3]。当前,我国对藜麦的研究主要集中在营养成分和初级加工阶段,缺少对藜麦深加工的探索。研究藜麦抗性淀粉的制备方法及其理化性质,获得功能与性质较好的抗性淀粉产品,对拓宽藜麦淀粉深加工途径,提升藜麦淀粉价值具有积极的意义。因此,试验主要采用微波法制备藜麦抗性淀粉,并对其理化性质进行测定,旨在为藜麦的利用提供一定的参考。
1 材料与方法
1.1 材料和试剂
白藜麦,产于青海;耐高温α-淀粉酶,阿拉丁公司;葡萄糖淀粉酶,食品级;其他试剂均为国产分析纯。
1.2 主要仪器和设备
欧普T6新世纪型紫外可见分光光度计;科恒101型电热鼓风干燥箱;梅特勒MS 105型电子分析天平;蔡司Sigma 300型扫描电子显微镜等。
1.3 微波法制备藜麦抗性淀粉
1.3.1 藜麦淀粉的制备
取一定量的藜麦烘干,粉碎后过80目筛,按照1∶10(g/mL)的固液比添加0.25%氢氧化钠溶液,置于磁力搅拌器上,53 ℃浸泡搅拌6 h,4 000 rpm离心
15 min,弃去上清液,数次洗涤至呈中性,用双缩脲试剂测试无蛋白质后,过200目滤布,经50 ℃烘箱干燥后粉碎过60目筛,石油醚回流12 h脱脂,干燥密封
储存[4]。
1.3.2 藜麦抗性淀粉的制备
取一定质量的藜麦淀粉置于离心管中,加入蒸馏水配制成10%的淀粉乳,充分搅拌后于560 W功率微波3 min。微波后将淀粉糊冷却至室温,4 ℃冷藏12 h回生。取出后放入干燥箱50 ℃烘干,将其粉碎并过80目筛,得到粗制藜麦抗性淀粉。取粗制抗性淀粉加入蒸馏水,依次使用过量耐高温α-淀粉酶、过量葡萄糖淀粉酶充分酶解。酶解后,离心保留沉淀,用蒸馏水洗涤2次后得到纯化藜麦抗性淀粉[5]。
1.4 藜麦抗性淀粉结构及性质研究
1.4.1 淀粉颗粒形态观察
淀粉样品经镀金处理后通过蔡司Sigma 300型扫描电子显微镜测定微观形貌,测试电压为3.0 kV,放大倍数为1 500倍。
1.4.2 溶解度测定
精确称量两种淀粉样品并添加蒸馏水制备成1%淀粉悬浮液。在不同温度下对悬浮液加热40 min,此期间每5 min使用涡旋振荡仪进行混合。离心后将上层清液倾倒入预先恒重的称量瓶中,并于105 ℃烘干至恒重。此时,称量的质量即为被溶解的淀粉质量,根据称量结果计算出淀粉的溶解度[6]。
1.4.3 膨胀度测定
精确称取两种淀粉样品,并添加蒸馏水制备成1%淀粉悬浮液。在设定的温度梯度(55、65、75、85、95 ℃)
中对悬浮液加热40 min,此期间每5 min使用涡旋振荡仪混合悬浮液。之后,在3 000 r/min下离心30 min,称取离心后的沉淀物质量,这即为膨胀淀粉的质量。根据称量结果计算出淀粉的膨胀度。
1.4.4 凝沉稳定性测定
为测定淀粉的凝沉稳定性,首先精确称量了两种淀粉样品,并将它们分别与蒸馏水混合,制备成浓度为1%的淀粉乳。随后,在沸水浴中将1%的淀粉乳搅拌糊化30 min,冷却至室温,并移至带有塞子的试管中均匀摇晃。之后,试管放置在室温下静置,并且每隔1 h记录上清液的体积变化。以时间为横坐标,上清液体积占总体积的百分比为纵坐标,绘制凝沉稳定性的变化曲线。
1.4.5 透明度测定
为了对淀粉的透明度进行评估,称取一定量的淀粉,并与蒸馏水混合制成1%的淀粉乳。然后,在沸水浴中将淀粉乳加热20 min以确保充分糊化。在此过程中,不断加入蒸馏水以保持原有体积的稳定。糊化完成后,样品冷却至室温,并以蒸馏水作为参照,使用分光光度计在620 nm的波长下测量淀粉糊的透光率。这个透光率值即代表了淀粉的透明度。
2 结果与分析
2.1 淀粉颗粒形态观察
采用扫描电镜观察藜麦淀粉与微波法制备的藜麦抗性淀粉的形态。由图1a可以看出,藜麦原淀粉呈较小的多边形颗粒状,颗粒聚集紧密;图1b结果表明,藜麦抗性淀粉的结构已经完全被破坏,原有的形态消失,失去了独立性和完整性,形成整体较为光滑的片状结构。这可能是因为用微波法制备藜麦抗性淀粉的过程中,微波能快速作用于藜麦淀粉,且作用时间较短,直链淀粉无法完全从颗粒中溢出,并且微波会导致热量集中于分子而不易散去,发生过度降解,从而减少了游离的适宜长度的直链淀粉形成双螺旋
结构[7]。
图1 藜麦淀粉(a)、藜麦抗性淀粉(b)扫描电镜照片
2.2 溶解度测定
溶解度是在一定温度下已溶解的淀粉样品的质量分数,指直链淀粉分子从有序态,扩散至溶液中转变为无序态的过程,能够反映结晶结构和无定形结构含量比率[8]。溶解度的测定结果如图2所示,藜麦淀粉与藜麦抗性淀粉的溶解度均呈现出随温度升高而增大的趋势,这一现象表明,在加热过程中,淀粉的晶体分子结构遭受破坏,导致水分子能够通过氢键作用与直链淀粉及支链淀粉的羟基发生结合,此变化增强了淀粉与水分子的结合能力,促使其溶解度得到增大。在所有温度下抗性淀粉溶解度均高于淀粉,可能是因为抗性淀粉的晶体结构在加热过程中被瓦解,导致直链淀粉解离扩散至水中,这也说明抗性淀粉无定型区的含量更高。
图2 溶解度测定
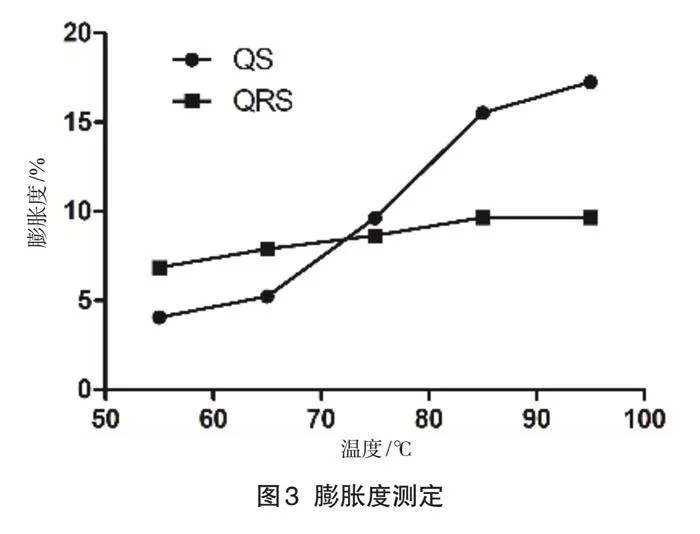
2.3 膨胀度测定
膨胀度是指每克干淀粉在一定温度下吸收水分的质量,体现了无定型区和结晶区淀粉链的结合程度[9]。膨胀度的结果如图3所示,藜麦淀粉的膨胀度随温度升高而快速增大,而抗性淀粉的膨胀度上升趋势较为平缓,但随着温度升高,膨胀度也持续增大。抗性淀粉展现出较低的膨胀度并保持相对稳定性,这一现象归因于淀粉颗粒的膨胀主要发生在移动的无定形区域,抗性淀粉所吸收的能量不足以使该无定形区域迅速糊化,并且在微波处理过程中,抗性淀粉的分子链会重组,形成更多的双螺旋结构,这些紧密的双螺旋结构进一步限制淀粉的膨胀能力。
2.4 凝沉稳定性测定
淀粉的凝沉现象是与糊化相对应的过程,描述的是已经糊化的淀粉分子由混乱状态重新排列成有序状态,并出现凝结沉降的现象。这种凝沉性质被视为评估淀粉老化特性的关键指标。具体来说,淀粉经过加热糊化后,在冷却过程中,其分子的热运动会逐渐减弱,这致使淀粉分子链趋向于有序排列,尤其是平行排列,从而触发凝沉现象。同时,凝沉性的强弱也可以反映淀粉与水结合能力的强弱[10]。凝沉稳定性结果如图4所示,由于抗性淀粉属于老化淀粉,糊化过程对其淀粉颗粒不会产生影响,因此置于室温后未糊化的淀粉颗粒均迅速沉降随后趋于平稳。与藜麦淀粉相比,藜麦抗性淀粉经过重结晶,形成了稳定的晶体结构。
图3 膨胀度测定
图4 凝沉稳定性测定
2.5 透明度测定
透明度这一概念,可以通过测量光线穿透特定浓度的淀粉糊时的透光率来量化。因此,透光率可以作为透明度的衡量指标,较高的透光率即意味着淀粉糊的透明度更优。透明度受多个核心要素影响,如淀粉颗粒的尺寸、膨胀程度,以及直链淀粉与支链淀粉之间的比率等。此外,在淀粉糊化过程中,未充分膨胀的残余颗粒和未完全破裂的淀粉颗粒数量,同样对透明度有显著影响。试验结果显示,藜麦淀粉的透光度为5.8%,相比之下,抗性淀粉的透光度高达58.9%,显示出抗性淀粉具有更高的透明度。这一差异产生的原因在于抗性淀粉是一种老化淀粉,在加热温度低于
100 ℃时,不会发生糊化。通过分析凝沉稳定性曲线可以发现,一旦淀粉发生糊化并处于室温条件下,抗性淀粉颗粒会迅速沉降,这导致溶液中淀粉颗粒的数量显著减少,从而使溶液呈现出较高的透明度;相反,藜麦淀粉的沉降速度较慢,糊化后大量的淀粉颗粒仍然悬浮于淀粉溶液中,因此其透明度相对较低。
3 结束语
淀粉的理化性质和功能主要取决于淀粉的颗粒特性和分子特性,研究了微波法处理对藜麦淀粉和藜麦抗性淀粉的颗粒形貌、溶解度、膨胀度、凝沉稳定性和透光率的影响,并利用扫描电子显微镜对藜麦淀粉、藜麦抗性淀粉的颗粒大小、形态进行研究。结果表明,藜麦淀粉呈不规则的多边形,淀粉颗粒聚集紧密,而藜麦抗性淀粉的结构已经完全被破坏,原有的形态消失,整体形成较为光滑的片状结构,拥有更多的双螺旋结构。藜麦抗性淀粉溶解度高于藜麦淀粉,膨胀度低于藜麦淀粉,两者的溶解度均随温度升高而增大,膨胀度也随温度升高而快速增大。但抗性淀粉膨胀度的增大趋势较为平缓,这表明抗性淀粉已形成较为稳定的晶体结构,不易被糊化。凝沉稳定性结果表明糊化过程对藜麦抗性淀粉的颗粒不会产生影响,未糊化的淀粉颗粒能够迅速沉降随后趋于平稳,与藜麦淀粉相比,其具有更稳定的晶体结构。透明度测定结果表明,藜麦抗性淀粉颗粒迅速沉降,透明度高于藜麦淀粉。在此基础上,可以进一步研究藜麦抗性淀粉的功能,探究藜麦抗性淀粉功能与结构的关系,为藜麦抗性淀粉的加工与利用提供一定理论依据。
参考文献
[1] 刘佳,曾英男,李瑞,等.抗性淀粉的制备研究进展[J].粮食问题研究,2020(5):47-50.
[2] Englyst H, Wiggins H S, Cummings J H. Determination of the non-starch polysaccharides in plant foods by gas-liquid chromatography of constituent sugars as alditol acetates [J]. Analyst, 1982, 107(1272): 307-318.
[3] 汪晓璇,张妤,钱澄,等.藜麦的营养及其淀粉特性的研究进展[J].粮油食品科技,2021,29(4):12-19.
[4] 丁瑞瑞,罗阳,陈欢,等.藜麦淀粉提取工艺优化及性质表征[J].林农业大学学报,2022,44(1):117-126.
[5] 吴小婷.不同方法制备的莲子抗性淀粉性质及其体外益生元作用的研究[D].福州:福建农林大学,2015.
[6] 汪颖.莲子抗性淀粉制备、性质及其对双歧杆菌增殖效应的研究[D].福州:福建农林大学,2013.
[7] 杨光,杨波,丁霄霖.微波辐射对抗性淀粉形成的影响[J].食品科学,2008(10):118-120.
[8] 邵秀芝,肖永霞.小麦抗性淀粉物理性质研究[J].粮食与油脂,2009(9):11-13.
[9] 夏强.基于高静压技术调控全谷物糙米理化品质特性的研究[D].上海:上海交通大学,2018.
[10] Singh N, Inouchi N, Nishinari K. Structural, thermal and viscoelastic characteristics of starches separated from normal, sugary and waxy maize[J]. Food Hydrocolloids, 2006, 20(6): 923-935.

