聚乙二醇对盐碱胁迫下花楸胚胎萌发及幼苗生理指标的影响






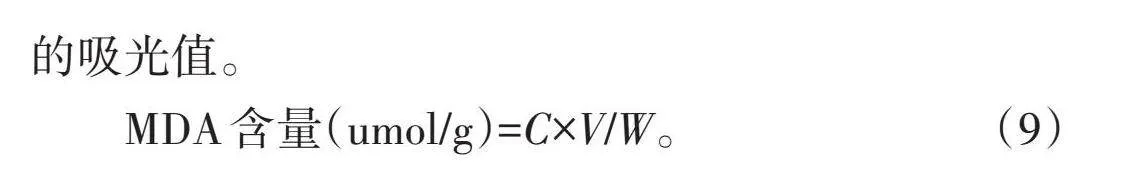




摘 要:采用室内培养皿发芽法,研究外源添加聚乙二醇、碳酸钠、碳酸氢钠对花楸胚胎萌发及幼苗生理指标的影响。结果表明,聚乙二醇处理花楸胚胎后使萌发率提高15%~25%,碳酸钠、碳酸氢钠处理使花楸胚胎的萌发率分别降低了88%和85%。聚乙二醇可缓解盐碱胁迫对花楸胚胎萌发的抑制,使胁迫下胚胎的萌发率提高1~2倍。聚乙二醇可提高盐碱胁迫下花楸胚胎中抗氧化酶活性,使胁迫下胚胎中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶活性(CAT)分别提高16.45%、75%、80%。聚乙二醇使胁迫下胚胎中的丙二醛(MDA)含量降低41.44%。研究显示,聚乙二醇能够有效缓解盐碱胁迫对花楸胚胎的抑制作用,并提高花楸胚胎中的抗氧化酶活性,增强花楸的抗逆性,为建立PEG引发促进花楸胚胎萌发技术提供科学依据。
关键词:花楸; 胚胎萌发; 聚乙二醇; 引发; 盐碱胁迫
中图分类号:S722.1;S722.8 文献标识码:A DOI:10.7525/j.issn.1006-8023.2024.04.003
Effects of Polyethylene Glycol on Embryo Germination and Physiological Indicators of Sorbus pohuashanensis Empryos under Saline Alkali Stress
WANG Xiaodong, ZHAO Caihong, WANG Ruirui, ZHANG Yue, YANG Ling*
(State Key Laboratory of Tree Genetics and Breeding (College of Forestry, Northeast Forestry University), Harbin 150040, China)
Abstract: This experiment used an indoor culture dish germination method to study the effects of exogenous addition of polyethylene glycol, sodium carbonate, and sodium bicarbonate on the embryos germination and physiological indicators of S. pohuashanensis seedlings. The results showed that polyethylene glycol treatment increased the germination percentage of S. pohuashanensis embryos by 15% to 25%, while sodium carbonate and sodium bicarbonate treatment reduced the germination percentage of S. pohuashanensis embryos by 88% and 85%, respectively. Polyethylene glycol can alleviate the inhibition of saline alkali stress on the germination of S. pohuashanensis embryos, and increase the germination rate of embryos under stress by 1-2 times. Polyethylene glycol can increase the activity of antioxidant enzymes in the embryos of S. pohuashanensis under saline alkali stress, resulting in an increase of 16.45%, 75%, and 80% in enzyme activities such as SOD, POD, and CAT, respectively. Polyethylene glycol reduced MDA in embryos under stress by 41.44%. Research has shown that polyethylene glycol can effectively alleviate the inhibitory effect of salt alkali stress on the embryos of S. pohuashanensis, improve the activity of antioxidant enzymes in S. pohuashanensis embryos, enhance the stress resistance of S. pohuashanensis, and provide scientific basis for establishing PEG priming technology to promote the germination of S. pohuashanensis embryos.
Keywords: Sorbus pohuashanensis; embryo germination; polyethylene glycol; priming; salt-alkali stress
0 引言
花楸(Sorbus pohuashanensis)又名百花山花楸,为蔷薇科(Rosaceae)花楸属(Sorbus)落叶小乔木,是我国北方珍贵的野生观果树种之一,具有很高的观赏价值、经济价值和药用价值[1]。主要分布在我国东北、华北,朝鲜北部,俄罗斯远东地区也有分布[2]。种子具有深休眠特性,引起花楸种子休眠的主要原因是由于花楸的果肉、果汁、种皮和种胚中均含有明显抑制种子萌发的物质。花楸的果肉和果汁均明显抑制种子的发芽。用乙烯处理盐碱胁迫下花楸胚胎,可提高其萌发率、平均发芽速度、发芽指数和发芽势[3]。用聚乙二醇(PEG)浸种处理可使种子处于低水势的介质中,从而降低种子萌发过程中水分进入的速度,提高种子的出苗率及整齐度,缩短出苗期,尤其对于不易萌发的种子(硬实度高、未成熟及老化种子)的促进效果显著[4]。用25% PEG溶液浸种水曲柳(Fraxinus mandshurica)3 d可显著提高种子发芽率[5]。与未引发相比,引发后的油菜(Brassica napus)中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性显著升高[6]。聚乙二醇浸种,有利于大豆(Glycine max)出苗,并提高其产量[7]。
近年来,我国多数地区土地盐碱化越发严重,影响了植物的生长及产量。盐度导致Na+毒性和离子失衡,破坏植物细胞的重要代谢过程,如蛋白质合成、酶促反应和核糖体功能[8-10]。在植物中,盐碱胁迫会产生较多的活性氧引起蛋白质变性、脂质过氧化、DNA损伤、碳水化合物氧化、色素分解和酶活性损伤,从而影响光合作用[11]。种子萌发与幼苗生长是作物生产成功的关键,这一生长阶段对盐碱胁迫非常敏感,这取决于植物的耐受机制[12]。在植物种子萌发的过程中,PEG作为种子萌发的引发剂,能够抵御低温、干旱和盐碱胁迫等不利的环境因素,使种子活力显著增强且抗逆性提高,保证出苗迅速有序[13]。PEG可以减弱盐碱胁迫对种子萌发抑制作用[14]。但对其调控机制尚不明确。PEG是否可以提高盐碱胁迫下花楸胚胎萌发率尚待研究确定。
本研究通过PEG处理花楸胚胎,对PEG影响盐碱胁迫下花楸胚胎的萌发情况进行观察,并对不同处理的萌发率、平均发芽速度、发芽指数、发芽势和幼苗胚轴胚根长度等指标进行观察和分析。之后取材进行抗氧化及氧化相关参数的测定,分析花楸胚胎体内活性氧代谢情况。研究结果为建立PEG诱导促进花楸种子萌发技术提供了科学依据,并为花楸在大庆等盐碱地区推广栽培提供了参考依据,为人工促进花楸种子萌发、有效保护和扩展花楸自然资源提供了技术和理论参考。
1 材料与方法
1.1 萌发试验
1.1.1 试验材料
2022年10月上旬在东北林业大学帽儿山实验林场成年母树上采集成熟浆果后,用水选法调制种子。将处于安全含水量(9%~10%)的饱满、纯净成熟种子放入塑封袋,在0~5 ℃贮藏备用。
1.1.2 试验方法
1.1.2.1 种子前处理
试验前测定种子千粒质量、含水量和生活力,然后在质量浓度为5%的PEG溶液中吸胀5 d。将吸胀后种子用无菌水冲洗,以除去种子表面的药品,然后用滤纸吸干种子表面水分,将种子置于室温条件下回干48 h。以未引发(无菌水浸种)的种子为对照。然后将种子室温条件下用蒸馏水浸泡复水48 h,将吸胀后种子用体积分数为0.2% NaClO溶液搅拌浸泡15 min,用无菌水冲洗至水清,在冰上剥除种皮(花楸为无胚乳种子)挤出裸胚用于试验,裸胚获得方法同杨玲等[15]研究方法。
1.1.2.2 种子发芽试验
PEG处理试验。将胚胎放在3 mL无菌水浸湿的滤纸上吸胀,对照为无菌水浸种。所有试验均在直径为9 cm的培养皿中(每皿30个胚),温度25 ℃,光照强度60 μmol/(cm2·s),光照/黑暗为16 h/8 h下萌发。对照和处理均设置3个及以上重复。
碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)处理试验。将胚胎(无菌水浸种)分别放在3 mL Na2CO3(浓度为14 mmol/L)或NaHCO3(浓度为26 mmol/L)浸湿的滤纸上,对照和萌发条件同上。
Na2CO3、NaHCO3分别与聚乙二醇组合处理试验。将胚胎分别用Na2CO3或NaHCO3溶液浸湿的滤纸上吸胀,对照和萌发条件同上。
1.2 生理指标测定
在第5天、6天、7天、8天进行取材,共4个处理,每个处理设置3个重复,每个样品质量为0.1 g,每个指标共12个样品,4个指标共48个样品。
SOD采用氮蓝四唑光还原法测定,POD采用愈创木酚比色法测定,CAT采用紫外分光光度法测定[16];丙二醛(MDA)含量采用硫代巴比妥酸法测定[17]。
1.3 数据处理与统计分析
选择Excel2019软件进行数据整理,采用SPSS26.0软件进行数据系统方差分析、邓肯(Duncan)多重比较和相关性分析,采用Sigmaplot14.0进行绘图。方差分析在P=0.05水平上进行显著性检验。平均数间统计学差异用Duncan多重比较法在P=0.05水平上进行显著性检验。各指标计算公式如下。
萌发率=(胚胎萌发数/供试胚胎总数)×100%。 (1)
平均发芽速度(d)=∑(D×X)/∑X。 (2)
式中:D为从发芽试验开始计算的天数;X为第D天新萌发的胚胎数;∑X为胚胎最终萌发的总数。
发芽指数=∑G_t/D_t。 (3)
式中:Gt为发芽试验终期内每日发芽数;Dt为发芽日数;∑为总和。
发芽势=(日发芽数/供试胚胎总数)×100%。 (4)
SOD活性(U/g)=(AE-Ack)/ V /(1/2×Ack×W×Vt)。 (5)
式中:Ack为对照管吸光度值;AE为样品管吸光度值;V为样品液总体积,mL;W为样品质量,g;Vt为测定时样品用量,mL。
POD活性(U/(g·min))=(ΔOD470×Vt)/(W×Vs×0.01×t)。 (6)
式中:ΔOD470为1 min内在波长470 nm下吸光度值 的变化值;Vs为测定时取酶液体积,mL;t为反应时间,min。
CAT活性(U/(g·min))=(ΔOD240×Vt)/(W×Vs×0.01×t)。 (7)
式中,ΔOD240为1 min内在波长240 nm下吸光度值的变化值。
MDA浓度C(umol/L)=6.45(OD532-OD600)- 0.56OD450。 (8)
式中:OD532、OD600、OD450分别为波长532、600、450 nm的吸光值。
MDA含量(umol/g)=C×V/W。 (9)
2 结果与分析
2.1 聚乙二醇对盐碱胁迫下花楸胚胎萌发情况的影响
2.1.1 聚乙二醇对盐碱胁迫下花楸胚胎萌发的影响
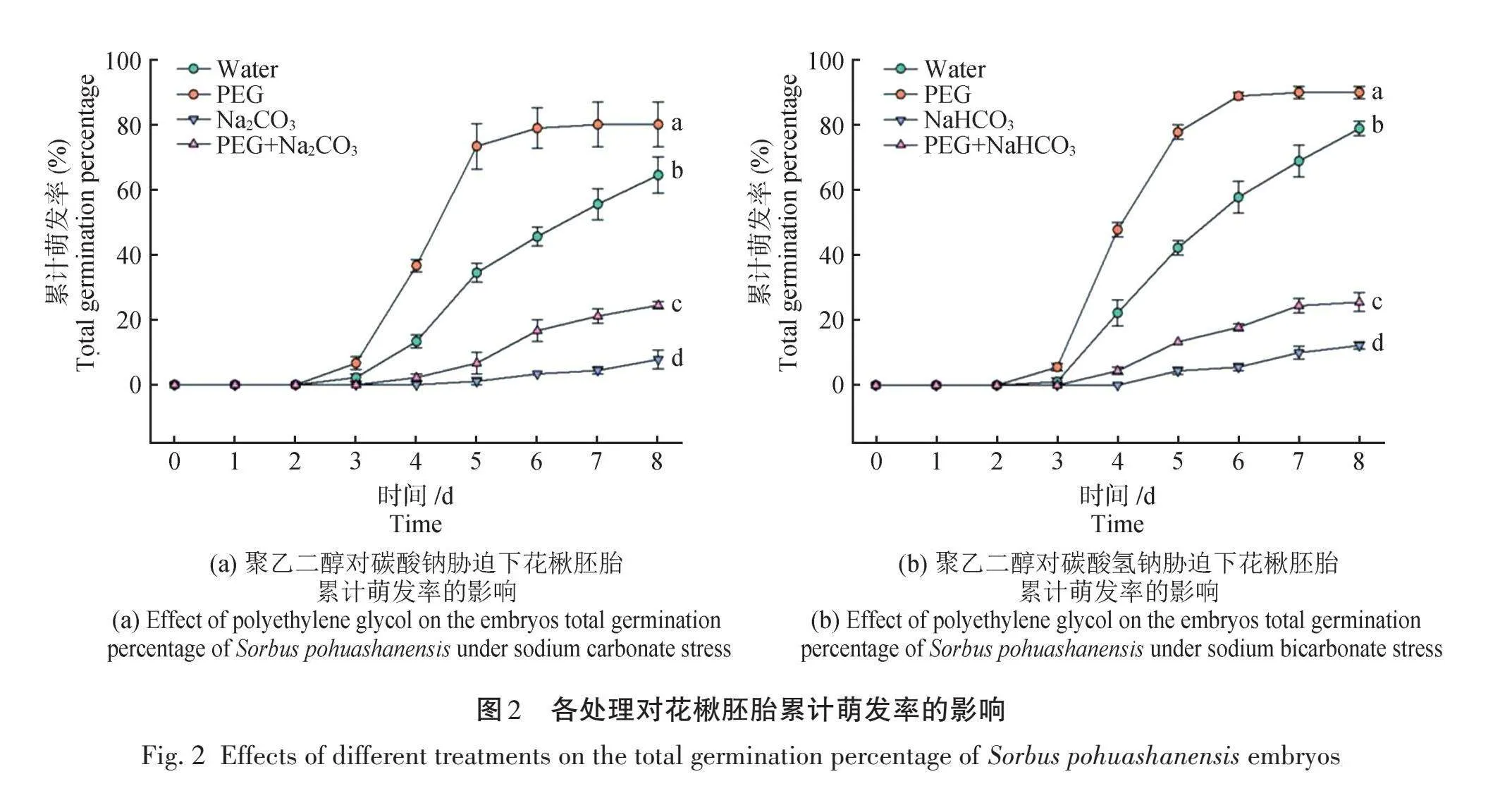
不同处理对花楸胚胎萌发的影响如图1所示。各处理之间差异显著(P<0.05),用Na2CO3或NaHCO3处理过的胚胎萌发率显著低于对照(比对照分别降低了88%和85%);添加PEG处理后,萌发率虽然没有达到对照水平,但相比于Na2CO3、NaHCO3单独处理分别提高了214%和109%,显著高于Na2CO3、NaHCO3单独处理,PEG对Na2CO3处理的缓解作用更加明显。由图2可知,PEG处理的花楸胚胎于第3天开始萌发,说明PEG可以缓解Na2CO3和NaHCO3对花楸胚胎萌发的抑制作用。
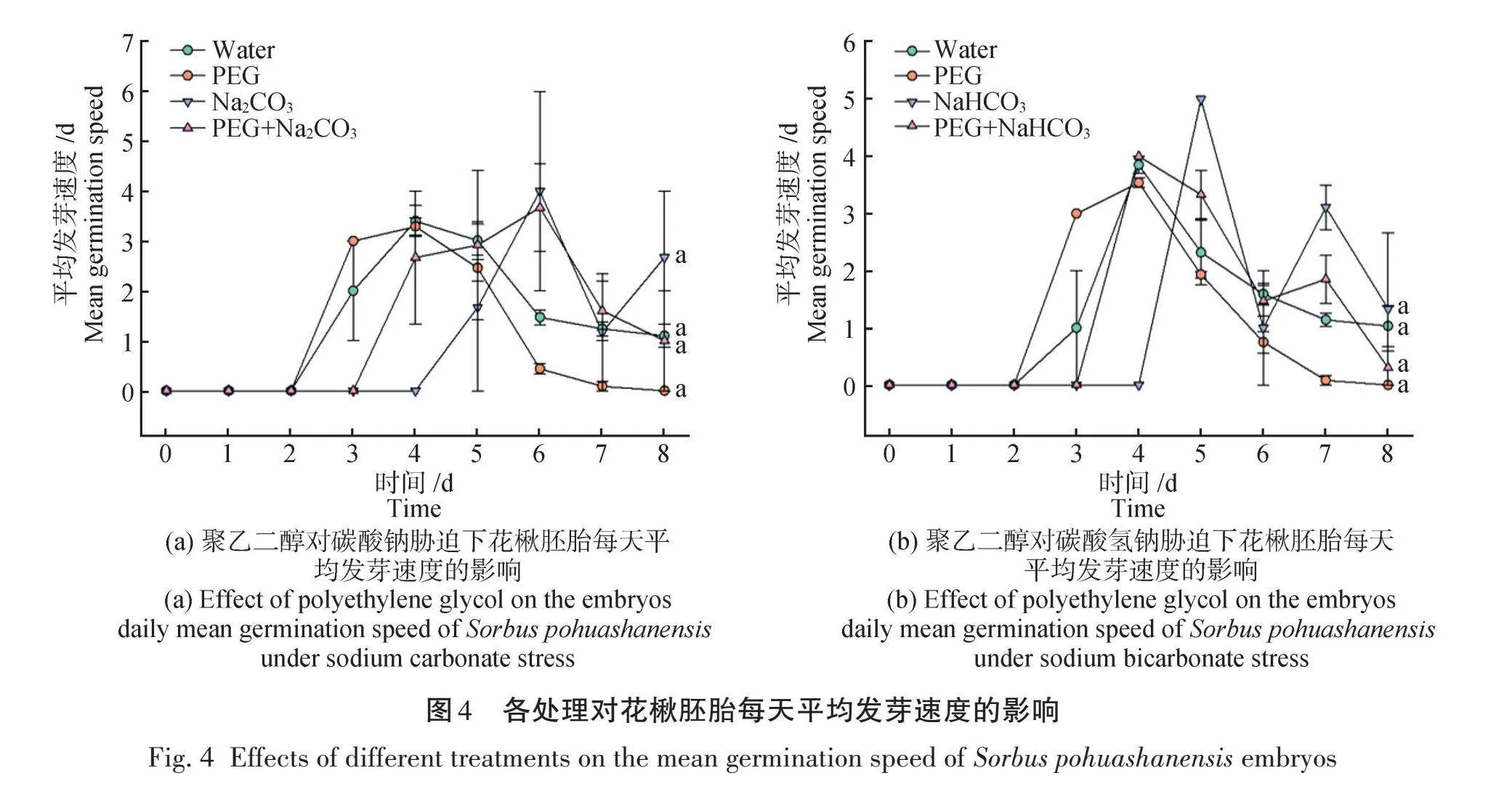
2.1.2 聚乙二醇对盐碱胁迫下花楸胚胎平均发芽速度的影响
不同处理对花楸胚胎平均发芽速度的影响如图3所示,平均发芽速度数值越小,表示该批种子发芽速度大,发芽能力较好。PEG处理后平均发芽速度数值最低,为4.55 d,显著低于其他处理,而Na2CO3、NaHCO3处理后平均发芽速度数值最高,分别为6.58 d和6.33 d,显著高于对照。PEG处理的花楸胚胎发芽速度大,发芽能力较好,说明PEG可以促进胚胎萌发。在添加PEG处理后,胁迫下的胚胎平均发芽速度数值接近对照水平,分别为6.06 d和5.60 d,说明PEG使得盐碱对胚胎萌发的抑制作用减弱,胚胎发芽能力得到增强。由图4可知,在第5天和第6天,Na2CO3和NaHCO3的平均发芽速度数值分别达到最大,此时发芽能力较低,发芽情况受抑制最严重。添加PEG处理后,每天的胚胎平均发芽速度数值均低于其单独处理,说明PEG可以提高盐碱胁迫下花楸胚胎的发芽速度,增强其发芽能力。
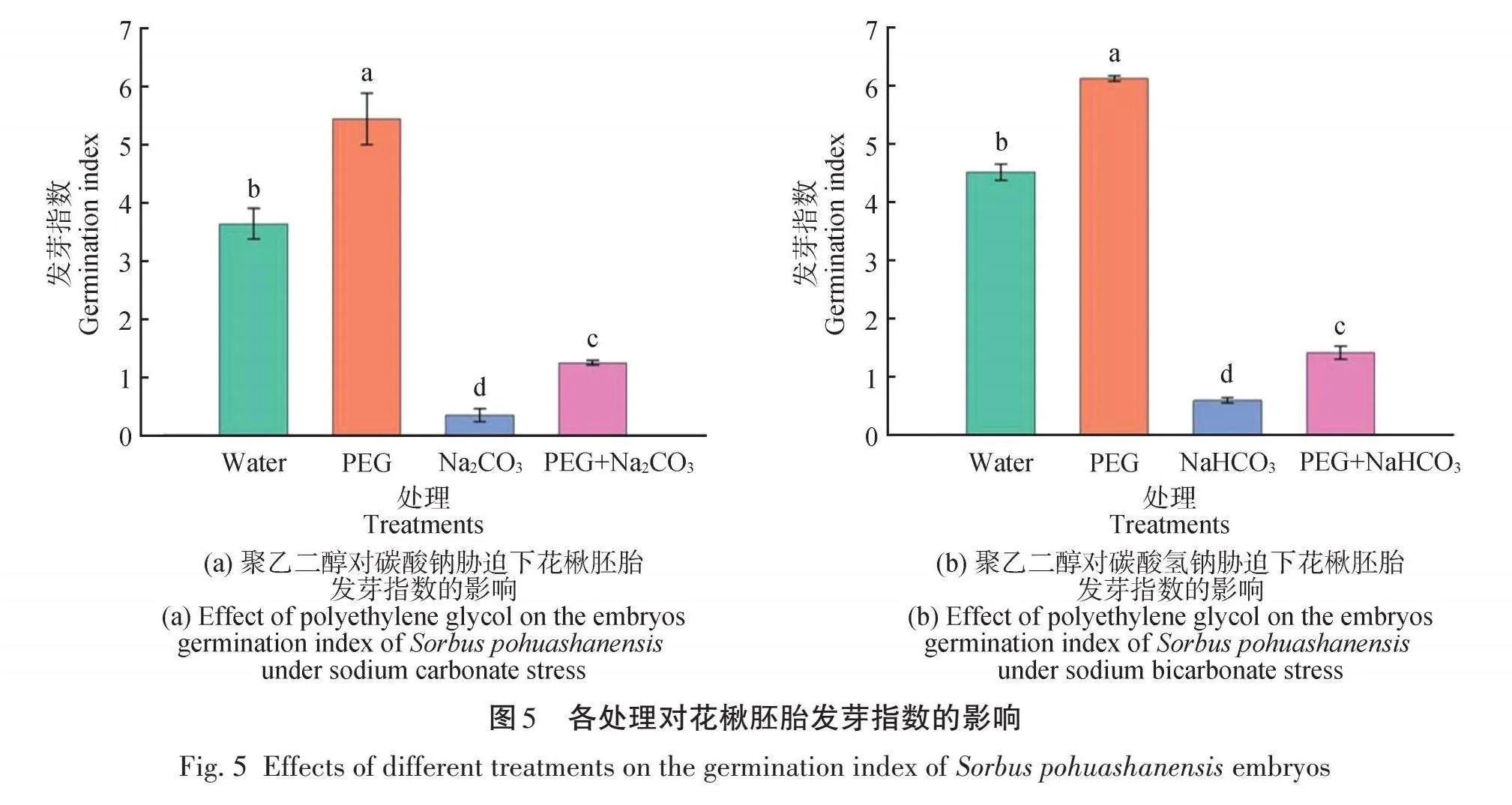
2.1.3 聚乙二醇对盐碱胁迫下花楸胚胎发芽指数的影响
不同处理对花楸胚胎发芽指数的影响如图5所示。PEG处理后的花楸胚胎发芽指数最高,Na2CO3、NaHCO3处理后的发芽指数最低,且各处理间差异显著;添加PEG处理后,Na2CO3、NaHCO3处理的胚胎的发芽指数增加,且与Na2CO3、NaHCO3单独处理的发芽指数差异比较显著,这说明PEG不仅能促进花楸胚胎的萌发,还能够缓解盐碱胁迫的抑制作用。由图6可知,PEG处理过的花楸胚胎在第4天达到最大,各处理在0~8 d的发芽指数呈先增后降的趋势,之后趋于平缓。
2.1.4 聚乙二醇对盐碱胁迫下花楸胚胎发芽势的影响
不同处理对花楸胚胎发芽势的影响如图7所示。PEG处理后的胚胎发芽势最大,且显著高于其他处理;Na2CO3、NaHCO3处理的发芽势最低,显著低于对照;说明PEG可以促进花楸胚胎萌发,而盐碱胁迫抑制花楸胚胎的萌发。在添加PEG处理之后,花楸胚胎的发芽势相对于Na2CO3、NaHCO3单独处理的分别增加了199.85%和42.80%(增加不显著),说明PEG可以缓解盐碱胁迫对花楸胚胎的部分抑制作用。
2.1.5 聚乙二醇对盐碱胁迫下花楸胚胎胚轴胚根长度的影响
不同处理对花楸胚胎胚轴胚根长度的影响如图8所示。PEG处理过的花楸胚胎胚轴胚根长度最长;在添加PEG之后,相对于Na2CO3、NaHCO3单独处理的胚轴胚根长度效果不显著。由图9可知,虽然PEG不能使胚胎的胚轴胚根长度增加,但出苗的整齐度非常好,说明PEG可以改善出苗整齐度。
2.2 聚乙二醇对盐碱胁迫下花楸胚胎抗氧化及氧化相关参数的影响
2.2.1 聚乙二醇对盐碱胁迫下花楸胚胎中SOD活性的影响
由图10可知,萌发过程中各项处理花楸胚胎中的SOD活性均逐渐升高。PEG处理均显著高于对照处理,PEG和Na2CO3组合处理均显著高于Na2CO3单独处理。萌发至第8天时,PEG处理的SOD活性达到最大值,为341.78 U/g,相比于其他各处理(水、Na2CO3、PEG+Na2CO3)分别提高了10.34%、53.26%、31.62%,此时PEG和Na2CO3组合处理SOD活性比Na2CO3单独处理提高了16.45%。
2.2.2 聚乙二醇对盐碱胁迫下花楸胚胎中POD活性的影响
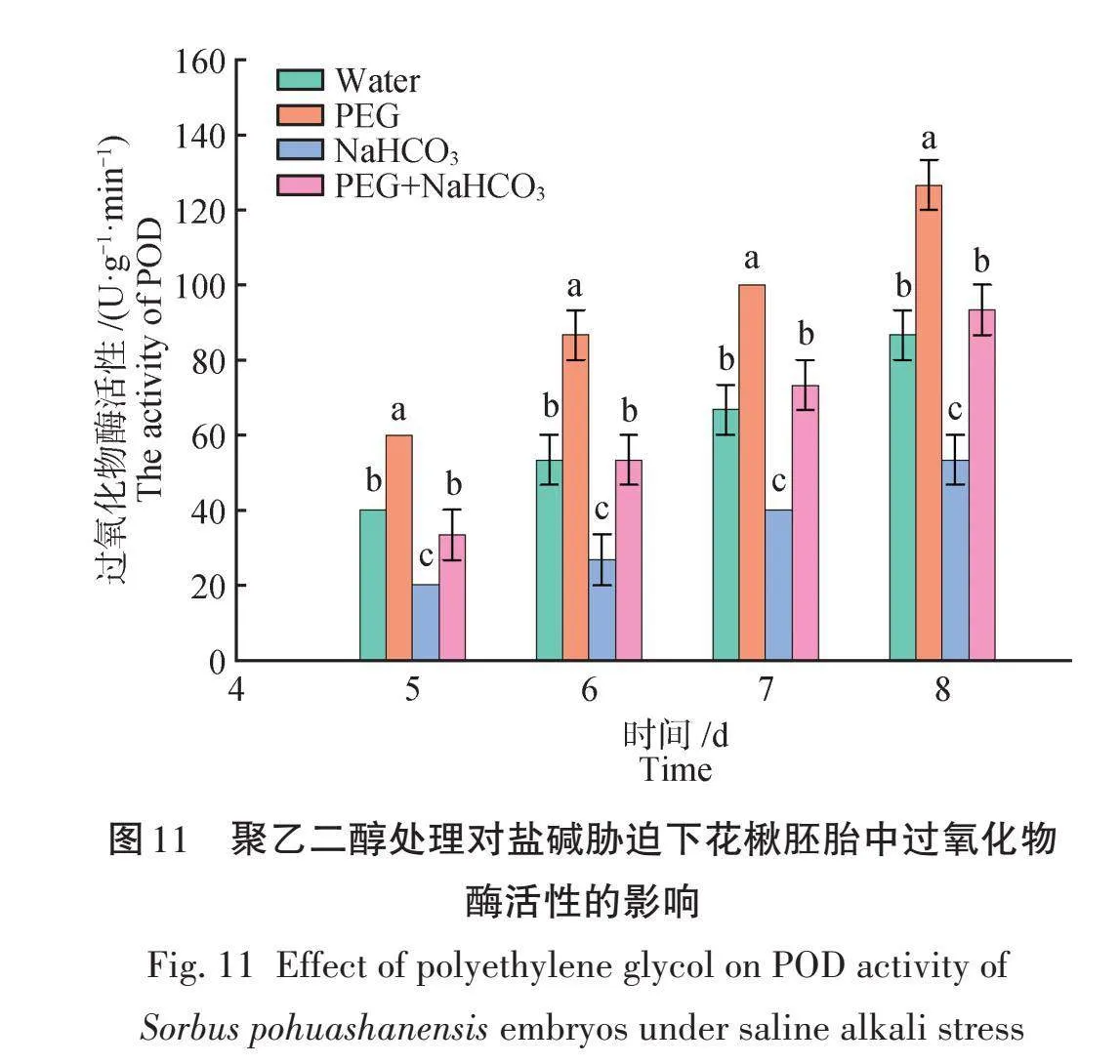
由图11可知,PEG处理的花楸胚胎中的POD活性均显著高于其他各处理,PEG和Na2CO3组合处理与对照差异不显著。萌发至第5天时,Na2CO3处理的花楸胚胎POD活性最低,为40.00 U/(g‧min),此时PEG和Na2CO3组合处理要比Na2CO3单独处理提高50%,差异显著。萌发至第8天时,PEG处理的花楸胚胎POD活性达到最大值,为126.67 U/(g‧min),此时PEG和Na2CO3组合处理要比Na2CO3单独处理提高75%,但与对照无显著差异。
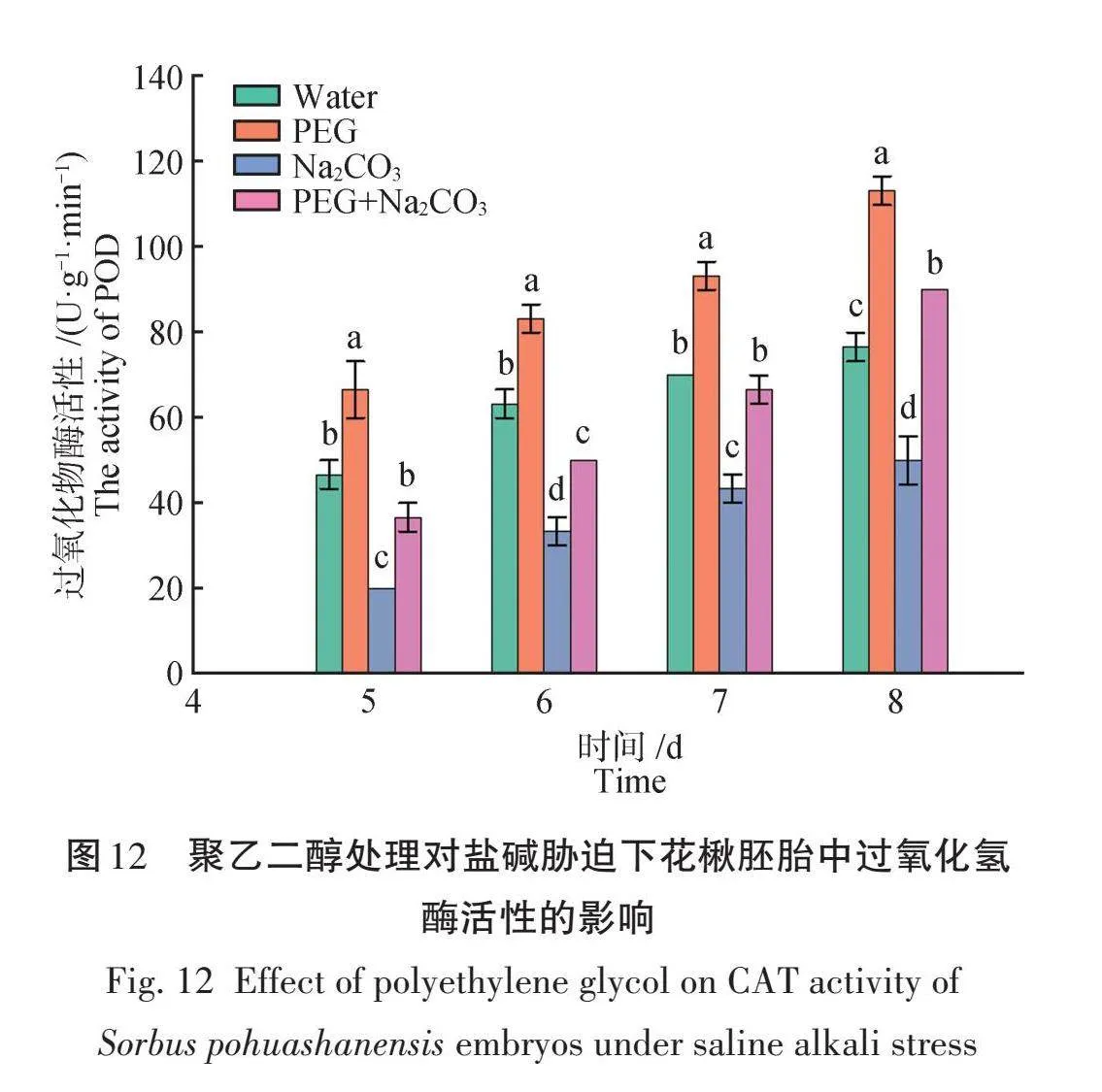
2.2.3 聚乙二醇对盐碱胁迫下花楸胚胎中CAT活性的影响
由图12可知,PEG处理的花楸胚胎中的CAT活性均显著高于其他各处理。萌发至第5天时,PEG和Na2CO3组合处理与对照差异不显著;萌发至第8天时,PEG处理的花楸胚胎中的CAT活性达到最大值,为113.33 U/(g‧min),此时PEG和Na2CO3组合处理比对照和Na2CO3单独处理分别提高了17.39%和80%,且差异显著。
2.2.4 聚乙二醇对盐碱胁迫下花楸胚胎中MDA含量的影响
由图13可知,Na2CO3处理的花楸胚胎中的MDA含量均显著高于其他各处理,PEG和Na2CO3组合处理与对照差异不显著。萌发至第7天时,PEG处理的花楸胚胎中MDA含量最低,为5.15 umol/g,与其他各处理差异显著。萌发至第8天时,Na2CO3处理的花楸胚胎中MDA含量到达最大值,为17.52 umol/g,此时PEG和Na2CO3组合处理的胚胎中MDA含量比Na2CO3单独处理降低了41.44%。
3 讨论与结论
3.1 Na2CO3和NaHCO3处理抑制花楸胚胎萌发
东北地区盐碱土主要盐分是Na2CO3和NaHCO3,土壤呈强碱性,pH很高[18],这不仅直接影响种子的萌发,还可通过影响植物的生理代谢和光合作用等来限制其生长[19]。本研究结果发现,Na2CO3和NaHCO3处理过的花楸胚胎萌发率相比于对照分别降低了88%和85%,平均发芽速度分别提升了17%和14%,发芽指数分别降低了90%和87%,发芽势分别降低了81%和76%,胚轴胚根长度分别降低了66%和74%,与对照差异显著。这说明盐碱胁迫会抑制花楸胚胎的萌发。
3.2 PEG引发缓解了盐碱胁迫对花楸胚胎的抑制作用
种子引发是对种子萌发和胁迫响应机理研究常用的一种方法[20]。PEG 是最常用的引发剂,在一定的质量浓度范围内,有利于种子的萌发和生长,能提高种子的出苗率、成苗率和对逆境胁迫的适应性[21-22]。近些年来,种子引发技术得到了广泛应用,如苹果(Malus pumila)[23]、水曲柳[5]等。此外,单昕昕等[24]研究发现,PEG引发能够提高种子的萌发率、发芽势等指标。本研究结果发现,胚胎萌发率、发芽指数、发芽势、胚轴胚根长度均高于对照,而平均发芽速度低于对照。PEG引发后的胚胎在第3天开始发芽,早于其他处理,并在第7天萌发率达到最大值。结果表明,PEG引发对种子萌发具有促进作用。此外,PEG使盐碱胁迫下花楸胚胎萌发率、发芽指数有了显著的提升。平均发芽速度降低到对照水平,发芽势及胚轴胚根长度提升效果不明显,但可以改善出苗的整齐度。这说明PEG能够有效缓解Na2CO3、NaHCO3对花楸的抑制作用,与前人研究结果一致。但具体的作用机理还尚不明确,需进一步进行研究。
3.3 PEG引发对盐碱胁迫下种子具有调控作用
Angon等[25]研究发现,在严重的盐碱胁迫下,植物体内的H2O2含量和MDA含量比对照显著增加,SOD、CAT、抗坏血酸过氧化物酶(APX)等抗氧化酶活性均显著低于对照。这说明盐碱胁迫严重影响植物细胞内自由基的平衡,导致ROS积累,细胞膜过氧化,细胞结构受损[26]。单昕昕等[24]研究发现,PEG引发可以增强SOD和POD的表达和活性,降低MDA的含量,提高种子根系活力。Wang等[27]研究发现,乙烯利(ethrel,ETH)可以提高花楸胚胎在盐碱胁迫下的SOD、POD、CAT等抗氧化酶活性,提高谷胱甘肽(glutathione,GSH)等抗氧化剂含量,降低MDA、H2O2含量。抗氧化酶和抗氧化剂是活性氧解毒的关键因素,维持细胞氧化还原平衡在其生理限度内。在盐碱胁迫下,CAT和SOD在抵御氧化损伤和调节抗氧化酶相互协调消除细胞内ROS中发挥重要作用。本研究中,PEG可使盐碱胁迫下花楸胚胎中SOD、POD、CAT酶活性分别提高16.45%、75%、80%,MDA含量降低41.44%。这说明在盐碱胁迫条件下,PEG可以诱导花楸胚胎产生抗氧化酶来提高其活性,增强其代谢水平。这与前人的研究结果一致[28]。
综上所述,PEG可以有效解除花楸胚胎休眠,促进萌发。盐碱胁迫会抑制花楸胚胎萌发。PEG引发后能够有效缓解盐碱胁迫对花楸胚胎的抑制作用。PEG引发可以有效提高盐碱胁迫下花楸胚胎中的SOD、POD、CAT抗氧化酶活性,并降低MDA含量,增强花楸胚胎的抗逆性。研究结果将为建立PEG引发促进花楸胚胎萌发技术提供科学依据,并解决花楸在大庆等盐碱地区的栽培工作,为人工培育花楸抗逆性树种,保护和扩展花楸自然资源提供技术和理论参考。
【参 考 文 献】
[1] YANG L,SHEN H L.Effect of electrostatic field on seed germination and seedling growth of Sorbus pohuashanesis[J].Journal of Forestry Research,2011,22(1):27-34.
[2] YANG L,WANG J N,BIAN L,et al.Cyclic secondary somatic embryogenesis and efficient plant regeneration in mountain ash(Sorbus pohuashanensis)[J].Plant Cell,Tissue and Organ Culture:An International Journal on in Vitro Culture of Higher Plants,2012,111:173-182.
[3] 王雨童,赵彩鸿,王晓东,等.外源乙烯对盐碱胁迫下花楸胚胎萌发的影响[J].种子,2022,41(9):34-39.
WANG Y T,ZHAO C H,WANG X D,et al.The effect of exogenous ethylene on the embryo germination of Sorbus pohuashanensis under salt alkali stress[J].Seed,2022,41(9):34-39.
[4] 富波年,马乐元,马慧霞,等.PEG引发对小冠花种子萌发及幼苗生理特性的影响[J].草原与草坪,2021,41(1):126-131.
FU B N,MA L Y,MA H X,et al.Effects of PEG priming on seed germination and physiological characteristics of seedlings of Coronilla varia[J].Grassland and Turf,2021,41(1):126-131.
[5] 闫月,卢艳,崔程程,等.聚乙二醇引发处理对水曲柳种子在高温下萌发的影响[J].东北林业大学学报,2020,48(6):13-16.
YAN Y,LU Y,CUI C C,et al.Effect of PEG priming treatment on the germination of Fraxinus mandshurica seeds at high temperature[J].Journal of Northeast Forestry University,2020,48(6):13-16.
[6] KAZEMI O B,BANDEHAGH A,FARAJZADEH D,et al.Morphological,biochemical,and physiological responses of canola cultivars to drought stress[J].International Journal of Environmental Science and Technology,2023,20(12):13551-13560.
[7] CHAKRABORTY P,DWIVEDI P.Seed priming and its role in mitigating heat stress responses in crop plants[J].Journal of Soil Science and Plant Nutrition,2021,21:1718-1734.
[8] ALKHARABSHEH H M,SELEIMAN M F,HEWEDY O A,et al.Field crop responses and management strategies to mitigate soil salinity in modern agriculture:a review[J].Agronomy,2021,11:2299.
[9] ARIF Y,SINGH P,SIDDIQUI H,et al.Salinity induced physiological and biochemical changes in plants:An omic approach towards salt stress tolerance[J].Plant Physiology and Biochemistry.2020,156(23):64-77.
[10] MUSHTAQ Z,FAIZAN S,GULZAR B.Salt stress,its impacts on plants and the strategies plants are employing against it:A review[J].Applied Biology & Biotechnology,2020,8(3):81-91.
[11] HASANUZZAMAN M,BHUYAN B,ANEE T I,et al.Regulation of ascorbate-glutathione pathway in mitigating oxidative damage in plants under abiotic stress[J].Antioxidants,2019,8:384.
[12] HAJIHASHEMI S,SKALICKY M,BRESTIC M,et al.Cross-talk between nitric oxide,hydrogen peroxide and calcium in salt-stressed Chenopodium quinoa Willd.at seed germination stage[J].Plant Physiology and Biochemistry,2020,154:657-664.
[13] 崔凤娟,王振国,徐庆全,等.种子引发对碱胁迫下甜高粱种子萌发及幼苗生长的影响[J].中国农学通报,2020,36(7):16-21.
CUI F J,WANG Z G,XU Q Q,et al.Effect of seed priming on sweet sorghum seed germination and seedling growth under alkaline stress [J].Chinese Agricultural Science Bulletin,2020,36(7):16-21.
[14] 肖爽,韩雨辰,王晓蕾,等.聚乙二醇引发对盐胁迫下棉种萌发及生理特性的影响[J].核农学报,2021,35(1):202-210.
XIAO S,HAN Y C,WANG X L,et al.Effects of polyethylene glycol priming on germination and physiological characteristics of cotton seeds under salt stress[J].Journal of Nuclear Agricultural,2021,35(1):202-210.
[15] 杨玲,王佳男,边磊,等.外源NO对花楸树胚胎萌发和幼苗发育初期活性氧积累的影响[J].林业科学,2013,49(6):60-67.
YANG L,WANG J N,BIAN L,et al.The effect of exogenous NO on embryo germination and early accumulation of reactive oxygen species during seedling development of Sorbus pohuashanensis tree[J].Forestry Science,2013,49(6):60-67.
[16] 程艳,陈璐,米艳华,等.水稻抗氧化酶活性测定方法的比较研究[J].江西农业学报,2018,30(2):108-111.
CHENG Y,CHEN L,MI Y H,et al.Comparative study on methods for measuring antioxidant enzyme activity in rice[J].Jiangxi Agricultural Journal,2018,30(2):108-111.
[17] 文欢,蒋丹,南文斌,等.一份水稻长穗突变体的鉴定及相关生理特性分析[J].西南农业学报,2021,34(3):461-468.
WEN H,JIANG D,NAN W B,et al.Identification and related physiological characteristics analysis of a rice long spike mutant[J].Southwest Agricultural Journal,2021,34(3):461-468.
[18] 徐璐,王志春,赵长巍,等.东北地区盐碱土及耕作改良研究进展[J].中国农学通报,2011,27(27):23-31.
XU L,WANG Z C,ZHAO C W,et al.A Review of saline-sodic soil and tillage amelioration in northeast of china[J].Chinese Journal of Agriculture,2011,27(27):23-31.
[19] 王佺珍,刘倩,高娅妮,等.植物对盐碱胁迫的响应机制研究进展[J].生态学报,2017,37(16):5565-5577.
WANG Q Z,LIU Q,GAO Y N,et al.Review on the mechanisms of the response to salinity-alkalinity stress in plants [J].Journal of Ecology,2017,37(16):5565-5577.
[20] 刘东让,董邵云,苗晗,等.黄瓜耐盐胁迫遗传育种研究进展[J].中国蔬菜,2021(7):14-23.
LIU D R,DONG S Y,MIAO H,et al.Research progress on genetic breeding of cucumber tolerance for salt stress[J].Chinese Vegetables,2021(7):14-23.
[21] 张泽旭,骆岩,王维成,等.不同浓度PEG对甜菜种子萌发的影响[J].中国农学通报,2019,35(13):48-52.
ZHANG Z X,LUO Y,WANG W C,et al.Effects on the germination of sugar beet seeds:different concentrations of PEG[J].Chinese Journal of Agriculture,2019,35(13):48-52.
[22] 于惠琳,吴玉群,石清琢,等.水分逆境下PEG诱导引发种子对糯玉米芽苗的生理调控[J].种子,2019,38(5):48-52.
YU H L,WU Y Q,SHI Q Z,et al.Physiological regulation of PEG-induced priming seeds on waxy maize sprouts under water stress [J].Seed,2019,38(5):48-52.
[23] KAUTZ B,NOGA G,HUNSCHE M.PEG and drought cause distinct changes in biochemical,physiological and morphological parameters of apple seedlings[J].Acta Physiologiae Plantarum,2015,37(8):162-167.
[24] 单昕昕,张仕林,陈晖,等.PEG引发对洋葱种子萌发及幼苗生理指标的影[J].北方农业学报,2021,49(2):129-134.
DAN X X,ZHANG S L,CHEN H,et al.Effect of PEG priming on seed germination and seedling physiological indexes in onion[J].Journal of Northern Agriculture,2021,49(2):129-134.
[25] ANGON P B,TAHJIB-UL-ARIF M,SAMIN S I,et al.How do plants respond to combined drought and salinity stress?-A systematic review[J].Plants,2022,11:2884.
[26] YIN D,HALIFU S,SONG R,et al.Effects of an ectomycorrhizal fungus on the growth and physiology of Pinus sylvestris var.mongolica seedlings subjected to saline-alkali stress[J].Journal of Forestry Research,2019,31(3):781-788.
[27] WANG Y T,ZHAO C H,WANG X D,et al.Exogenous ethylene alleviates the inhibition of Sorbus pohuashanensis embryo germination in a saline-alkali environment(NaHCO3)[J].International Journal of Molecular Sciences,2023,24:4244.
[28] WANG Y,DIAO P F,KONG L Q,et al.Ethylene enhances seed germination and seedling growth under salinity by reducing oxidative stress and promoting chlorophyll content via ETR2 pathway[J].Frontiers in plant science,2020,11:1066.

