基于线粒体基因序列的广西柑橘木虱遗传多样性及种群结构分析




摘要:【目的】研究广西柑橘木虱遗传多样性及种群结构,为制定柑橘木虱的防控措施提供理论基础。【方法】通过分析来自我国广东、贵州、云南、海南、广西以及越南太平和柬埔寨暹粒等地区的9个柑橘木虱线粒体基因组序列,确定并设计针对多态性位点的引物。利用获得的引物对采集自广西合浦、环江、富川、西林、永福和右江6个柑橘产区的柑橘木虱线粒体基因序列进行扩增和测序;使用DnaSP 6.12对测序序列进行多态性分析和单倍型多样性分析;采用最大似然法和贝叶斯法构建系统发育进化树;使用PopART绘制单倍型网络图以展示种群进化结构和关系。【结果】对来自我国和越南太平、柬埔寨暹粒的9个柑橘木虱线粒体基因组序列进行比对分析,共获得22个多态性位点,针对多态性位点区域序列设计引物并筛选获得5对有效引物,其中包括8个多态性位点。利用5对引物对采集自广西6个柑橘产区的18个柑橘木虱线粒体基因进行PCR扩增并测序,获得总长度2272 bp的线粒体基因序列,经分析发现广西柑橘木虱共包含6种单倍型,单倍型多样性为0.882、核苷酸多样性为0.00181。最大似然进化树、贝叶斯进化树和单倍型网络分析发现,广西西林柑橘木虱种群与云贵川等我国西南地区高海拔的柑橘木虱种群在遗传距离上较近,其他地区的柑橘木虱种群与我国南方和东南亚的种群更接近。【结论】广西柑橘木虱种群展现较高的单倍型多样性和较低的核苷酸多样性,表现明显的种群结构分化和多样性;广西柑橘木虱种群遗传分化受地理距离影响明显,二者存在相关性。
关键词:柑橘木虱;遗传多样性;种群结构;单倍型;柑橘;广西
中图分类号:S511.31文献标志码:A文章编号:2095-1191(2024)07-2100-08
Genetic diversity and population structure analysis ofDiaphorinacitriKuwayama in Guangxi based onmitochondrial gene sequences
DENG Tie-jun YANG Li-ting LEI Wei LIU Li-hui LIU Ji-min CHEN Qi 3*
(1Plant Protection Research Institute,Guangxi Academy of Agricultural Sciences/Guangxi Huanglongbing Prevention andControl Engineering Technology Research Center/Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pest,Nanning,Guangxi 530007,China;2Nanning Gold-Tech Biotechnology Co.,Ltd.,Nanning,Guangxi 530007,China;3Nanning New Technology Entrepreneur Center,Nanning,Guangxi 530007,China)
Abstract:【Objective】To study the genetic diversity and population structure of DiaphorinacitriKuwayama in Guangxi,this study provided research foundation for the strategy of controlling D.citri.【Method】Mitochondrial genome sequences of D.citri from 9 regions,Guangdong,Guizhou,Yunnan,Hainan and Guangxi of China,Thai Binh of Viet-nam and Siem Reap of Cambodia,were analyzed to identify and design primers for polymorphic sites.Amplification and sequencing on D.citri gene mitochondrial sequences from Hepu,Huanjiang,Fuchuan,Xilin,Yongfu and Youjiang in Guangxi were conducted.DnaSP 6.12 was used to analyze the polymorphism and haplotype diversity of the sequences;and phylogenetic trees were constructed using maximum likelihood method and Bayes method;haplotype network was generated using PopART software to depict the population genetic structure and relationships.【Result】The mitochondrial genome sequences of 9 D.citri samples from China,Thai Binh of Vietnam and Se8823dff19ac5d2d8543a444dbc9f93ciem Reap of Cambodia were compared and analyzed,resulting in the identification of 22 polymorphic sites.Primers were designed for the regions surrounding these polymorphic sites,and 5 pairs of effective primers were selected,which included 8 polymorphic sites.Mitochon-drial genes of 18 D.citri collected from 6 citrus producing areas in Guangxi were amplified and sequenced by PCR using 5 pairs of primers,resulting in a mitochondrial gene sequence with a total length of 2272 bp.Analysis showed that D.citri in Guangxi contained 6 haplotypes,the haplotype diversity was 0.88 with a nucleotide diversity of 0.00181.Maximum likelihood evolutionary tree,Bayesian evolutionary tree and haplotype network analysis showed that the genetic distance between XilinD.citri population in Guangxi and D.citri populations at high altitude in southwestern China such as Yun-nan,Guizhou and Sichuan was relatively close,while populations in other regions were more closely related to those in southern China and southeastern Asia.【Conclusion】D.citri populations in Guangxi exhibit high haplotype diversity and low nucleotide diversity,implying obvious differentiation and diversity of population structure.The genetic differentia-tion of D.citri population in Guangxi is affected by geographical distance,and there is correlation between the two.
Key words:DiaphorinacitriKuwayama;genetic diversity;population structure;haplotype;citrus;Guangxi
Foundation items:Guangxi Innovation Driven Development Project(Guike AA18118046-1);Guangxi Innovation Team Construction Project of China Agriculture Research System(nycytxgxcxtd-2021-05-02);Project of Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pest(2019-ST-04);Guangxi Characteristic Crop Test Station Project(Gui TS2022008)
0引言
【研究意义】柑橘木虱(DiaphorinacitriKuwaya-ma)隶属于半翅目(Hemiptera)木虱科(Psyllidae),是柑橘最重要的害虫之一,在我国广西、广东、福建、贵州、湖南、江西、四川、云南和浙江等大多数柑橘种植区有发现,该虫以成虫和若虫刺吸新芽嫩梢的韧皮部汁液,造成寄主嫩梢凋萎、新梢畸变等,是柑橘黄龙病菌(Candidatus Liberibacter asiaticus,CLas)的主要传播媒介(Hall etal.,2013)。柑橘木虱若虫和成虫在刺吸已感染黄龙病的植物后会携带CLas,CLas在木虱体内可复制,并侵入唾液腺,当带CLas的木虱在吸食柑橘嫩芽时会将CLas传染至其他柑橘植株(Gottwald,2010;Wang et al.,2017a)。目前柑橘黄龙病尚无有效防治药剂,是柑橘产业可持续发展的瓶颈问题,感染黄龙病的柑橘树会出现包括斑驳黄化叶片、根部坏死、果实发育不良等症状(Dala-Paula et al.,2019;吕丽兰等,2022)。控制柑橘黄龙病的主要手段有砍除染病植株、控制柑橘木虱、种植不带病菌的树苗,其中控制木虱种群是目前阻止黄龙病传播的最有效方法(Alquézaretal.,2022)。昆虫的种群遗传分化与物种对环境的适应性有着直接联系,研究柑橘木虱的遗传多样性和遗传结构对于准确把握柑橘木虱的扩散规律、暴发原因及防控有着重要意义。【前人研究进展】线粒体基因组(mtDNA)是独立于细胞核DNA的遗传物质,具有进化速度快、重组率极低及单倍型遗传等特点,在昆虫的群体遗传结构、种群系统进化及种群系统地理学研究上应用广泛(Dong et al.,2021;李中波等,2022;赵卓等,2023)。Boykin等(2012)对212头来源于15个国家的柑橘木虱进行线粒体细胞色素C氧化酶I基因(mtCOI)序列分析,发现212头柑橘木虱共包含8种单倍型,可分为东南亚和西南亚2个大单倍型群。Wang等(2017b)通过对亚洲多国和美国的柑橘木虱线粒体基因进行遗传多样性和种群结构分析,发现我国和东南亚的柑橘木虱在遗传结构上与巴基斯坦和美国的柑橘木虱存在显著差异,同时判断出我国的柑橘木虱有多种不同来源。宋章蓉等(2018)通过mtCOI基因研究了华南5个地理种群柑橘木虱的遗传距离,发现广西南宁、桂林和福建厦门地区种群间的遗传距离为0,华南地区5个种群之间分化程度较低,各种群间的同源性与地理距离无显著相关性。这或许是因为mtCOI基因的突变速率较低,在分析距离较近的种群时往往会呈现高度的遗传相似性(Wang et al.,2017b;宋章蓉等,2018)。Fuentes等(2018)通过mtCOI基因分析了来自27个国家的1108头柑橘木虱,共可分成28种单倍型,其中21种单倍型的分布与地理位置相关。Wu等(2018)采用全线粒体基因组序列进行柑橘木虱的种群多样性分析,发现主要存在3个群体,其中MG1群体包含我国西南地区的柑橘木虱(海拔高于1000m),MG2群体包含来自我国东南地区和东南亚地区的柑橘木虱(海拔低于180m),MG3群体包含巴基斯坦和美国的柑橘木虱,MG1和MG2群体与MG3群体存在显著差异。罗育发等(2019)通过分析线粒体基因片段,发现江西10个地点的柑橘木虱存在3种单倍型。Wang等(2021)采用线粒体基因组序列分析表明,肯尼亚柑橘木虱种群与地理位置距离较远的柬埔寨种群遗传距离较近,而与地理位置更近的法属留尼汪种群存在更远的遗传距离。Ajene等(2022)通过线粒体基因组序列分析,发现东非地区的柑橘木虱种群具有不同的来源,肯尼亚和坦桑尼亚种群可能源自东南亚,而埃塞俄比亚种群可能源自美洲。【本研究切入点】现有研究表明,柑橘木虱具有明显的种群遗传结构分化,但与地理分布相关性存在不同研究结果。广西是我国最大的柑橘产区,柑橘木虱常年均可发生,对广西柑橘产业的危害极大,但目前尚未见广西柑橘木虱种群遗传多样性和种群结构的研究报道。【拟解决的关键问题】选择来自我国广东、贵州、云南、海南、广西以及越南太平和柬埔寨暹粒等地区的9个柑橘木虱线粒体基因组序列进行比对分析,确定并设计针对多态性位点的引物,利用筛选获得的引物对采集自广西合浦、环江、富川、西林、永福和右江6个柑橘产区的柑橘木虱线粒体基因序列进行扩增和测序,识别多态性位点并评估其遗传多样性及种群结构,为制定柑橘木虱的防控措施提供理论基础。
1材料与方法
1.1供试材料
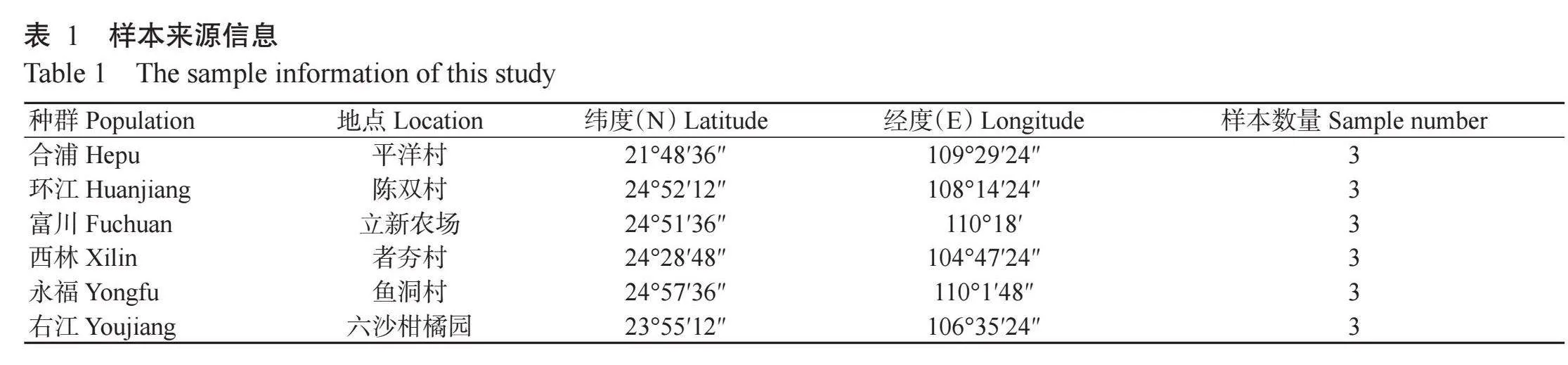
本研究柑橘木虱样本分别采集自广西合浦、环江、富川、西林、永福和右江6个柑橘产区,每个采样点采集3头柑橘木虱,共计18头,采样点覆盖了广西东北部、南部、西部和北部。采集地信息见表1。采集过程中,为防止采集的个体来源于同一个母本,选择距离至少10m的枝条上的柑橘木虱。
1.2线粒体基因序列分析及多态性位点筛选
选择来自我国广东、贵州、云南、海南、广西以及越南太平和柬埔寨暹粒等地区的9个柑橘木虱线粒体基因组序列进行比对,筛选具有核苷酸多态性的位点作为本研究进行群体多样性分析的分子标记。采用Primer3对多态性位点的上、下游序列进行引物设计,为便于测序,所扩增的PCR产物长度小于800 bp,相近的位点尽量包括于同一PCR产物内。
1.3 DNA提取、PCR扩增及测序
将单头柑橘木虱置于1.5 mL离心管中,加入若干钢珠,使用组织研磨仪(JXFSTPRP-2 上海净信实业发展有限公司)进行研磨破碎,使用BioSpin组织基因组DNA提取试剂盒(BSC0 杭州博日科技股份有限公司)提取单头柑橘木虱的总DNA,DNA提取操作流程参照产品说明书。PCR反应体系20μL:Phanta Super-Fidelity DNA Polymerase 1μL,正、反向引物(10μmol/L)各1μL,DNA模板1μL,5×SF Buffer 4μL,dNTP(10 mmol/L)1μL,加ddH2O至20μL。扩增程序:95℃预变性4 min;95℃30 s,58℃45 s,72℃60 s,进行34个循环;72℃延伸5min。PCR产物经电泳检测合格后克隆至pMD19-T Vector[宝生物生物技术(北京)有限公司]进行Sanger测序,获得片段序列。
1.4系统发育进化树分析及遗传结构分析
使用MEGA 11.0将测序获得的片段序列合并成1个序列并比对。使用DnaSP 6.12(Rozas et al.,2017)对序列进行多态性分析和单倍型多样性分析。采用最大似然法(Maximum likelihood,ML),自展值1000验证进化树分支可信度,选择HKY(Stecher et al.,2020)进行模型分析。使用MrBayes 3.2.7基于贝叶斯法(Bayesian inference,BI)构建系统发育进化树,运行1000000代,取样频率1000,取样数1000。使用PopART(Clement etal.,2002)绘制遗传单倍型网络图。
2结果与分析
2.1柑橘木虱线粒体基因序列多态性位点
对来自我国广东、贵州、云南、海南、广西以及越南太平和柬埔寨暹粒等地区的9个柑橘木虱线粒体基因组序列进行比对分析,共获得22个多态性位点(表2)。针对多态性位点区域序列设计引物并筛选获得5对有效引物(表3),包括其中8个多态性位点。
2.2广西柑橘木虱遗传多样性分析结果
对采集自广西合浦、环江、富川、西林、永福和右江6个柑橘产区的18个柑橘木虱线粒体基因进行PCR扩增和测序,获得柑橘木虱线粒体基因5个片段序列,长度分别为382、600、270、303和717bp,总长度为2272bp,这些区域包含或部分包含线粒体基因有cox2、nad5、tRNA-His、nad4、cob、nad1、16S rRNA和tRNA-Val(表3)。对本次测序获得的18个柑橘木虱线粒体基因序列进行遗传多样性分析,多态性位点数为1 平均核苷酸差异数(k)为4.11765,核苷酸多样性(π)为0.0018 核苷酸替换率(θ)为0.00179,单倍型数量为6,单倍型多样性(Hd)为0.88 单倍型多样性方差为0.00091。对18个序列进行2种中性检验检测,Tajima’s D值和Fu and Li’s F*值分别为0.04377、1.2532 差异均不显著(P>0.05)。
2.3柑橘木虱种群系统进化分析结果
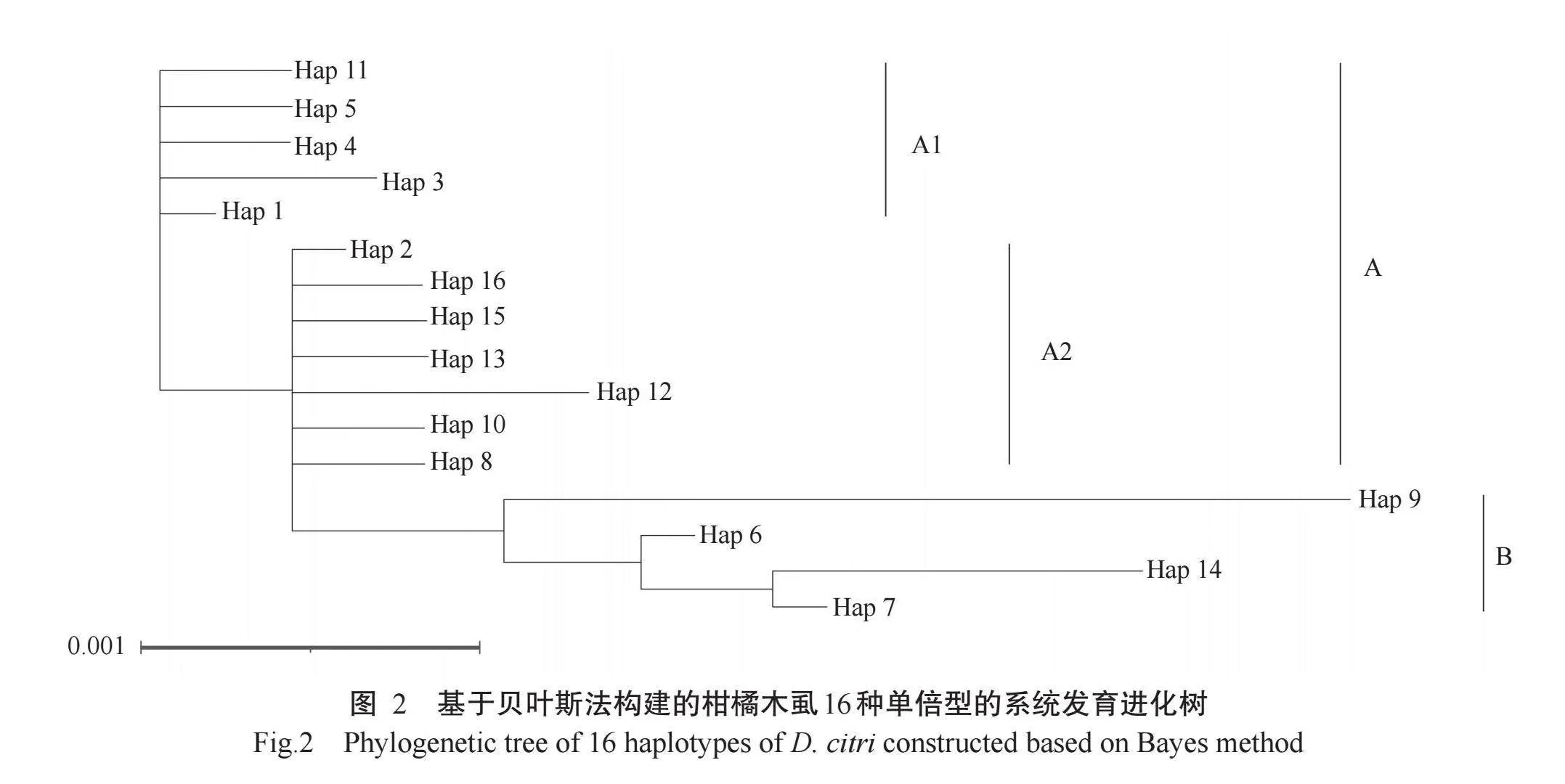
将来源于广西的18个柑橘木虱线粒体基因序列,以及从NCBI数据库中下载的25个其他地区的柑橘木虱线粒体基因序列共同分析,共鉴定得到16种单倍型(Hap 1~Hap 16)(表4)。
使用MEGA 11.0和Mrbayes 3.2.7对16种单倍型序列分别构建最大似然法(图1)和贝叶斯法系统发育进化树(图2),发现2种方法得到的进化树拓扑结构较一致。进化树中,来自巴基斯坦(Hap 9)的单倍型与来自我国和东南亚的其他单倍型距离最远,独立于最大的主分支。在主分支中,又可分为A和B两个分支,其中A分支包含了来自我国广东、湖南、江西、福建、台湾、海南以及东南亚的单倍型,B分支主要来自四川、贵州和云南。A分支包含2个亚支,其中A1亚支主要由Hap 1(广东韶关、广东惠州、广东阳春、江西吉安、江西广昌、海南海口)、Hap 3(广西玉林)、Hap 4(广西南宁)、Hap 5(湖南宜章)和Hap 11(广西合浦)的种群组成,A2亚支则包含Hap 2(中国广东揭阳、中国福建福州、中国台湾新竹、马来西亚帕亨、越南太平、印度尼西亚中爪哇)、Hap 8(柬埔寨暹粒)、Hap 10(法属留尼旺)、Hap 12(广西环江)、Hap 13(广西富川)、Hap 15(广西永福)和Hap16(广西右江)。B分支由Hap 6(四川米易、四川宁南、云南宾川、云南建水、云南瑞丽、云南保山)、Hap 7(贵州望谟)、Hap 9(巴基斯坦白沙瓦)和Hap 14(广西西林)群体组成。本次采集广西的单倍型除西林(Hap 14)聚在B分支外,其余的单倍型均分布于A分支。广西的大多数地区(合浦、富川、永福、右江、南宁和玉林)的单倍型与我国南方和东南亚的单倍型在遗传距离上较近,而紧邻贵州的西林(Hap 14)在遗传距离上与云贵川等我国西南地区高海拔的柑橘木虱种群在遗传距离上较近。
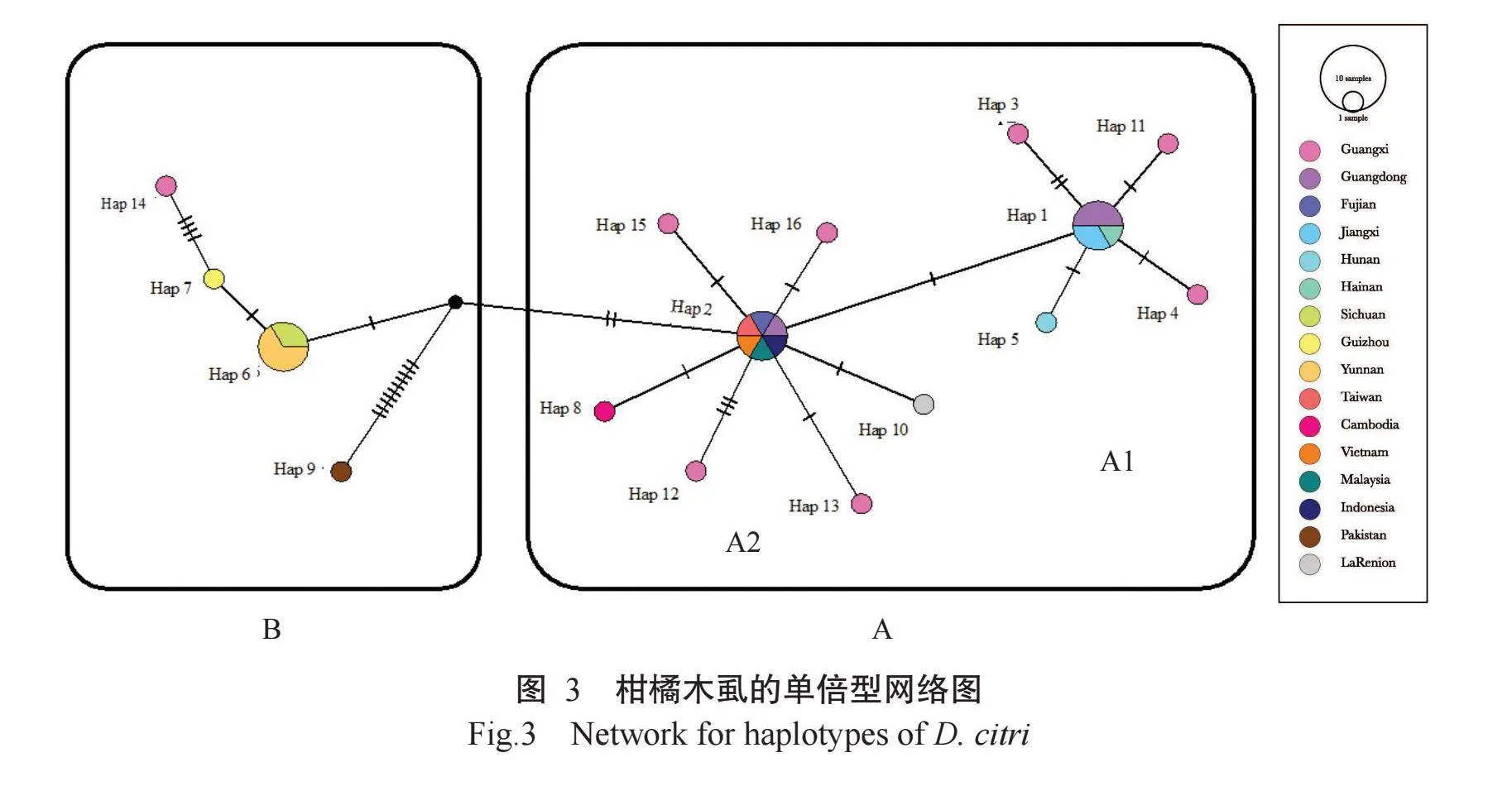
2.4单倍型网络图分析结果
使用PopART对16种单倍型的序列进行单倍型网络图构建,获得TCS单倍型网络图(图3),根据单倍型网络图可分为A和B两个种群,其中A种群又可分为A1和A2小群,A1包含5种单倍型、A2包含7种单倍型、B种群包含4种单倍型。A1小群以Hap 1为中心,4种倍型(Hap 3、Hap 4、Hap 5和Hap 11)呈星状辐射形态,4种倍型与Hap 1之间仅有1步或2步突变;A2小群以Hap 2为中心,其他6种倍型(Hap 8、Hap 10、Hap 12、Hap 13、Hap 15和Hap 16)呈星状辐射,其中除Hap 12与Hap 2之间存在3步突变外,其余5种倍型均只出现1步突变。B种群呈单向线状,从Hap 2经过3步突变成为Hap 6,再经1步突变成Hap 7,最末端的Hap 14与Hap 7之间存在4步突变。来自巴基斯坦的Hap 9单独分支在一侧,与最接近的Hap 2之间存在12步突变,说明该倍型与我国及东南亚的群体间存在较远的进化距离。整个网络图的中心在Hap 由此倍型发散出其他倍型,说明从Hap 2倍型开始发生过柑橘木虱种群扩增。
3讨论
线粒体DNA的进化速度快,具有更高的序列变异程度,因此在单物种群体遗传关系研究中应用更广(Allio etal.,2017)。利用具有多态性线粒体基因标记位点,在研究地理距离较近的柑橘木虱种群时更有效(Wang et al.,2018)。本研究对来自我国广东、贵州、云南、海南、广西以及越南太平和柬埔寨暹粒等地区的9个柑橘木虱线粒体基因组进行了序列分析,获得22个多态性位点,根据多态性位点的上、下游序列设计出5对适合的PCR引物,合并后基因片段总长2272bp,覆盖了8个多态性位点。从广西6个柑橘产区采集的18头柑橘木虱的遗传多样性分析发现,共包含6种单倍型,核苷酸多样性(π)为0.0018 单倍型多样性(Hd)为0.882。Qasim等(2018)研究发现,我国多个地区的柑橘木虱的核苷酸多样性和单倍型多样性分别为0.00402和0.76333;Wang等(2018)从广西南宁采集的20头柑橘木虱的核苷酸多样性和单倍型多样性分别为0.00017和0.511。本研究结果与Qasim等(2018)、Wang等(2018)的研究结果基本一致,呈现低的核苷酸多样性(π<0.005)和高的单倍型多样性(Hd>0.5),原因可能是广西柑橘木虱种群近期受到瓶颈效应后种群扩张所致,核苷酸多样性的积累时间远长于单倍型多样性的积累时间(邓春兴,2014)。自2003年广西实施优果工程以来,柑橘种植面积迅猛增长(杨智文,2016;陈元新和黎继红,2021),柑橘木虱管控不科学导致广西多地出现柑橘木虱暴发(蒙文考等,2021;梁载林等,2023),短期内种群大扩增可能是造成柑橘木虱单倍型多样性较高的直接原因。
本研究对来自不同国家和我国不同省(区)的柑橘木虱线粒体基因组序列,以及从广西采集的18头柑橘木虱的基因序列进行了最大似然进化树、贝叶斯进化树和单倍型网络分析,3种分析所获得的拓扑结构基本相似,主要分成2个大群,来自我国南方和东南亚的单倍型聚成一个分支,来自云贵川高原、巴基斯坦及广西西林的单倍型聚成另一个分支,与前人的多个研究结果(Boykin et al.,2012;Fuentes et al.,2018;Meng et al.,2018;Qasim et al.,2018;Wang et al.,2018)基本一致。以Hap 1为中心的A1亚支,该亚支包含来自广东、广西和湖南等地的种群,广东在国内最早发现柑橘木虱(Yang et al.,2006);从单倍型网络图可看出,来自广西合浦(Hap 11)、玉林(Hap 3)和南宁(Hap 4)与中心Hap 1之间分别存在1个或2个位点突变,说明这3个地方的柑橘木虱种群可能经由Hap 1进化而来。A2支以Hap 2单倍型为中心,散射出包括环江(Hap 12)、富川(Hap 13)、永福(Hap 15)和右江(Hap 16)4种广西单倍型,说明这些地区的柑橘木虱种群在当地出现过种群突变。本研究采集的广西6个柑橘产区的柑橘木虱中出现6种单倍型,西林位于广西西北部,紧邻云南,从单倍型的关系上看,Hap 14位于网络的末端,与云贵川高原的B分支为同一谱系,推测西林的柑橘木虱种群传自贵州望谟(Hap 7)。此外,地形对扩散能力较弱的昆虫种群遗传多样性的影响较明显,广西地势自西北向东南倾斜,西北部位于云贵高原东南边缘,多个山脉将地形分隔成若干盆地(黄冬梅等,2022),柑橘木虱飞行能力较弱,可能受地形隔绝的影响较大,容易表现出明显的分化(Zhang et al.,2019)。本研究发现地理距离与广西柑橘木虱种群的遗传分化存在相关性,与宋章蓉等(2018)关于广西柑橘木虱的群体遗传与地理距离无显著相关性的研究结果存在差异,可能是本研究采用的多态性线粒体基因位点相较于前人研究中使用的COI基因具有更高的突变概率。
4结论
广西柑橘木虱种群的单倍型多样性高、核苷酸多样性低,表现明显的种群结构分化和多样性;西林柑橘木虱种群与云贵川高原种群在遗传距离上较近,其他地区的柑橘木虱种群与我国南方和东南亚的种群更接近。广西柑橘木虱种群遗传分化受地理距离影响明显,二者存在相关性。
参考文献(References):
陈元新,黎继红.2021.广西柑橘生产现状及发展前景探索[J].南方农业,15(12):189-190.[ChenYX,Li J H.2021.Exploration of the current status and development pros-pects of citrus production in Guangxi[J].South China Agriculture,15(12):189-190.]doi:10.19415/j.cnki.1673-890x.2021.12.088.
邓春兴.2014.基于COI基因序列的中国东南沿海四指马鲅属鱼类的遗传多样性分析[D].广州:暨南大学.[Deng C X.2014.Genetic diversity of Eleutheronema in the East and South China Seas based on mitochondrial COI gene sequences analysis[D].Guangzhou:Jinan University.]
黄冬梅,陈燕丽,莫建飞,黄肖寒,毛宜川,覃弼勇.2022.广西典型地貌植被覆盖度随地形的变化特征[J].广西林业科学,51(5):626-633.[Huang D M,Chen Y L,Mo J F,Huang X H,Mao Y C,Qin B Y.2022.Vegetation coverage change characteristics of typical landforms in Guangxi with topography[J].Guangxi Forestry Science,51(5):626-633.]doi:10.19692/j.issn.1006-1126.20220505.
李中波,侯强红,李晖,舒鸣.2022.湘西地区吕氏泰勒虫的单倍型多样性及种系发育关系分析[J].河南农业科学,51(4):130-137.[Li Z B,Hou Q H,Li H,Shu M.2022.Hap-lotype diversity and phylogenetic relationships of Theilerialuwenshuni from Western Hunan[J].Journal of Henan Agricultural Sciences,51(4):130-137.]doi:10.15933/j.cnki.1004-3268.2022.04.015.
梁载林,梁旻雯,邓铁军,刘吉敏,刘丽辉.2023.柑橘木虱与柑橘黄龙病相关性、暴发原因与防治对策[J].植物检疫,37(3):26-30.[Liang Z L,Liang M W,Deng T J,Liu J M,Liu L H.2023.Outbreak causes and control strategies of the Diaphorinacitri and its relation with citrus Huanglong-bing[J].Plant Quarantine,37(3):26-30.]doi:10.19662/j.cnki.issn 1005-2755.2023.03.006.
罗育发,吴凯,付丹,王艾平,徐兵.2019.江西亚洲柑橘木虱的种群遗传结构研究[J].植物保护,45(3):55-59.[Luo Y F,Wu K,Fu D,Wang A P,Xu B.2019.Population genetic structure of the Asian citrus psyllid,DiaphorinacitriKuwayama(Hemiptera:Liviidae)in Jiangxi[J].Plant Protection,45(3):55-59.]doi:10.16688/j.zwbh.2018234.
吕丽兰,陈琦,徐勇,罗清,吴凤,邹承武,何新华.2022.柑橘果实中的微生物多样性与黄龙病症状的相互关系研究[J].基因组学与应用生物学,41(1):148-158.[LüL L,Chen Q,Xu Y,Luo Q,Wu F,Zou C W,He X H.2022.Relationship between endophytic microbial diversity andsymptoms of Huanglongbing in the fruits of Citrus reticu-late[J].Genomics and Applied Biology,41(1):148-158.]doi:10.13417/j.gab.041.000148.
蒙文考,黄奕蔓,李宜爽,朱文倩,任立云,廖咏梅.2021.2020年广西象州县柑橘木虱爆发的原因分析及柑橘黄龙病菌检测[J].农业研究与应用,34(2):68-75.[Meng W K,Huang Y M,Li Y S,Zhu W Q,Ren L Y,Liao Y M.2021.Cause analysis of Diaphorinacitri outbreak in Xiangzhou County of Guangxi in 2020 and detection of Candidatus Liberibacter asiaticus[J].Agricultural Research and Appli-cation,34(2):68-75.]doi:10.3969/j.issn.2095-0764.2021.02.012.
宋章蓉,李翌菡,欧达,邱宝利,桑文.2018.基于COI基因的华南地区柑橘木虱系统发育研究[J].亚热带植物科学,47(1):18-22.[Song Z R,Li Y H,Ou D,Qiu B L,Sang W.2018.Phylogenetic analysis of Diaphorinacitri from Southern China based on COI gene[J].Subtropical Plant Science,47(1):18-22.]doi:10.3969/j.issn.1009-7791.2018.01.004.
杨智文.2016.“十三五”广西柑橘产业发展对策研究[D].南宁:广西大学.[Yang Z W.2016.Study on the develop-mental countermeasure of Guangxi’s citrus industry in the 13th Five-Year-Plan[D].Nanning:Guangxi University.]
赵卓,刘晨阳,瓮青芬,王保海,翟卿.2023.茶六斑褐锦斑蛾Soritapulchella线粒体基因组特征与系统发育分析[J].河南农业大学学报,57(2):277-287.[Zhao Z,Liu C Y,Weng Q F,Wang B H,Zhai Q.2023.Characterization of the mitochondrial genome and phylogenetic analysis of Soritapulchella[J].Journal of Henan Agricultural Univer-sity,57(2):277-287.]doi:10.16445/j.cnki.1000-2340.202 21110.001.
Ajene I,Khamis F,van Asch B,Pietersen G,Seid N,Wairimu AW,Ombura F L,Akutse K,Sétamou M,Subramanian S,Mohammed S,Ekesi S.2022.Genetic diversity of Diapho-rinacitri(Hemiptera:Liviidae)unravels phylogeographic structure and invasion history of eastern African popula-tions[J].Ecology and Evolution,12(7):e9090.doi:10.1002/ece3.9090.
Allio R,Donega S,Galtier N,Nabholz B.2017.Large variation in the ratio of mitochondrial to nuclear mutation rate across animals:Implications for genetic diversity and the use of mitochondrial DNA as a molecular marker[J].Mo-lecular Biology and Evolution,34(11):2762-2772.doi:10.1093/molbev/msx 197.
Alquézar B,Carmona L,Bennici S,Miranda M P,Bassanezi R B,Peña L.2022.Cultural management of Huanglongbing:Current status and ongoing research[J].Phytopathology,112(1):11-25.doi:10.1094/PHYTO-08-21-0358-IA.
Boykin L M,De Barro P,Hall D G,Hunter W B,McKenzie C L,Powell C A,Shatters Jr R G.2012.Overview of world-wide diversity of DiaphorinacitriKuwayamamitochon-drial cytochrome oxidase 1 haplotypes:Two Old World lineages and a New World invasion[J].Bulletin of Ento-mological Research,102(5):573-582.doi:10.1017/S000 7485312000181.
Clement M,Snell Q,Walker P,Posada D,Crandall K.2002.TCS:Estimating gene genealogies[C]//Proceedings 16th International Parallel and Distributed Processing Sympo-sium.Fort Lauderdale:IEEE.doi:10.1109/IPDPS.2002.1016585.
Dala-Paula B M,Plotto A,Bai J,Manthey A J,Baldwin A E,Ferrarezi S R,Gloria M.2019.Effect of Huanglongbing or greening disease on orange juice quality,a review[J].Fron-tiers in Plant Science,9:1976.doi:10.3389/fpls.2018.01976.
Dong Z K,Wang Y Z,Li C,Li L L,Men X Y.2021.Mitochon-drial DNA as a molecular marker in insect ecology:Cur-rent status and future prospects[J].Annals of the Entomo-logical Society of America,114(4):470-476.doi:10.1093/aesa/saab020.
Fuentes A,Braswell W E,Ruiz-Arce R,Racelis A.2018.Genetic variation and population structure of Diaphorinacitri using cytochrome oxidase I sequencing[J].PLoS One,13(6):e0198399.doi:10.1371/journal.pone.0198399.
Gottwald T R.2010.Current epidemiological understanding of citrus Huanglongbing[J].Annual Reviews Phytopatho-logy,48(1):119-139.doi:10.1146/annurev-phyto-073009-114418.
Hall D G,Richardson M,Ammar El D,Halbert S.2012.Asian citrus psyllid,Diaphorinacitri,vector of citrus Huanglong-bing disease[J].EntomologiaExperimentalis et Applicata,146(2):207-223.doi:10.1111/eea.12025.
Meng L X,Wang Y M,Wei W H,Zhang H Y.2018.Populationgenetic structure of DiaphorinacitriKuwayama(Hemip-tera:Liviidae):Host-driven genetic differentiation in China[J].Scientific Reports,8:1473.doi:10.1038/s41598-018-19533-5.
Qasim M,Wang B H,Zou H S,Lin Y W,Dash C K,Bamisile B S,Hussain M,Zhao Z W,Wang L D.2018.Phyloge-netic relationship and genetic diversity of citrus psyllid populations from China and Pakistan and their associated Candidatus bacterium[J].Molecular Phylogenetic Evolu-tion,126(1):173-180.doi:10.1016/j.ympev.2018.04.028.
Rozas J,Ferrer-Mata A,Sánchez-DelBarrio J C,Guirao-Rico S,Librado P,Ramos-Onsins S E,Sánchez-Gracia A.2017.DnaSP 6:DNA sequence polymorphism analysis of large data sets[J].Molecular Biology and Evolution,34(12):3299-3302.doi:10.1093/molbev/msx248.
Stecher G,Tamura K,Kumar S.2020.Molecular evolutionary genetics analysis(MEGA)for macOS[J].Molecular Bio-logy and Evolution,37(4):1237-1239.doi:10.1093/mo-lbev/msz312.
Wang N,Pierson E A,Setubal J C,Xu J,Levy J G,Zhang Y Z,Li J Y,Rangel L T,Martins Jr J.2017a.The Candidatus Liberibacter-Host interface:Insights into pathogenesis mechanisms and disease control[J].Annual Reviews Phy-topathology,55:451-482.doi:10.1146/annurev-phyto-08 0516-035513.
Wang Y J,Halbert S,Mohamed S D H,Reynaud B,Beattie GA C,Holford P,Lu J M,Cen Y J.2021.Mitochondrial genomes reveal diverse lineages of Diaphorinacitri Ku-wayama(Hemiptera:Sternorrhyncha:Psyllidae)in Kenya and La Réunion[J].Biological Invasions,23(10):3109-3117.doi:10.1007/s 10530-021-02560-1.
Wang Y J,Lu J M,Beattie G A,Islam M R,Om N,Dao H T,Nguyen V L,Zaka S M,Guo J,Tian M Y,Deng X L,Tan S Y,Holford P,He Y,Cen Y.2018.Phylogeography of Diaphorinacitri(Hemiptera:Liviidae)and its primary endosymbiont,‘Candidatus Carsonellaruddii’:An evolu-tionary approach to host-endosymbiont interaction[J].Pest Management Science,74(9):2185-2194.doi:10.1002/ps.4917.
Wang Y J,Xu C B,Tian M Y,Deng X L,Cen Y J,He Y R.2017b.Genetic diversity of Diaphorinacitri and its endo-symbionts across east and south-east Asia[J].Pest Ma-nagement Science,73(10):2090-2099.doi:10.1002/ps.4582.
Wu F N,Jiang H Y,Beattie GA C,Holford P,Chen J C,Wallis C M,Zheng Z,Deng X L,CenY J.2018.Population diver-sity of Diaphorinacitri(Hemiptera:Liviidae)in China based on whole mitochondrial genome sequences[J].Pest Management Science,74(11):2569-2577.doi:10.1002/ps.5044.
Yang Y P,Huang M D,Beattie G A C,Xia Y L,Ouyang G,Xiong J J.2006.Distribution,biology,ecology and control of the psyllidDiaphorinacitriKuwayama,a major pest of citrus:A status report for China[J].International Journal of Pest Management,52(4):343-352.doi:10.1080/0967 0870600872994.
Zhang C,Xiong X,Liu X,Zou Z W,Xin T R,Wang J,Xia B.2019.Diaphorina citri(Hemiptera:Psylloidea)in China:Two invasion routes and three transmission paths[J].Jour-nal of Economic Entomology,112(3):1418-1427.doi:10.1093/jee/toz046.
(责任编辑麻小燕)

