基于高通量测序分析槲皮素对家蚕生长、产丝量及肠道菌群多样性的影响







摘要:【目的】基于高通量测序分析槲皮素对家蚕生长、产丝量及肠道菌群多样性的影响,探究槲皮素在家蚕肠道微生态调控中的作用,为功能性蚕丝的高质量生产提供理论依据。【方法】选取240头品种为9芙×7湘的家蚕分为3组,对照组(NC组)喂食普通桑叶,低剂量槲皮素组(LQR组)和高剂量槲皮素组(HQR组)分别喂食含有1.25%(w/w)和5.00%(w/w)槲皮素的桑叶,从五龄眠起(五龄第1 d)开始连续添食6 d,测定家蚕平均生长速率、存活率和蚕茧质量指标,利用高通量测序分析家蚕肠道菌群的组成。【结果】家蚕添食槲皮素后,平均生长速率减缓,存活率降低,HQR组的全茧量、茧层量和茧层率均显著低于NC组(P<0.05,下同)。添食槲皮素可增加家蚕肠道菌群的丰富度和多样性,HQR组和NC组的家蚕肠道菌群物种组成差异显著。在门分类水平上,各组的优势菌门均为变形菌门、蓝细菌门和厚壁菌门;与NC组相比,HQR组变形菌门的相对丰度显著降低。在属分类水平上,各组的优势菌属均为无色杆菌属、甲基杆菌属、norank f norank o Chloroplast、鞘氨醇单胞菌属和不动杆菌属;与NC组相比,HQR组无色杆菌属的相对丰度显著降低。KEGG信号通路分析结果显示,HQR组肠道菌群注释到全局和概述图及能量代谢通路的比例均显著高于NC组,而注释到氨基酸代谢和膜转运通路的比例均显著低于NC组;COG功能注释分析结果表明,HQR组注释到氨基酸转运和代谢、能量生成和转换及无机离子转运和代谢类别的比例均显著低于NC组,与KEGG信号通路分析结果相符,说明HQR组家蚕需要消耗更多的能量用于维持正常生长,同时蛋白质的生物合成受限制,不利于家蚕的生长和丝蛋白的合成。【结论】在桑叶中添加槲皮素会引起家蚕肠道菌群组成的变化,使变形菌门和无色杆菌属的相对丰度降低,导致家蚕能量代谢提高,氨基酸代谢、能量生成和转换及膜转运等方面能力下降,影响家蚕生长和产丝量。
关键词:家蚕;槲皮素;肠道菌群;代谢功能;高通量测序
中图分类号:S881.2文献标志码:A文章编号:2095-1191(2024)07-1981-11
Effects of quercetin on the growth,silk yield and gut microbiota diversity in silkworms based on high-throughput sequencing
CHEN Wen-kai ZHONG Yang-sheng LI Hong-xia CHEN Fang-yan1*
(1College of Animal Science,South China Agricultural University,Guangzhou,Guangdong 51064 China;2College of Animal Science,Ganzhou Polytechnic,Ganzhou,Jiangxi 341008,China)
Abstract:【Objective】This study employed high-throughput sequencing to evaluate the effects of quercetin on the growth,silk yield,and gut microbiota diversity of silkworms,to elucidate quercetin’s regulatory function on the silk-worm gut microecology,thereby providing a theoretical foundation for the high-quality production of functional silk.【Method】A total of 240 silkworms of the 9 Fu×7 Xiang breed were selected and divided into 3 groups:a control group(NC group)fed with ordinary mulberry leaves,a low-dose quercetin group(LQR group)fed with mulberry leaves con-taining 1.25%(w/w)quercetin,and a high-dose quercetin group(HQR group)fed with mulberry leaves containing 5.00%(w/w)quercetin.Beginning at the fifth instar(day 1 of the fifth instar),the silkworms were fed continuously for 6 d.The average growth rate,survival rate and cocoon quality indexes were measured,the silkworms’gut microbiota compo-sition was analyzed via high-throughput sequencing.【Result】After quercetin was supplemented into the silkworms’diet,their average growth rate slowed down,and survival rate decreased.The cocoon mass,cocoon shell mass,and rate of co-coon shell in the HQR group were significantly lower than those in the NC group(P<0.05,the same below).The addition of quercetin enhanced the richness and diversity of the silkworm gut microbiota,with a significant difference in species composition observed between the HQR and NC groups.At the phylum level,the dominant bacterial phyla in all groups were Proteobacteria,Cyanobacteria,and Firmicutes.Compared with the NC group,the relative abundance of Proteobac-teria in the HQR group was significantly reduced.At the genus level,the dominant bacterial genera in all groups were Achromobacter,Methylobacterium,norank f norank o Chloroplast,Sphingomonas and Acinetobacter.The relative abundance of Achromobacter in the HQR group was significantly reduced compared with the NC group.The KEGG signal pathway analysis results showed that the proportion of gut microbiota in the HQR group which annotated to global and overview maps as well as energy metabolism pathways was significantly higher than in the NC group.In contrast,the pro-portion that annotated to amino acid metabolism and membrane transport pathways was significantly lower than in the NC group.Similarly,COG functional annotation analysis revealed that the HQR group had a significantly lower proportion of annotations related to amino acid transport and metabolism,energy production and conversion,and inorganic ion trans-port and metabolism compared to the NC group.These findings aligned with the KEGG pathway analysis,suggesting that silkworms in the HQR group needed to expend more energy to sustain normal growth,while protein biosynthesis was hin-dered,negatively affecting both silkworm growth and silk protein synthesis.【Conclusion】The addition of quercetin to mulberry leaves alters the composition of the silkworm gut microbiota,reducing the relative abundance of Proteobacteria and Achromobacter.This shift leads to an increase in energy metabolism,but a reduction in the efficiency of amino acid metabolism,energy production and conversion,and membrane transport,ultimately impairing silkworm growth and re-ducing silk yield.
Key words:silkworm;quercetin;gut microbiota;metabolic function;high-throughput sequencing
Foundation items:General Project of National Natural Science Foundation of China(31970463);Guangdong Mo-dern Agricultural Industry Technology System(Sericulture)Innovation Team Development Project(2022KJ124)
0引言
【研究意义】家蚕是一种能吐丝结茧的重要养殖动物,也是目前已知唯一能高效率合成分泌天然丝蛋白、形成高分子长纤维的昆虫,具有巨大的经济价值(Chen et al.,2023)。通过人工添食槲皮素可提高蚕丝的强伸力,增加蚕丝抗氧化、抗紫外能力并赋予蚕丝独特的荧光特性(严会超等,2023,2024),对推动蚕丝的功能化改性与附加价值提升具有重要意义。肠道微生物在家蚕的生产性能、健康状况及营养消化吸收等方面发挥重要作用,槲皮素作为一种典型的植物次生代谢物具有明显的抑菌作用,添食槲皮素对家蚕生长发育和茧丝产量的影响是否源于肠道菌群的变化,目前尚未明确。因此,分析添食槲皮素后家蚕肠道菌群多样性的变化有利于探究槲皮素对家蚕生长与茧丝合成的调控与影响机制,对开发高性能茧丝具有重要意义。【前人研究进展】家蚕是寡食性昆虫,桑叶是其唯一的食物来源。家蚕幼虫在五龄期食下大量桑叶,从桑叶中吸收的营养物质大部分用于丝腺的生长与丝蛋白的合成(Xu et al.,2019)。桑叶中富含大量的黄酮类物质,其中含量丰富的槲皮素具有抗菌、抗氧化等多种功能(Shabir et al.,2022;Aghababaei and Hadidi,2023;Carrillo-Martinez et al.,2024)。槲皮素进入家蚕体内后经过一系列的糖基化修饰作用,会在蚕茧中积累,进而赋予蚕丝特殊的性能(Daimon et al.,2010;Xu etal.,2013),部分茧丝所呈现的荧光和黄绿色泽就与槲皮素等黄酮类化合物有关(Lu et al.,2023;Waizumi et al.,2024)。然而,当添食槲皮素超过一定剂量时,对家蚕的生长发育会产生抑制作用。Zhang等(2012)用含槲皮素的饲料喂养家蚕幼虫,结果发现家蚕幼虫生长受抑制;唐佳琪(2022)研究发现在饲料中添加1.02 mg/mL的桑叶黄酮类化合物会显著降低五龄家蚕的生长率和食物利用率。家蚕的中肠是桑叶主要的吸收场所,也是肠道微生物的主要活动区域,肠道微生物群落在宿主的消化、解毒、发育、抵抗病原菌和其他生理功能中起重要作用(张振宇等,2017;全爽等,2023)。肠道菌群的组成与家蚕生长和产丝量关系密切(李庆荣等,2023),张雨丽等(2022)研究发现家蚕肠道内肠球菌属(Enterococcus)相对丰度与茧层量呈显著正相关,柯克斯体属(Coxiella)的相对丰度与茧层量呈显著负相关但与蛹重呈显著正相关,而葡萄球菌属(Staphy-lococcus)相对丰度与蛹重呈显著负相关。【本研究切入点】至今,有关槲皮素对家蚕肠道微生物的影响鲜见报道,家蚕肠道菌群结构和多样性与产丝量是否存在关联也有待进一步探究。【拟解决的关键问题】以9芙×7湘为供试家蚕品种,分别喂食含有不同剂量槲皮素的桑叶,测定家蚕平均生长速率、存活率和蚕茧质量指标,利用高通量测序分析家蚕肠道菌群的组成以及槲皮素在家蚕肠道菌群调控中的作用机制和对产丝量的影响,探究槲皮素在家蚕肠道微生态调控中的作用,为功能性蚕丝的高质量生产提供理论依据。
1材料与方法
1.1试验材料
家蚕品种为9芙×7湘,由广东省蚕业技术推广中心提供;新鲜桑叶采集自华南农业大学桑园;槲皮素(纯度95%)购自陕西圣青常青藤生物科技有限公司;DNA抽提试剂盒(E.Z.N.A.®Soil DNA Kit)购自美国Omega Bio-Tek公司;DNA凝胶回收纯化试剂盒(PCR Clean-Up Kit C01-10000)购自中高逾华生物技术有限公司;建库试剂盒(NEXTFLEX®Rapid DNA-Seq Kit)购自美国Bioo Scientific公司。
1.2添食槲皮素处理
试验于2022年9月在华南农业大学亚太地区蚕桑培训中心进行,家蚕的饲养环境湿度为70%~75%,温度为24~25℃。槲皮素添食剂量参考严会超等(2023)的研究结果并稍加改进,分别为0、1.25%(w/w)和5.00%(w/w),依据槲皮素占新鲜桑叶的质量分数称取槲皮素粉末,溶解在蒸馏水中制成槲皮素混悬液,经超声处理20min后,均匀涂覆在新鲜桑叶表面,并置于室温环境自然晾干,制成含有不同剂量槲皮素的桑叶。选取240头五龄眠起(五龄第1 d)的健康家蚕分为3组,每组80头,对照组(NC组)喂食普通新鲜桑叶(槲皮素含量为0),低剂量槲皮素组(LQR组)喂食含有1.25%(w/w)槲皮素的桑叶,高剂量槲皮素组(HQR组)喂食含有5.00%(w/w)槲皮素的桑叶,每组每次喂食60 g桑叶,每隔8 h给食1次,连续添食6 d,直至家蚕完成吐丝。试验期间,每晚21:00最后1次喂食前,每组随机选取10头家蚕测定平均体质量,设3次重复,计算各组家蚕生长速率,生长速率(g/d)=(终末平均体质量-初始平均体质量)/试验天数。同时,统计各组家蚕的存活率。在家蚕结茧后第5~8 d收集各组蚕茧,将新鲜蚕茧放入烘箱,60℃恒温干燥1h,取出放至常温后用密封袋分装保存。每组随机选取30个蚕茧,统计全茧量、茧层量和茧层率。
1.3肠道微生物DNA提取及16S rRNA测序
添食槲皮素6 d后,每组随机选取10头家蚕,用70%乙醇浸泡1 min进行体表消毒,无菌水冲洗3次,剖取完整肠道,剔除马氏管等组织后置于无菌离心管中,液氮速冻后置于-80℃冰箱保存,每组设3次重复。
按照E.Z.N.A.®Saidoil DNA Kit说明提取微生物群落总基因组DNA,用1%琼脂糖凝胶电泳检测DNA质量,采用NanoDrop 2000超微量分光光度计(美国ThermoFisher Scientific公司)测定DNA浓度和纯度。以提取的DNA为模板,使用携带Barcode序列的上游引物338F(5'-ACTCCTACGGGAGGCA GCAG-3')和下游引物806R(5'-GGACTACHVGGG TWTCTAAT-3')对16S rRNA序列V3~V4可变区进行PCR扩增(Liu et al.,2016)。PCR扩增产物采用DNA凝胶回收纯化试剂盒进行纯化,使用Qubit 4.0荧光定量仪(美国ThermoFisher Scientific公司)进行定量分析。采用NEXTFLEX®Rapid DNA-Seq Kit对纯化后的PCR扩增产物进行建库,利用Illumina PE300/PE250平台进行测序。
1.4生物信息学分析
对测序获得的原始序列进行质控,使用FLASH(version 1.2.11)进行拼接(Magočand Salzberg,2011),使用UPARSE(version 7.1)根据97%相似度对质控拼接后的序列进行操作分类单元(OTU)聚类并去除嵌合体(Edgar,2013)。为减少测序深度对后续多样性分析的影响,将所有样本序列数抽平至20000,利用RDP classifier比对SILVA数据库(release 138)进行OTU物种分类注释,置信度阈值为70%,基于不同物种分类水平统计每个样本的群落组成和显著差异物种。采用Mothur进行Alpha多样性分析,计算ACE指数、Shannon指数和Simpson指数等;ACE指数反映样品中群落的丰富度,Shannon指数及Simp‐son指数受样品群落中物种丰富度和物种均匀度的影响,较大的Shannon指数与较小的Simpson指数表明菌群多样性较高(胡博等,2022)。使用基于Bray-Curtis距离算法的主坐标分析(PCoA)检验样本间微生物群落结构的相似性,利用置换多元方差分析(PERMANOVA)检验样本间微生物群落结构差异显著性。使用PICRUSt2(version 2.2.0)对家蚕肠道菌群进行KEGG信号通路分析和同源蛋白簇(COG)功能注释分析(Douglas et al.,2020)。
1.5统计分析
试验数据以平均值±标准差的形式表示,采用SPSS 22.0进行单因素方差分析(One-way ANOVA)和独立样本t检验,分析组间差异显著性。
2结果与分析
2.1槲皮素对家蚕生长的影响
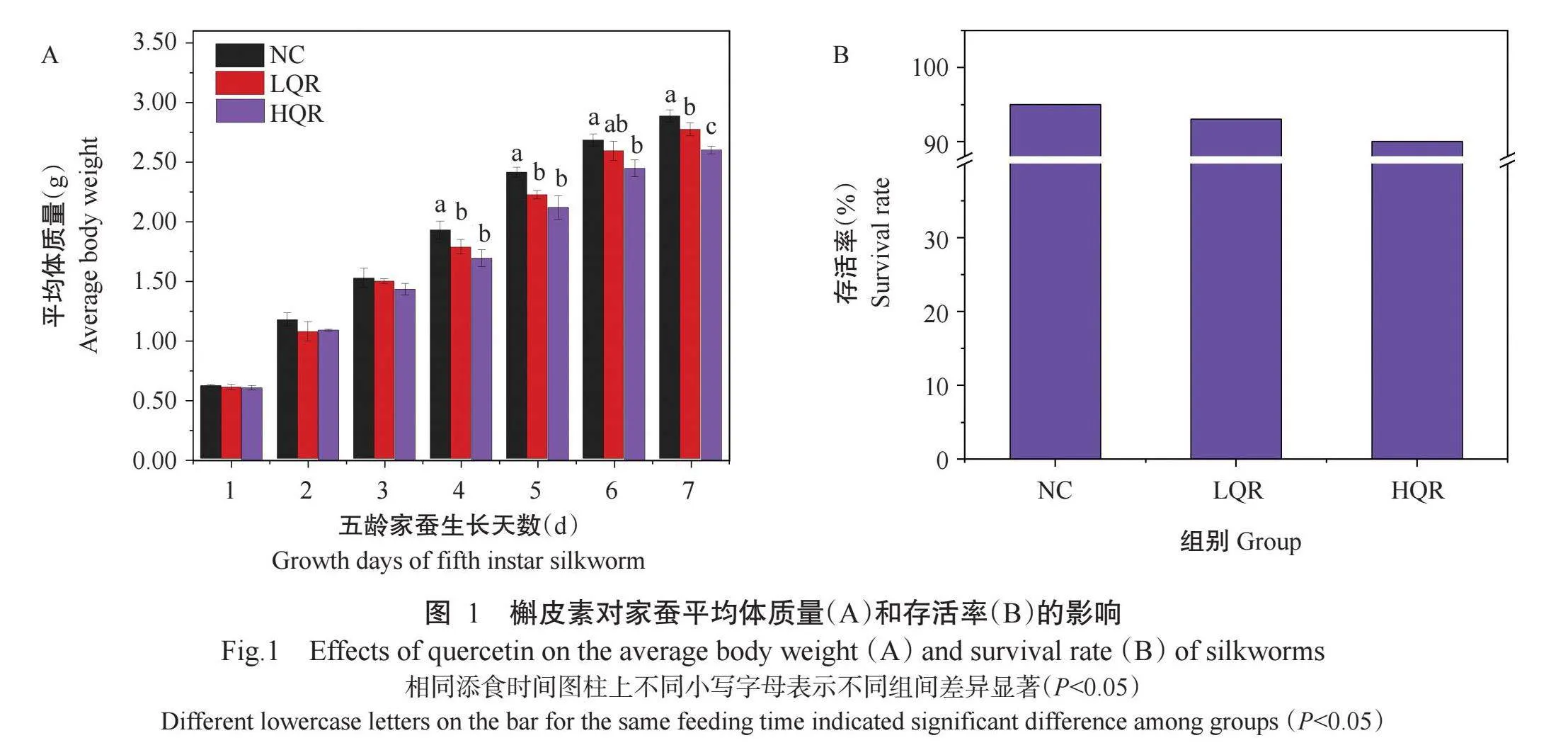
通过对家蚕平均体质量及存活率进行统计分析,探究槲皮素对家蚕生长情况的影响。如图1-A所示,随着五龄家蚕生长天数的增加,各组家蚕的平均体质量均呈增长趋势,NC组家蚕的平均生长速率为0.38 g/d,LQR组和HQR组平均生长速率分别为0.36 g/d和0.33 g/d,均比NC组缓慢;至五龄第7 d,LQR组和HQR组家蚕的平均体质量均显著低于NC组(r<0.05,下同)。如图1-B所示,虽然各组家蚕的存活率均超过90%,但LQR组和HQR组均低于NC组,说明试验所用槲皮素剂量会对家蚕的生长发育产生不利影响。
2.2槲皮素对家蚕产丝量的影响
全茧量、茧层量及茧层率是衡量蚕茧质量的核心指标,可反映蚕丝产量(Chen et al.,2023)。各组的蚕茧质量见表 NC组的全茧量、茧层量和茧层率分别为1.23 g、0.27 g和21.87%,LQR组与NC组间无显著差异(r>0.05,下同);但HQR组的全茧量(1.01 g)、茧层量(0.19 g)和茧层率(19.16%)均显著低于NC组,表明高剂量的槲皮素不利于家蚕生长和丝蛋白的合成。
2.3不同槲皮素添食剂量的家蚕肠道菌群Alpha多样性分析结果
Coverage指数反映样本文库的覆盖率,由表2可知,各组的Coverage指数均为0.99,说明测序深度已基本覆盖样品中的所有物种,可全面准确地反映物种信息。ACE指数反映样品中群落的丰富度,Shannon指数及Simpson指数反映群落的多样性。随着槲皮素添食剂量的增加,ACE指数具有升高趋势,LQR组和HQR组的ACE指数均较NC组提高,但无显著差异;与NC组相比,HQR组的Shannon指数显著提高,而Simpson指数显著降低,说明添食槲皮素可增加家蚕肠道菌群的丰富度和多样性。
2.4不同槲皮素添食剂量的家蚕肠道菌群结构分析结果
利用韦恩图显示各组家蚕肠道菌群间共有和独有的物种数目,以分析各组物种组成相似性及重叠情况。如图2-A所示,NC组、LQR组和HQR组共有的OTU数目为44个,NC组特有的OTU数目为75个,LQR组特有的OTU数目为173个,HQR组特有的OTU数目为283个,说明添食槲皮素可提高家蚕肠道菌群的丰富度,与Alpha多样性的ACE指数变化趋势一致。为探究不同组间的物种多样性差异,基于OTU丰度进行PCoA分析,结果如图2-B所示,PCoA1和PCoA2的贡献率分别为56.81%和16.18%。不同样品间的距离表示物种组成的差异情况,样品距离越近,说明菌群组成结构越相似,差异性越小。NC组和HQR组间的距离较远,分离较为明显(R=0.514 P=0.03),表明HQR组和NC组的肠道菌群物种组成差异显著。
2.5不同槲皮素添食剂量的家蚕肠道菌群物种组成分析结果
2.5.1门分类水平的家蚕肠道菌群组成分析结果门分类水平上的菌群组成分析结果如图3-A所示,NC组、LQR组和HQR组家蚕肠道菌群中含量最丰富的均是变形菌门(Proteobacteria),其次是蓝细菌门(Cyanobacteria)和厚壁菌门(Firmicutes)。添食槲皮素并未引起家蚕肠道细菌物种种类的较大变化,而是引起了相对丰度的变化。变形菌门在NC组、LQR组和HQR组中分别占总菌群的94.08%、91.15%和75.16%,为绝对优势菌门;与NC组相比,HQR组变形菌门相对丰度显著降低,降幅达20.11%(图3-B)。各组间的蓝细菌门和厚壁菌门相对丰度均无显著差异,但HQR组较其他组明显增加(图3-C和图3-D)。
2.5.2属分类水平的家蚕肠道菌群组成分析结果在属分类水平上,排名前5的优势菌属分别为无色杆菌属(Achromobacter)、甲基杆菌属(Methylo-bacterium)、norank f norank o Chloroplast、鞘氨醇单胞菌属(Sphingomonas)和不动杆菌属(Acineto-bacter),无色杆菌属在各组中均处于优势地位(图4-A)。NC组和LQR组在属分类水平上的菌群组成具有很高相似性,无色杆菌属、甲基杆菌属和norank_f__norank o Chloroplast的相对丰度均无显著差异(图4-B~图4-D)。NC组和HQR组的无色杆菌属相对丰度分别为84.41%和57.71%,HQR组较NC组显著降低,降幅达31.63%(图4-B)。各组间甲基杆菌属和norank f norank o Chloroplast的相对丰度均无显著差异,但HQR组较其他组明显增加(图4-C和图4-D)。
2.6不同槲皮素添食剂量的家蚕肠道菌群功能预测分析结果
2.6.1 KEGG信号通路分析结果通过PICRUSt2进行KEGG信号通路分析,探究肠道菌群与家蚕生长发育间的关系。NC组、LQR组和HQR组家蚕肠道菌群涉及的二级通路主要为全局和概述图(Global and overview maps)、氨基酸代谢(Amino acid metabo-lism)、碳水化合物代谢(Carbohydrate metabolism)、膜转运(Membrane transport)、能量代谢(Energy me-tabolism)等(图5-A)。NC组和LQR组注释到主要通路的比例无显著差异,其中比例最高的是全局和概述图通路(图5-B)。而HQR组肠道菌群注释到全局和概述图及能量代谢通路的比例均显著高于NC组,注释到氨基酸代谢和膜转运通路的比例均显著低于NC组,说明HQR组家蚕不仅需要消耗更多的能量以维持生长,同时丝蛋白的生物合成受限制,可能是HQR组家蚕生长速率和产丝量降低的重要原因。
2.6.2 COG功能注释分析结果利用PICRUSt2进行COG功能注释分析,将测序结果与COG数据库进行比对,结果如图6-A所示,NC组、LQR组和HQR组肠道菌群注释到最多的COG功能类别是氨基酸转运和代谢(Amino acid transport and metabo-lism),氨基酸是组成蛋白质的基本单元,对家蚕的生长发育和丝蛋白的合成分泌起关键作用。其次为无机离子转运和代谢(Inorganic ion transport and metabolism)、能量生成和转换(Energy production and conversion)、转录(Transcription)及细胞壁/膜/被膜的生物合成(Cell wall/membrane/envelope biogene-sis)等与生物合成代谢相关的类别。NC组和LQR组的COG功能类别组成较相似,注释到主要类别的比例无显著差异(图6-B)。而HQR组肠道菌群注释到氨基酸转运和代谢、能量生成和转换及无机离子转运和代谢类别的比例均显著低于NC组,与KEGG信号通路分析结果相符,说明HQR组家蚕需要消耗更多的能量用于维持正常生长,体内能量积累的减少及氨基酸转运和代谢的降低不利于家蚕的生长和丝蛋白合成分泌。
3讨论
本研究中,家蚕添食槲皮素后,平均生长速率减缓,存活率降低,与Zhang等(2012)、唐佳琪(2022)的研究结果一致。家蚕对食物中碳水化合物、氨基酸和蛋白质等营养物质的吸收利用是影响其生长发育及产丝量的最主要因素(Konala etal.,2013)。高剂量的槲皮素可能抑制了家蚕对营养物质的吸收利用。有研究分析了槲皮素抑制鳞翅目昆虫生长发育的机制,Divekar等(2023)、Zhou等(2024)认为槲皮素通过抑制动物体内蛋白酶和淀粉酶等消化酶活性,降低其对营养物质的消化和吸收能力。Shi等(2020)发现槲皮素可抑制抗氧化酶和解毒酶活性,从而削弱免疫系统,影响家蚕生长发育并导致其死亡率增加。Bahadoran等(2013)、Mzhel’skaya等(2019)则认为槲皮素通过干扰糖的代谢途径及脂肪酸的合成与分解,影响能量的生成和利用。
为进一步探究槲皮素对微生物的抑制作用是否会改变肠道菌群的物种组成,进而影响家蚕生长和产丝量,本研究对不同槲皮素添食剂量的五龄家蚕肠菌群组成进行分析,发现家蚕肠道菌群以变形菌门、蓝细菌门和厚壁菌门等为优势菌门;与杜仲梦尼夜蛾(Orthosia songi)、斜纹夜蛾(Spodoptera litura)、舞毒蛾(Lymantria dispar)和草地贪夜蛾(Spodop-tera frugiperda)等其他鳞翅目昆虫肠道菌群在门分类水平的研究结果相符(陈勃生等,2017;张凌英等,2020;唐凌霄等,2023),变形菌门在昆虫肠道中占主导地位是其与昆虫长期协同进化的结果。有研究表明,变形菌门的某些菌株能参与纤维素酶、淀粉酶等的编码,在肠道中参与糖酵解等代谢,促进多糖类物质降解(Jing et al.,2020;Yeruva et al.,2020;唐凌霄等,2023)。Jing等(2020)研究发现变形菌门在必需氨基酸和维生素的生物合成中发挥主导作用,从而在有限的饮食中保障维系宿主生存的营养。此外,变形菌门还被视为反映肠道菌群稳态失调的微生物标志(Shin etal.,2015)。HQR组家蚕肠道菌群变形菌门相对丰度较NC组显著降低,降幅达20.11%,表明添食高剂量槲皮素会打破家蚕肠道内菌群平衡,影响家蚕对营养物质的吸收和利用。
在属分类水平上,无色杆菌属在家蚕肠道菌群中占优势地位,无色杆菌属的一些细菌能分泌纤维素酶、淀粉酶等消化酶,这些消化酶可将纤维素和木质素转化成易利用的糖类等有机小分子物质为宿主提供能量(王立秀等,2018);相较NC组,HQR组无色杆菌属的相对丰度显著降低,可能会降低家蚕分解桑叶纤维素并转化成糖类的效率,导致家蚕对桑叶营养的利用率下降。此外,无色杆菌属的细菌还能分泌抑菌活性物质,抵御其它微生物的侵袭,陈志宇等(2018)认为美洲大蠊良好的环境适应性和抗逆性与其肠道内无色杆菌的抑菌能力有关。HQR组无色杆菌属丰度的降低,使其对家蚕肠道内其他细菌的抑制能力减弱,可能导致添食槲皮素后家蚕肠道内菌群多样性和丰富度的提升,推测这些变化与家蚕对食物的适应性有关(Jing et al.,2020)。变形菌门和无色杆菌属相对丰度的降低,还会导致家蚕能量代谢提高,氨基酸代谢、能量生成和转换及膜转运等方面的能力下降。为维持正常生长,家蚕需要消耗更多的能量,同时蛋白质的生物合成受限制。Taguchi和White(2008)、Cui等(2019)的研究结果表明,槲皮素通过胰岛素样信号通路的调节,促进叉头框转录因子O(FOXO)的去磷酸化,从而增强超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等保护酶和解毒酶的转录活性,有助于家蚕对抗摄入的植物有害物质,但这种抗氧化和解毒反应的增强会导致能量消耗的增加,进而影响家蚕的生长和发育。因此,肠道菌群的变化可能是导致家蚕生长缓慢、产丝量下降、存活率降低的重要原因。
槲皮素作为一种普遍存在于多种植物中的天然聚集诱导发光(AIE)材料,对细胞毒性较低,且具备灵敏的荧光响应特性,是家蚕理想的外源添食材料。桑叶中富含槲皮素,其含量在不同品种、不同采摘时间和不同种植地点间存在差异,超高效液相色谱法测定结果表明,桑叶中槲皮素含量为1.784~3.645 mg/g(钟月葵等,2021)。严会超等(2023)研究发现,在桑叶槲皮素含量基础上添加1.25%(w/w)、2.50%(w/w)和5.00%(w/w)槲皮素或芦丁均可获得高性能的抗氧化荧光蚕丝和多功能桑蚕丝胶蛋白。但用于生物成像和其他生物医学领域的改性蚕丝中,添加剂的含量应尽可能减少(Chen et al.,2023)。本研究结果表明,添食高剂量槲皮素对家蚕生长和产丝量有不利影响,建议利用添食法开发高性能蚕丝时,可选择向家蚕人工饲料中添加低剂量槲皮素[1.25%(w/w)]或其他黄酮类物质,以兼顾家蚕的正常生长吐丝与蚕丝的高性能,同时有助于降低规模化生产成本。
4结论
在桑叶中添加槲皮素会引起家蚕肠道菌群组成的变化,使变形菌门和无色杆菌属的相对丰度降低,导致家蚕能量代谢提高,氨基酸代谢、能量生成和转换及膜转运等方面能力下降,影响家蚕生长和产丝量。
参考文献(References):
陈勃生,鲁兴萌,邵勇奇.2017.鳞翅目昆虫肠道微生物的多样性及其与宿主的相互作用[J].昆虫学报,60(6):710-722.[Chen B S,Lu X M,Shao Y Q.2017.Diversity of the gut microbiota in lepidopteran insects and their interaction with hosts[J].Acta EntomologicaSinica,60(6):710-722.]doi:10.16380/j.kcxb.2017.06.011.
陈志宇,区佩渝,刘凌燕,曾还雄,朱家勇,金小宝.2018.美洲大蠊肠道无色杆菌的分离鉴定及其抑菌活性的初步研究[J].中国人兽共患病学报,34(9):811-816.[Chen ZY,Ou P Y,Liu LY,Zeng H X,Zhu J Y,Jin X B.2018.Isola-tion and identification of intestinal endogenic Achromo-bacter from Periplaneta americana and preliminary studyon its antibacterial activity[J].Chinese Journal of Zoono-ses,34(9):811-816.]doi:10.3969/j.issn.1002-2694.2018.00.145.
胡博,陈雪梅,唐晓姝,张白曦,郭自涛.2022.基于高通量测序分析红枣枸杞浸泡酒对小鼠肠道菌群的影响[J].食品与发酵工业,48(5):47-52.[Hu B,Chen X M,Tang X S,Zhang B X,Guo Z T.2022.Effect of red jujube wolfberry soaked wine on gut microbiota in mice based on high-throughput sequencing[J].Food and Fermentation Indus-tries,48(5):47-52.]doi:10.13995/j.cnki.11-1802/ts.027747.
李庆荣,杨琼,邢东旭,邹宇晓,张伟龙,肖阳.2023.不同家蚕品种五龄幼虫期与蛹期中肠细菌组成与功能差异分析[J].昆虫学报,66(8):1020-1030.[Li Q R,Yang Q,Xing D X,Zou Y X,Zhang W L,Xiao Y.2023.Analysis of dif-ferences in the midgut bacterial composition and function between different Bombyx mori varieties at the 5th instarlarval and pupal stages[J].Acta EntomologicaSinica,66(8):1020-1030.]doi:10.16380/j.kcxb.2023.08.003.
全爽,郭天凯,杜占军,李喜升,韩冰.2023.不同饲料育条件下柞蚕幼虫中肠细菌的多样性分析[J].蚕业科学,49(6):490-497.[Quan S,Guo T K,Du Z J,Li X S,Han B.2023.Diversity analysis of midgut intestinal bacterial com-position in Antheraea pernyi larvae reared with different diets[J].Science of Sericulture,49(6):490-497.]doi:10.13441/j.cnki.cykx.2023.06.002.
唐佳琪.2022.桑叶代谢物对家蚕的影响及其与家蚕味觉受体相互作用的初探[D].重庆:西南大学.[Tang J Q.2022.Effects of mulberry leaf metabolites on the silkworm and their interaction with silkworm gustatory receptors[D].Chongqing:Southwest University.]doi:10.27684/d.cnki.gxndx.2022.000316.
唐凌霄,赵燕子,胡欣,朱铭强,贺虹.2023.杜仲梦尼夜蛾幼虫肠道可培养微生物的组成研究[J].西北林学院学报,38(6):130-137.[Tang L X,Zhao Y Z,Hu X,Zhu M Q,He H.2023.Composition of cultural microorganisms inthe larval guts of Orthosia songi(Lepidoptera:Noctuidae)[J].Journal of Northwest Forestry University,38(6):130-137.]doi:10.3969/j.issn.1001-7461.2023.06.18.
王立秀,陈伟,谢桂林,周亮.2018.阿南原等跳肠道细菌的分离鉴定及降解纤维素细菌的筛选[J].昆虫学报,61(7):835-842.[Wang L X,Chen W,Xie G L,Zhou L.2018.Isolation and identification of intestinal bacteria andscreening of cellulolytic bacteria in Proisotomaananevae(Collembola:Isotomidae)[J].Acta EntomologicaSinica,61(7):835-842.]doi:10.16380/j.kcxb.2018.07.010.
严会超,陈文凯,陈芳艳,钟杨生,王新.2024.一种多功能桑蚕丝胶蛋白及其在生物医学材料中的应用:202210682578.4[P].2024-01-30.[Yan H C,Chen W K,Chen F Y,Zhong Y S,Wang X.2024.A multifunctional silk fibroin and its application in biomedical materials:202210682578.4[P].2024-01-30.]
严会超,陈文凯,钟杨生,陈芳艳,赖文轩,司马元昊.2023.一种蚕丝功能材料及其制备方法和应用:202210461662.3[P].2023-08-18.[Yan H C,Chen W K,Zhong Y S,Chen
F Y,Lai W X,Sima Y H.2023.A functional silk material and its preparation method and application:202210461662.3[P].2023-08-18.]
张凌英,苏造堂,徐天梅,张志红,郑亚强,桂富荣,陈斌.2020.云南普洱江城县草地贪夜蛾幼虫肠道中可培养细菌的分离及鉴定[J].环境昆虫学报,42(1):60-67.[Zhang L Y,Su Z T,Xu T M,Zhang Z H,Zheng Y Q,Gui F R,Chen B.2020.Isolation and identification of culturable intestinal bacteria of Spodoptera frugiperda in Jiangcheng,Puer,Yunnan Province[J]Journal of Environmental Ento-mology,42(1):60-67.]doi:10.3969/j.issn.1674-0858.2020.01.8.
张雨丽,曾珠,刘艳伟,陆俣伽,韦伟,鲁成,崔为正,闭立辉,王平阳,张桂征.2022.更换饲料对家蚕幼虫肠道细菌组成的影响及关键物种与产茧性能的相关性[J].昆虫学报,65(2):176-186.[Zhang Y L,Zeng Z,Liu Y W,Lu Y J,Wei W,Lu C,Cui W Z,Bi L H,Wang P Y,Zhang G Z.2022.Effects of feed change on intestinal bacterial compo-sition in Bombyx mori larvae and the correlation between the key species and cocoon production performance[J].Acta EntomologicaSinica,65(2):176-186.]doi:10.16380/j.kcxb.2022.02.006.
张振宇,圣平,黄胜威,赵永顺,张宏宇.2017.昆虫肠道微生物的多样性、功能及应用[J].生物资源,39(4):231-239.[Zhang Z Y,Sheng P,Huang S W,Zhao Y S,Zhang H Y.2017.Diversity,function and application of insect gut microbiota[J].Biotic Resources,39(4):231-239.]doi:10.14188/j.ajsh.2017.04.001.
钟月葵,蔡庆群,丘振文.2021.超高效液相色谱法测定不同产地桑叶中4种主要黄酮含量[J].食品安全质量检测学报,12(5):1855-1860.[Zhong Y K,Cai Q Q,Qiu Z W.2021.Determination of 4 flavonoids in mulberry leaves from different habitats by ultra performance liquid chroma-tography[J].Journal of Food Safety and Quality,12(5):1855-1860.]doi:10.19812/j.cnki.jfsq 11-5956/ts.2021.05.039.
Aghababaei F,Hadidi M.2023.Recent advances in potential health benefits of quercetin[J].Pharmaceuticals,16(7):1020.doi:10.3390/ph 16071020.
Bahadoran Z,Mirmiran P,Azizi F.2013.Dietary polyphenols as potential nutraceuticals in management of diabetes:Areview[J].Journal of Diabetes&Metabolic Disorders,12(1):43.doi:10.1186/2251-6581-12-43.
Carrillo-Martinez E J,Flores-Hernández F Y,Salazar-Montes A M,Nario-Chaidez H F,Hernández-Ortega L D.2024.Quercetin,a flavonoid with great pharmacological capacity[J].Molecules,29(5):1000.doi:10.3390/molecules2905 1000.
Chen W K,Zhong Y S,Fu G R,Lai W X,Pan Z W,Yang Y L,Chen F Y,Yan H C.2023.Microwave-assisted synthesis of luminescent carbonaceous nanoparticles as silkworm feed for fabricating fluorescent silkworm silk[J].Coatings,13(1):31.doi:10.3390/coatings 13010031.
Cui B Y,Huang X B,Li S,Hao K,Chang B H,Tu X B,Pang BP,Zhang Z H.2019.Quercetin affects the growth and development of the grasshopper Oedaleus asiaticus(Orthop-tera:Acrididae)[J].Journal of Economic Entomology,112(3):1175-1182.doi:10.1093/jee/toz050.
Daimon T,Hirayama C,Kanai M,Ruike Y,Meng Y,Kosegawa E,Nakamura M,Tsujimoto G,Katsuma S,Shimada T.2010.The silkworm Green b locus encodes a quercetin 5-O-glucosyltransferase that produces green cocoons with UV-shielding properties[J].Proceedings of the National Academy of Sciences of the United States of America,107(25):11471-11476.doi:10.1073/pnas.1000479107.
Divekar P A,Rani V,Majumder S,Karkute S G,Molla K A,Pandey K K,Behera T K,Govindharaj G P P.2023.Protea-se inhibitors:An induced plant defense mechanism against herbivores[J].Journal of Plant Growth Regulation,42(10):6057-6073.doi:10.1007/s00344-022-10767-2.
Douglas G M,Maffei V J,Zaneveld J R,Yurgel S N,Brown J R,Taylor C M,Huttenhower C,Langille M G I.2020.PIC‐RUSt2 for prediction of metagenome functions[J].Nature Biotechnology,38(6):685-688.doi:10.1038/s41587-020-0548-6.
Edgar R C.2013.UPARSE:Highly accurate OTU sequencesfrom microbial amplicon reads[J].Nature Methods,10(10):996-998.doi:10.1038/nmeth.2604.
Jing T Z,Qi F H,Wang Z Y.2020.Most dominant roles of insect gut bacteria:Digestion,detoxification,or essential nutrient provision?[J].Microbiome,8(1):38.doi:10.1186/s40168-020-00823-y.
Konala N,Abburi P,Bovillac V R,Mamillapalli A.2013.The effect of bovine milk on the growth of Bombyx mori[J].Journal of Insect Science,13(1):98.doi:10.1673/031.013.9801.
Liu C S,Zhao D F,Ma W J,Guo Y D,Wang A J,Wang Q L,Lee D J.2016.Denitrifying sulfide removal process on high-salinity wastewaters in the presence of Halomonas sp.[J].Applied Microbiology and Biotechnology,100(3):1421-1426.doi:10.1007/s00253-015-7039-6.
Lu Y R,Luo J W,An E X,Lu B,Wei Y Q,Chen X,Lu K P,Liang S B,Hu H,Han M J,He S Z,Shen J H,Guo D Y,Bu N P,Yang L,Xu W Y,Lu C,Xiang Z H,Tong X L,Dai F Y.2023.Deciphering the genetic basis of silkworm cocoon colors provides new insights into biological colora-tion and phenotypic diversification[J].Molecular Biology and Evolution,40(2):msad017.doi:10.1093/molbev/msad 017.
MagočT,Salzberg S L.2011.FLASH:Fast length adjustment of short reads to improve genome assemblies[J].Bioinfor‐matics,27(21):2957-2963.doi:10.1093/bioinformatics/btr507.
Mzhel’skaya K V,Trusov N V,Guseva G N,Aksenov I V,Kravchenko L V,Tutelyan V A.2019.Effects of quercetin on expression of genes of carbohydrate and lipid metabo‐lism enzymes in the liver of rats receiving high-fructoseration[J].Bulletin of Experimental Biology and Medicine,167(2):263-266.doi:10.1007/s 10517-019-04505-0.
Shabir I,Kumar Pandey V,Shams R,Dar A H,Dash K K,Khan S A,Bashir I,Jeevarathinam G,Rusu AV,Esatbeyo‐glu T,Pandiselvam R.2022.Promising bioactive proper‐ties of quercetin for potential food applications and health benefits:A review[J].Frontiers in Nutrition,9:999752.doi:10.3389/fnut.2022.999752.
Shi G Q,Kang Z Y,Ren F,Zhou Y,Guo P L.2020.Effects of quercetin on the growth and expression of immune-pathway-related genes in silkworm(Lepidoptera:Bombycidae)[J].Journal of Insect Science,20(6):23.doi:10.1093/jisesa/ieaa 124.
Shin N R,Whon T W,Bae J W.2015.Proteobacteria:Micro‐bial signature of dysbiosis in gut microbiota[J].Trends in Biotechnology,33(9):496-503.doi:10.1016/j.tibtech.2015.06.011.
Taguchi A,White M F.2008.Insulin-like signaling,nutrient homeostasis,and life span[J].Annual Review of Physio-logy,70:191-212.doi:10.1146/annurev.physiol.70.113006.100533.
Waizumi R,Hirayama C,Tomita S,Iizuka T,Kuwazaki S,Joura-ku A,Tsubota T,Yokoi K,Yamamoto K,Sezutsu H.2024.A major endogenous glycoside hydrolase mediating quer‐cetin uptake in Bombyx mori[J].PLoS Genetics,20(1):e1011118.doi:10.1371/journal.pgen.1011118.
Xu P Z,Zhang M R,Qian P,Li J W,Wang X Y,Wu Y C.2019.iTRAQ-based quantitative proteomic analysis of digestive juice across the first 48 hours of the fifth instar in silk‐worm larvae[J].International Journal of Molecular Scien-ces,20(24):6113.doi:10.3390/ijms20246113.
Xu X,Wang M,Wang Y,Sima Y H,Zhang D Y,Li J,Yin W M,Xu S Q.2013.Green cocoons in silkworm Bombyx mori resulting from the quercetin 5-O-glucosyltransferase of UGT86,is an evolved response to dietary toxins[J].Mo-lecular Biology Reports,40(5):3631-3639.doi:10.1007/s11033-012-2437-7.
Yeruva T,Vankadara S,Ramasa102431c6cac3327f37add78abc749310my S,Lingaiah K.2020.Identi‐fication of potential probiotics in the midgut of mulberrysilkworm,Bombyx mori through metagenomic approach[J].Probiotics and Antimicrobial Proteins,12(2):635-640.doi:10.1007/s 12602-019-09580-3.
Zhang Y E,Ma H J,Feng D D,Lai X F,Chen Z M,Xu M Y,Yu Q Y,Zhang Z.2012.Induction of detoxification enzymes by quercetin in the silkworm[J].Journal of Eco‐nomic Entomology,105(3):1034-1042.doi:10.1603/EC 11287.
Zhou J F,Xu H X,Yin Z P,Chen J G,Zhang Q F.2024.The combination effects of quercetin on starch and digestive enzymes reduce postprandial blood glucose in rats[J].Eu-ropean Food Research and Technology,250(4):1189-1199.doi:10.1007/s00217-023-04455-y.
(责任编辑刘可丹)

