罗汉果甜苷与黄芪多糖联用对小鼠骨骼肌抗氧化能力的影响



摘要:【目的】探讨罗汉果甜苷与黄芪多糖联用对提升小鼠骨骼肌抗氧化能力的影响,并揭示其协同作用机制,为开发罗汉果甜苷和黄芪多糖作为绿色、安全的新型饲料添加剂应用于畜禽骨骼肌抗氧化能力提升及肉品质改善提供理论依据。【方法】将40只SPF级昆明小鼠随机分为4组,即对照组(CK)、罗汉果甜苷组(MOG)、黄芪多糖组(APS)及罗汉果甜苷+黄芪多糖联用组(MOG+APS),每组10只。采取经口灌胃方式给药,MOG组小鼠每日灌服200 mg/kg罗汉果甜苷,APS组小鼠每日灌服200 mg/kg黄芪多糖,MOG+APS组小鼠每日灌服200 mg/kg罗汉果甜苷+200 mg/kg黄芪多糖,CK组小鼠每日灌服0.1 mL生理盐水,连续灌服4周。给药结束后,采集小鼠脏器计算脏器指数,测定血清和骨骼肌中的抗氧化酶活性,并通过实时荧光定量PCR检测小鼠骨骼肌中抗氧化相关基因及Keap1/Nrf2信号通路相关基因的表达变化。【结果】与CK组小鼠相比,MOG组、APS组和MOG+APS组小鼠的平均日采食量、平均日增重及各脏器指数均无显著变化(P>0.05)。MOG组、APS组和MOG+APS组小鼠血清和腓肠肌中的丙二醛(MDA)含量较CK组小鼠显著降低(P<0.05,下同),谷胱苷肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性则显著升高;MOG+APS组小鼠血清和腓肠肌中的MDA含量较MOG组和APS组显著降低,而GSH-Px和SOD活性显著升高。与MOG组和APS组小鼠相比,MOG+APS组小鼠腓肠肌中的GSH-Px和SOD基因相对表达量显著上升,NF-E2相关因子2基因(Nrf2)相对表达量分别显著升高19.02%和20.10%,而Kelch样环氧氯丙烷相关蛋白1基因(Keap1)相对表达量分别显著下降29.92%和24.20%。【结论】罗汉果甜苷与黄芪多糖联用能激活Keap1/Nrf2信号通路,上调SOD和GSH-Px基因表达,提高抗氧化酶活性,而增强小鼠骨骼肌抗氧化能力。罗汉果甜苷和黄芪多糖可作为绿色、安全的新型饲料添加剂,用于提升畜禽骨骼肌抗氧化能力及改善畜禽肉品质。
关键词:小鼠;罗汉果甜苷;黄芪多糖;骨骼肌;抗氧化能力;Keap1/Nrf2信号通路
中图分类号:S816.7文献标志码:A文章编号:2095-1191(2024)07-1925-10
Effects of mogrosides and Astragalus polysacharin combination on antioxidant capacity of mouse skeletal muscle
LU Xiao-feng,LUO Jun-yan,WEI Ming-han,NONG Cai-mi,DANG Zhao-lin,LIYin,WANG Qian,JIANG Qin-yang,HUANG Yan-na*
(College of Animal Science and Technology,Guangxi University,Nanning,Guangxi 530004,China)
Abstract:【Objective】To explore the effect of mogrosides combined with Astragalus polysacharin on improving the antioxidant capacity of skeletal muscle in mice,and to reveal its synergistic mechanism,so as to provide theoretical basisfor the development of mogrosides and Astragalus polysacharin as green and safe new feed additives for improving the an-tioxidant capacity of skeletal muscle and meat quality in livestock and poultry.【Method】Forty SPF KM mice were ran-domly divided into four groups:the control(CK)group,the mogrosides(MOG)group,the Astragalus polysacharin(APS)group,and the mogrosides+Astragaluspolysacharin combination(MOG+APS)group,with 10 mice in each group.The drug was administered by oral gavage,the mice in the MOG group were given 200 mg/kgmogrosides daily,the mice in the APS group were given 200 mg/kg Astragalus polysacharin daily,the mice in the MOG+APS group weregiven 200 mg/kgmogrosides+200 mg/kg Astragalus polysacharin daily,and the mice in the CK group were given 0.1 ml of normal saline daily for 4 weeks.After the administration,the organs of mice were collected to calculate the organ in-dex,the antioxidant enzyme activities in serum and skeletal muscle were determined,and the expression changes of antioxidant-related genes and Keap1/Nrf2 signaling pathway-related genes in skeletal muscle of mice were detected byreal-time fluorescence quantitative PCR.【Result】Compared with CK group,the average daily feed intake,average daily gain and organ index of MOG group,APS group and MOG+APS group had no significant changes(P>0.05).The con-tent of malondialdehyde(MDA)in serum and gastrocnemius muscle of mice in MOG group,APS group and MOG+APS group was significantly decreased compared to that in CK group(P<0.05,the same below),while the activities of glutathi-one peroxidase(GSH-Px)and superoxide dismutase(SOD)were significantly increased.The content of MDA in serum and gastrocnemius muscle of mice in MOG+APS group was significantly decreased compared to that in MOG group and APS group,while the activities of GSH-Px and SOD were significantly increased.Compared with the MOG group and APS group,the relative expression of GSH-Px and SOD genes in the gastrocnemius muscle of MOG+APS group showedsignificant upward trend,the relative expression of NF-E2-related factor 2 gene(Nrf2)was significantly increased by19.02%and 20.10%respectively,while the relative expression of Kelch-like epichlorohydrin-related protein 1 gene(Keap1)was significantly decreased by 29.92%and 24.20%respectively.【Conclusion】Mogrosides and Astragalus poly-sacharin combination can activate Keap1/Nrf2 signaling pathway,up-regulate SOD and GSH-Px genes expression,in-crease antioxidant enzyme activity,and enhance the antioxidant capacity of skeletal muscle in mice.It is indicated that mogrosides and Astragalus polysacharin can be used as green and safe new feed additives to improve the antioxidant ca-pacity of skeletal muscle and meat quality of livestock and poultry.
Key words:mice;mogrosides;Astragalus polysacharin;skeletal muscle;antioxidant capacity;Keap1/Nrf2 signa-ling pathway
Foundation items:National Nature Science Foundation of China(32360839,31760672);National College Stu-dents’Innovation and Entrepreneurship Training Project(202310593044)
0引言
【研究意义】随着现代社会的不断发展,人们的经济能力和生活水平也不断提高,对畜禽产品的要求已不局限于饱腹,而是更加关注肉品质及食物安全等问题。肌肉氧化水平与肉品质间存在密切联系(Rahman et al.,2018)。肌肉在屠宰后的氧化速率及程度主要受动物体内抗氧化能力的制约,而在饲粮中有针对性地添加抗氧化剂可提升动物机体的抗氧化能力,有效抵御自由基对肌肉组织的氧化损伤,维护肌肉组织内生物膜的结构稳固性和功能正常性,从而实现提升肉品质的目标(Lund et al.,2011;李贝贝等,2017;樊路杰等,2018)。在抗氧化机制研究中,Kelch样环氧氯丙烷相关蛋白1/NF-E2相关因子2(Keap1/Nrf2)信号通路被认定是最关键的内源性抗氧化途径(冯雪等,2023)。NF-E2相关因子2(Nrf2)作为Keap1/Nrf2信号通路的关键转录因子,能有效调控抗氧化酶转录活性,从而增强细胞的抗氧化能力。Kelch样环氧氯丙烷相关蛋白1(Keap1)作为Nrf2的调节因子,在维持细胞稳态中发挥重要作用(陈光海和刘晓平,2016)。在正常生理条件下,Keap1与Nrf2形成稳定的复合物,而抑制Nrf2的激活;当机体面临氧化应激时,Keap1与Nrf2的耦合状态被破坏,导致Nrf2释放并激活,活化的Nrf2与抗氧化反应元件结合,触发超氧化物歧化酶基因(SOD)、谷胱甘肽过氧化物酶基因(GSH-Px)等下游靶基因转录表达,而发挥抗氧化作用(Bellezza et al.,2018)。因此,通过激活Keap1/Nrf2信号通路,增加抗氧化酶基因表达及提高肌肉抗氧化能力,是改善肉品质的有效手段之一。【前人研究进展】罗汉果天然提取物中含有一种被命名为罗汉果甜苷(Mogrosides,Mog)的活性成分,其本质上是三萜皂苷类化合物,具有独特的化学结构和生物活性(刘嘉昊等,2022)。近年来的研究已揭示了罗汉果甜苷在止咳祛痰(陈瑶等,2006)、血糖调节(何超文等,2012)及抗氧化(邹健等,2016)等方面的潜力。姚绩伟等(2008)研究发现,罗汉果提取物能有效提升小鼠肝脏抗氧化酶(SOD和GSH-Px)活性,同时显著降低丙二醛(MDA)含量,在运动过程中高效清除过量的自由基,进而有效预防和抑制机体脂质过氧化反应的发生。黄芪多糖(Astragalus polysacharin,APS)作为中药黄芪的主要成分,不仅在促进抗体生成方面表现优异,还具备诱导干扰素产生及增强Jm2Bm6bvKHw4XS/5BpGVvQ==整体免疫反应等活性功能(舒迎霜等,2020;吴志刚等,2024)。申义君(2014)研究表明,在奶牛日粮中添加不同剂量[10、50和100 g/(头·d)]黄芪多糖均可显著提高泌乳期奶牛的抗氧化能力;徐盛明等(2017)研究证实,在日粮中加入1 g/kg黄芪多糖能有效提高断奶仔猪生长性能及抗氧化能力;张有增(2022)研究发现,黄芪多糖在畜禽饲养中不仅促进畜禽的采食量和增重效果,还能显著增强其抗病能力和抗氧化性,为畜禽的健康成长提供有力支持,具体表现为在日粮中添加黄芪多糖有利于肉鸡免疫器官发育,降低料重比,同时提高肉鸡抗氧化能力。【本研究切入点】天然植物提取物联用具有协同效应,对于增强机体抗氧化能力的效果更显著(陈敏等,2022)。赵莲芳等(2006)研究报道,黄芪多糖与人参总皂苷联用可提高小鼠血清及肝脏的抗氧化酶(SOD和GSH-Px)活性;谢红兵(2018)研究发现,以黄芪多糖和白术多糖2种天然植物提取物同时饲喂断奶仔猪,仔猪血清总抗氧化能力(T-AOC)提升效果明显优于单独补充黄芪多糖。罗汉果甜苷和黄芪多糖都属于天然植物提取物,但至今鲜见二者联用的相关研究报道。【拟解决的关键问题】探讨罗汉果甜苷与黄芪多糖联用对提升小鼠骨骼肌抗氧化能力的影响,并揭示其协同作用机制,为开发罗汉果甜苷和黄芪多糖作为绿色、安全的新型饲料添加剂应用于畜禽骨骼肌抗氧化能力提升及肉品质改善提供理论依据。
1材料与方法
1.1试验材料
SPF级昆明小鼠(平均体重35±1 g)购自南宁市研成生物科技有限公司,共40只,其生产合格证号为SYXK桂2020-0004。罗汉果甜苷和黄芪多糖购自陕西藤迈生物科技有限责任公司。MDA测定试剂盒(20231201)、GSH-Px测定试剂盒(20231204)及SOD测定试剂盒(20231125)购自南京建成生物工程研究所;HiScript III All-in-one RT SuperMix Perfect for qPCR试剂盒(7E531J1)购自南京诺唯赞生物科技股份有限公司。
1.2试验设计
对40只小鼠进行打耳洞标记后,随机分为4组,每组10只,即对照组(CK)、罗汉果甜苷组(MOG)、黄芪多糖组(APS)及罗汉果甜苷+黄芪多糖联用组(MOG+APS)。所有小鼠分笼饲养,每天给予充足、相同的普通饲料,自由饮水,自然采光,饲养室温度维持在25℃。每日采取经口灌胃方式给药:MOG组小鼠每日灌服200mg/kg罗汉果甜苷;APS组小鼠每日灌服200mg/kg黄芪多糖;MOG+APS组小鼠每日灌服200mg/kg罗汉果甜苷+200 mg/kg黄芪多糖;CK组小鼠每日灌服0.1 mL生理盐水。连续灌服4周。动物试验由广西大学动物实验伦理审查委员会批准,批准号GXU-2024-148。
1.3采食量及各脏器重量指标测定
每天记录各处理组小鼠的采食量;每周定期测量每只小鼠的体重,并监测其健康状况。药物灌服4周结束后禁食12h以上,通过眼眶静脉丛采血,完成血样采集后脱颈处死各处理组小鼠,迅速分离骨骼肌组织,同时采集每只小鼠的心脏、肝脏、脾脏、肺脏和肾脏,称量各脏器组织重量并计算脏器指数:
脏器指数(%)=脏器重量/小鼠体重×100
1.4抗氧化酶活性测定
小鼠血样3000 r/min离心15 min,收集血清;将腓肠肌(约0.1 g)剪碎置于EP管中,加入0.9 mL生理盐水和5颗研磨珠,以25 Hz的频率研磨30 min,然后将EP管取出,3000 r/min离心15 min,取上清液转移至新的EP管中,制备成10%组织匀浆备用。根据抗氧化测定试剂盒说明,分别测定小鼠血清与腓肠肌中的MDA含量及SOD和GSH-Px活性。
1.5抗氧化相关基因及Keap1/Nrf2信号通路相关基因测定
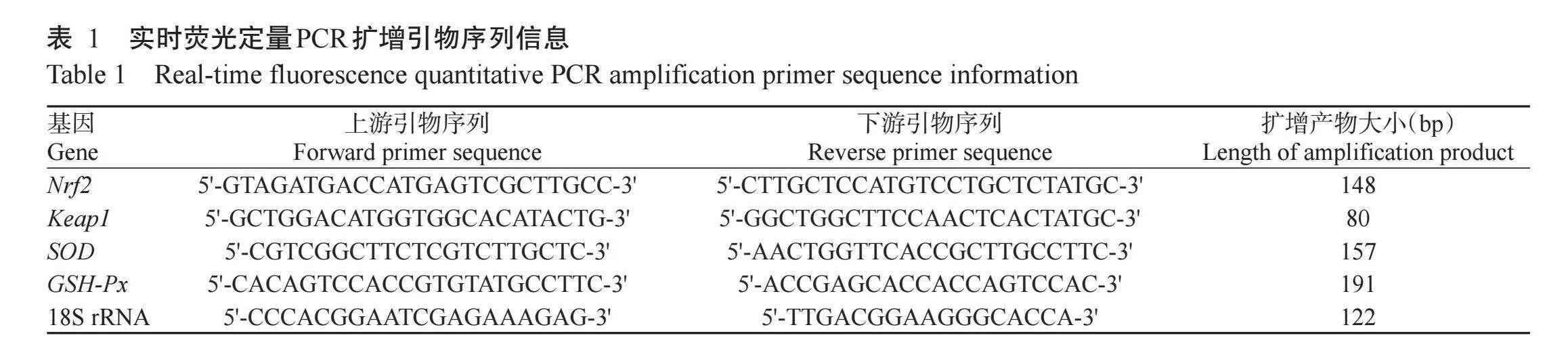
利用TRIzol法提取各处理组小鼠骨骼肌总RNA,测定RNA浓度及纯度,当OD260 nm/OD280 nm达1.8~2.1时,RNA纯度较高,可用于后续试验。参照反转录试剂盒说明,将RNA反转录合成cDNA。参照杨忠敏等(2020)的方法设计实时荧光定量PCR扩增引物(表1),委托南宁捷尼斯生物公司进行合成。以小鼠骨骼肌cDNA为模板、18S rRNA为内参基因,采用实时荧光定量PCR检测各处理组小鼠腓肠肌中的SOD、GSH-Px、Keap1和Nrf2基因相对表达量。实时荧光定量PCR反应体系10.0μL:TB Green®Premix Ex TaqⅡTM 5.0μL,上、下游引物各0.25μL,cDNA模板2.0μL,RNase free H2O 2.5μL。扩增程序:95℃预变性30 s;95℃5 s,60℃30 s,65℃5 s,进行45个循环。然后采用2-ΔΔCt法计算目的基因相对表达量。
1.6统计分析
试验数据使用Excel 2021进行整理,采用SPSS 21.0进行单因素方差分析(One-way ANOVA),通过LSD和Duncan’s法进行显著性检验,并以GraphPad Prism 8.0绘制图表。
2结果与分析
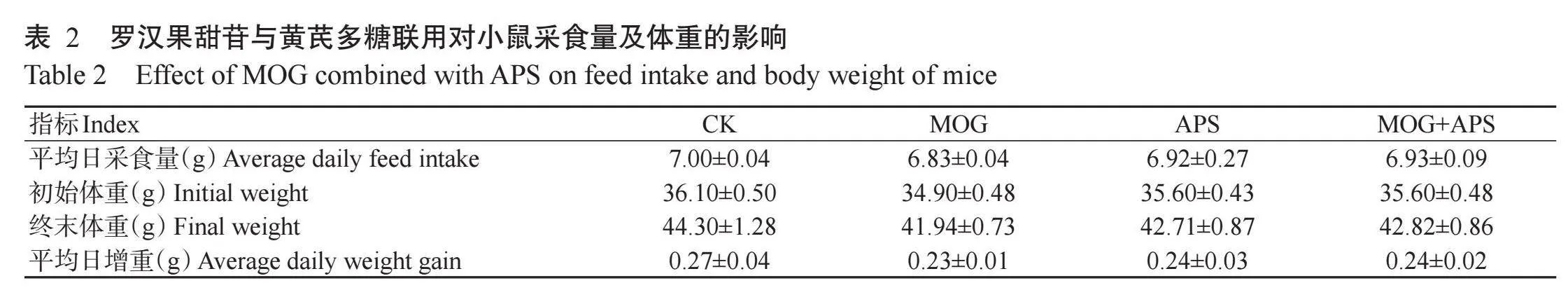
2.1罗汉果甜苷与黄芪多糖联用对小鼠采食量及体重的影响
由表2可看出,至药物灌服4周结束后,APS组、MOG组和MOG+APS组小鼠的终末体重与CK组小鼠相比均无显著差异(P>0.05,下同),3个药物处理组小鼠的平均日增重略低于CK组小鼠,但差异均不显著,表明罗汉果甜苷和黄芪多糖对小鼠的生长发育无明显影响。此外,在试验过程中各处理组小鼠的平均日采食量也无显著差异。
2.2罗汉果甜苷与黄芪多糖联用对小鼠脏器指数的影响
由表3可看出,APS组、MOG组和MOG+APS组小鼠心脏、肝脏、脾脏、肺脏和肾脏的脏器指数较CK组小鼠均无显著差异,表明罗汉果甜苷与黄芪多糖联用或单独使用均不会影响小鼠的脏器健康,无任何不良副作用。
2.3罗汉果甜苷与黄芪多糖联用对小鼠血清MDA含量及抗氧化酶活性的影响
由图1可看出,MOG组、APS组和MOG+APS组小鼠的血清MDA含量较CK组小鼠显著降低(P<0.05,下同);在血清抗氧化酶活性方面,MOG组、APS组和MOG+APS组小鼠的血清GSH-Px和SOD活性较CK组小鼠显著升高。与MOG组和APS组小鼠相比,MOG+APS组小鼠的血清MDA含量显著降低,GSH-Px和SOD活性显著升高。可见,罗汉果甜苷与黄芪多糖联用能有效降低小鼠血清MDA含量及提高GSH-Px和SOD活性,且作用效果优于罗汉果甜苷和黄芪多糖单独用药。
2.4罗汉果甜苷与黄芪多糖联用对小鼠腓肠肌MDA含量及抗氧化酶活性的影响
由图2可看出,MOG组、APS组和MOG+APS组小鼠腓肠肌中的MDA含量显著低于CK组小鼠;在腓肠肌抗氧化酶活性方面,MOG、APS组和MOG+APS组小鼠腓肠肌中的GSH-Px和SOD活性较CK组小鼠显著升高。与MOG组和APS组小鼠相比,MOG+APS组小鼠腓肠肌中的MDA含量显著降低,GSH-Px和SOD活性显著上升。说明罗汉果甜苷与黄芪多糖联用能有效降低小鼠骨骼肌中的MDA含量,并增强抗氧化酶(GSH-Px和SOD)活性。
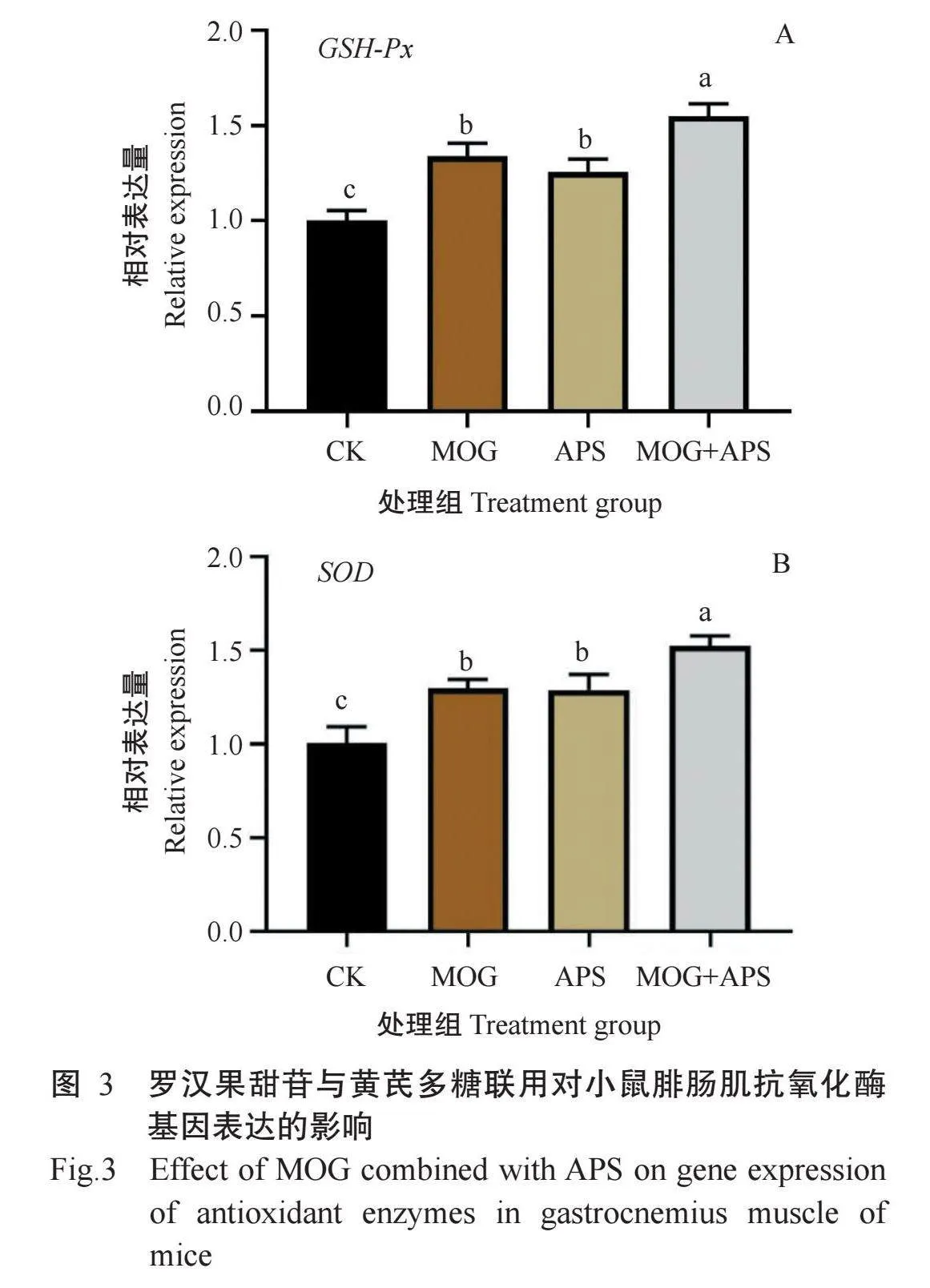
2.5罗汉果甜苷与黄芪多糖联用对小鼠腓肠肌抗氧化酶基因表达的影响
实时荧光定量PCR检测结果(图3)表明,与CK组小鼠相比,MOG组、APS组和MOG+APS组小鼠腓肠肌中的GSH-Px和SOD基因相对表达量均显著升高。与MOG组和APS组小鼠相比,MOG+APS组小鼠腓肠肌中的GSH-Px和SOD基因相对表达量显著升高,进一步证实罗汉果甜苷与黄芪多糖联用具有增强小鼠腓肠肌抗氧化酶(GSH-Px和SOD)活性的能力。
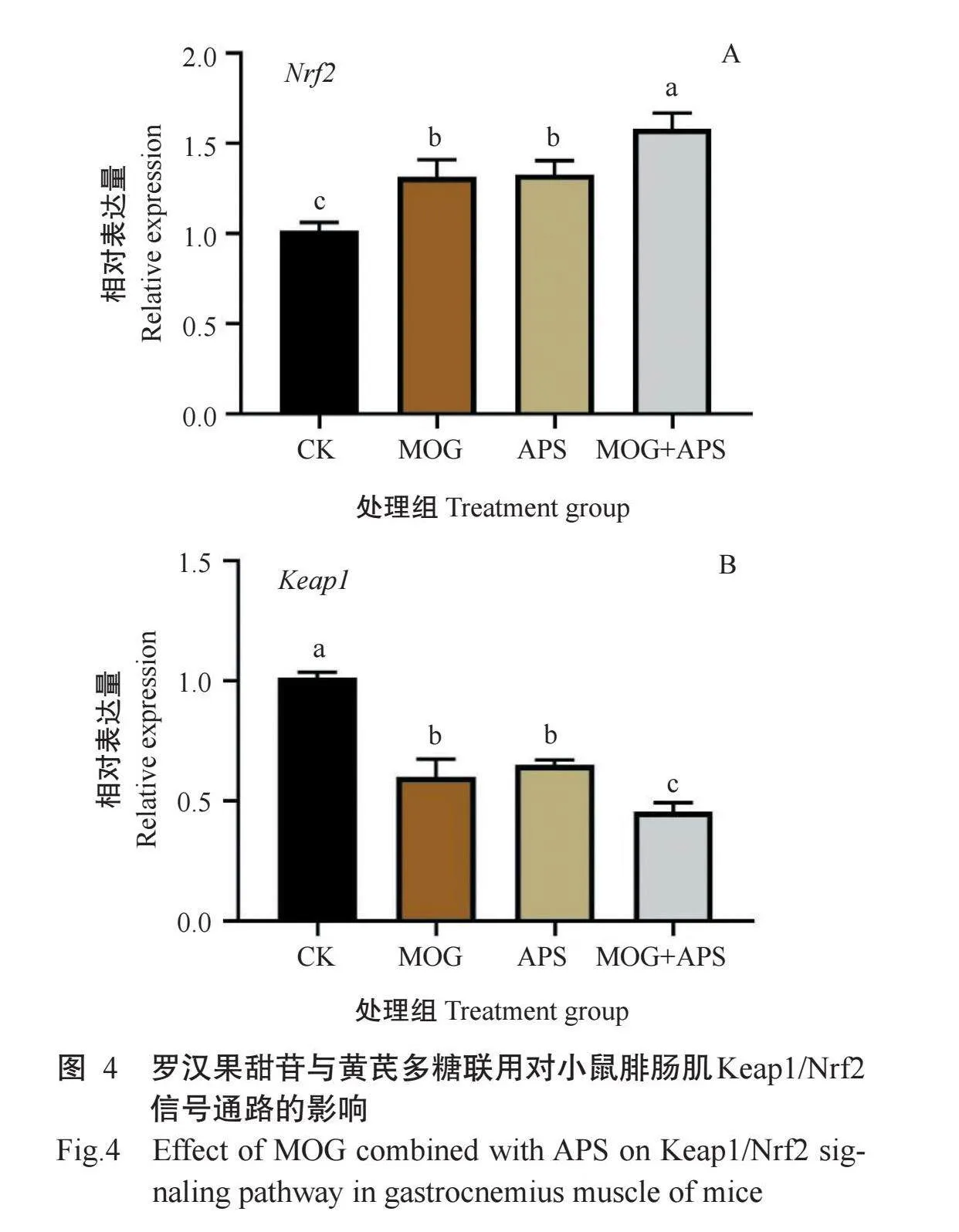
2.6罗汉果甜苷与黄芪多糖联用对小鼠腓肠肌Keap1/Nrf2信号通路的影响
由图4可看出,MOG组、APS组和MOG+APS组小鼠腓肠肌的Nrf2基因相对表达量较CK组小鼠显著升高,其中,MOG+APS组小鼠腓肠肌中的Nrf2基因相对表达量较MOG组、APS组分别显著升高19.02%和20.10%。小鼠腓肠肌的Keap1基因表达趋势与Nrf2基因恰好相反,3个药物处理组小鼠腓肠肌中的Keap1基因相对表达量较CK组小鼠显著下降,其中,MOG+APS组小鼠腓肠肌中的Keap1基因相对表达量较MOG组、APS组分别显著下降29.92%和24.20%。可见,罗汉果甜苷与黄芪多糖联用能有效提高小鼠骨骼肌中的Nrf2基因相对表达量,同时降低Keap1基因相对表达量。
3讨论
已有研究证实,不同剂量(100、200、400、800、1000和2000 mg/kg)黄芪多糖对不同日龄肉仔鸡平均采食量、21日龄平均日增重及料重比均无显著影响(王俊丽,2010);在日粮中添加15%黄芪多糖对育肥猪的生长性能及部分屠宰性能均无显著影响(宋丽丽,2023)。此外,宋颖等(2022)研究发现,小鼠摄入600 mg/kg的罗汉果甜苷并未对其生长性能造成明显影响。本研究结果也表明,罗汉果甜苷和黄芪多糖对小鼠的生长发育无明显影响。脏器指数作为动物体内试验的一个重要检测指标,可评估药物可能产生的毒性作用和免疫效应(谢梦蕊等,2018)。杨松等(2012)研究表明,小鼠经口灌服50、500和1000 mg/kg的黄芪多糖,其脾脏指数变化不明显;宋颖等(2022)发现在小鼠日常饮食中添加600 mg/kg罗汉果甜苷,并未明显改变小鼠心脏、肝脏、肾脏、肺脏及脾脏的脏器指数;虞伟祥等(2023)研究发现在日粮添加400 mg/kg黄芪多糖对小鼠脾脏指数无显著影响。本研究结果表明,罗汉果甜苷与黄芪多糖联用或单独使用均不会影响小鼠的脏器健康,说明罗汉果甜苷和黄芪多糖对小鼠脏器未产生明显的不良影响或毒性作用。
在正常生理状态下,动物细胞不断面临着来自体内外各种压力因素的考验,尤其是活性氧(Reac-tive oxygen species,ROS)。当ROS积累过量时,会引起细胞的氧化应激,进而影响其正常功能(蒋守群和蒋宗勇,2011)。已有研究发现,罗汉果甜苷能阻止大鼠肝脏组织中的脂质过氧化,且对因Fe2+和H2O2引起的肝脏过氧化损伤具有防护作用,表明罗汉果甜苷能有效消除自由基(戚向阳等,2006)。黄文蔚等(2019)研究发现,饲喂罗汉果皂苷可明显提高大鼠SOD活性和降低MDA含量,提示罗汉果皂苷能抑制氧化应激。黄芪多糖具有多种生物活性,包括抗氧化、抗炎症、调节免疫及改善胰岛素抵抗等,在牛、羊、兔、鸡、鸭等畜禽养殖生产中具有广阔的应用前景(王义翠等,2024)。高旭等(2010)研究发现,每天经口灌服50和150 mg/kg黄芪多糖能显著提高小鼠血清SOD活性及显著降低MDA含量;刘邦(2020)研究证实,诺丽果粉与黄芪多糖组合能促使海南黑山羊血清SOD和GSH-Px活性上升,有效提高海南黑山羊的抗氧化能力。本研究发现,罗汉果甜苷、黄芪多糖及二者联用均能有效降低小鼠血清和腓肠肌中的MDA含量,同时显著增强SOD和GSH-Px活性,尤其是罗汉果甜苷与黄芪多糖联用的效果更明显。由此推测,罗汉果甜苷与黄芪多糖联用是通过增强小鼠骨骼肌中的抗氧化酶活性,清除机体产生的过量ROS,从而增强骨骼肌的抗氧化能力。
减轻器官或细胞氧化应激损伤的关键是提高抗氧化酶活性及其基因表达水平(Zhuang et al.,2019)。已有研究表明,罗汉果甜苷可上调SOD基因表达,增强猪卵母细胞的抗氧化能力(聂骏宇,2020);罗汉果甜苷还能提高小鼠肠道组织中SOD、GPX1和Nrf2基因的相对表达量,缓解小鼠肠道组织氧化应激及提高其抗氧化能力(Lu et al.,2023)。在黄芪多糖方面,靳淑委等(2022)研究发现在饲粮添加黄芪多糖可提高蛋鸡肝脏组织中SOD1、SOD2、GPX1和GPX4基因的相对表达量,即通过上调抗氧化酶基因表达来提高抗氧化酶活性;宋丽丽(2023)研究证实,在日粮中分别添加0.05%、0.10%和0.15%的黄芪多糖,断奶仔猪肌肉中的SOD和GSH-Px基因相对表达量明显升高。本研究的实时荧光定量PCR检测结果表明,无论是单独使用罗汉果甜苷或黄芪多糖,还是二者联用,小鼠腓肠肌中的GSH-Px和SOD基因相对表达量与CK组小鼠相比均上升,尤其是罗汉果甜苷与黄芪多糖联用时表现出更强的抗氧化效果。可见,罗汉果甜苷与黄芪多糖联用能有效上调小鼠骨骼肌中抗氧化基因表达,增强骨骼肌抗氧化能力,同时有助于缓解氧化应激的影响。
Keap1/Nrf2信号通路是经典的抗氧化应激通路(陈敏等,2022;吴艺帆等,2022),在维持细胞氧化还原稳态中发挥重要作用(Faragetal.,2019)。Nrf2是调节体内抗氧化防御系统的主要内源性因子。正常情况下,Nrf2与Keap1在细胞质中形成复合体;发生氧化应激后,复合体分解,Nrf2进入细胞核并激活抗氧化应激酶,进而提升机体的抗氧化能力(卢苇等,2024)。于万芹等(2019)研究表明,经罗汉果皂苷提取物处理后,大鼠胰腺组织中的Keap1基因表达明显下调,而Nrf2和ARE基因表达明显上调,说明罗汉果皂苷提取物是通过激活Keap1-Nrf2/ARE信号通路发挥作用,以减轻胰腺组织的氧化应激损伤;李浩雨等(2023)研究发现,罗汉果总黄酮可显著提高Nrf2基因相对表达量,激活Keap1/Nrf2信号通路,使Nrf2与Keap1解离而进入细胞核,增强机体的抗氧化应激能力。有关黄芪多糖的研究,Farag等(2019)研究证实黄芪多糖能显著上调小鼠肝脏组织中的Nrf2基因表达;张林超等(2021)研究发现黄芪多糖可提高小鼠卵巢组织中的Nrf2基因相对表达量,同时降低Keap1基因相对表达量;宋丽丽(2023)研究表明,黄芪多糖可促使Nrf2与Keap1形成的复合体解偶联,通过激活Nrf2信号通路及上调关键调控因子表达,而改善肌肉与肝脏的抗氧化能力,提高机体的整体抗氧化水平。本研究结果表明,罗汉果甜苷与黄芪多糖联用能有效提高小鼠骨骼肌中的Nrf2基因相对表达量,同时降低Keap1基因相对表达量,且效果较单独使用罗汉果甜苷或黄芪多糖更明显。故推测罗汉果甜苷与黄芪多糖联用是通过影响Keap1和Nrf2基因表达,激活Keap1/Nrf2信号通路,以增强肌肉组织抗氧化能力,进而增强机体抗氧化水平。
4结论
罗汉果甜苷与黄芪多糖联用能激活Keap1/Nrf2信号通路,上调SOD和GSH-Px基因表达,提高抗氧化酶活性,而增强小鼠骨骼肌抗氧化能力。罗汉果甜苷和黄芪多糖可作为绿色、安全的新型饲料添加剂,用于提升畜禽骨骼肌抗氧化能力及改善畜禽肉品质。
参考文献(References):
陈光海,刘晓平.2016.Keap1-Nrf2信号通路与细胞氧化应激反应相关性研究进展[J].医学理论与实践,29(15):2012-2015.[Chen G H,Liu X P.2016.Research progress on the correlation between Keap1-Nrf2 signaling pathway and cellular oxidative stress response[J].The Journal of Medical Theory and Practice,29(15):2012-2015.]doi:10.19381/j.issn.1001-7585.2016.15.011.
陈敏,周金凤,韦崇万,蒋钦杨,黄艳娜.2022.白藜芦醇和EGCG联用对小鼠骨骼肌抗氧化能力的影响[J].南方农业学报,53(9):2683-2690.[Chen M,Zhou J F,Wei C W,Jiang Q Y,Huang Y N.2022.Effects of resveratrol and EGCG combination on antioxidant capacity of mouse ske-letal muscle[J].Journal of SuJLjQz5W9bHXLgJZAUm4gg==outhern Agriculture,53(9):2683-2690.]doi:10.3969/j.issn.2095-1191.2022.09.031.
陈瑶,范小兵,王永祥,杭晓敏.2006.罗汉果甜苷的止咳祛痰作用研究[J].中国食品添加剂,(1):41-43.[Chen Y,Fan X B,Wang Y X,Hang X M.2006.Functional study of natural food sweetener mogrosides[J].China Food Addi-tives,(1):41-43.]doi:10.3969/j.issn.1006-2513.2006.01.009.
樊路杰,窦鸣乐,王小宇,李泽,史新娥,李晓.2018.宰后肌肉抗氧化能力与肉品质的关系[J].动物营养学报,30(5):1676-1680.[Fan L J,Dou M L,Wang X Y,Li Z,Shi X E,Li X.2018.Relationship between antioxidant capacity of postmortem muscle and meat quality[J].Chinese Journal of Animal Nutrition,30(5):1676-1680.]doi:10.3969/j.issn.1006-267x.2018.05.010.
冯雪,刘雅清,刘滨,马旭冉,王敦方,杨伟鹏.2023.黄芩汤通过Nrf2信号通路对Caco-2细胞抗氧化应激作用的机制[J].中国实验方剂学杂志,29(7):29-37.[Feng X,Liu Y Q,Liu B,Ma X R,Wang D F,Yang W P.2023.Anti-oxidative stress effect and mechanism of Huangqintang on Caco-2 cells through Nrf2 signaling pathway[J].ChineseJournal of Experimental Traditional Medical Formulae,29(7):29-37.]doi:10.13422/j.cnki.syfjx.20230205.
高旭,李丽芬,刘斌钰.2010.黄芪多糖对小鼠应激能力和自由基代谢的影响[J].中国预防医学杂志,11(2):120-121.[Gao X,Li L F,Liu B Y.2010.Effect of Astragalus polysaccharides on stress response ability and regulation of free radicals in mice[J].Chinese Preventive Medicine,11(2):120-121.]doi:10.16506/j.1009-6639.2010.02.013.
何超文,姚美村,夏星,朱晓韵,何伟平.2012.鲜罗汉果皂苷对小鼠血糖的调节作用研究[J].现代食品科技,28(4):382-386.[He CW,Yao M C,Xia X,Zhu XY,He WP.2012.Regulation effect of fresh mangosteen saponins on blood sugar[J].Modern Food Science and Technology,28(4):382-386.]doi:10.13982/j.mfst.1673-9078.2012.04.002.
黄文蔚,洪李锋,郭璠,龚平,伍琼.2019.罗汉果皂苷对阿霉素心肌损伤大鼠氧化应激和凋亡调节作用研究[J].辽宁中医药大学学报,21(6):39-42.[Huang W W,Hong L F,Guo F,Gong P,Wu Q.2019.Effect of mogmside on oxida-tive stress and cell apoptosis in myocardium of adriamycin myocardial injury rat[J].Journal of Liaoning University of Traditional Chinese Medicine,21(6):39-42.]doi:10.13194/j.issn.1673-842x.2019.06.010.
蒋守群,蒋宗勇.2011.氧化应激对畜禽肉品质的影响研究综述[J].广东饲料,(10):42-45.[Jiang S Q,Jiang ZY.2011.Review on the effects of oxidative stress on meat quality of livestock and poultry[J].Guangdong Feed,(10):42-45.]doi:10.3969/j.issn.1005-8613.2011.10.016.
靳淑委,张光波,常羽,杨军艳.2022.黄芪提取物对蛋鸡生产性能、蛋品质和抗氧化性能的影响[J].中国饲料,(20):41-44.[Jin S W,Zhang G B,Chang Y,Yang J Y.2022.Effects of astragalus extract on performance,egg quality and antioxidant activity of laying hens[J].China Feed,(20):41-44.]doi:10.15906/j.cnki.cn11-2975/s.20222011.
李贝贝,徐泽权,李涛,于晨晨,马欣,王子荣.2017.饲粮中添加番茄渣对育肥猪生长性能、胴体性状、肉品质和抗氧化能力的影响[J].动物营养学报,29(12):4554-4561.[Li B B,Xu Z Q,Li T,Yu C C,Ma X,Wang Z R.2017.Effects of tomato pomace supplementation on growth per-formance,carcass traits,meat quality and antioxidant capacity of finishing pigs[J].Chinese Journal of Animal Nutrition,29(12):4554-4561.]doi:10.3969/j.issn.1006-267x.2017.12.037.
李浩雨,徐兴军,李雪涵,张伟伟,邵淑丽.2023.罗汉果总黄酮对慢性睡眠剥夺小鼠抗氧化能力及炎症反应的影响[J].动物营养学报,35(7):4668-4677.[Li H Y,Xu X J,Li X H,Zhang W W,Shao S L.2023.Effects of total fla-vonoids of Siraitiagrosvenorii on antioxidant ability andinflammatory responses in mice with chronic sleep depri-vation[J].Chinese Journal of Animal Nutrition,35(7):4668-4677.]doi:10.12418/CJAN2023.433.
刘邦.2020.诺丽果粉和黄芪多糖对海南黑山羊生长性能、抗氧化性能及免疫机能的影响[D].海口:海南大学.[Liu B.2020.Effects of Noni fruit powder and Astragalus poly-saccharides on growth performance,antioxidant capability and immune function of Hainan black goats[D].Haikou:Hainan University.]doi:10.27073/d.cnki.ghadu.2020.00 1352.
刘嘉昊,王金兴,胡俊杰,冯明,蒋慧敏,李孟琪,卢克焕,杨小淦,梁兴伟.2022.罗汉果甜苷V对持续光照小鼠脂肪积累的缓解作用[J].南方农业学报,53(9):2624-2633.[Liu J H,Wang J X,Hu J J,Feng M,Jiang H M,Li M Q,
Lu K H,Yang X G,Liang XW.2022.Mogroside V attenua-ted constant light exposure-induced accumulation of bodyfat mass in mice[J].Journal of Southern Agriculture,53(9):2624-2633.]doi:10.3969/j.issn.2095-1191.2022.09.025.
卢苇,尤红,张敏,何宝峰,马瑞,高雅雅,马鑫宇.2024.胞磷胆碱对脑出血小鼠Keap1/Nrf2/ARE信号通路的影响[J].中国临床药理学杂志,40(8):1175-1179.[Lu W,You H,Zhang M,He B F,Ma R,Gao YY,Ma X Y.2024.Effects of citicoline on Keap1/Nrf2/ARE signaling path-way in mice with cerebral hemorrhage[J].The Chinese Journal of Clinical Pharmacology,40(8):1175-1179.]doi:10.13699/j.cnki.1001-6821.2024.08.018.
聂骏宇.2020.罗汉果甜甙V对猪卵母细胞及胚胎发育的影响和机制研究[D].南宁:广西大学.[Nie J Y.2020.The effect of and mogroside V on porcine oocyte development and embryonic development and mechanism study[D].Nan-ning:Guangxi University.]doi:10.27034/d.cnki.ggxiu.2020.000914.
戚向阳,陈维军,张俐勤,单夏锋,宋云飞.2006.罗汉果皂甙清除自由基及抗脂质过氧化作用的研究[J].中国农业科学,39(2):382-388.[Qi X Y,Chen W J,Zhang L Q,Shan X F,Song Y F.2006.Study on the inhibitory effects of natural sweetnermogrosides on radical and lipid peroxida-tion[J].Scientia Agricultura Sinica,39(2):382-388.]doi:10.3321/j.issn:0578-1752.2006.02.024.
申义君.2014.奶牛口服黄芪多糖对奶牛血液生理生化、口蹄疫抗体水平及抗氧化能力的影响研究[D].雅安:四川农业大学.[Shen Y J.2014.Studies on the activity of blood physiologic and serum biochemical and antioxidant enzyme and theimmunomodulation effect of the Astraga-lus polysaccharides in lactating Holstein cows[D].Ya’an:Sichuan Agricultural University.]
舒迎霜,贺濛初,桂雪儿,夏晓冬,冯士彬,李玉,王希春,吴金节.2020.黄芪多糖对犬盲肠菌群的影响[J].甘肃农业大学学报,55(2):1-8.[Shu Y S,He M C,Gui X E,Xia X D,Feng S B,Li Y,Wang X C,Wu J J.2020.Effect of Astragalus polysaccharide on cecal flora in canines[J].Journal of Gansu Agricultural University,55(2):1-8.]doi:10.13432/j.cnki.jgsau.2020.02.001.
宋丽丽.2023.黄芪多糖对育肥猪生产性能、抗氧化、脂质代谢及肠道微生物的影响[D].兰州:甘肃农业大学.[Song L L.2023.Effect of Astragalus polysaccharide on perfor-mance,antioxidant,lipid metabolism and intestinal micro-organism of fattening pigs[D].Lanzhou:Gansu Agricul-tural University.]doi:10.27025/d.cnki.ggsnu.2023.000369.
宋颖,罗煜林,蔡沛燃,陆建东,蓝毅,蒋民聪,蒋钦杨.2022.罗汉果甜苷对小鼠生长性能及肌纤维类型的影响[J].黑龙江畜牧兽医,(13):110-114.[Song Y,Luo Y L,Cai P R,Lu J D,Lan Y,Jiang M C,Jiang Q Y.2022.Effects of mogroside on growth performance and muscle fiber types in mice[J].Heilongjiang Animal Science and Veterinary Medicine,(13):110-114.]doi:10.13881/j.cnki.hljxmsy.2022.03.0017.
王俊丽.2010.黄芪多糖对肉仔鸡免疫性能和生产性能影响的研究[D].扬州:扬州大学.[Wang J L.2010.Effect of Astragalus polysacchrides on immune function and growth performance in broilers[D].Yangzhou:Yangzhou Univer-sity.]doi:10.7666/d.Y1702144.
王义翠,魏炳琦,陈柳,刘延鑫.2024.黄芪多糖的生物学功能及其在畜禽生产中的应用研究进展[J].动物营养学报,36(5):2830-2844.[Wang Y C,Wei B Q,Chen L,Liu Y X.2024.Advances in biological functions of Astragalus polysaccharide and its application in livestock and poultry production[J].Chinese Journal of Animal Nutrition,36(5):2830-2844.]doi:10.12418/CJAN2024.244.
吴艺帆,傅晨,罗超琴,刘孟涵,王翎沣,刘雪梅.2022.补肾启智方调控Keap1/Nrf2/ARE信号通路对缺血性卒中大鼠认知功能的影响[J].北京中医药大学学报,45(7):654-662.[Wu Y F,Fu C,Luo C Q,Liu M H,Wang L F,Liu X M.2022.The effects of Bushen Qizhi formula on cogni-tive function in rats with ischemic stroke are mediated by the Keap1/Nrf2/ARE signaling pathway[J].Journal of Bei-jing University of Traditional Chinese Medicine,45(7):654-662.]doi:10.3969/j.issn.1006-2157.2022.07.009.
吴志刚,张洪耀,高铭佐,严子科,谭雯予,韩书煜,施金谷,黄德生,梁静真,黄钧.2024.黄芪多糖对黄喉拟水龟生长性能、血清生化指标及肠道菌群结构的影响[J].南方农业学报,55(2):388-396.[Wu Z G,Zhang H Y,Gao M Z,Yan Z K,Tan W Y,Han S Y,Shi J G,Huang D S,Liang J Z,Huang J.2024.Effects of Astragalus polysaccharides on growth performance,serum biochemical indexes and intes-tinal flora structure of Mauremysmutica[J].Journal of Southern Agriculture,55(2):388-396.]doi:10.3969/j.issn.2095-1191.2024.02.009.
谢红兵.2018.植物多糖对断奶仔猪肠道生理特征和免疫机能的影响及机理研究[D].长沙:湖南农业大学.[Xie H B.2018.Effects and mechanism of botanical polysaccha-rides on intestinal physiological characteristics and immue function of weaned piglets[D].Changsha:Hunan Agricul-tural University.]
谢梦蕊,李秋明,邱思奇,齐晓龙,沈红.2018.地鳖肽对氧化应激肉仔鸡生长性能、肉品质、脏器指数和抗氧化能力的影响[J].动物营养学报,30(5):1726-1735.[Xie M R,Li Q M,Qiu S Q,Qi X L,Shen H.2018.Effects of Eupolyphaga sinensis Walker polypeptides on growth per-formance,meat quality,organ indexes and antioxidant capacity of broilers under oxidative stress[J].Chinese Jour-nal of Animal Nutrition,30(5):1726-1735.]doi:10.3969/j.issn.1006-267x.2018.05.015.
徐盛明,郭勇,孙士军,李俊婷.2017.黄芪多糖对断奶仔猪生长性能及抗氧化能力的影响[J].南方农业,11(26):77-78.[Xu S M,Guo Y,Sun S J,Li J T.2017.Effects of Astragalus polysaccharide on growth performance and antioxidant capacity of weaned piglets[J].South China Agriculture,11(26):77-78.]doi:10.19415/j.cnki.1673-890x.2017.26.042.
杨松,王长月,何悦.2012.黄芪多糖对小鼠生长、免疫及抗氧化功能的影响[J].饲料研究,(7):28-29.[Yang S,Wang C Y,He Y.2012.Effects of Astragalus polysaccharide on growth,immunity and antioxidant function in mice[J].Feed Research,(7):28-29.]doi:10.3969/j.issn.1002-2813.2012.07.010.
杨忠敏,沈以红,黄先智,王祖文,丁晓雯.2020.桑叶生物碱粗提物对D-半乳糖诱导的小鼠蛋白氧化损伤的改善作用[J].食品科学,41(17):182-187.[Yang Z M,ShenY H,Huang X Z,Wang Z W,Ding X W.2020.Effect of crude alkaloids from mulberry leaves on improving D-galactose-induced oxidative protein damage in mice[J].Food Scien-ce,41(17):182-187.]doi:10.7506/spkx 1002-6630-2019 0731-430.
姚绩伟,唐晖,周亮,申伟华,李忆湘,田新姿,丁秀诗.2008.罗汉果提取液对小鼠运动耐力及肝组织抗氧化损伤的影响[J].中国运动医学杂志,27(2):221-223.[Yao J W,Tang H,Zhou L,Shen W H,Li Y X,Tian X Z,Ding X S.2008.Effects of Siraitiagrosvenorii extract on exercise to-lerance and liver tissue antioxidant injury in mice[J].Chi-nese Journal of Sports Medicine,27(2):221-223.]doi:10.3969/j.issn.1000-6710.2008.02.022.
于万芹,杜晓娜,刘巧敏,杜彦芳.2019.罗汉果皂苷对妊娠糖尿病大鼠氧化应激损伤影响[J].中国临床药理学杂志,35(21):2723-2727.[Yu W Q,Du X N,Liu Q M,Du Y F.2019.Effects of momordicagrosvenori saponin on oxida-tive stress injury in gestational diabetic rats[J].The Chi-nese Journal of Clinical Pharmacology,35(21):2723-2727.]doi:10.13699/j.cnki.1001-6821.2019.21.021.
虞伟祥,周利娟,陆华娟.2023.黄芪多糖对肉仔鸡生长性能、免疫及血清生化指标的影响[J].中国饲料,(24):70-73.[Yu W X,Zhou L J,Lu H J.2023.Effects of Astragalus polysaccharides on growth performance,immunity,andserum biochemical indicators in broilers[J].China Feed,(24):70-73.]doi:10.15906/j.cnki.cn11-2975/s.20232418.
张林超,宫英阑,温冉,包佳鹭,张妍,王晓丹.2021.5种中药多糖通过Keap1-Nrf2通路缓解代森锰锌氧化和卵巢毒性[J].中国兽医学报,41(8):1575-1582.[Zhang L C,Gong Y L,Wen R,Bao J L,Zhang Y,Wang X D.2021.Five traditional Chinese medicine polysaccharides allevia-ting oxidation and ovarian toxicity of mancozeb through Keap1-Nrf2 pathway[J].Chinese Journal of Veterinary Science,41(8):1575-1582.]doi:10.16303/j.cnki.1005-4545.2021.08.21.
张有增.2022.黄芪多糖对肉鸡生产性能、免疫功能和抗氧化能力的影响[J].家禽科学,(7):56-58.[Zhang Y Z.2022.Effects of Astragalus polysaccharide on production perfor-mance,immune function and antioxidant capacity of broi-lers[J].Poultry Science,(7):56-58.]doi:10.3969/j.issn.1673-1085.2022.07.020.
赵莲芳,郑玉淑,朴惠顺,张善玉.2006.黄芪多糖及人参总皂苷对衰老小鼠的抗衰老作用[J].延边大学医学学报,29(4):249-251.[Zhao L F,Zheng Y S,Piao H S,Zhang S Y.2006.Antisenility effects of Astragalus polysaccharide and total ginsenoside on senile mice[J].Journal of Medi-cal Science Yanbian University,(4):249-251.]doi:10.3969/j.issn.1000-1824.2006.04.006.
邹健,陈秋平,刘合生,柳余莉,李冲冲,戚向阳,宋云飞.2016.罗汉果皂甙类化合物的抗氧化活性研究[J].核农学报,30(10):1982-1988.[Zou J,Chen Q P,Liu H S,Liu Y L,Li C C,Qi X Y,Song Y F.2016.Antioxidant activi-ties of mogrosides from Siratiagrosvenorii fruits[J].Jour-nal of Nuclear Agricultural Sciences,30(10):1982-1988.]doi:10.11869/j.issn.100-8551.2016.10.1982.
Bellezza I,Giambanco I,Minelli A,Donato R.2018.Nrf2-Keap1 signaling in oxidative and reductive stress[J].Bio-chimica et Biophysica Acta-Molecular Cell Research,1865(5):721-733.doi:10.1016/j.bbamcr.2018.02.010.
Farag M R,Elhady W M,Ahmed S Y A,Taha H S A,Alaga-wany M.2019.Astragalus polysaccharides alleviate tilmicosin-induced toxicity in rats by inhibiting oxidative damage and modulating the expressions of HSP70,NF-kB and Nrf2/HO-1 pathway[J].Research in Veterinary Scien-ce,124:137-148.doi:10.1016/j.rvsc.2019.03.010.
Lu R H,Hu J H,Liu X X,Yu L J,Hu J J,Jiang H M,Liu S Y,Li M Q,He J K,Yang X G,Liang X W.2023.Mogroside-rich extract from Siraitiagrosvenorii fruits protects against heat stress-induced intestinal damage by ameliorating oxi-dative stress and inflammation in mice[J].Food&Func-tion,14(2):1238-1247.doi:10.1039/d2fo02179j.
Lund M N,Heinonen M,Baron C P,Estévez M.2011.Protein oxidation in muscle foods:A review[J].Molecular nutri-tion&Food Research,55(1):83-95.doi:10.1002/mnfr.201000453.
Rahman U,Sahar A,Ishaq A,Aadil R M,Zahoor T,Ahmad M H.2018.Advanced meat preservation methods:A mini review[J].Journal of Food Safety,38(4):e12467.doi:10.1111/jfs.12467.
Zhuang Y,Wu H R,Wang X X,He J Y,He S P,Yin Y L.2019.Resveratrol attenuates oxidative stress-induced intestinal barrier injury through PI3K/Akt-mediated Nrf2 signaling pathway[J].Oxidative Medicine and Cellular Longevity,2019:7591840.doi:10.1155/2019/7591840.
(责任编辑兰宗宝)

