芒果苷抑制脂多糖诱导小鼠肺泡巨噬细胞炎症反应的机制研究







摘要:【目的】探究芒果苷抑制脂多糖(LPS)诱导的炎症反应作用机制,为筛选治疗脓毒症的候选药物提供科学依据。【方法】选取小鼠肺泡巨噬细胞(MH-S)为研究对象,通过CCK-8试剂检测芒果苷对MH-S细胞的毒性作用,根据细胞毒性试验确定芒果苷的作用浓度为100μg/mL,以正常培养的MH-S细胞为对照,使用10μg/mL LPS处理24 h构建体外炎症模型(LPS组),再以100μg/mL芒果苷干预24 h(干预组);通过ELISA检测MH-S细胞上清液中的炎症因子(IL-1β、TNF-α、IL-6和IL-18)含量,采用实时荧光定量PCR检测IL-1β、TNF-α、IL-6和IL-18基因表达情况,并以Western blotting和免疫荧光法检测TLR4/NF-κB信号通路的变化。【结果】芒果苷浓度低于287.60μg/mL时,对MH-S细胞无明显的毒性作用。与对照组相比,LPS组MH-S细胞中的IL-1β、TNF-α、IL-6和IL-18基因相对表达量极显著升高(P<0.0 下同),细胞上清液中的IL-1β、TNF-α、IL-6和IL-18含量显著(P<0.05,下同)或极显著升高;但以芒果苷干预后,IL-1β、TNF-α、IL-6和IL-18基因的相对表达量及其分泌水平均显著降低,表明芒果苷能有效抑制LPS诱导MH-S细胞的炎症反应。此外,LPS组MH-S细胞中的NF-κB基因相对表达量与蛋白表达水平极显著高于对照组,经芒果苷干预后NF-κB基因相对表达量与蛋白表达水平均显著下降,表明芒果苷能有效抑制LPS诱导MH-S细胞中核转录因子的表达;LPS组MH-S细胞表面的TLR4表达水平明显升高,但经芒果苷干预后MH-S细胞表面的TLR4表达水平明显降低,说明芒果苷能有效抑制LPS诱导MH-S细胞表面TLR4的表达。【结论】芒果苷对MH-S细胞的增殖无明显抑制作用,其半数增殖抑制率(IC50)为287.60μg/mL;芒果苷对LPS诱导的MH-S细胞炎症反应具有良好的保护作用,其作用机制可能与抑制TLR4/NF-κB信号通路激活而减少炎症因子的分泌有关。
关键词:芒果苷;小鼠肺泡巨噬细胞(MH-S);脂多糖(LPS);炎症因子;TLR4/NF-κB信号通路
中图分类号:S853.74文献标志码:A文章编号:2095-1191(2024)07-1907-09
Machenism of mangiferin suppressing the inflammatoryresponse induced by lipopolysaccharide in mousealveolar macrophage
LI Ya-juan FANG Qiu-guo LI Yu-shu SUN Qin-qin LI Shun HUANG Yun-fei ,FU Qiang
(1School of Biology and Biological Engineering,South China University of Technology,Guangzhou,Guangdong51064 China;2School of Animal Science and Technology,Foshan University,Foshan,Guangdong 528225,China)
Abstract:【Objective】The objective of this study was to analyze the inhibition mechanisms of mangiferin on lipopoly‐saccharide(LPS)-induced inflammatory response,with the goal of identifying a potential therapeutic agent for sepsis.【Method】In this research,mouse alveolar macrophage(MH-S)were chosen as the subject of investigation,and the cyto‐toxic impact of mangiferin on MH-S was assessed using the CCK-8 assay.According to the cytotoxicity test,the concen‐tration of mangiferin was 100μg/mL.With normal cultured MH-S as the control,10μg/mL LPS was used for 24 hto con‐struct an in vitro inflammatory model(LPS group),and then 100μg/mL mangiferin was intervened for 24 h(intervention group).The contents of inflammatory factors(IL-1β,TNF-α,IL-6 and IL-18)in MH-S supernatants were measured by ELISA,gene expression of IL-1β,TNF-α,IL-6 and IL-18 was assessed using real-time fluorescence quantitative PCR,and changes in TLR4/NF-κB signaling pathway were measured by Western blotting and immunofluorescence.【Result】Mangiferin did not have obvious toxic effect on MH-S when its concentration was below 287.60μg/mL.Compared with the control group,the relative expression of IL-1β,TNF-α,IL-6 and IL-18 was extremely significantly increased in the LPS group(P<0.0 the same below),and the contents of IL-1β,TNF-α,IL-6 and IL-18 in the cell supernatant was sig‐nificantly(P<0.05,the same below)or extremely significantly increased.Following treatment with mangiferininterven‐tion,there was significant decrease in both relative expression levels of IL-1β,TNF-α,IL-6 and IL-18 genes and their se‐cretion levels,suggesting that mangiferin could alleviate inflammatory response in MH-S induced by LPS.In addition,relative expression of NF-κB gene and protein expression level in MH-S of LPS group were extremely significantly higher than that of the control group,and the relative expression of NF-κB gene and protein expression level decreased signifi‐cantly after mangiferin intervention,indicating that mangiferin could effectively inhibit expression of nuclear transcrip‐tion factors in MH-S induced by LPS;the TLR 4 expression level on the surface of MH-S of LPS group was greatly in‐creased,but the TLR 4 expression level on MH-S surface decreased greatly after mangiferin intervention,indicating that mangiferin could effectively inhibit TLR 4 expression on the surface of MH-S induced by LPS.【Conclusion】Mangiferin has no obvious inhibitory effect on the proliferation of MH-S cells,and the half proliferation inhibition rate(IC50)of man‐giferin is 287.60μg/mL.Mangiferin has fine protective effect against the LPS-induced inflammatory response in MH-S,and the mechanism of action may be related to the reduction of inflammatory factor secretion by inhibiting the activation of TLR4/NF-κB signaling pathway.
Key words:mangiferin;mouse alveolar macrophage(MH-S);lipopolysaccharide(LPS);inflammatory factor;TLR4/NF-κB signaling pathway
Foundation items:National Natural Science Foundation of China(31872443);Guangdong Basic and Applied Basic Research Project(2022A151514005 2023A1515110264);Guangdong Postgraduate Education Innovation Plan Project(2022JGXM128)
0引言
【研究意义】细菌性疾病是畜禽养殖中的常见疾病,具有易感性高、传染性强、致病性高等特征,主要侵害动物的免疫系统,严重制约了养殖业的健康发展。尤其是革兰氏阴性菌感染机体后,其毒力因子——脂多糖(Lipopolysaccharide,LPS)会引发严重的炎症反应,造成多器官功能衰竭甚至死亡,临床上多表现为脓毒症(Peng et al.,2021)。脓毒症可引发多种严重的临床病症,对动物的致死率极高(张旋,2018;刘欢,2023)。目前,脓毒症的治疗主要采取抗生素支持疗法,但随着抗生素的禁用及绿色养殖的推广,寻找新的脓毒症治疗方法已迫在眉睫。【前人研究进展】越来越多天然产物被证实具有较强的抗感染功效,且具有无残留、不产生耐药性的优点(Jianget al.,2022)。芒果苷是一种广泛存在于百合科植物知母及漆树科植物芒果树和扁桃树果实、树皮、叶中的天然产物(李秀楠等,2023;范香成等,2024),属于黄酮类化合物,因具有C-葡萄糖黄铜结构,可稳定与其特定的受体结合,并表现出多种药效作用(韦啟球等,2023),在抗肿瘤(Morozkina et al.,2021)、改善心血管功能(Zhang et al.,2021)、抵抗细菌感染(Gálvez-Rodríguez et al.,2022)、抗炎症(Lum et al.,2022)及治疗糖尿病(Wang et al.,2022)等方面疗效显著。已有研究证实,芒果苷可通过作用于NF-κB/NLRP3/GSDMD信号通路而抑制LPS诱导的小鼠骨髓巨噬细胞焦亡(Feng et al.,2022);芒果苷还能通过抑制p-IκB和p-p65活性,改善CCL4诱导的小鼠肝脏纤维化(Zhang et al.,2023)。此外,Fomenko和Chi(2016)研究发现,芒果苷可调节代谢紊乱,改善肥胖与糖尿病症状;Walia等(2021)研究表明,芒果苷可增强机体内源性抗氧化水平,从而保护神经元免受氧化应激影响。可见,芒果苷具有多种药理学活性,且毒性很小,仅在远超临床使用剂量的高剂量(1000 mg/kg)下才观察到毒性作用(Dou et al.,2014)。【本研究切入点】巨噬细胞是启动炎症反应的重要效应细胞,受LPS刺激后分泌大量炎症因子,参与多种疾病的发生与发展(Hu etal.,2021;李静等,2023)。Toll样受体4(Toll like receptor 4,TLR4)是巨噬细胞识别与结合胞外信号的重要受体,当LPS与其结合蛋白LPB结合后能被TLR4识别,并激活下游核转录因子-κB(Nuclear factor kappa B,NF-κB),从而促进炎症因子的表达与释放(Olona et al.,2021)。芒果苷具有抑制炎症因子表达与分泌的作用,但有关芒果苷抑制LPS诱导巨噬细胞TLR4/NF-κB信号通路介导炎症反应的研究尚无文献报道。【拟解决的关键问题】培养小鼠肺泡巨噬细胞(MH-S),通过LPS诱导MH-S细胞构建炎症模型,以芒果苷进行干预处理后,检测MH-S细胞中的炎症因子分泌水平与基因转录情况,以及TLR4和NF-κB的表达变化,旨在探究芒果苷抑制LPS诱导的炎症反应作用机制,为筛选治疗脓毒症的候选药物提供科学依据。
1材料与方法
1.1试验材料
MH-S细胞系购自武汉普诺赛生命科技有限公司;芒果苷、β-巯基乙醇(β-mercaptoethanol)、二甲基亚砜(DMSO)和TRIzol购自西格玛奥德里奇(上海)贸易有限公司;RPMI-1640培养基和胎牛血清(FBS)购自美国ThermoFisher Scientific公司;Evo M-MLV RT-PCR试剂盒及SYBR Green Pro Taq HS预混型qPCR试剂盒购自湖南艾科瑞生物工程有限公司;CCK-8检测试剂盒购自上海碧云天生物技术股份有限公司;细胞总蛋白提取试剂盒购自北京全式金生物技术有限公司;BCA蛋白定量试剂盒购自宝生物工程(大连)有限公司;β-Actin一抗(ab8226)、p65一抗(ab307840)、TLR4一抗(ab22048)及重组羊抗鼠IgG抗体购自艾博抗(上海)贸易有限公司;ELISA试剂盒购自北京索莱宝科技有限公司。主要仪器设备有实时荧光定量PCR仪(ABI,Q5)、全波长酶标仪及激光共聚焦扫描显微镜(ZISS,LSM-800)等。
1.2细胞培养及分组
MH-S细胞采用含0.05 mmol/Lβ-巯基乙醇和10%FBS的RPMI-1640培养基进行培养,培养条件为5%CO2、温度37℃。(1)芒果苷对MH-S细胞毒性试验:MH-S细胞接种至96孔细胞培养板,接种密度为5000个/孔,接种24h后进行后续试验。(2)芒果苷干预LPS诱导MH-S细胞炎症模型试验:MH-S细胞接种至6孔细胞培养板,接种密度为1×106个/孔,培养24h后进行后续试验。对照组:不进行任何处理,正常培养24h;LPS组:用含10μg/mL LPS的培养基培养24 h;干预组:先加入含10μg/mL LPS的培养基,再加入以DMSO溶解的芒果苷溶液(终浓度100μg/mL),24 h后进行后续试验。
1.3芒果苷对MH-S细胞的毒性检测
按5000个/孔的密度将MH-S细胞接种至96孔细胞培养板(每孔添加100.0μL培养基),培养24h后加入芒果苷溶液,浓度分别为50、100、200、400和800μg/mL,每个浓度设8个复孔。处理24h后每孔加入10.0μL CCK-8试剂,置于培养箱中继续培养4 h,使用酶标仪在450 nm处检测其光密度(OD)。根据OD与药物浓度,计算芒果苷对MH-S细胞的增殖抑制率和半数增殖抑制率(IC50)。
增殖抑制率(%)=O(O)D空白(D空白)组(组)OD(OD)对照组(芒果苷)×100
式中,OD空白组为只有培养基的细胞培养孔OD,OD芒果苷为加入芒果苷的细胞培养孔OD,OD对照组为加入DMSO的细胞培养孔OD。
1.4细胞炎症因子含量检测
根据1.2的操作方法对MH-S细胞进行处理,试验结束后收集上清液,采用ELISA试剂盒检测IL-1β、TNF-α、IL-6及IL-18等细胞炎症因子含量。
1.5基因表达水平检测
根据1.2的操作方法对MH-S细胞进行处理,试验结束后弃上清液。以预冷的PBS洗涤细胞后,采用TRIzol提取细胞总RNA,并反转录合成cDNA。采用实时荧光定量PCR检测MH-S细胞中IL-1β、TNF-α、IL-6、IL-18和NF-κB基因的相对表达量,反应体系20.0μL:2×SYBR Green Pro Taq HS PremixⅡ10.0μL,上、下游引物(10μmol/L)各1.0μL,cDNA模板2.0μL,无酶水6.0μL。扩增程序:95℃预变性30 s;95℃30 s,60℃30 s,进行40个循环。以β-Actin为内参基因,通过2-ΔΔCt法计算IL-1β、TNF-α、IL-6、IL-18和NF-κB基因的相对表达量。实时荧光定量PCR扩增引物序列信息如表1所示。
1.6蛋白表达水平检测
采用Western blotting检测MH-S细胞中NF-κB表达水平。根据1.2的操作方法对MH-S细胞进行处理,试验结束后弃上清液。以预冷的PBS洗涤细胞后加入裂解液,冰上裂解30min,每隔10min剧烈振荡1次。4℃下12000×g离心10 min,得到总蛋白溶液;然后使用BCA法对总蛋白溶液进行定量,经SDS-PAGE电泳分离后转印至PVDF膜上,以封闭液封闭1h。使用一抗进行孵育(4℃孵育过夜),孵育结束以TBST洗涤5次,加入HRP标记山羊抗鼠IgG(二抗)室温孵育2h,二抗孵育结束后通过凝胶成像系统曝光采集图片,并以Image J对图像中的条带进行灰度值分析。
同时,采用免疫荧光法对MH-S细胞中的TLR4表达水平进行检测,将MH-S细胞接种于共聚焦显微镜观察专用的培养皿中,按照1.2的操作方法对细胞进行处理,试验结束后弃上清液,并以预冷的PBS洗涤3次。经4%多聚甲醛室温固定30min后,加入0.5%Triton X-100通透处理细胞膜5 min,再加入含1%BSA的PBS进行封闭;封闭结束后以TLR4一抗室温孵育2h,再用荧光标记山羊抗鼠IgG(二抗)室温孵育2 h,然后以Hoechst 33342(H33342)室温染色15 min,最后在激光共聚焦显微镜下进行观察拍照。
1.7统计分析
试验数据采用GraphPad Prism 8.0进行统计分析。
2结果与分析
2.1芒果苷对MH-S细胞的毒性检测结果
采用CCK-8试剂检测芒果苷对MH-S细胞的增殖抑制率,以评价芒果苷对MH-S细胞的毒性作用。OD与药物浓度呈剂量依赖的线性关系,其线性回归方程为y=0.1545x-2.8575,R2=0.9998。芒果苷对MH-S细胞的增殖抑制率如图1所示,IC50=287.60μg/mL。表明芒果苷浓度低于287.60μg/mL时,对MH-S细胞无明显的毒性作用。基于芒果苷对MH-S细胞的毒性试验结果,选择100μg/mL作为后续试验的药物浓度。
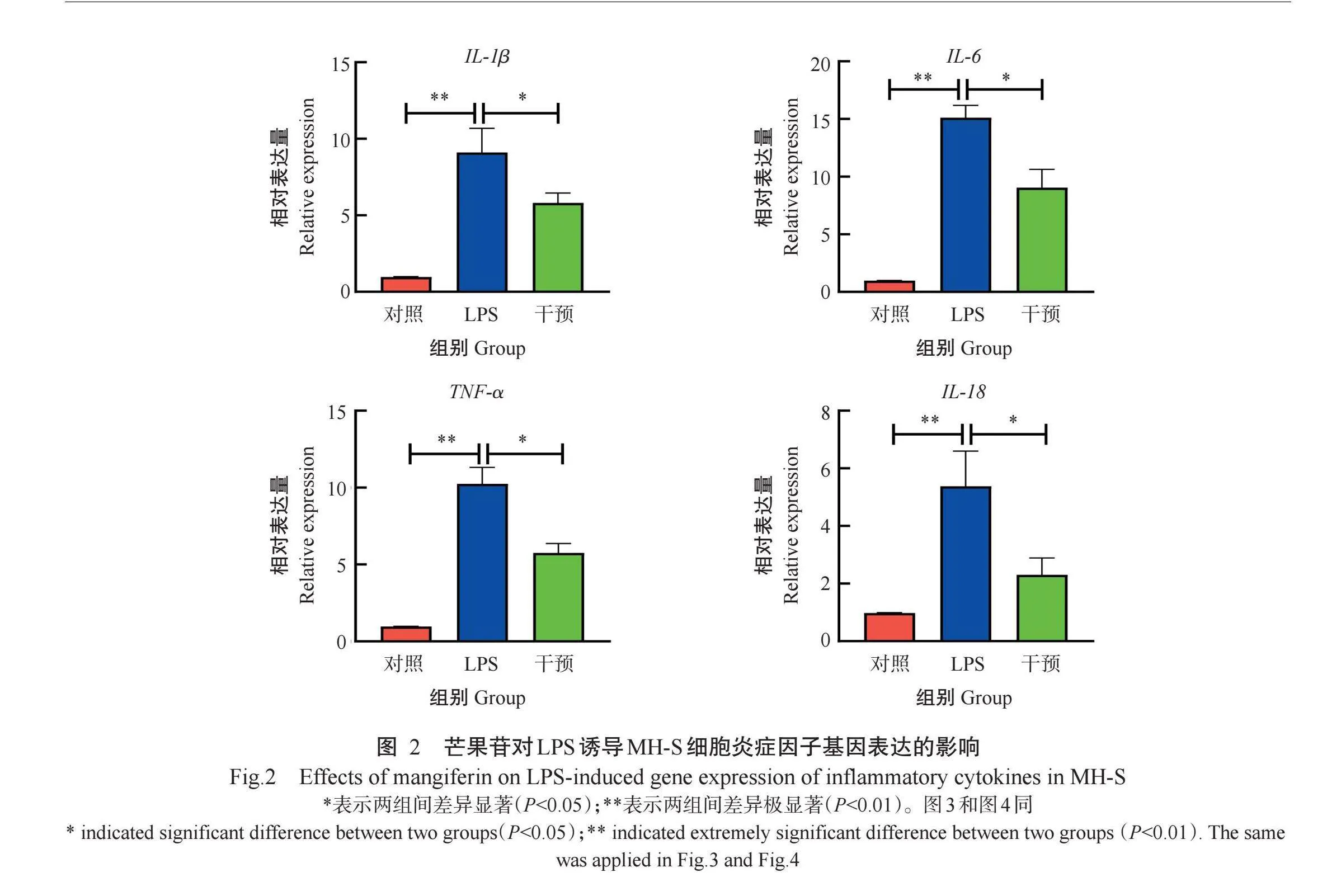
2.2芒果苷对LPS诱导MH-S细胞炎症因子基因表达的影响
由图2可看出,与对照组相比,LPS组MH-S细胞中的IL-1β、TNF-α、IL-6和IL-18基因相对表达量均极显著升高(P<0.0 下同);与LPS组相比,干预组MH-S细胞中的IL-1β、TNF-α、IL-6和IL-18基因相对表达量显著降低(P<0.05,下同)。说明芒果苷能有效抑制LPS诱导MH-S细胞炎症因子基因的表达。
2.3芒果苷对LPS诱导MH-S细胞炎症因子分泌的影响
由图3可看出,与对照组相比,LPS组MH-S细胞上清液中的IL-1β、TNF-α、IL-6和IL-18含量显著或极显著升高;与LPS组相比,干预组MH-S细胞上清液中的IL-1β、TNF-α、IL-6和IL-18含量均显著降低。可见,芒果苷能有效抑制LPS诱导MH-S细胞炎症因子的分泌。
2.4芒果苷对LPS诱导MH-S细胞核转录因子表达的影响
为进一步验证芒果苷对MH-S细胞核转录因子表达的影响,采用实时荧光定量PCR检测MH-S细胞中NF-κB基因的表达情况。如图4所示,LPS组MH-S细胞中的NF-κB基因相对表达量极显著高于对照组,而干预组MH-S细胞中的NF-κB基因相对表达量显著低于LPS组;在蛋白表达水平方面,LPS诱导MH-S细胞中的NF-κB表达水平极显著高于对照组,但添加芒果苷后NF-κB的表达水平显著下降,表明芒果苷能有效抑制LPS诱导MH-S细胞中核转录因子的表达。
2.5芒果苷对LPS诱导MH-S细胞表面TLR4表达的影响
如图5所示,LPS组MH-S细胞表面的TLR4表达水平明显升高,但添加芒果苷后MH-S细胞表面的TLR4表达水平明显降低,说明芒果苷能有效抑制LPS诱导MH-S细胞表面TLR4的表达。
3讨论
革兰氏阴性菌感染机体后,在机体的生长或死亡过程中会释放出LPS,而LPS在机体内能引发炎症级联瀑布效应(Tang et al.,2019)。炎症反应失控引发的炎症因子风暴是LPS导致组织损伤的重要原因(Sul and Ra,2021),因此控制炎症反应对改善革兰氏阴性菌感染引起的组织损伤具有重要意义。已有研究表明,芒果苷具有多种药理学活性,因含有与多个与羟基连接的C-葡萄糖基而表现出较强的抗炎活性(范香成等,2024)。巨噬细胞是动物机体重要的免疫效应细胞,遍布于各器官组织中。巨噬细胞受LPS刺激后会释放IL-1β、TNF-α等炎症因子(Liuet al.,2020)。鉴于MH-S细胞较小鼠原代肺泡巨噬细胞更稳定,且试验所需细胞数量较多,故本研究通过LPS诱导MH-S细胞构建炎症模型,再以芒果苷处理炎症细胞,结果表明芒果苷能有效抑制LPS诱导MH-S细胞的炎症反应。
炎症反应是一种伴随着多种疾病发生的病理现象,炎症因子分泌是炎症反应的典型特征,过度分泌会引起细胞及组织损伤(Tu and Li,2023)。IL-1β、TNF-α、IL-6和IL-18是巨噬细胞受LPS刺激后产生的主要炎症因子(Ishida et al.,2023)。本研究也发现,经LPS刺激处理后,MH-S细胞中的炎症因子基因相对表达量及其分泌水平呈显著或极显著的升高趋势。IL-1β和TNF-α可通过激活细胞焦亡、氧化应激等相关通路而诱导多种细胞损伤(Wang et al.,2020);IL-6能激活JAK1/STST3-MMP9信号通路造成视网膜神经节细胞损伤(曹平和苏露煜,2023),IL-6还能通过影响上皮细胞通透性而引起猪肠道黏膜损伤,进而加重仔猪腹泻(谢开会,2023);IL-18激活NF-κB后导致人类脐静脉内皮细胞损伤,是深静脉血栓形成的重要原因(李光第等,2017)。这些炎症因子还通过募集各种类型的免疫细胞而加重炎症反应(Kolaczkowska and Kubes,2013)。综上所述,抑制炎症因子分泌对控制LPS诱导的炎症反应具有重要意义。本研究结果表明,100μg/mL芒果苷可有效抑制LPS诱导MH-S细胞中IL-1β、TNF-α、IL-6和IL-18基因相对表达量及其分泌水平的升高。Feng等(2022)研究表明,芒果苷能显著抑制LPS诱导小鼠骨髓源巨噬细胞中IL-1β、TNF-α、IL-6和IL-18等炎症因子的表达与分泌;刘睿喆和陈德胜(2023)研究发现,芒果苷可显著降低小鼠磨损颗粒诱导骨溶解动物模型中的TNF-α和IL-6含量。此外,芒果苷在多种疾病模型或炎症损伤模型中表现出极强的抗氧化活性(韦啟球等,2023;潘敏丽等,2024)。可见,芒果苷具有潜在的抗炎和抗氧化药用价值。
芒果苷属于天然产物中的黄酮类化合物,具有毒性小甚至无毒性的优点(范香成等,2024)。本研究中,100μg/mL芒果苷表现出理想的抑制细胞炎症反应特性,鉴于芒果苷可有效降低炎症因子基因的相对表达量,故推测芒果苷可抑制相关核转录因子的表达。卫智权等(2011)研究表明,使用LPS处理小鼠后白细胞中的NF-κB基因相对表达量显著升高,但经芒果苷处理后NF-κB基因相对表达量又显著降低。除了NF-κB外,芒果苷还能激活心肌成纤维细胞中核转录因子E2相关因子2(Nuclear factor-erythroid 2-related factor Nrf2)的表达(孟云霞,2020),进一步说明芒果苷可通过干预核转录因子表达而控制炎症反应。LPS引起的炎症反应是涉及多种信号通路的复杂病理反应,其中核转录因子的激活是这一病理反应的主要特征。Toll样受体(Toll like receptor,TLR)是位于多种细胞膜表面的模式识别受体,其中TLR4可结合LPS,通过信号转导方式激活核转录因子(Ciesielska et al.,2021)。本研究结果表明,以LPS处理MH-S细胞后,TLR4表达水平明显升高,但芒果苷能有效抑制LPS诱导的TLR4表达升高。由此推测,芒果苷可通过抑制TLR4/NF-κB信号通路关键蛋白的表达,而控制LPS诱导的炎症反应(图6)。Jia等(2019)研究表明,芒果苷有效改善了博来霉素诱导的小鼠肺纤维化,且主要是通过TLR4/p65信号通路抑制炎症反应;但Feng等(2022)研究发现芒果苷通过干预Caspase-1/GSDMD通路介导的细胞焦亡而抑制LPS诱导的巨噬细胞炎症反应。芒果苷对LPS诱导的巨噬细胞炎症反应具有良好保护作用,为使用芒果苷治疗革兰氏阴性菌感染引起的脓毒症及其他感染性疾病提供了参考依据。
4结论
芒果苷对MH-S细胞的增殖无明显抑制作用,其IC50为287.60μg/mL;芒果苷对LPS诱导的MH-S细胞炎症反应具有良好的保护作用,其作用机制可能与抑制TLR4/NF-κB信号通路激活而减少炎症因子的分泌有关。
参考文献(References):
曹平,苏露煜.2023.决明子多糖调节IL-6/JAK2/STAT3通路对高糖诱导视网膜神经节细胞损伤的影响[J].河北医药,45(9):1297-1301.[Cao P,Su L Y.2023.Influence of cassia polysaccharide on high glucose-induced retinal gan-glion cell injury by regulating the IL-6/AK2/STAT3 path-way[J].Hebei Medical Journal,45(9):1297-1301.]doi:10.3969/i.issn.1002-7386.2023.09.003.
范香成,焦广洋,张凤,韩军,陈万生.2024.芒果苷的药效作用研究进展[J].海军军医大学学报,45(2):219-226.[Fan X C,Jiao G Y,Zhang F,Han J,Chen W S.2024.Pharmacodynamics of mangiferin:Research progress[J].Academic Journal of Naval Medical University,45(2):219-226.]doi:10.16781/j.CN31-2187/R.20220402.
李光第,赵学凌,周如丹.2017.IL-18激活NF-κB细胞信号通路对人脐静脉内皮细胞损伤作用的体外研究[J].重庆医学,46(24):3313-3317.[Li G D,Zhao X L,Zhou R D.2017.In vitro study on injury effect of lL-18 activating NF-κB cell signal pathway on human umbilical vein endothe-lial cells[J].Chongqing Medicine,46(24):3313-3317.]doi:10.3969/i.issn.1671-8348.2017.24.001.
李静,武万强,杨靖亚.2023.紫草素可抑制在RAW264.7巨噬细胞和斑马鱼幼虫中由脂多糖诱导的炎症反应[J].甘肃农业大学学报,58(1):38-45.[Li J,Wu W Q,Yang J Y.2023.Shikonin inhibits lipopolysaccharide-induced inflam-matory responses in RAW264.7 macrophages and zebra-fish larvae[J].Journal of Gansu Agricultural University,58(1):38-45.]doi:10.13432/j.cnki.jgsau.2023.01.005.
李秀楠,王海云,吴倩,徐敏.2023.芒果苷在扁桃叶与芒果叶中含量的比较研究[J].产业科技创新,5(6):48-50.[Li X N,Wang H Y,Wu Q,Xu M.2023.Comparative study on the content of mangiferin in almond and mango leaves[J].Industrial Technology Innovation,5(6):48-50.]
刘欢.2023.转录因子ZBED6在猪骨骼肌生长和脓毒症肌萎缩中的作用及机制研究[D].杨凌:西北农林科技大学.[Liu H.2023.The role and mechanism of transcription fac‐tor ZBED6 in porcine skeletal muscle growth and sepsisinduced muscle atrophy[D].Yangling:Northwest A&F University.]doi:10.27409/d.cnki.gxbnu.2023.002377.
刘睿喆,陈德胜.2023.新芒果苷对小鼠磨损颗粒诱导骨溶解动物模型中炎症骨溶解影响的研究[J].宁夏医科大学学报,45(9):871-875.[Liu R Z,Chen D S.2023.The re-search on effects of neomangiferin on inflammatory osteo-lysis in mouse animal models induced by titanium particles[J].Journal of Ningxia Medical University,45(9):871-875.]doi:10.16050/j.cnki.issn 1674-6309.2023.09.002.
孟云霞.2020.芒果苷激活Nrf2抑制心肌纤维化——基于谷氨酰胺分解和谷氨酸重分配的研究[D].石家庄:河北中医学院.[Meng Y X.2020.Mangiferin activates Nrf2 to attenuate cardiac fibrosis via redistributing glutaminolysis-derived glutamate[D].Shijiazhuang:Hebei University of Chinese Medicine.]doi:10.27982/d.cnki.ghbyz.2020.000 167.
潘敏丽,黄国定,蔡冠虎,卢宏全.2024.基于Nrf2-GPX4铁死亡途径探讨芒果苷对大鼠心肌缺血再灌注损伤的作用机制[J].中西医结合心脑血管病杂志,22(4):646-652.[Pan M L,Huang G D,Cai G H,Lu H Q.2024.Effect of mangiferin on myocardial ischemia-repertusion injury inrats based on Nrf2-GPX4 ferroptosis pathway[J].Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease,22(4):646-652.]doi:10.12102/j.issn.1672-1349.2024.04.011.
韦啟球,高思,冯艺萍,裴世成,刘雪萍.2023.芒果苷对心肌细胞损伤的保护作用及对NFATc4表达的影响[J].中国药房,34(20):2454-2458.[Wei Q Q,Gao S,Feng Y P,Pei S C,Liu X P.2023.Protective effects of mangiferin against myocardial cell damage and its effects on the expression of NFATc4[J].China Pharmacy,34(20):2454-2458.]doi:10.6039/i.issn.1001-0408.2023.20.02.
卫智权,邓家刚,阎莉,包传红.2011.芒果苷对脂多糖诱导慢性炎症的抗炎作用[J].中药药理与临床,27(2):43-45.[Wei Z Q,Deng J G,Yan L,Bao C H.2011.The anti-inflammatory actions of mangiferin on the chronic inflam‐mation induced by lipopolysaccharide[J].Pharmacology and Clinics of Chinese Materia Medica,27(2):43-45.]doi:10.13412/j.cnki.zyyl.2011.02.017.
谢开会.2023.Lnc001776通过ssc-let-7i-5p/IL-6调控CPB2毒素诱导IPEC-J2细胞损伤的作用机制研究[D].兰州:甘肃农业大学.[Xie K H.2023.Functional mechanism of Lnc001776 modulating CPB2 toxin-induced injury of IPEC-J2 cells via ssc-let-7i-5p/IL-6[D].Lanzhou:Gansu Agricultural University.]doi:10.27025/d.cnki.ggsnu.2023.000035.
张旋.2018.脓毒症在H7N9禽流感以及侵袭性肺曲霉菌病中的临床研究[D].杭州:浙江大学.[Zhang X.2018.Clini‐cal study of sepsis in avian-origin influenza A(H7N9)and invasive pulmonary aspergillosis[D].Hangzhou:Zhejiang University]
Ciesielska A,Matyjek M,Kwiatkowska K.2021.TLR4 andCD14 trafficking and its influence on LPS-induced pro-inflammatory signaling[J].Cellular and Molecular LifeSciences,78:1233-1261.doi:10.1007/s00018-020-03656-y.Dou W,Zhang J J,Ren G Y,Ding L L,Sun A N,Deng C,WuX J,Wei X H,Mani S,Wang Z T.2014.Mangiferin attenua-tes the symptoms of dextran sulfate sodium-induced colitis in mice via NF-κB and MAPK signaling inactivation[J].International Immunopharmacology,23(1):170-178.doi:10.1016/j.intimp.2014.08.025.
Feng M,Wei S Q,Zhang S D,Yang Y.2022.Anti-inflammation and anti-pyroptosis activities of mangiferin via suppressing NF-κB/NLRP3/GSDMD signaling cascades[J].Internatio-nal Journal of Molecular Sciences,23(17):10124.doi:10.3390/ijms231710124.
Fomenko E V,Chi Y L.2016.Mangiferin modulation of metabolism and metabolic syndrome[J].BioFactors,42(5):492-503.doi:10.1002/biof.1309.
Gálvez-Rodríguez A,Ferino-Pérez A,Rodríguez-Riera Z,Rodeiro G I,Řeha D,Minofar B,Jáuregui-Haza U J.2022.Explaining the interaction of mangiferin with MMP-9 and NF-kB:A computational study[J].Journal of Molecular Modeling,28:266.doi:10.1007/s00894-022-05260-2.
Hu Q,Lyon C J,Fletcher J K,Tang W F,Wan M H,Hu T Y.2021.Extracellular vesicle activities regulating macro‐phage-and tissue-mediated injury and repair responses[J].Acta Pharmaceutica Sinica B,11(6):1493-1512.doi:10.1016/j.apsb.2020.12.014.
Ishida K,Nagatake T,Saika A,Kawai S,Node E,Hosomi K,Kunisawa J.2023.Induction of unique macrophage subset by simultaneous stimulation with LPS and IL-4[J].Fron‐tiers in Immunology,14:1111729.doi:10.3389/fimmu.2023.1111729.
Jia L,Sun P,Gao H,Shen J,Gao Y,Meng C,Fu S D,Yao H J,Zhang G.2019.Mangiferin attenuates bleomycin-induced pulmonary fibrosis in mice through inhibiting TLR4/p65 and TGF-β1/Smad2/3 pathway[J].Journal of Pharmacy and Pharmacology,71(6):1017-1028.doi:10.1111/jphp.13077.
Jiang Q Q,Chen X,Tian X,Zhang J M,Xue S M,Jiang Y Y,Liu T T,Wang X P,Sun Q B,Hong Y Q,Li C,Guo D Q,Wang Y,Wang Q Y.2022.Tanshinone I inhibitsdoxorubicin-induced cardiotoxicity by regulating Nrf2 sig-naling pathway[J].Phytomedicine,106:154439.doi:10.1016/j.phymed.2022.154439.
Kolaczkowska E,Kubes P.2013.Neutrophil recruitment and function in health and inflammation[J].Nature Reviews Immunology,13(3):159-175.doi:10.1038/nri3399.
Liu L L,Guo H M,Song A M,Huang J H,Zhang Y,Jin S S,Li S T,Zhang L G,Yang C Z,Yang P S.2020.Progranulin inhibits LPS-induced macrophage M1 polarization via NF-κB and MAPK pathways[J].BMC Immunology,21(1):32.doi:10.1186/s 12865-020-00355-y.
Lum P T,Sekar M,Gan S H,Jeyabalan S,Bonam S R,Rani N N I M,Ku-Mahdzir K M,Seow L J,Wu Y S,Subramani-yan V,Fuloria N K,Fuloria S.2022.Therapeutic potential of mangiferin against kidney disorders and its mechanism of action:A review[J].Saudi Journal of Biological Scien-ces,29(3):1530-1542.doi:10.1016/j.sjbs.2021.11.016.
Morozkina S N,Nhung V T H,Generalova Y E,Snetkov P P,Uspenskaya M V.2021.Mangiferin as new potential anti-cancer agent and mangiferin-integrated polymer systems—A novel research direction[J].Biomolecules,11(1):79.doi:10.3390/biom 11010079.
Olona A,Hateley C,Muralidharan S,Wenk M R,Torta F,Beh-moaras J.2021.Sphingolipid metabolism during Toll-like receptor 4(TLR4)-mediated macrophage activation[J].British Journal of Pharmacology,178(23):4575-4587.doi:10.1111/bph.15642.
Peng X Y,Lu Z X,He S,Zhang L H,Li Y.2021.Blood-brain barrier disruption by lipopolysaccharide and sepsis-associated encephalopathy[J].Frontiers in Cellular and In-fection Microbiology,11:768108.doi:10.3389/fcimb.2021.768108.
Sul O J,Ra S W.2021.Quercetin prevents LPS-induced oxida-tive stress and inflammation by modulating NOX2/ROS/NF-κB in lung epithelial cells[J].Molecules,26(22):6949.doi:10.3390/molecules26226949.
Tang J,Diao P,Shu X H,Li L,Xiong L D.2019.Quercetin and quercitrin attenuates the inflammatory response and oxida-tive stress in LPS-induced RAW264.7 cells:In vitro assess-ment and a theoretical model[J].Biomed Research Inter-nal,2019:7039802.doi:10.1155/2019/7039802.
Tu H Y,Li Y L.2023.Inflammation balance in skeletal muscle damage and repair[J].Frontiers in Immunology,14:1133 355.doi:10.3389/fimmu.2023.1133355.
Walia V,Chaudhary S K,Sethiya K N.2021.Therapeutic potential of mangiferin in the treatment of various neuro-psychiatric and neurodegenerative disorders[J].Neuroche-mistry International,143:104939.doi:10.1016/j.neuint.2020.104939.
Wang M D,Liang Y,Chen K Q,Wang M L,Long X H,Liu H L,Sun Y,He B.2022.The management of diabetes melli-tus by mangiferin:Advances and prospects[J].Nanoscale,14:2119-2135.doi:10.1039/d 1nr06690k.
Wang Y J,Che M X,Xin J G,Zheng Z,Li J B,Zhang S K.2020.The role of IL-1βand TNF-αin intervertebral disc degeneration[J].Biomedicine&Pharmacotherapy,131:110660.doi:10.1016/j.biopha.2020.110660.
Zhang L J,Huang C,Fan S J.2021.Mangiferin and organ fibro-sis:A mini review[J].BioFactors,47(1):59-68.doi:10.1002/biof.1693.
Zhang L J,Liu C H,Yin L F,Huang C,Fan S J.2023.Mangi-ferin relieves CCl4-induced liver fibrosis in mice[J].Scien-tific Reports,13:4172.doi:10.1038/s41598-023-30582-3.
(责任编辑兰宗宝)

