棘孢木霉对苹果幼苗生长及抗氧化系统的影响
摘 要:为了探讨棘孢木霉(Trichoderma asperellum)对苹果幼苗生长、叶片光合参数和抗氧化系统的影响,设计了组培苗和盆栽苗两大试验系列。结果表明,棘孢木霉在苹果根际具有较强的定殖能力,并且能够显著促进组培苗根系的生长。具体来说,接种后的幼苗根部定殖率高达9×103CFU/克,根表面积、根长、根体积及投影面积均呈现出显著的增长趋势。在盆栽苗设计试验中也观察到了棘孢木霉对苹果幼苗生长的促进作用。与对照组相比,接种后的幼苗在株高、叶片光合作用及抗氧化酶系统方面均表现出明显的优势。在幼苗生长的40~50天时,生长速度达到了峰值,相较于对照组,增长率分别为27.97%和32.86%。此外,经棘孢木霉诱导的苹果苗在叶片光合作用方面也展现出优异的表现,包括光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)及叶绿素含量(Chi)的显著提升。同时,过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性也明显增强,而胞间CO2浓度及丙二醛(MDA)含量则显著降低。
关键词:棘孢木霉;苹果;叶片;光合作用;抗氧化系统
目前,化学肥料和农药对保障粮食、果蔬高产稳产起到不可替代的作用。它们的过度使用已经对生态环境造成了严重的污染和破坏,同时也对食品安全和食品贸易产生了不良影响。研究表明,微生物农药和微生物肥料具有可持续性及与环境相容性的特点,有望成为化学药剂的潜在替代品。近年来,越来越多的学者致力于研究木霉对植物的促生机制。
对植物起促生作用的有益微生物种类多样,包括链霉菌属(Streptomyces)、根瘤菌属(Rhizobium)等。木霉属(Trichoderma)真菌,具有高效性和广谱性的抑菌功能并且能促进植物生长[1-3],广泛存在于土壤中。21世纪前大多研究都注重在木霉生物防治方面,对其促生机制研究甚少[4-6]。近年来,越来越多的研究表明,木霉菌可以稳定地定殖在植物的根部,并通过改良土壤、引起植物新陈代谢的变化、分泌植物生长激素、抑制病原菌生长、诱导植物抗性、提高养分利用率等方式促生[7]。接种哈茨木霉菌可以有效促进番茄幼苗生长并提高产量[8],而钩状木霉菌则对辣椒疫病具有生物防治作用[9]。此外,当植株面临非生物胁迫时,木霉的诱导作用可以显著降低植株中的活性氧水平,从而提高其对逆境的抵抗力。例如,在玉米接种绿色木霉和哈茨木霉后,盐和干旱对玉米的伤害得到了有效缓解[10-11]。
虽然目前关于木霉对作物生长发育及抗逆性的影响已有研究报道,但受试物种主要集中在番茄、小麦、玉米和水稻等禾本科植物上,而关于木霉对木本植物苹果生长发育影响的研究较少。鉴于此,笔者在本试验中以苹果幼苗为试材,评价菌株ACCC30536对幼苗生长、叶片光合参数、叶绿素含量以及抗氧化酶活性等生理指标的影响,以期为木霉开发成为新型生物农药提供一定的理论和科学依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 供试菌株 棘孢木霉 ACCC30536菌株购买自泰斯拓生物。
1.1.2 供试植物 嘎拉苹果组培苗,培养于鲁东大学农学院农林作物抗逆育种实验室,设置室内温度 24 ℃,光/暗周期 14小时/10 小时。
1.1.3 试剂与培养基 马铃薯葡萄糖琼脂 (PDA) 培养基(表1)。
1.1.4 主要仪器
紫外可见分光光度计 TU-1810 (北京普析通用仪器有限责任公司);ME104E1/1000 电子天平 (赛多利斯科学仪器有限公司);SW-CJ-1BU 型洁净工作台 (苏州安泰空气技术有限公司);ZQZY-CF 型振荡培养箱 (上海知楚仪器有限公司)、DHT-450A 高温鼓风干燥箱(上海岛韩实业有限公司)。
1.2 试验方法
1.2.1 棘孢木霉孢子悬浮液制备 将棘孢木霉在PDA平板上28 ℃生长7天,将10毫升无菌水加入培养皿中,将培养皿中的孢子刮下。将孢子悬浮液转移至30个直径为30毫米玻璃珠的无菌锥形瓶(150毫升)中,用封口膜封口,将其放入恒温振荡器,最后制成木霉孢子悬浮液,用血球计数板测定孢子浓度,将其调整为1×105CFU/毫升,备用。
1.2.2 苹果组培苗处理 将生根30~40天的苹果苗在超净工作台中移栽至装有灭菌苔藓组培瓶中,放在植物组培室生长5天,然后将制作好的棘孢木霉孢子悬浮液接种至苔藓组培瓶中。
1.2.3 苹果组培苗根部定殖的测定 取接菌后的苹果苗根部于 FAA 透明液中固定 1 分钟,制作临时装片,于显微镜下观察苹果苗根部菌丝定殖情况。采用菌落计数法统计棘孢木霉菌定殖数量。在超净工作台内取出接菌后的苹果苗,将根部苔藓清理干净,利用研钵将苹果根部研磨破碎,梯度稀释后涂在PDA 培养基中,统计定殖数量。
1.2.4 苹果盆栽苗处理 将生根30~40天的苹果苗移栽至蛭石与营养土混合(体积比1∶1)的营养钵中(7厘米×7 厘米),之后缓苗1周,选取大小一致的苹果苗分为2组。空白对照组(CK)用无菌水、处理组(T)用1×105CFU/毫升的棘孢木霉孢子悬浮液对苹果苗进行浇灌处理。
1.2.5 苹果苗形态指标测定 处理45天后,将生长在苔藓组培瓶中苹果植株取出,去除附着在根系上的苔藓,从根茎处剪断,用纯水清洗根系3~4遍,放入扫描盒后铺平,使用SNAPSCAN310扫描仪扫描拍照,用Win RHIZO根系扫描仪对扫描后的图像进行分析。
处理60天后,每组随机选取5棵苹果幼苗,用米尺测定株高;取整株植物于电子天平称鲜质量。
1.2.6 苹果苗光合参数及叶绿素含量测定 在09:00—11:00用 LI-6400光合测定仪测定植株功能叶的光合参数。叶绿素含量采用紫外分光光度法测定[12]。
1.2.7 苹果苗抗氧化酶活性测定 在不同处理植株上取相同部位成熟叶片,每个处理3次重复,用纯水洗干净且吸干水分,将叶片剪碎,用电子天平称0.1克叶片,加入1毫升磷酸缓冲液(pH 7.5),进行冰浴匀浆。8000 g4 ℃离心10分钟,取上清液,至冰上待测。
超氧化物歧化酶(SOD)活性测定:反应混合物含有 100毫摩尔/升 磷酸盐缓冲液(pH 7.8),75毫摩尔/升核黄素,2毫摩尔/升NBT,3毫摩尔/升 EDTA,200毫摩尔/升蛋氨酸和 50毫升酶提取物,在光照下在 25 ℃下开始光还原反应 15分钟后再暗反应一段时间,在560纳米下测量SOD的活性。
过氧化氢酶(CAT)活性测定:2.5毫升总反应混合物包含 100毫摩尔/升磷酸缓冲液 (pH 7)和 100微升20 毫摩尔/升H2O2。通过添加酶提取物开始反应,3 分钟内在 240纳米下监测 H2O2 含量的减少。
过氧化物酶(POD)活性测定:取 2 只光径 1厘米比色杯,1 只加入反应物(100毫摩尔磷酸缓冲溶液50毫升,加入愈创木酚 28微升和 30%H2O219微升混合均匀)3毫升,磷酸氢钾溶液 1毫升作为参比液;在另一只比色管中加入反应混合物 3毫升,酶液提取物 1毫升,立即放入紫外分光光度计TU-1810 (北京普析通用仪器有限责任公司)中,470纳米下测定光密度值,用愈创木酚氧化引起吸收度的增加来测量酶活性。使用牛血清白蛋白作为标准测量蛋白质浓度[13]。
丙二醛含量测定:将称取剪碎的叶片0.1克,用5毫升10%TCA和少量石英砂研磨,10 000转/分离心10分钟,取提取液2毫升(对照加2毫升蒸馏水),加入2毫升0.6%TBA溶液,混匀物于沸水浴上反应15分钟,迅速冷却后3000转/分离心10分钟,取上清液于分光光度计450、532、600纳米处测量吸光度值[13],计算公式:丙二醛含量=6.54×(OD532-OD600)-0.56×OD450。
1.3 数据统计分析
运用 Excel 整理数据,进行平均值和标准差的计算;用 Sigma Plot 10 软件对数据绘图,数据取平均值 ±标准差(n=3,3 个生物学重复)。
2 结果与分析
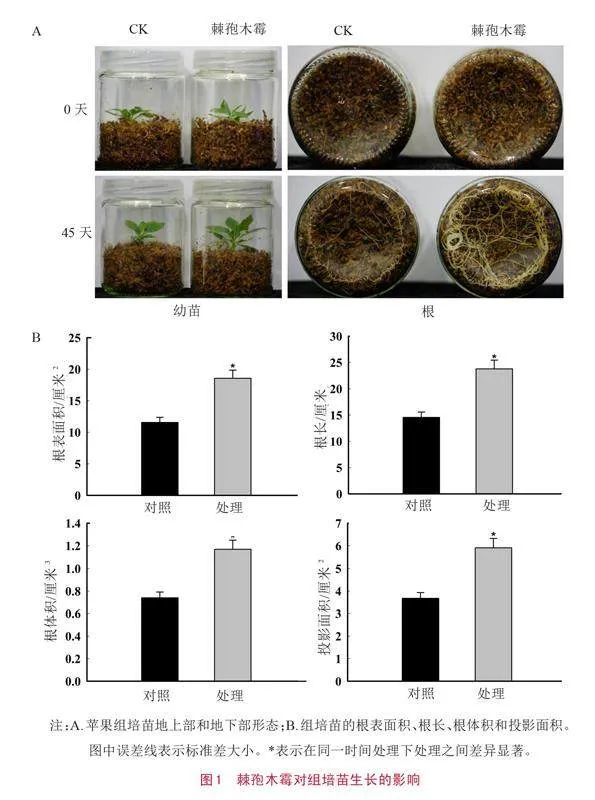
2.1 接种棘孢木霉对组培苗生长的影响
经棘孢木霉诱导后,苹果组培苗的生长受到了显著影响。在接种初期,地上部和地下部的生长保持一致。随着时间的推移,特别是在接种后的第45天,地下部展现出了明显的生长促进作用,而地上部的变化相对较小(如图1-A所示)。对根部进行进一步扫描分析,结果显示,幼苗的根表面积、根长、根体积和投影面积均显著提高,与对照相比,分别增加了60.54%、63.48%、57.73%和60.54%(如图1-B所示)。这些差异极为显著,表明苹果苗与棘孢木霉之间存在一种有益的相互作用,这种作用有效地促进了苹果幼苗地上部和地下部的协同生长。
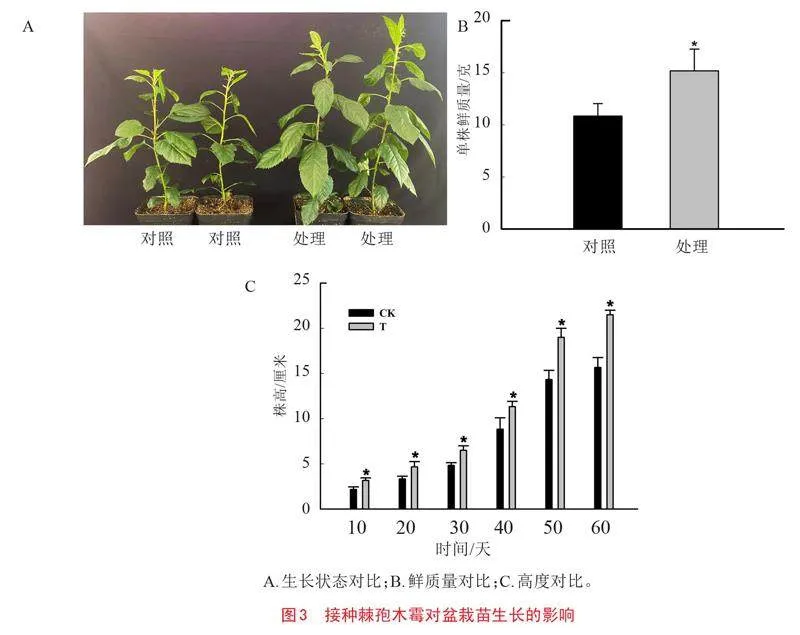
2.2 接种棘孢木霉对组培苗根部定殖的影响
接种棘孢木霉后,其在组培苗根部的定殖情况如图2所示。图2-A为对照组,只有少量侧根;图2-B为试验组,经棘孢木霉诱导后的苹果幼苗根部被菌丝紧密缠绕;图2-C显示棘孢木霉在根部的定殖率为9×103CFU/克。
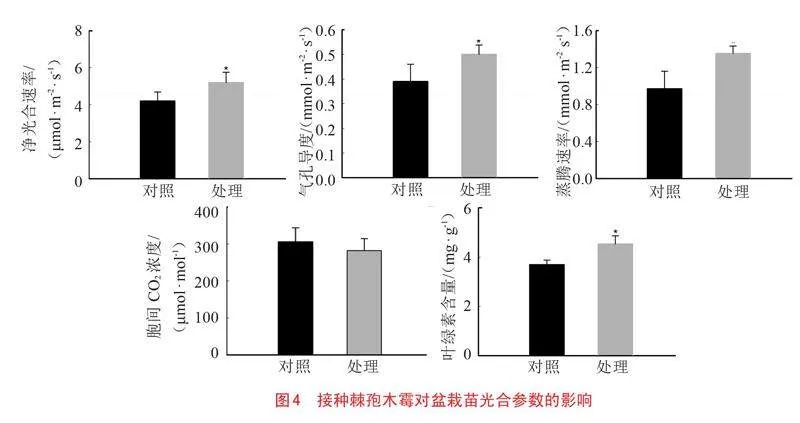
2.3 接种棘孢木霉对盆栽苗生长的影响
经过棘孢木霉的诱导处理后,苹果苗株高呈现出了稳定的增长趋势。在生长初期的前30天内,苹果苗的生长速度相对较慢;但在接下来的30~50天阶段,其生长速度显著提升,特别是在诱导后的第40天和第50天,苹果苗的高度分别显著增加了27.97%和32.86%。经过为期60天的生长后,试验组苹果植株的高度均明显高于对照组。与对照组相比,经过棘孢木霉的诱导处理的试验组苹果植株的鲜质量增加了39.99%,进一步证实了棘孢木霉对苹果植株生长的积极促进作用(如图3所示)。
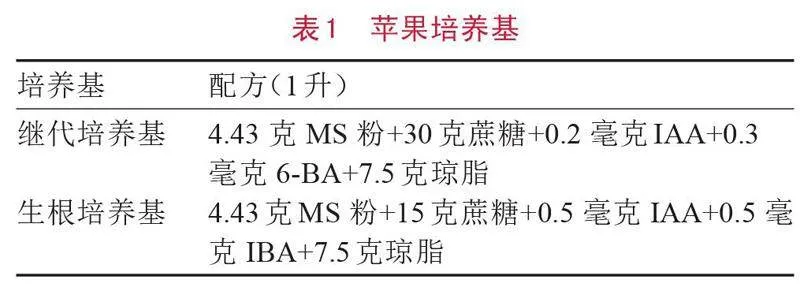
2.4 接种棘孢木霉对盆栽苗光合参数的影响
经过棘孢木霉的诱导后,苹果叶片的光合参数呈现出显著高于对照组的趋势。其中,净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)分别比对照组提高了23.8%、28.2%和39.34%。而细胞间CO2浓度(Ci)比对照组降低了8.49%。另外,叶绿素含量比对照组增加了22.76%。这些结果表明,棘孢木霉对苹果叶片的光合作用有着积极的促进作用(图4)。
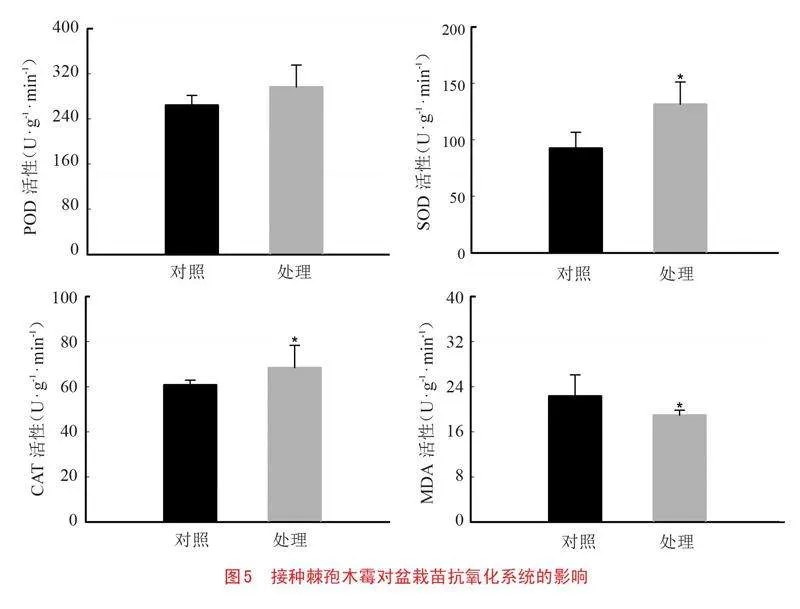
2.5 接种棘孢木霉对盆栽苗抗氧化系统的影响
经过棘孢木霉的诱导处理后,苹果叶片中的过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性均显著提高,同时丙二醛(MDA)含量则有所降低。与对照组相比,接种了棘孢木霉的苹果幼苗POD、SOD和CAT的活性分别提高了1.96%、42.22%和12.58%,MDA含量降低了17.87%。综合来看,棘孢木霉对苹果叶片的酶活性产生了显著影响(图5)。
3 讨 论
定殖是衡量微生物与植物互作的重要标志[14]。当微生物定殖于植物根际时,可以为植物提供水和氮、磷等矿物元素,而植物为微生物提供营养物质,如氨基酸、碳水化合物和有机酸等。研究表明,木霉菌在盐胁迫下促进了氮素的获取和光合参数的改善,从而促进了枸杞的生长[15];棘孢木霉M45a定殖于水稻根系组织,株高、地上部干质量、根际土壤总氮含量和硝态氮含量显著增加[16]。本研究中将棘孢木霉与苹果组培苗共培养,定殖于根部并显著促进了植株生长,说明其与根系发生了有益的相互作用。
一系列研究表明,木霉定殖能显著促进植物光合作用。例如,当植物的根部与木霉菌发生互作时,会导致基因和色素的上调,从而提高植物的光合作用效率[17]。Shoresh等[18-19]通过蛋白质组学的方法深入研究了玉米与木霉之间的互作,他们发现,木霉可以上调参与碳水化合物代谢、光合作用和应激过程相关的蛋白质的表达,进而促进玉米植株的生长。本研究结果表明,棘孢木霉侵染根系后,显著促进苹果光合作用、增加苹果叶片叶绿素含量。这暗示着,棘孢木霉可能通过提高苹果叶绿素含量,使叶片更有效地吸收光能,并将其转化为碳水化合物,从而促进植物的生长和发育。
本研究结果表明,菌株还影响了苹果幼苗的其他代谢活性。菌株提高了过氧化氢酶(CAT)和过氧化物酶(POD)的活性,降低了丙二醛(MDA)含量。POD和SOD可以参与清除细胞中的活性氧、防止细胞过氧化,在保持细胞膜结构完整、增强植物抗逆性、延缓植株衰老等方面具有重要作用[20]。MDA含量是膜脂质过氧化的指标,指示植物的衰老程度。本研究中POD、SOD活性增强和MDA含量降低,表明木霉能够有效提高苹果的防御酶活性,降低脂质过氧化水平,因此具有较大的生防潜力。
参考文献
[1] HARMAN G E, HOWELl C R, VITERBO A, et al. Trichoderma species-opportunistic, avirulent plant symbionts[J]. Nature Reviews Microbiology, 2004, 2 (1) : 43-56.
[2] GHAZANFAR M U, RAZA M, RAZA W, et al. Trichoderma as potential biocontrolagent,its exploitation in agriculture: A review[J]. Plant Protection, 2018, 2 (3) : 109-135.
[3] OLOWE O M, NICOLA L, ASEMOLOYE M D, et al. Trichoderma: Potential bio-resource for the management of tomato root rot diseases in Africa[J].Microbiological Research, 2022, 257 : 126978.
[4] HARMAN G E. Trichoderma-not just for biocontrol anymore[J]. Phytoparasitica, 2011, 39 (2) : 103-108.
[5] HERMOSA R, RUBIO M B, CARDOZA R E, et al. The contribution of Trichoderma to balancing the costs of plant growth and defense[J]. International Microbiology the Official Journal of the Spanish Society for Microbiology, 2013, 16 (2) : 69-80.
[6] MAHATO S, BHUJU S, SHRESTHA J. Effect of Trichoderma viride as biofertilizeron growth and yield of wheat[J]. Malaysian Journal of Sustainable Agriculture, 2018, 2 : 1-5.
[7] 赵 欣,王怡霏,王嘉嘉,等. 木霉菌对作物及土壤生态环境的影响[J]. 中国农业科技导报,2023,25(11):166-172.
[8] 孙 锦. 生物基质应用研究进展与前景[J]. 寒旱农业科学,2023,2(11):981-98.
[9] 赵兴丽,陶 刚,娄 璇,等.钩状木霉在辣椒根际定殖动态及其对辣椒疫病的生物防治[J]. 中国农业科技导报,2020,22(5):106-114.
[10] 付 健,王玉凤,张翼飞,等. 不同木霉菌对寒地盐碱土壤玉米杂交种光合特性及活性氧代谢的影响[J]. 黑龙江八一农垦大学学报,2021,33(1):7-14.
[11] 邓 薇,张祖衔,曹宇航,等. 绿色木霉缓解干旱胁迫对玉米幼苗根系生长的影响[J]. 山东农业科学,2022,54(2):40-45.
[12] 张以顺,黄 霞,陈云凤. 植物生理学实验教程[M]. 北京:高等教育出版社,2009.
[13] CHEN, Y J, WAN S, ZHOU J, et al. Leaf chlorophyll fluorescence, hyperspectral reflectance, pigments content, malondialdehyde and proline accumulation responses of castor bean (Ricinus communis L.) seedlings to salt stress levels[J]. Industrial Crops and Products, 2010, 31 (1) : 13-19.
[14] 李纪顺,陈 凯,李 玲,等. 木霉融合子Tpf-2的定殖及其对番茄防御酶系的影响[J]. 植物保护,2018,44(4):65-69
[15] YAN K, ZHU M, SU H, et al. Trichoderma asperellum boosts nitrogen accumulation and photosynthetic capacity of wolfberry (Lycium chinense) under saline soil stress[J]. Tree Physiology, 2024, 44 (1), tpad148.
[16] 张 屹,何 英,肖姬玲,等. 棘孢木霉M45a的定殖能力及其对水稻促生作用研究[J]. 安徽农业大学学报,2021,48(2):261-265.
[17] HARMAN G E, DONI F, KHADKA R B, et al. Endophytic strains of Trichoderma increase plants' photosynthetic capability[J]. Journal of Applied Microbiology[J]. 2021, 130 (2) : 529-546.
[18] SHORESH M, HARMAN G E. The molecular basis of shoot responses of maize seedlings to Trichoderma harzianum T22 inoculation of the root: A proteomic approach[J]. Plant Physiology. 2008, 147 (4): 2147-2163.
[19] SHORESH M, HARMAN G E. The relationship between increased growth and resistance induced in plants by root colonizing microbes[J]. Plant Signaling & Behavior,2008, 3 (9) : 737-739.
[20] 沈 菲. 不同品牌哈茨木霉及施用方式对青菜的促生作用[D]. 杭州:浙江农林大学,2023.

