基于组学分析的鸡环境适应性研究进展
摘 要:鸡作为世界上分布最为广泛的家养动物之一,对不同环境具有良好的适应能力并形成了稳定的遗传机制,是研究动物环境适应性的重要模型。测序技术的成熟与全球环境数据库的日渐完善使遗传与环境的关联分析成为可能。群体遗传学、景观基因组学、泛基因组学等多种研究方法不断丰富鸡环境适应性的研究,鉴定出一系列与环境适应性相关的候选因子,如与低氧适应性相关的关键因子EPAS1、HIF1A;与鸡寒冷适应性相关的关键因子av-UCP;与鸡高温适应性相关的关键因子HSP,为动物环境适应性遗传机制研究奠定了重要基础。尽管如此,目前鸡环境适应性的分子机制仍不完善。本文从高海拔适应性、冷适应性、热适应性、干旱适应性及综合气候适应性等5个方面,概述近年来鸡的环境适应性研究进展,引出鸡环境适应性研究面临的问题,并对未来的研究趋势进行展望,以期为鸡的种质资源保护与利用提供理论支持。
关键词:鸡;环境适应性;多组学;环境变量
中图分类号:S831.2
文献标志码:A
文章编号:0366-6964(2024)07-2809-16
收稿日期:2023-12-08
基金项目:国家重点研发计划(2021YFD1200302)
作者简介:黄晓隆(2000-),男,辽宁大连人,硕士生,主要从事鸡遗传育种研究,E-mail:xlhuang00@163.com
*通信作者:袁经纬,主要从事家禽遗传育种研究,E-mail:amstrongyuan@163.com;盛熙晖,主要从事家禽遗传育种研究,E-mail:shengxh03@163.com
Research Progress of Environmental Adaptability in Chickens from Perspective of
Omics Analysis
HUANGXiaolong1,2,SHENGXihui1*,YUANJingwei2*
(1.Animal Science and Technology College,Beijing University of Agriculture,Beijing102206,
China; 2.Key Laboratory of Animal(Poultry)Genetics Breeding and Reproduction of
Ministry of Agriculture and Rural Affairs,Institute of Animal Science,Chinese Academy of
Agricultural Sciences,Beijing100193,China)
Abstract:Chicken is one of the most widely distributed animals in the world.It has evolved astable genetic mechanism that allows it to adapt well to various environments,leading chicken as to become an important model for studying the biological mechanism of environmental adaptability.The development of sequencing technology and global environmental databases has made it possible to analyze the association between genetics and the environment.Population genetics,landscape genomics,pan-genome,and other research methods constantly promote researches on the chicken environmental adaptability,identifying aseries of candidate factors,such as EPAS1and HIF1A related to hypoxia adaptability; av-UCP related to cold adaptability and HSP related to heat adaptability in chickens,which laid the foundation for further studies on the genetic mechanism of environmental adaptability.Nevertheless,the molecular mechanisms of chicken environmental adaptability are still elusive.In this review,we summarize the recent research progress that chicken adapted to high-altitude,cold,heat,drought,and comprehensive climate,and put forward the challenges faced and the future research spots in the field,aiming to provide theoretical support for the conservation and utilization of chicken genetic resources.
Key words:chicken; environmental adaptability; omics; environmental variables
*Corresponding authors:YUAN Jingwei,E-mail:amstrongyuan@163.com; SHENG Xihui,E-mail:shengxh03@163.com
气候环境是生物适应性进化的重要驱动力。现代生物进化论认为,生物适应性进化是自然环境驱动生物发生遗传突变导致其表型改变以适应环境的过程。在动物环境适应性研究领域,涉及高原(低氧、低压、强辐射)[1]、炎热[2]、干旱[3]、寒冷[4]等环境类型。大量研究认为,动物能够适应环境而存活,通常取决于其适应现有环境条件的能力[5]。当面临环境压力时,动物可以通过细胞应激反应等途径,保护大分子免受损伤,维持细胞和有机体的正常生理功能,进而适应环境的改变。这一过程被称为应激诱导进化,是动物进化的主要驱动力,主要涉及基因突变、DNA损伤和修复、表观遗传变化(DNA甲基化、组蛋白翻译后修饰、转座因子活性等)、染色体结构变异等分子机制。长期生存在某一环境中的物种会在群体水平上产生可遗传表型变异,提高动物群体适应新环境条件的能力,减小种群灭绝几率[6-7]。通过研究这些变异可以揭示动物环境适应性的潜在遗传机制,为地方品种资源的保护和利用提供科学方法,有利于保护物种多样性与维持生态平衡。
人们主要利用群体遗传学来研究环境适应性,并鉴定出一系列关键因子。近年来随着测序技术的成熟与大量测序数据的累积,人们相继提出了景观基因组学、泛基因组学等组学概念[8]。景观基因组学在群体遗传分析基础上,整合遗传变异数据与环境变量数据,分析基因型-环境互作关系(genotype-environment associations,GEAs),进而揭示生物适应气候环境因子的分子机制[9]。泛基因组相较于单一参考基因组包含更多的变异信息,通过泛基因组研究动物环境适应性可以发现大量以往被我们所忽略的重要基因。然而利用景观基因组学、泛基因组学来分析鸡环境适应性的研究很少,需要相应研究填充该领域内容。目前,利用上述研究方法已经鉴定到大量鸡环境适应性候选基因,但是这些基因发挥功能的分子机制仍不明确,未来需要整合基因组、转录组、甲基化组、蛋白质组、代谢组、微生物组等多种组学研究,同时联合分子试验来解析鸡的环境适应性遗传机制[10]。
鸡起源于东南亚地区,其祖先是红色原鸡滇南亚种(Gallus galluss padiceus)[11-12],被人类驯化后,跟随人类的迁移,分布在世界各地,如高海拔的青藏高原、青海,寒冷的西伯利亚、黑龙江,炎热潮湿的老挝、斯里兰卡,炎热干旱的吐鲁番盆地、利比亚等地区。生存在不同地域的鸡经过长期适应,形成了环境适应性良好且遗传性稳定的地方品种[13]。鸡作为重要家畜之一,极大满足了人们对蛋、肉等畜产品的需求,成为现代农业中不可或缺的一部分[14]。低氧、高温、寒冷等恶劣环境条件会降低鸡的生产性能,造成严重的经济损失。可以通过开展鸡环境适应性研究,揭示鸡有利性状的遗传机制,了解不同环境条件对鸡生产性能的影响,进而培育具有优良性状的鸡品种,并科学地调整饲养管理方法,达到鸡的生产性能与遗传多样性协调发展的目的,最终促进鸡产业的良性发展[15-16]。目前,主要聚焦于鸡的高海拔环境、寒冷环境和高温环境适应性研究,而对于辐射适应性、干旱适应性的相关研究较少。本文主要从高海拔(低氧、辐射)、冷、热及干旱适应性等方面对鸡的环境适应性机制进行阐述,概述环境适应性的研究方法,综述近年来基于组学分析方法取得的最新研究进展,归纳了鸡环境适应性的分子遗传机制。
1 环境类型简介
不同地区在气压、温湿度、降水量、太阳紫外辐射(ultraviolet radiation,UVR)等不同环境因素影响下形成了不同的环境类型,主要包括高海拔、强紫外辐射、寒冷、炎热、干旱等环境类型。高原环境通常伴随着低氧、低压、低温、强辐射等气候条件[17]。辐射是继水、空气和噪音污染外第四大普遍的污染类型,会对正常的身体机能产生不利影响[18]。研究表明,UVR可诱导生物机体发生遗传突变,形成丰富的生物多样性[19]。然而过量的紫外辐射往往会对生物机体造成不可逆的伤害,例如黑色素瘤的发生、维生素合成异常、免疫力下降、行为异常等。青藏高原作为典型的高原环境,大气稀薄、太阳紫外辐射较为强烈,为高海拔动物的辐射适应性研究提供了较为丰富的试验资源,对人类医学、生态环境等研究具有实用价值[20]。温度是影响畜禽生产性能的关键气候因素之一[21-22]。长期生活在寒冷或炎热环境中的鸡群体主要通过调节机体产热与散热来应对温度的变化,并形成了稳定的遗传机制[23]。干旱地区,如塔里木沙漠、撒哈拉沙漠、中东地区,通常伴随高温,生活在该地区的动物往往具有较好的耐热性。
2 环境适应性的研究方法
2.1 环境信息数据化
随着工程技术发展和人们对生态环境的日益重视,多种采集环境信息的设备被研制出来用于全方位收集不同地区的环境数据,如温湿度、水质、氧分压等[24]。针对大量、复杂且与生活和生产活动息息相关的环境数据,不同地区相继建立了各自的环境数据库[25]。这为生物环境适应性的研究提供了相对完善的环境信息。
2.2 群体遗传学方法
群体遗传学主要应用数学和统计学的原理和方法分析群体中基因分布、频率与遗传结构,利用处于不同环境中的群体测序数据,计算群体的遗传分化指数(genetic differentiation index,FST)、基因组纯合片段(runs of homozygosity,ROH)[26]、核苷酸多样性(nucleotide diversity,π)等指标,筛选出受选择的特异性位点或基因组区域[27],为动物环境适应性研究提供理论基础[28]。Petegrosso等[29]在对植物表型、基因型和地理气候进行关联分析时,提出层次规范相关分析方法(hierarchical canonical correlation analysis,HCCA)。该方法将基因突变、基因表达、DNA甲基化与地理气候特征相结合,更深入地挖掘基因功能与环境之间的相互作用,有望为鸡环境适应性研究提供新发现。Gheyas等[30]应用生态位模型(ecological niche modeling,ENM)与全基因组选择特征分析、基因型-环境关联分析相结合的方法,确定非洲本土鸡品种的基因组特征,为阐明畜禽的环境适应性机制提供了一种强有力的新方法。
2.3 景观基因组学方法
景观基因组学主要研究异质性环境变量对群体结构和基因流的影响[31]。环境数据库的建立与高通量测序技术的成熟,极大地推动了景观基因组学的发展成熟。相较于群体遗传学,景观基因组学通过对环境信息与遗传信息进行联合分析,能够更加精准地筛选出相关候选基因,推动动物环境适应性的研究。随着人工智能的广泛应用,机器学习方法可以通过经验学习,不断完善具体算法,比传统统计模型具有更高灵敏度,结果更加准确[32-33]。但是,目前尚无应用机器学习算法分析动物环境适应性的相关研究。将机器学习算法与景观基因组学等方法结合,应用于动物环境适应性研究将会是一个富有潜力的研究方向。
2.4 三代基因组组装及泛基因组策略
组装高质量参考基因组是生物信息学领域的核心问题[34]。基于高质量基因组序列,结合群体遗传学分析、全基因组关联分析(genome-wide association study,GWAS)等研究方法,可以深入剖析该物种与环境适应性相关的基因组区域,发现在以往研究中被忽略的重要基因,更加全面地揭示物种的环境适应性分子机制[35]。随着研究的深入,人们发现在群体遗传学水平上,同一物种的不同个体的基因组序列与其对应的参考基因组存在偏差,参考基因组并不具有该物种的所有基因组信息。泛基因组(pan-genome)概念应运而生,它包含存在于某一物种几乎所有个体中的核心基因组与由自然选择造成的只存在于部分个体中的可变基因组[36]。相较于单一参考基因组,泛基因组包含更多的遗传多样性[37]。通过构建鸡泛基因组,完善现有的鸡参考基因组并获取整个物种的完整变异信息,将有助于深入研究鸡遗传多样性与环境适应性的分子机制[38]。
2.5 多组学联合分析
联合基因组、转录组、蛋白质组等组学分析,可以帮助研究者们较为全面地了解动物环境适应性的分子遗传机制。此外,代谢物是遗传信息流动线路中相关分子机制的底物和产物,可以诱导大分子活性并调控表型,是机体对环境、疾病以及遗传变异等压力因素影响的最终应答和最直接表现[39]。同时,人们通过标记基因分析、宏基因组分析、宏转录组分析等方法进行微生物组学研究,并在宿主对疾病的反应、宿主环境适应性、微生物-宿主共同进化等领域取得了一系列进展,完善了环境适应性机制研究[40-41]。
3 鸡环境适应性机制
3.1 高海拔适应性机制
在藏鸡[42]、藏猪[43]、藏羊[44]、牦牛[45]等畜禽的高原适应性研究中发现,长期生活在高海拔地区的畜禽,在组织器官形态、血液生理生化指标、细胞分子水平变异、肠道微生物群落等方面产生了与高海拔地区适应性相关的、稳定的遗传学特征[46]。
3.1.1 低氧适应性机制
目前,鸡的低氧适应性研究主要集中于藏鸡等高海拔群体,且研究内容较为全面、深入,但鸡低氧适应性分子机制仍不清晰[47]。
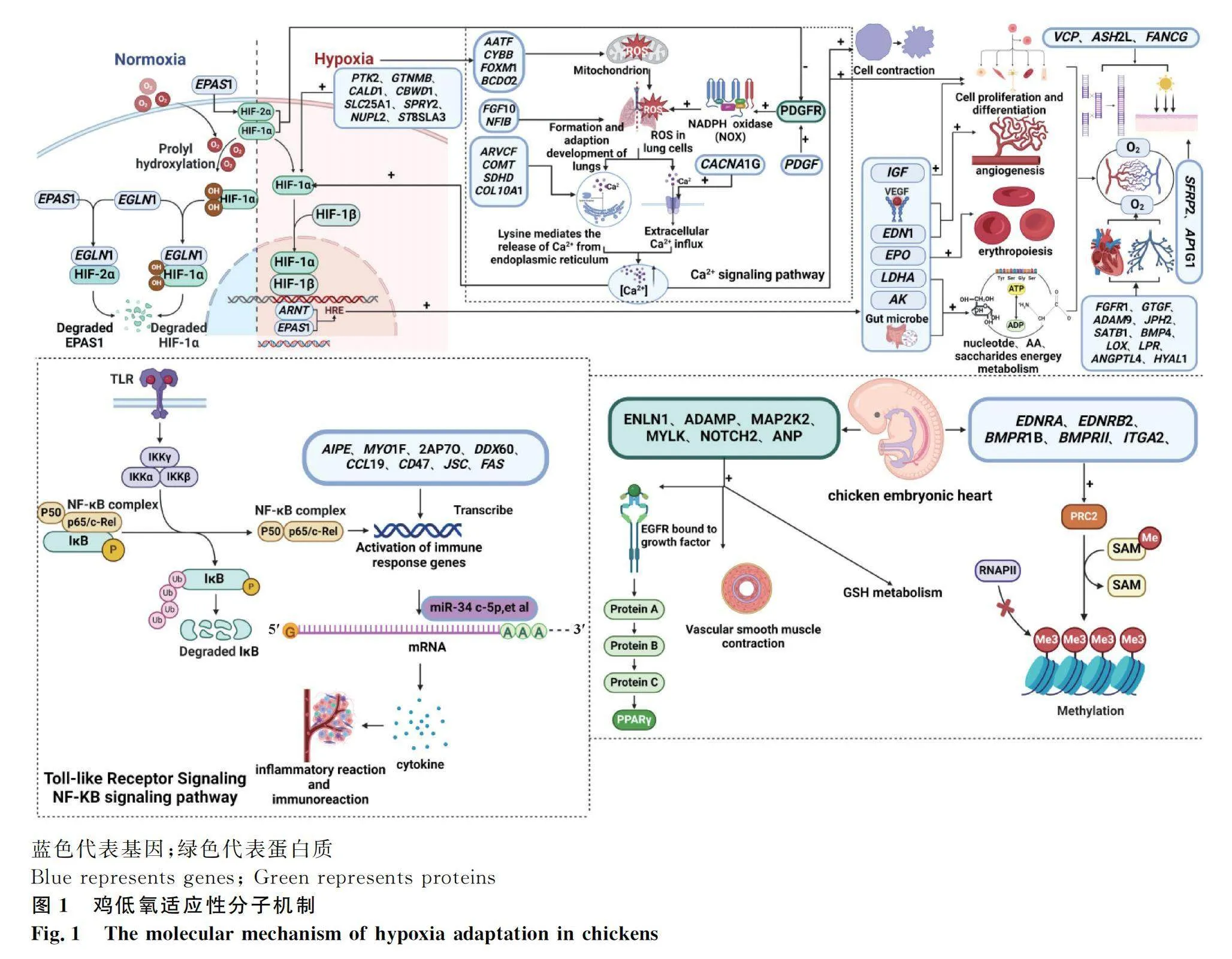
在基因组层面,已经鉴定出大量与低氧适应性相关的候选基因(表1)。EPAS1、HIF-1是被广泛报道与高海拔适应相关的因子。研究者利用全基因组变异信息在人[48]、马[49]、牛[50]和猪[51]等高原土著动物中发现EPAS1基因通常在缺氧环境中受到选择,并在不同家养动物中趋同进化[52]。EPAS1基因编码的HIF-2α与HIF1A基因编码的HIF-1α,均是调节低氧诱导因子(HIF-1)活性的功能亚单位。在低氧条件下,HIF-1可以通过调节血管内皮生长因子(VEGF)、胰岛素样生长因子Ⅱ、糖酵解酶、促红细胞生成素(EPO)的编码基因等,参与红细胞生成、血管形成、核苷酸、氨基酸、糖的能量代谢等生物学过程,提高了机体氧的摄入和利用,进而使机体内环境维持稳态,最终使机体适应低氧环境[53-54]。EGLN1基因在畜禽低氧适应过程中同样重要。该基因参与正常氧分压下HIF-1α、EPAS1蛋白的降解,在低氧条件下,该基因的降解能力下降,HIF-1α、EPAS1蛋白表达量增加,进而使畜禽适应低氧环境[55](图1)。
通过研究不同鸡组织样本的转录组数据,鉴定出大量与鸡低氧适应性相关的基因(表1),同时发现鸡的低氧适应性机制不仅因品种而异[56],还会在鸡的不同发育阶段产生变化。Tang等[57]通过分析藏鸡3个发育阶段(5周、42周和4.5年)的肺脏转录组数据,发现与4.5年龄的鸡相比,5和42周龄个体中上调的差异表达基因富集在氧气转运、氧气结合、氧气载体活性及钙信号通路等与低氧适应性相关的生理过程(图1),该研究结果丰富了鸡低氧适应性机制研究。随着研究深入,人们发现表观遗传修饰也参与调控动物环境适应性。Zhang等[58]利用甲基化DNA免疫沉淀高通量测序(MeDIP-seq)筛选出5个具有低甲基化的候选基因(EDNRA、EDNRB2、BMPR1B、BMPRII和ITGA2)。这些基因参与血管平滑肌收缩、VEGF信号通路、钙信号通路等与低氧适应性相关的通路,在藏鸡胚胎适应低氧过程中发挥关键调节作用(图1)。
蛋白质组学层面的低氧适应性机制研究取得了一定进展。Zhang等[59]在低氧和常氧条件下对藏鸡和茶花鸡的胚胎心脏组织进行蛋白质组学研究,发现ENLN1、ADAM9、MAP2K2、MYLK、NOTCH2、ANP等蛋白参与谷胱甘肽代谢、PPAR信号通路、血管平滑肌收缩等生物学过程。Meng等[60]对西藏和低地鸡的受精卵进行比较N-糖蛋白组学分析,从143种糖蛋白中共发现396个N-糖基化物。通过生物信息学分析,发现这些不同的糖蛋白可能与抗冻活性、低氧适应性相关,进而提高藏鸡适应高原环境的能力(图1)。
目前,已有研究证实鸡肠道微生物组会影响鸡的高海拔适应能力。通过比较高海拔鸡和平原鸡的肠道微生物多样性,发现高海拔鸡盲肠和回肠的微生物多样性显著低于平原鸡,并且高海拔鸡肠道的微生物群落主要涉及能量代谢和聚糖生物合成,推测高海拔鸡的肠道微生物群,可以通过促进能量代谢和聚糖生物合成来提高藏鸡适应高海拔环境的能力[61-62]。目前,利用不同组学技术对鸡的低氧适应性研究已经较为深入,整合不同组学研究结果进行联合分析,可以进一步发现以往被我们所忽略的关键因子,提高深入探索鸡低氧适应性分子机制的能力。
3.1.2 辐射适应性机制
目前,鸡辐射适应性机制的聚焦性研究较少。Elbeltagy等[63]在非洲和埃及鸡品种中,发现SFRP2基因可以促进黑色素生成,AP1G1基因在羽毛色素沉着中起主要作用,二者均有助于增强鸡适应高强度太阳辐射的能力(图1)。同时,辐射适应性机制在植物研究领域已取得较为深入的进展。极地雪藻、拟南芥等植物均被报道是具有抗紫外作用的物质,可有效提升紫外修复能力[64-65]。在未来的研究中,可以借鉴其他生物的辐射适应性研究方法,进而完善鸡的辐射适应性机制。
3.2 温度变化适应性机制
大量研究表明,鸡温度适应性相关基因多数在神经-体液调节途径与脂肪酸代谢中发挥作用[66-68]。
3.2.1 冷适应性机制
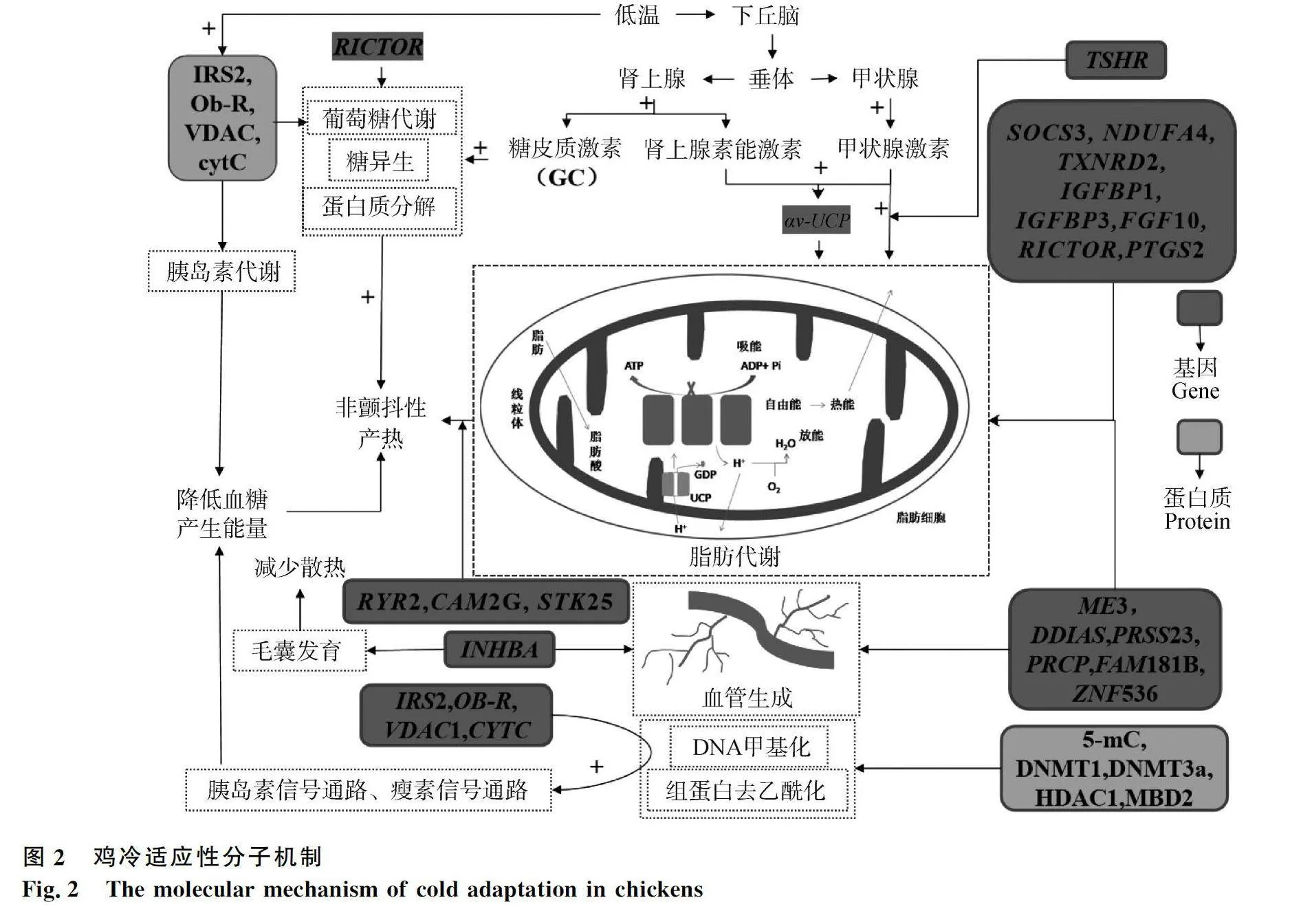
目前,在基因组水平对鸡冷适应性机制的研究较为深入,发现了许多与冷适应相关的候选基因(表1)。Fedorova等[69]利用基因组数据计算横斑洛克鸡群体和俄罗斯白鸡群体的ROH来检测受到选择的基因组区域,并通过Ensembl等数据库进行筛选,最终鉴定到与脂质代谢(SOCS3、NDUFA4、TXNRD2、IGFBP1、IGFBP3)、体温维持(ADIPOQ、GCGR、TRPM2)、非颤抖性产热(RYR2、CAM2G、STK25)和肌肉发育(METTL21C)相关的12个关键基因,认为它们可能参与雏鸡适应寒冷环境的过程(图2)。研究表明,基因组学和转录组学的联合分析可以更好地揭示鸡冷适应性机制。Zhao等[70]通过整合基因组和转录组数据鉴定出6个与鸡冷适应性相关的候选基因(DNAH5、PTGS2、INHBA、IRX2、ENSGALG00000054917和ENSGALG00000046652)。在寒冷条件下,PTGS2基因上调,参与脂肪酸、花生四烯酸代谢等多种代谢反应,并在调节血压、脂肪细胞分化、产热等生理过程中发挥重要作用;IRX2基因上调,在动物发育过程中的组织和器官区域化中发挥关键作用;INHBA基因下调,参与调控毛囊发育、血管生成等生理过程,推测该基因可能对寒冷环境的适应能力有抑制作用(图2)。
在蛋白质组学层面,发现许多蛋白质参与动物冷适应调控。位于线粒体内的解偶联蛋白(UCP)是产热的关键因子。UCP通过解除正常呼吸链中的电子传递,阻碍ATP生成,使生成ATP的自由能转化为热量,其中解偶联蛋白1(UCP1)的产热效果最为显著[21]。鸟类不具备UCP1、UCP2基因,但在禽类基因组中发现了哺乳动物UCP2和UCP3的直系同源物—禽解偶联蛋白基因(avUCP)[22]。通过将鸡暴露于寒冷环境中,结合其生理反应与转录组分析发现av-UCP基因表达上调,正向调节下丘脑-垂体-甲状腺轴,促进脂肪酸代谢,增强鸡的非颤抖产热能力,进而维持温度稳态[71](图2)。
表观遗传学研究表明,长久生存在寒冷环境中的鸡,其某些基因的甲基化水平发生了变化,最终导致基因表达发生改变,从而影响了鸡的冷适应性[72]。但是,目前关于影响鸡冷适应性机制的甲基化基因组区域或甲基化基因尚未报道。未来,需要加强表观遗传学研究,以更好地了解鸡冷适应性机制。
在代谢组学层面的研究聚焦于激素调节机制。激素是影响机体代谢的主要因素之一,机体可通过下丘脑-垂体-甲状腺轴(hypothalamus-pituitary-thyroid axis,HPT axis)、下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA axis)等神经-体液途径调节体内甲状腺激素、促甲状腺激素受体(TSHR)、类固醇激素等激素水平,促进细胞代谢活动,增加产热,从而适应寒冷刺激[73]。基础代谢率(basal metabolic rate,BMR)是机体正常状态下维持基本生命活动的最低代谢速度,随环境温度降低而显著增加[74-75]。目前通过BMR分析鸡冷适应性的研究相对较少。深入解析家禽BMR机制将有助于调节鸡舍温度,提高家禽生产性能。
3.2.2 热适应性机制
禽类无法出汗,当气温高于鸡体温时,主要通过蒸发散热的方式实现热平衡[76-78]。这种散热方式是经过长期内环境与外部环境的互作效应形成的,主要涉及到以下几个方面。
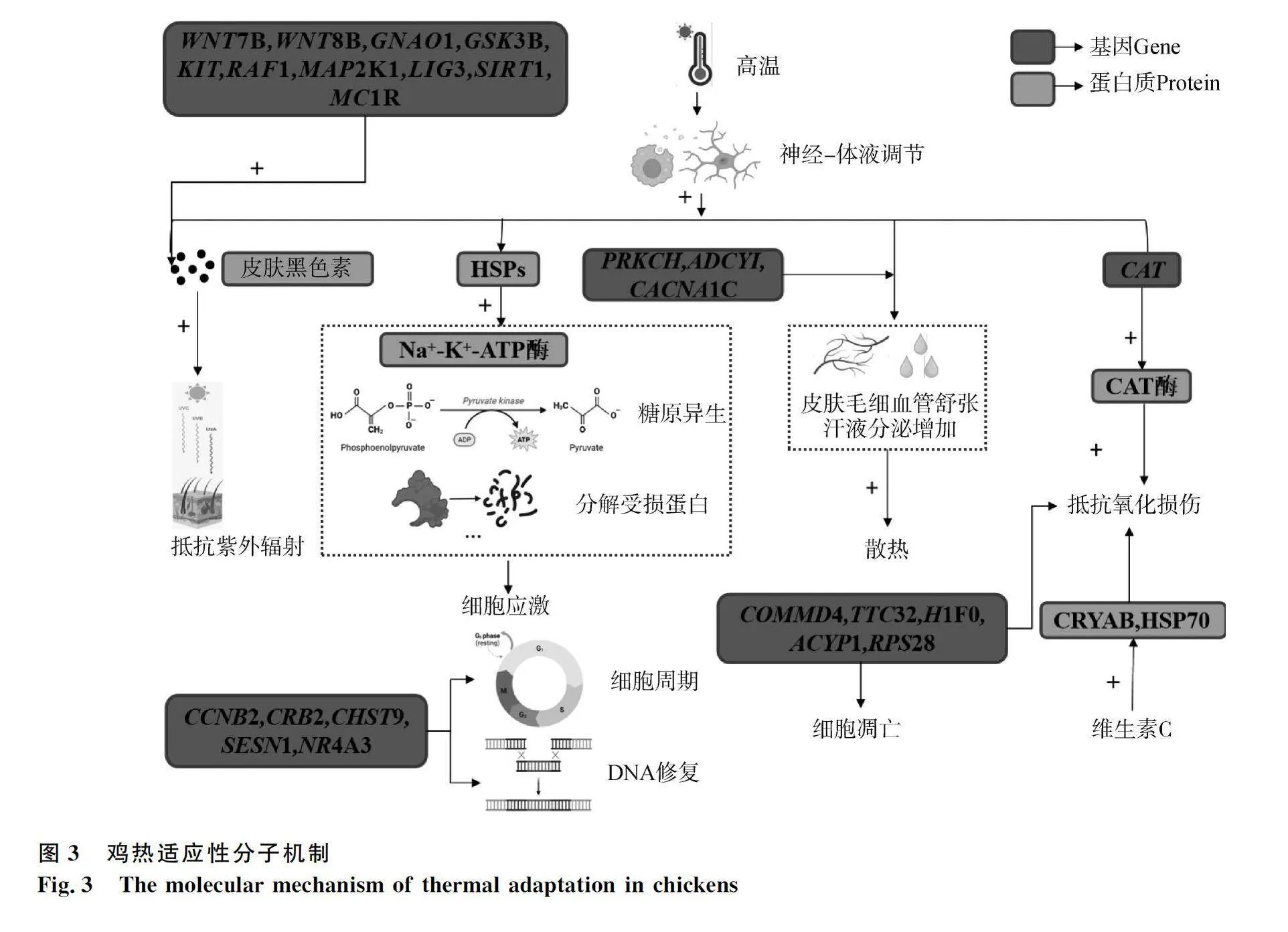
在基因组层面,鉴定出大量候选基因(表1)。Walugembe等[79]通过对来自巴西、斯里兰卡和埃及的鸡基因组进行分析,发现SOCS2基因与埃及鸡热适应性相关,NFKB1基因与斯里兰卡鸡热适应性相关,SLC6A2、HSFl、HSF2、HSF3、HSF4基因与非洲鸡的热适应性相关。Tian等[80]在斯里兰卡鸡和沙特阿拉伯鸡基因组中鉴定到与黑色素生成(WNT7B、WNT8B、GNAO1、GSK3B、KIT、RAF1、MAP2K1、LIG3、SIRT1、MC1R)、血管收缩舒张(PRKCH、ADCYI、CACNA1C)、线粒体呼吸作用(SDHD、VPS13C、PARK2、PACRG)、免疫(TLR7、ZC3HAV1)相关的基因(图3),进一步补充了Walugembe等[79]的研究结果。以上研究并没有排除异质性环境因素的影响,如海拔高度。Srikanth等[81]通过比较低地鸡和高地鸡的差异表达基因及其在不同通路中的富集情况,发现低地鸡对热应激的耐受性比高海拔鸡更强烈,并推测这种现象可能是由于低地鸡已经在低地环境中提前适应过高温环境造成的。所以,在生产实践中通过对鸡进行热处理来提高鸡的耐热性,是一个很有价值的研究方向。Borhan等[82]与Ramiah等[83]的研究回答了这一问题,对鸡预先进行热处理可以使脾脏和肝脏的促炎细胞因子白细胞介素6基因(IL-6)的表达增强,并调节其诱导途径中重要基因的表达来改善鸡对热应激的保护性免疫反应,从而增强其耐热能力。
在鸡热适应性研究中往往联合转录组和表观遗传学分析。Te Pas等[84]通过分析埃塞俄比亚低地鸡的心脏、胸肌和脾脏组织的转录组信息,发现染色质甲基化、组蛋白乙酰化和组蛋白去乙酰化的表观遗传变化可能是埃塞俄比亚低地鸡中所有组织的中心调节机制。这些精细的反应在动物机体适应高温环境的过程中可以维持染色质与蛋白质稳态,保护细胞。动物适应高温环境的过程不仅涉及长期进化形成的分子遗传机制,还包括短暂的应激性适应。多项研究表明[33,66,76],暴露于热应激条件下的鸡肝脏中HSP70、HSP90的转录水平仅在短时间内升高,后又恢复正常值。这一发现有助于挑选耐热应激鸡品种,例如以色列的裸颈鸡,以培育适应炎热环境的新品种或新品系。
在蛋白质组学层面分析鸡热适应性的过程中发现,在应激条件下,细胞为了存活会通过许多诱导因子建立紧急反应机制。热休克蛋白(heat shock proteins,HSPs)是主要调节因子之一。在热应激对鸡呼吸系统造成损伤时,肺脏HSPs表达量增高[85],通过调节凋亡和抗凋亡信号、细胞氧化还原条件等不同的机制以提高细胞的应激能力,进而提高鸡的耐热能力[86-87]。高温条件还会导致氧化损伤,而过氧化氢酶(catalase,CAT)是抗氧化损伤的第一道防线。Rimoldi等[88]的研究结果表明,在经过长达4周的高温条件下,肉鸡体内CAT基因表达增加,其转录水平随之增加,最终导致CAT酶活性增加,提高鸡的热适应性(图3)。
在代谢组学层面,鸡可通过神经发育、激素调节等代谢途径共同作用,减少机体产热,增加散热来适应高温环境。Mackei等[89]利用一种由鸡不同类型肝细胞组成的新型细胞培养物,作为研究急性热应激的模型。结果表明,短期强烈的热应激会促进新陈代谢。但这些改变在热应激2h后恢复,推测鸡肝细胞在应对急性热应激时具有快速适应的潜力。该研究从代谢组学层面进一步验证了Nawaz等[76]的结论。在鸡应对慢性热应激的研究中,发现慢性热应激会激活肉鸡体内的HPA轴,使肾上腺皮质快速释放皮质醇(CORT),最终导致血浆CORT水平增高以应对热应激条件[88]。此外,Yin等[90]发现在鸡日粮中添加维生素C可以诱导CRYAB和HSP70表达,提高机体抵抗热应激损伤的能力。
3.3 干旱适应性机制
鸡的干旱适应性机制与热适应性机制联合分析,可以完善我们对鸡环境适应性的认知。目前关于畜禽干旱适应性机制的研究较少。在鸡干旱适应性机制研究中,大部分与鸡的热适应性机制、辐射适应性机制相关。Walugembe等[79]在来自巴西、斯里兰卡和埃及的鸡基因组中,鉴定到TLR3、SOCS2、EOMES和NFAT5等基因与鸡的干旱和热带环境适应性机制有关。Gu等[91]利用中国尼雅鸡的全基因组数据,挖掘到与循环系统和血管发育(BVES、SMYD1、IL18、PDGFRA、NRP1和CORIN)、中枢神经系统发育(SIM2和NALCN)、细胞凋亡(CLPTM1L、APP、CRADD和PARK2)和脂肪酸代谢(FABP1)相关的基因,并认为这些基因与鸡对炎热干旱环境的适应性有关。
Rocha等[92]总结近年来关于沙漠哺乳动物干旱适应性遗传机制的基因组、转录组、代谢组等方面的研究进展,发现沙漠哺乳动物在脂肪代谢、甲状腺诱导代谢、胰岛素信号转导、盐代谢、氧化应激、DNA损伤修复、辐射反应等生命活动过程中具有趋同进化现象。这些沙漠哺乳动物共用的生物反应途径可能同样适用于长期生存于干旱环境的禽类,这为鸡干旱适应性机制研究提供了新的研究方向。
3.4 综合环境适应性机制
气候类型指一个地区的自然条件,受到太阳辐射、海拔高度、地势地形、大气洋流等多种因素影响[93]。一个气候类型往往具有多种环境变量,如热带沙漠气候,具有高温、干旱两种主要的环境变量,所以动物对某一环境变量的适应性机制往往与同一气候类型中其他环境变量有所关联。由于同一区域的环境变量在不同时间尺度下会有所不同,所以在研究鸡环境适应性时还应该注意环境变量所属的历史时间。针对综合气候适应性的研究,可以利用主成分分析法(PCA)降维处理多变量环境数据,并与遗传数据进行关联分析。Gheyas等[30]在利用环境数据和基因组数据分析非洲本土鸡环境适应性时,通过建立生态位模型(ENM)确定了6个关键环境变量:一个与海拔密切相关的温度变量,三个降水量变量,两个土壤变量,并确定了一些与应对海拔、温度、水资源短缺相关的基因组区域。通过比较不同环境类型中的畜禽环境适应性机制,会发现某些因子或机制在多种环境适应性机制中均可发挥作用,例如,在鸡对温度变化的适应过程中,HSPs蛋白家族、甲状腺激素、TSHR基因等通过不同途径调节鸡的冷适应性与热适应性。结合复杂多变的环境数据与组学研究,有利于在探索鸡环境适应性分子遗传机制的过程中筛选出有利性状,为鸡遗传育种工作提供理论支持[94]。
4 展 望
测序技术的快速发展,使我们能够更低成本、更快速地获得更高质量、更多维度的组学数据;全球环境数据的不断完善,允许我们根据不同需要获得更精准、更全面的环境数据,进而将其与组学数据联合分析,使通过景观基因组学获得的结果更加可靠;分析方法的不断创新,使研究结果更加可靠。这些高精尖生物技术的发展和交叉融合,为我们挖掘动物环境适应性机制提供了良好的基础。此外,生物在长期适应环境过程中,会表现出趋同与平行进化。研究不同物种和品种间的趋同与平行进化,可以有效地帮助我们找到与某一环境变量相关的、大多数动物共有的有利候选基因和遗传机制。在此基础上可以采用基因编辑、基因组选择、杂交等方式培育优良品种,减少应激对鸡生产性能的影响。
地方鸡品种经过长期微进化后,携带着有利于适应不同恶劣环境条件的特定基因,具有丰富的遗传多样性。但是,由于高产商品鸡的规模化养殖和人为的自然环境破坏,一些地方鸡品种的生存空间不断被侵占,群体规模不断减小,群体近交程度不断升高,面临灭绝风险。深入研究鸡的环境适应性,阐明地方鸡品种适应环境的分子机制,有利于提高我们对地方鸡品种种质资源的认识,进而采取科学有效的管理方法,如建立种质资源库,提升地方鸡品种的保护效果,进而维持鸡的遗传多样性,同时对于培育具有良好生产性能的新品种,实现鸡生产性能与遗传多样性的协调发展,具有重要的经济和社会意义。
参考文献(References):
[1]张剑搏,丁学智,AHMAD AA,等.高原土著动物适应性进化的研究进展[J].畜牧兽医学报,2019,50(9):1723-1736.
ZHANG JB,DING XZ,AHMAD AA,et al.Advances in research on adaptive evolution of native animals of tibetan plateau[J].Acta Veterinaria et Zootechnica Sinica,2019,50(9):1723-1736.(in Chinese)
[2]RAMÍREZ-AYALA LC,ROCHA D,RAMOS-ONSINS SE,et al.Whole-genome sequencing reveals insights into the adaptation of French Charolais cattle to Cuban tropical conditions[J].Genet Sel Evol,2021,53(1):3.
[3]TIBARY A,EL ALLALI K.Dromedary camel:A model of heat resistant livestock animal[J].Theriogenology,2020,154:203-211.
[4]CASTELLANI JW,YOUNG AJ.Human physiological responses to cold exposure:Acute responses and acclimatization to prolonged exposure[J].Auton Neurosci,2016,196:63-74.
[5]BOOTHBY TC.Mechanisms and evolution of resistance to environmental extremes in animals[J].EvoDevo,2019,10:30.
[6]MOJICA EA,KÜLTZ D.Physiological mechanisms of stress-induced evolution[J].J Exp Biol,2022,225(S1):jeb243264.
[7]SARREMEJANE R,TRUCHY A,MCKIE BG,et al.Stochastic processes and ecological connectivity drive stream invertebrate community responses to short-term drought[J].J Anim Ecol,2021,90(4):886-898.
[8]XIONG XW,LIU JX,RAO YS.Whole genome resequencing helps study important traits in chickens[J].Genes(Basel),2023,14(6):1198.
[9]SHAFFER HB,TOFFELMIER E,CORBETT-DETIG RB,et al.Landscape genomics to enable conservation actions:the California conservation genomics project[J].J Hered,2022,113(6):577-588.
[10]冯 勉,张 莉.多组学联合分析在畜禽研究中的应用[J].中国畜牧杂志,2022,58(3):1-6.
FENG M,ZHANG L.Application of multi-omics joint analysis in the research of livestock and poultry[J].Chinese Journal of Animal Science,2022,58(3):1-6.(in Chinese)
[11]WANG MS,THAKUR M,PENG MS,et al.863genomes reveal the origin and domestication of chicken[J].Cell Res,2020,30(8):693-701.
[12]SHAO D,YANG Y,SHI SR,et al.Three-dimensional organization of chicken genome provides insights into genetic adaptation to extreme environments[J].Genes(Basel),2022,13(12):2317.
[13]PHAM LD,GIANG TT N,NGUYEN VB,et al.The complete mitochondrial genome and phylogenetic analyses of to chicken in vietnam[J].Genes(Basel),2023,14(5):1088.
[14]SINGH M,PATTON RN,MOLLIER RT,et al.Indigenous chicken production system in different agro-ecology of Indian Himalayan Region:implication on food and economic security[J].Front Nutr,2023,10:1244413.
[15]ZHANG MM,WANG SW,XU R,et al.Managing genomic diversity in conservation programs of Chinese domestic chickens[J].Genet Sel Evol,2023,55(1):92.
[16]VEKIC′M,STROIL BK,TRIVUNOVIC′S,et al.Genetic diversity of Banat Naked Neck,indigenous chicken breed from Serbia,inferred from mitochondrial DNA D-loop sequence and microsatellite markers[J].Anim Biotechnol,2023,34(7):2197-2206.
[17]赵 禹,张文才,刘成武,等.动物机体对高原低氧环境适应性的研究进展[J].畜牧与兽医,2021,53(12):128-133.
ZHAO Y,ZHANG WC,LIU CW,et al.Progress in research on adaptation of animals to high altitude hypoxia environment[J].Animal Husbandryamp;Veterinary Medicine,2021,53(12):128-133.(in Chinese)
[18]LI XY,YANG JX,QIAO YJ,et al.Effects of radiation on drug metabolism:a review[J].Curr Drug Metab,2019,20(5):350-360.
[19]JAYAPRAKASH P,VIGNALI PD A,DELGOFFE GM,et al.Hypoxia reduction sensitizes refractory cancers to immunotherapy[J].Annu Rev Med,2022,73:251-265.HU JF,FANG HC,WANG J,et al.Ultraviolet B-induced MdWRKY72expression promotes anthocyanin syntnesis in apple[J].Plant Sci,2020,292:110377.
[20]VERGNEAU-GROSSET C,PÉRON F.Effect of ultraviolet radiation on vertebrate animals:update from ethological and medical perspectives[J].Photochem Photobiol Sci,2020,19(6):752-762.
[21]LUO NJ,WANG J,HU Y,et al.Cold and heat climatic variations reduce indigenous goat birth weight and enhance pre-weaning mortality in subtropical monsoon region of China[J].Trop Anim Health Prod,2020,52(3):1385-1394.
[22]何 荣,张崇志,张春华,等.动物冷应激研究进展[J].家畜生态学报,2022,43(9):7-12.
HE R,ZHANG CZ,ZHANG CH,et al.Research progress on animal cold stress[J].Acta Ecologae Animalis Domastici,2022,43(9):7-12.(in Chinese)
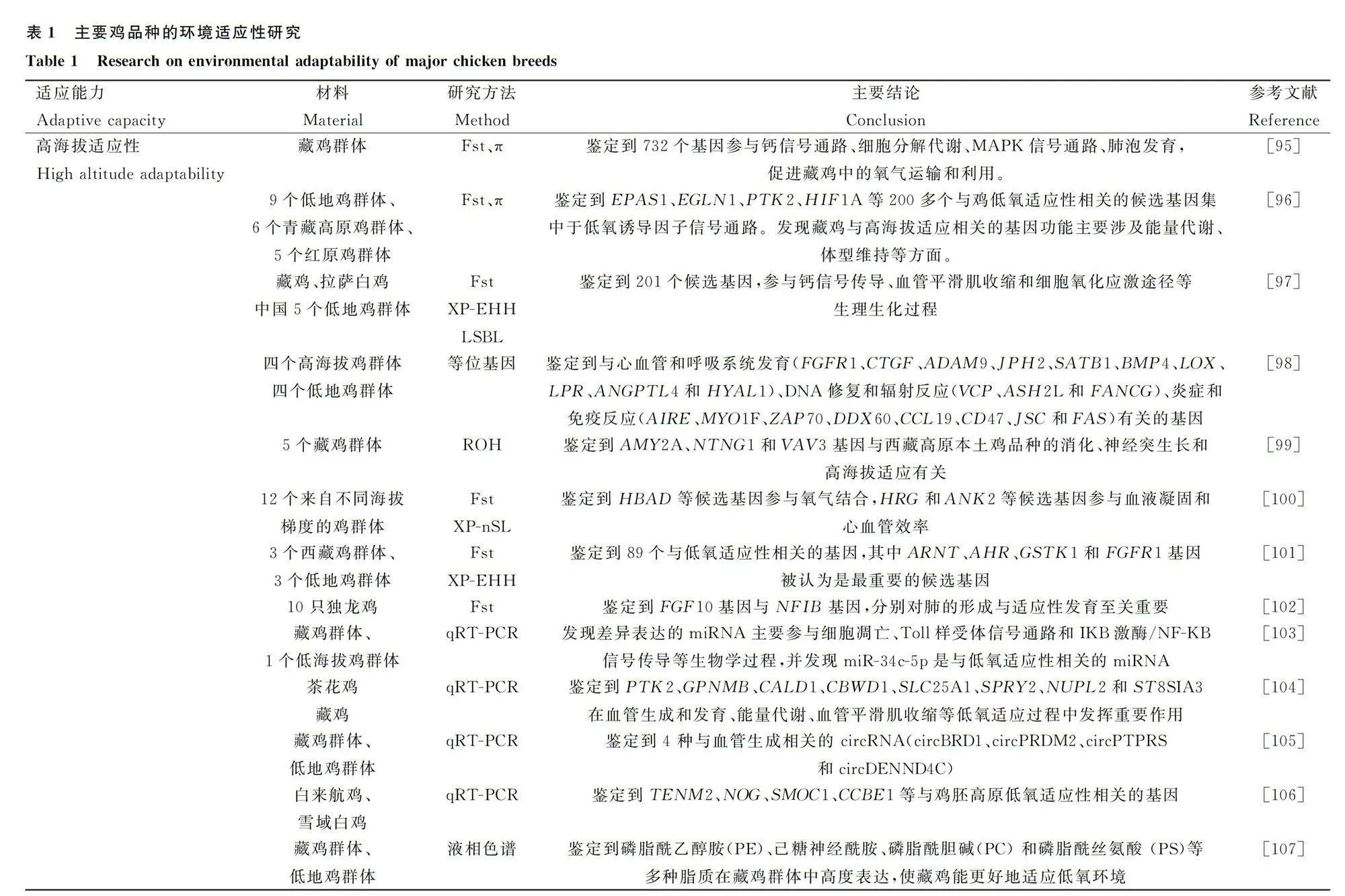
[23]FERNANDES E,RAYMUNDO A,MARTINS LL,et al.The naked neck gene in the domestic chicken:a genetic strategy to mitigate the impact of heat stress in poultry production-a review[J].Animals(Basel),2023,13(6):1007.
[24]常玮岑,李雨萌,钟秋萌,等.高空间分辨率环境数据库及其应用[J].环境工程,2022,40(6):1-11.
CHANG WC,LI YM,ZHONG QM,et al.High spatial resolution environmental dataset and its application[J].Environmental Engineering,2022,40(6):1-11.(in Chinese)
[25]邓舒迟,廖阳春.环境信息采集大数据统一控制平台设计研究[J].环境科学与管理,2019,44(2):20-23,38.
DENG SC,LIAO YC.Design of unified control platform for big data of environmental information collection[J].Environmental Science and Management,2019,44(2):20-23,38.(in Chinese)
[26]GAO CQ,WANG KJ,HU XY,et al.Conservation priority and run of homozygosity pattern assessment of global chicken genetic resources[J].Poult Sci,2023,102(11):103030.
[27]SUMIDA TS,HAFLER DA.Population genetics meets single-cell sequencing[J].Science,2022,376(6589):134-135.
[28]OKAZAKI A,YAMAZAKI S,INOUE I,et al.Population genetics:past,present,and future[J].Hum Genet,2021,140(2):231-240.
[29]PETEGROSSO R,SONG TC,KUANG R.Hierarchical canonical correlation analysis reveals phenotype,genotype,and geoclimate associations in plants[J].Plant Phenomics,2020,2020:1969142.
[30]GHEYAS AA,VALLEJO-TRUJILLO A,KEBEDE A,et al.Integrated environmental and genomic analysis reveals the drivers of local adaptation in African indigenous chickens[J].Mol Biol Evol,2021,38(10):4268-4285.
[31]DAUPHIN B,RELLSTAB C,WÜEST RO,et al.Re-thinking the environment in landscape genomics[J].Trends Ecol Evol,2023,38(3):261-274.
[32]POLEWKO-KLIM A,LESIN′SKI W,GOLIN′SKA AK,et al.Sensitivity analysis based on the random forest machine learning algorithm identifies candidate genes for regulation of innate and adaptive immune response of chicken[J].Poult Sci,2020,99(12):6341-6354.
[33]HOSSEINZADEH S,HASANPUR K.Gene expression networks and functionally enriched pathways involved in the response of domestic chicken to acute heat stress[J].Front Genet,2023,14:1102136.
[34]吕 利,王晓利,张文娟,等.基于三代长读长测序数据的基因组组装算法分析[J].宝鸡文理学院学报:自然科学版,2023,43(1):54-61.
LV L,WANG XL,ZHANG WJ,et al.Analysis of genome assembly algorithms for long-read sequencing data[J].Journal of Baoji university of Arts and Sciences:Natural Science,2023,43(1):54-61.(in Chinese)
[35]LI C,WU YJ,CHEN BC,et al.Markhor-derived introgression of agenomic region encompassing PAPSS2confers high-altitude adaptability in Tibetan goats[J].Mol Biol Evol,2022,39(12):msac253.
[36]GONG Y,LI YF,LIU XX,et al.A review of the pangenome:how it affects our understanding of genomic variation,selection and breeding in domestic animals?[J].J Anim Sci Biotechnol,2023,14(1):73.
[37]LIANG L,ZHANG JW,XIAO JC,et al.Genome and pan-genome assembly of asparagus bean(Vigna unguiculata ssp.sesquipedialis)reveal the genetic basis of cold adaptation[J].Front Plant Sci,2022,13:1059804.
[38]边培培,张 禹,姜 雨.泛基因组:高质量参考基因组的新标准[J].遗传,2021,43(11):1023-1037.
BIAN PP,ZHANG Y,JIANG Y.Pan-genome:setting anew standard for high-quality reference genomes[J].Hereditas,2021,43(11):1023-1037.(in Chinese)
[39]MELNIK BS,FINKELSTEIN AV.Physical basis of functioning of antifreeze protein[J].Mol Biol(Mosk),2022,56(2):297-305.
[40]BERG G,RYBAKOVA D,FISCHER D,et al.Microbiome definition re-visited:old concepts and new challenges[J].Microbiome,2020,8(1):103.
[41]WEI JK,LIU PH,LIU FY,et al.EDomics:a comprehensive and comparative multi-omics database for animal evo-devo[J].Nucleic Acids Res,2023,51(D1):D913-D923.
[42]陈雪娇,钟海安,张 博,等.藏鸡高原低氧适应性微进化机制研究进展[J].中国畜牧杂志,2023,59(2):1-5.
CHEN XJ,ZHONG HA,ZHANG B,et al.Research progress on microevolution mechanism of high-altitude hypoxic adaptation in Tibetan chicken[J].Chinese Journal of Animal Science,2023,59(2):1-5.(in Chinese)
[43]ZHAO FF,YANG LL,ZHANG T,et al.Gut microbiome signatures of extreme environment adaption in Tibetan pig[J].NPJ Biofilms Microbiomes,2023,9(1):27.
[44]LIU JB,YUAN C,GUO TT,et al.Genetic signatures of high-altitude adaptation and geographic distribution in Tibetan sheep[J].Sci Rep,2020,10(1):18332.
[45]AYALEW W,CHU M,LIANG CN,et al.Adaptation mechanisms of yak(Bos grunniens)to high-altitude environmental stress[J].Animals(Basel),2021,11(8):2344.
[46]张天留,高 雪,徐凌洋,等.高原家养动物环境适应性的研究进展[J].畜牧兽医学报,2020,51(7):1475-1487.
ZHANG TL,GAO X,XU LY,et al.Research progress on environment adaptation of plateau domestic animals[J].Acta Veterinaria et Zootechnica Sinica,2020,51(7):1475-1487.(in Chinese)
[47]LI SJ,ZHANG XJ,DONG XY,et al.Genetic structure and characteristics of Tibetan chickens[J].Poult Sci,2023,102(8):102767.
[48]GRAY OA,YOO J,SOBREIRA DR,et al.A pleiotropic hypoxia-sensitive EPAS1enhancer is disrupted by adaptive alleles in Tibetans[J].Sci Adv,2022,8(47):eade1942.
[49]LIU XX,ZHANG YL,LI YF,et al.EPAS1gain-of-function mutation contributes to high-altitude adaptation in Tibetan horses[J].Mol Biol Evol,2019,36(11):2591-2603.
[50]GUAN XW,HANIF Q,LI FY,et al.The three missense mutations of EPAS1,IL37and EEF1D genes associated with high-altitude adaptation in Chinese cattle[J].Anim Genet,2020,51(6):987-988.
[51]YANG YN,GAO CX,YANG TL,et al.Characteristics of Tibetan pig lung tissue in response to ahypoxic environment on the Qinghai-Tibet Plateau[J].Arch Anim Breed,2021,64(1):283-292.
[52]WITT KE,HUERTA-SÁNCHEZ E.Convergent evolution in human and domesticate adaptation to high-altitude environments[J].Philos Trans RSoc Lond BBiol Sci,2019,374(1777):20180235.
[53]KARAGHIANNIS V,MARIC D,GARREC C,et al.Comprehensive in silico and functional studies for classification of EPAS1/HIF2A genetic variants identified in patients with erythrocytosis[J].Haematologica,2023,108(6):1652-1666.
[54]TIRPE AA,GULEI D,CIORTEA SM,et al.Hypoxia:overview on hypoxia-mediated mechanisms with afocus on the role of HIF genes[J].Int JMol Sci,2019,20(24):6140.
[55]TANG JH,DENG HY,WANG ZX,et al.EGLN1prolyl hydroxylation of hypoxia-induced transcription factor HIF1α is repressed by SET7-catalyzed lysine methylation[J].J Biol Chem,2022,298(6):101961.
[56]CAO YQ,ZENG T,HAN W,et al.Comparative analysis of liver transcriptome reveals adaptive responses to hypoxia environmental condition in Tibetan chicken[J].Anim Biosci,2024,37(1):28-38.
[57]TANG RX,WANG J,ZHOU M,et al.Comprehensive analysis of lncRNA and mRNA expression changes in Tibetan chicken lung tissue between three developmental stages[J].Anim Genet,2020,51(5):731-740.
[58]ZHANG YW,GOU WY,MA J,et al.Genome methylation and regulatory functions for hypoxic adaptation in Tibetan chicken embryos[J].PeerJ,2017,5:e3891.
[59]ZHANG YW,GOU WY,ZHANG Y,et al.Insights into hypoxic adaptation in Tibetan chicken embryos from comparative proteomics[J].Comp Biochem Physiol Part DGenomics Proteomics,2019,31:100602.
[60]MENG YQ,CHEN D,QIU N,et al.Comparative N-glycoproteomic analysis of Tibetan and lowland chicken fertilized eggs:Implications on proteins biofunction and species evolution[J].J Food Biochem,2022,46(1):e14006.
[61]DU XX,LI FG,KONG FL,et al.Altitude-adaption of gut microbiota in Tibetan chicken[J].Poult Sci,2022,101(9):101998.
[62]BHAGAT NR,CHAUHAN P,VERMA P,et al.High-altitude and low-altitude adapted chicken gut-microbes have different functional diversity[J].Sci Rep,2023,13(1):20856.
[63]ELBELTAGY AR,BERTOLINI F,FLEMING DS,et al.Natural selection footprints among African chicken breeds and village ecotypes[J].Front Genet,2019,10:376.
[64]王晨寅,祁得胜,刘育昆,等.紫外辐射机制对生物生长发育的影响及紫外损伤修复作用的研究进展[J].农家参谋,2022(18):34-36.
WANG CY,QI DS,LIU YK,et al.Progress in the influence of UV radiation mechanism on biological growth and development and the repair effect of UV damage[J].The Farmers Consultant,2022(18):34-36.(in Chinese)
[65]XIONG Y,XING Q,MÜLLER-XING R.A novel UV-B priming system reveals an UVR8-depedent memory,which provides resistance against UV-B stress in Arabidopsis leaves[J].Plant Signal Behav,2021,16(4):1879533.
[66]PRITCHETT EM,VAN GOOR A,SCHNEIDER BK,et al.Chicken pituitary transcriptomic responses to acute heat stress[J].Mol Biol Rep,2023,50(6):5233-5246.
[67]LIM C,LIM B,KIL DY,et al.Hepatic transcriptome profiling according to growth rate reveals acclimation in metabolic regulatory mechanisms to cyclic heat stress in broiler chickens[J].Poult Sci,2022,101(12):102167.
[68]LIU YY,XING L,ZHANG Y,et al.Mild intermittent cold stimulation affects cardiac substance metabolism via the neuroendocrine pathway in broilers[J].Animals(Basel),2023,13(22):3577.
[69]FEDOROVA ES,DEMENTIEVA NV,SHCHERBAKOV YS,et al.Identification of key candidate genes in runs of homozygosity of the genome of two chicken breeds,associated with cold adaptation[J].Biology(Basel),2022,11(4):547.
[70]ZHAO XR,ZHANG JX,WANG HE,et al.Genomic and transcriptomic analyses reveal genetic adaptation to cold conditions in the chickens[J].Genomics,2022,114(6):110485.
[71]SOTOME R,HIRASAWA A,KIKUSATO M,et al.In vivo emergence of beige-like fat in chickens as physiological adaptation to cold environments[J].Amino Acids,2021,53(3):381-393.
[72]ZENG T,YIN JM,FENG PS,et al.Analysis of genome and methylation changes in Chinese indigenous chickens over time provides insight into species conservation[J].Commun Biol,2022,5(1):952.
[73]FALLAHSHAHROUDI A,JOHNSSON M,SORATO E,et al.Effects of the domestic thyroid stimulating hormone receptor(TSHR)variant on the hypothalamic-pituitary-thyroid axis and behavior in chicken[J].Genetics,2021,217(1):iyaa050.
[74]NAFSTAD ÅM,RØNNING B,AASE K,et al.Spatial variation in the evolutionary potential and constraints of basal metabolic rate and body mass in awild bird[J].J Evol Biol,2023,36(4):650-662.
[75]王风琴,韩亚鹏,许姝娟,等.笼养普通朱雀适应北方冬季气候的体温调节特征[J].动物学杂志,2021,56(4):591-596.
WANG FQ,HAN YP,XU SJ,et al.Thermoregulatory characteristics in winter-acclimatized common rosefinch Carpodacus erythrinus[J].Chinese Journal of Zoology,2021,56(4):591-596.(in Chinese)
[76]NAWAZ AH,LIN SD,WANG FJ,et al.Investigating the heat tolerance and production performance in local chicken breed having normal and dwarf size[J].Animal,2023,17(3):100707.
[77]ABIOJA MO,OMOTARA OP,IYASERE OS,et al.Comparative study of adaptation in three chicken genotypes under humid tropical conditions of Nigeria[J].J Anim Physiol Anim Nutr(Berl),2020,104(5):1401-1409.
[78]FATHI MM,GALAL A,RADWAN LM,et al.Using major genes to mitigate the deleterious effects of heat stress in poultry:an updated review[J].Poult Sci,2022,101(11):102157.
[79]WALUGEMBE M,BERTOLINI F,DEMATAWEWA CM B,et al.Detection of selection signatures among Brazilian,Sri Lankan,and egyptian chicken populations under different environmental conditions[J].Front Genet,2019,9:737.
[80]TIAN SL,ZHOU XM,PHUNTSOK T,et al.Genomic analyses reveal genetic adaptations to tropical climates in chickens[J].iScience,2020,23(11):101644.
[81]SRIKANTH K,KUMAR H,PARK W,et al.Corrigendum:cardiac and skeletal muscle transcriptome response to heat stress in Kenyan chicken ecotypes adapted to low and high altitudes reveal differences in thermal tolerance and stress response[J].Front Genet,2020,11:197.
[82]BORHAN AZ M,MUSA SK,KHEER AM M.Effects of pre-hatch thermal manipulation and post-hatch acute heat stress on the mRNA expression of interleukin-6and genes involved in its induction pathways in2broiler chicken breeds[J].Poult Sci,2019,98(4):1805-1819.
[83]RAMIAH SK,BALAKRISHNAN KN,SUBRAMANIAM Y,et al.Effects of thermal manipulation on mRNA regulation of response genes regarding improvement of thermotolerance adaptation in chickens during embryogenesis[J].Animals(Basel),2022,12(23):3354.
[84]TE PAS MF W,PARK W,SRIKANTH K,et al.Transcriptomic profiles of muscle,heart,and spleen in reaction to circadian heat stress in Ethiopian highland and lowland male chicken[J].Cell Stress Chaperones,2019,24(1):175-194.
[85]段滇宁,陈 超,杨润泽,等.急性热应激对鸡呼吸系统损伤及肺脏热休克蛋白表达的影响[J].畜牧与兽医,2021,53(3):65-70.
DUAN DN,CHEN C,YANG RZ,et al.Effects of heat stress on lung tissue damage and heat shock protein expression in chicken[J].Animal Husbandryamp;Veterinary Medicine,2021,53(3):65-70.(in Chinese)
[86]SHEHATA AM,SAADELDIN IM,TUKUR HA,et al.Modulation of heat-shock proteins mediates chicken cell survival against thermal stress[J].Animals(Basel),2020,10(12):2407.
[87]ABARE MY,RAHAYU S,TUGIYANTI E.Review:The role of heat shock proteins in chicken:Insights into stress adaptation and health[J].Res Vet Sci,2023,165:105057.
[88]RIMOLDI S,LASAGNA E,SARTI FM,et al.Expression profile of six stress-related genes and productive performances of fast and slow growing broiler strains reared under heat stress conditions[J].Meta Gene,2015,6:17-25.
[89]MACKEI M,MOLNÁR A,NAGY S,et al.Effects of acute heat stress on anewly established chicken hepatocyte-nonparenchymal cell co-culture model[J].Animals(Basel),2020,10(3):409.
[90]YIN B,DI LJ,TANG S,et al.Vitamin C-Na enhances the antioxidant ability of chicken myocardium cells and induces heat shock proteins to relieve heat stress injury[J].Res Vet Sci,2020,133:124-130.
[91]GU JJ,LIANG QQ,LIU C,et al.Genomic analyses reveal adaptation to hot arid and harsh environments in native chickens of China[J].Front Genet,2020,11:582355.
[92]ROCHA JL,GODINHO R,BRITO JC,et al.Life in deserts:the genetic basis of mammalian desert adaptation[J].Trends Ecol Evol,2021,36(7):637-650.
[93]张政凯,李业芳,叶绍辉,等.山羊环境适应性的研究进展[J].畜牧兽医学报,2022,53(7):2035-2046.
ZHANG ZK,LI YF,YE SH,et al.Research progress of environmental adaptability in goats[J].Acta Veterinaria et Zootechnica Sinica,2022,53(7):2035-2046.(in Chinese)
[94]KRISTENSEN TN,KETOLA T,KRONHOLM I.Adaptation to environmental stress at different timescales[J].Ann NY Acad Sci,2020,1476(1):5-22.
[95]FENG J,ZHU W,SHI HR,et al.Analysis of the selection signal of the tibetan black chicken genome based on whole-genome sequencing[J].Genes(Basel),2023,14(9):1672.
[96]LI DY,LI Y,LI M,et al.Population genomics identifies patterns of genetic diversity and selection in chicken[J].BMC Genomics,2019,20(1):263.
[97]NAN JH,YANG SD,ZHANG XJ,et al.Identification of candidate genes related to highland adaptation from multiple Chinese local chicken breeds by whole genome sequencing analysis[J].Anim Genet,2023,54(1):55-67.
[98]ZHANG Q,GOU WY,WANG XT,et al.Genome resequencing identifies unique adaptations of Tibetan chickens to hypoxia and high-dose ultraviolet radiation in high-altitude environments[J].Genome Biol Evol,2016,8(3):765-776.
[99]YUAN JW,LI SJ,SHENG ZY,et al.Genome-wide run of homozygosity analysis reveals candidate genomic regions associated with environmental adaptations of Tibetan native chickens[J].BMC Genomics,2022,23(1):91.
[100]ZHONG HA,KONG XY,ZHANG YW,et al.Microevolutionary mechanism of high-altitude adaptation in Tibetan chicken populations from an elevation gradient[J].Evol Appl,2022,15(12):2100-2112.
[101]LIU XY,WANG XC,LIU J,et al.Identifying candidate genes for hypoxia adaptation of Tibet chicken embryos by selection signature analyses and RNA sequencing[J].Genes(Basel),2020,11(7):823.
[102]WANG Q,LI D,GUO A,et al.Whole-genome resequencing of Dulong Chicken reveal signatures of selection[J].Br Poult Sci,2020,61(6):624-631.
[103]ZHANG Z,QIU M,DU H,et al.Small RNA sequencing reveals miRNAs important for hypoxic adaptation in the Tibetan chicken[J].Br Poult Sci,2020,61(6):632-639.
[104]ZHANG Y,ZHANG HL,ZHANG B,et al.Identification of key HIF-1α target genes that regulate adaptation to hypoxic conditions in Tibetan chicken embryos[J].Gene,2020,729:144321.
[105]CHEN XJ,ZHANG Y,ZHANG WH,et al.Regulatory effects of circular RNA on hypoxia adaptation in chicken embryos[J].J Anim Sci,2023,101:skad344.
[106]陈雪娇,刘会杰,臧 蕾,等.鸡胚心脏组织转录组数据鉴定雪域白鸡高原低氧适应性关键基因[J].畜牧兽医学报,2023,54(10):4154-4163.
CHEN XJ,LIU HJ,ZANG L,et al.Transcriptome data from chicken embryo heart tissue identified key genes for altitude hypoxia adaptation in Xueyu white chickens[J].Acta Veterinaria et Zootechnica Sinica,2023,54(10):4154-4163.(in Chinese)
[107]YU RJ,XIE FY,TANG QG.Insight into adaption to hypoxia in Tibetan chicken embryonic brains using lipidomics[J].Biochem Biophys Res Commun,2023,671:183-191.
[108]ROMANOV MN,ABDELMANOVA AS,FISININ VI,et al.Selective footprints and genes relevant to cold adaptation and other phenotypic traits are unscrambled in the genomes of divergently selected chicken breeds[J].J Anim Sci Biotechnol,2023,14(1):35.
[109]徐乃一.家鸡冷热适应性研究及其多组学数据库构建[D].杨凌:西北农林科技大学,2022.
XU NY.Study on cold and hot adaptation and construction of multi-omics database for domestic chicken[D].Yangling:Northwest Aamp;F University,2022.(in Chinese)
[110]SHI SR,SHAO D,YANG LY,et al.Whole genome analyses reveal novel genes associated with chicken adaptation to tropical and frigid environments[J].J Adv Res,2023,47:13-25.
[111]NANAEI HA,KHARRATI-KOOPAEE H,ESMAILIZADEH A.Genetic diversity and signatures of selection for heat tolerance and immune response in Iranian native chickens[J].BMC Genomics,2022,23(1):224.
[112]WEI HD,LI TT,ZHANG Y,et al.Cold stimulation causes oxidative stress,inflammatory response and apoptosis in broiler heart via regulating Nrf2/HO-1and NF-κB pathway[J].J Therm Biol,2023,116:103658.
[113]GONG RX,XING L,YIN JW,et al.Appropriate cold stimulation changes energy distribution to improve stress resistance in broilers[J].J Anim Sci,2023,101:skad185.
[114]LI S,LI XQ,WANG K,et al.Gut microbiota intervention attenuates thermogenesis in broilers exposed to high temperature through modulation of the hypothalamic5-HT pathway[J].J Anim Sci Biotechnol,2023,14(1):159.
[115]MALILA Y,UENGWETWANIT T,SANPINIT P,et al.Thermal impacts on transcriptome of Pectoralis major muscle collected from commercial broilers,Thai native chickens and its crossbreeds[J].Anim Biosci,2024,37(1):61-73.
[116]XU NY,LIU ZY,YANG QM,et al.Genomic analyses for selective signatures and genes involved in hot adaptation among indigenous chickens from different tropical climate regions[J].Front Genet,2022,13:906447.
[117]GUO X,XING CH,WEI W,et al.Genome-wide scan for selection signatures and genes related to heat tolerance in domestic chickens in the tropical and temperate regions in Asia[J].Poult Sci,2022,101(7):101821.
(编辑 郭云雁)

