抢分溶解度曲线

溶解度曲线是中考的重点内容,常以选择题、填空题等形式出现。根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定该物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的情况,从而判断提纯晶体的方法。
小题在线
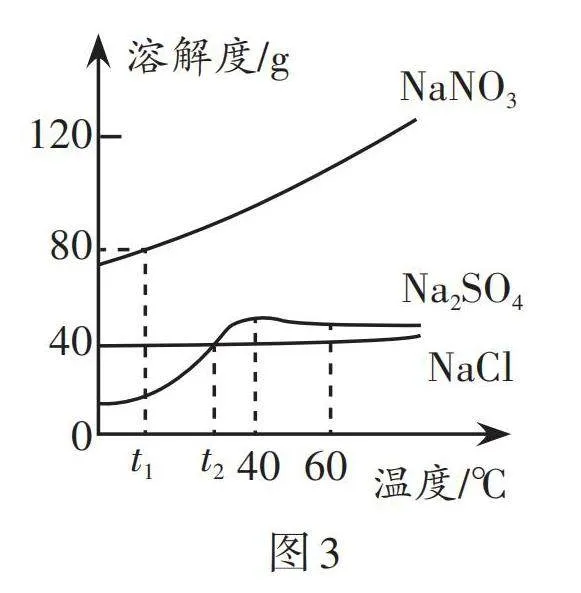
1.晾晒海水制盐在我国有着悠久的历史,利用该工艺可得到氯化钠和氯化镁等物质。氯化钠和氯化镁的溶解度曲线如图1,下列说法正确的是( )。
A. 海水晒盐利用了蒸发结晶的方法获得晶体
B. 氯化钠的溶解度受温度影响较大
C. t ℃时,氯化镁饱和溶液中溶质质量分数为70%
D. 采用降温结晶的方法可除去氯化钠饱和溶液中少量的氯化镁杂质
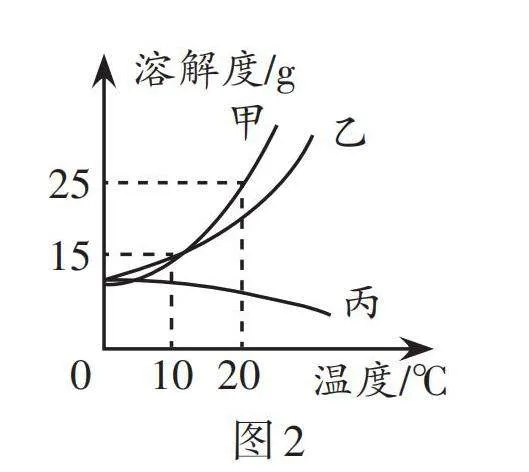
2.如图2是甲、乙、丙三种固体物质在水中的溶解度曲线。下列说法正确的是( )。
A. 20 ℃时,甲、乙两种物质的溶解度相同
B. 可用降温结晶的方法将丙从它的饱和溶液中结晶出来
C. 20 ℃时,将12.5 g乙物质溶于50 g水中,充分溶解后溶质的质量分数小于20%
D. 10 ℃时,将乙、丙两种饱和溶液升温到20 ℃,此时两种溶液都变成了不饱和溶液
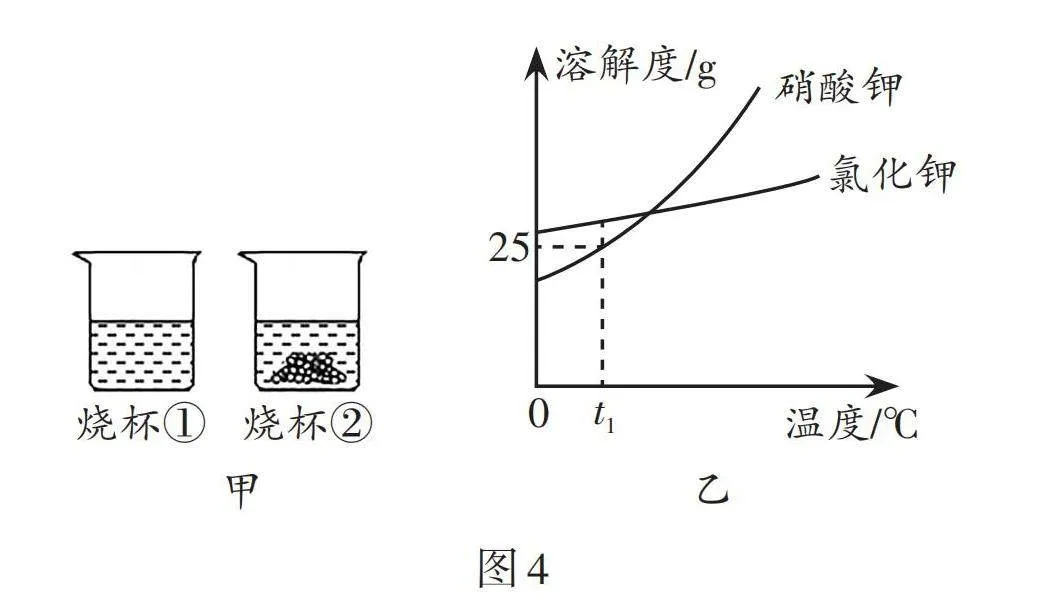
3.煤化工废水中含有NaCl、Na2SO4、NaNO3,这三种盐的溶解度曲线如图3所示。下列有关说法正确的是( )。
A. 与NaNO3相比,NaCl更适合通过饱和溶液降温结晶得到
B. t1℃时,NaNO3的饱和溶液中溶质的质量分数为80%
C. t2℃时,NaCl和Na2SO4的饱和溶液中溶质质量分数相等
D. 40 ℃时,Na2SO4的饱和溶液中升温到60 ℃变为不饱和溶液
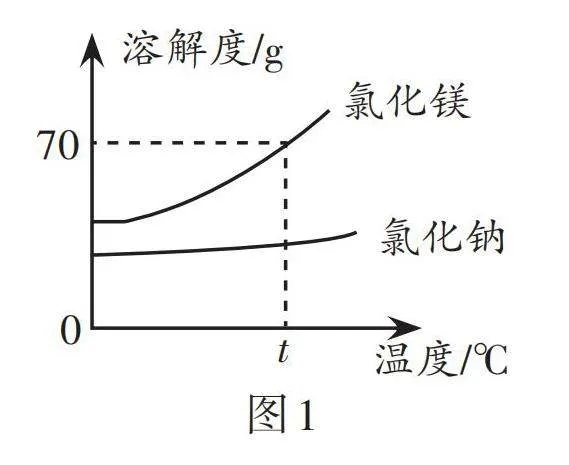
4. t1 ℃时,将等质量的硝酸钾和氯化钾分别加入盛有100 g水的两个烧杯中,充分搅拌后现象如图4甲所示,硝酸钾和氯化钾的溶解度曲线如图4乙所示,下列说法错误的是( )。
A. 烧杯①中溶解的溶质是氯化钾
B. 烧杯②中的上层清液属于饱和溶液
C. 将t1℃时50 g硝酸钾的饱和溶液稀释成5%的溶液,需加水150 g
D. t1℃时,将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
答案:1. A 2. C 3. C 4. D
抢分宝典
1. 溶解度曲线的意义
[点[]][曲线上的点:物质在该点所示温度下的溶解度
曲线的交点:两物质在该点所示温度下的溶解度相等]
线[物质在不同温度下的溶解度固体物质的溶解度随温度变化的趋势]
[面[]][曲线下方的各点: 表示此温度下溶液为不饱和溶液
曲线上方的各点: 表示此温度下溶液为饱和溶液且有未溶晶体]
2. 溶解度曲线的应用
某温度时,过该温度作纵坐标的平行线与溶解度曲线相交,根据交点位置的高低,就可判断出物质溶解度的大小。位置越高,相应物质的溶解度越大;位置越低,相应物质的溶解度越小。利用这一点,溶解度曲线有如下5点用途。
(1)判断某种物质在不同温度下的溶解度大小。
(2)比较不同物质在同一温度时溶解度的大小。
(3)判断固体物质的溶解度受温度影响变化的趋势。大多数固体物质的溶解度随温度的升高而增大,如KNO3;少数固体物质的溶解度受温度变化的影响很小 ,如NaCl;极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(4)判断如何将不饱和溶液变成饱和溶液。
(5)确定结晶的方法。
(作者单位:辽宁省实验中学分校)

