噬菌体TM4中LysinB蛋白的特征及抗菌特性研究
[摘要]目的对分枝杆菌噬菌体TM4LysinB蛋白序列进行生物学分析,原核表达LysinB蛋白并评估其体外杀菌特性。方法合成噬菌体TM4LysinB基因,构建原核表达重组质粒,诱导蛋白可溶表达、纯化,通过在线软件程序分析噬菌体TM4LysinB蛋白的生物学特征;在7H9培养基中培养耻垢分枝杆菌,检测其杀菌效果及稳定性。结果LysinB蛋白理论等电点为6.66,不稳定指数为28.71,为稳定蛋白质,且为两亲性蛋白。二级结构中,无规则卷曲、a-螺旋、β-折叠和转角分别占42.00%、40.25%、12.00%和5.75%;三级结构中,无规则卷曲含量高,由11~73位AA组成的肽段构成肽聚糖结合结构域。预测出B细胞抗原表位区段和T细胞抗原表位的强结合肽段。LysinB蛋白具有显著的体外杀耻垢分枝杆菌的能力,pH8.0的PBST蛋白缓冲液有利于在实验周期内维持LysinB蛋白的杀菌效果。结论进一步了解分枝杆菌噬菌体TM4裂解酶LysinB蛋白,为研制可稳定贮存的噬菌体酶制剂及其临床应用提供参考。
[关键词]噬菌体TM4;LysinB蛋白;耻垢分枝杆菌;生物信息学
[中图分类号]R378.91[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.21.002
CharacterizationandantibacterialpropertiesofLysinBproteininbacteriophageTM4
PANZhifen1,ZHOUZiwei2,XUHaiping1,WANGWei1
1.DepartmentofTuberculosis,theFirstHospitalofJiaxing,AffiliatedHospitalofJiaxingUniversity,Jiaxing314001,Zhejiang,China;2.SchoolofLifeSciences,FudanUniversity,Shanghai200438,China
[Abstract]ObjectiveToanalyzethesequenceofLysinBproteininbacteriophageTM4,expressLysinBproteininE.coliandevaluateitsbactericidalactivityinvitro.MethodsBacteriophageTM4LysinBgenewassynthesizedandtherecombinantprokaryoticexpressionplasmidwasconstructed.Thesolubleproteinwasinducedandpurified.ThebiologicalcharacteristicsofbacteriophageTM4LysinBproteinwereanalyzedbyonlinesoftwareprogram.Mycobacteriumsmegmatiswasculturedin7H9medium,anditsbactericidaleffectandstabilityweredetected.ResultsThetheoreticalisoelectricpointwas6.66,theinstabilityindexwas28.71,whichwasastableandamphiphilicprotein.Inthesecondarystructure,Therandomcoil,a-helix,β-foldandturnAngleaccountedfor42.00%,40.25%,12.00%and5.75%;Inthetertiarystructure,thecontentofrandomcoilwashigh.ThepeptidecomposedofAAatpositions11to73constitutedthepeptidoglycanbindingdomain.TheregionsofBcellepitopesandthestrongbindingpeptidesofTcellepitopeswerepredicted.LysinBproteinhasasignificantabilitytokillMycobacteriumsmegmatisinvitro.PBSTproteinbufferwithpH8.0wasbeneficialtomaintainthebactericidaleffectofLysinBproteinsduringtheexperimentalcycle.ConclusionThisstudyexpandsthecomprehensiveunderstandingoftheLysinBproteinofmycobacterialphageTM4lyase,andalsoprovidesreferenceforthedevelopmentofstablestorageofphageenzymepreparationanditsclinicalapplication.
[Keywords]BacteriophageTM4;LysinBprotein;Mycobacteriumsmegmatis;Bioinformatics
由结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)引起的肺结核是呼吸系统传染病。2022年WHO结核病报告显示:2021年耐多药(multidrug-resistance,MDR)/利福平耐药(rifampicinresistance,RR)的病例增加到45万例,耐药菌株的传播仍然是“终止结核病战略”的重大挑战[1]。
随着噬菌体研究的进展,噬菌体治疗耐多药细菌及慢性和持续性感染备受关注,分枝杆菌噬菌体也被成功地用于治疗耐药脓肿分枝杆菌感染[2-5]。迄今为止,已有近2000个分枝杆菌噬菌体基因组完成测序[6];功能基因编码的噬菌体裂解酶(bacteriophagelysin)是噬菌体感染细菌末期合成的作用于胞壁质的水解酶,其中LysinB是阿拉伯半乳聚糖酯酶,可特异性裂解肽聚糖-阿拉伯半乳聚糖复合物与霉菌酸的连接,从而破坏分枝杆菌细胞壁,发挥裂解分枝杆菌的作用;还可水解海藻糖二甲酸酯(trehalosedimethylate,TDM)降低结核分枝杆菌在巨噬细胞内的致病力。研究表明分枝杆菌噬菌体间同源性裂解酶基因低于50%[7]。Abouhmad等[8]比较4种分枝杆菌噬菌体(D29、Omega、Saal、Obama12)中LysinB蛋白的催化特性,发现同源性30%~76%的这些蛋白的催化能力存在差异。烈性噬菌体TM4可裂解结核菌细胞壁及生物膜,同时也对缺氧型结核休眠菌具有复苏作用,但其编码的LysinB蛋白的杀菌能力未见系统报道[9-10]。因此,本研究对噬菌体TM4的LysinB蛋白进行生物信息学分析,同时原核表达并纯化蛋白,分析其杀菌功能。本研究经嘉兴市第一医院医学伦理委员会审批通过(伦理审批号:LS2020-337)。
1材料与方法
1.1材料
1.1.1菌株、质粒耻垢分枝杆菌(Mycobacteriumsmegmatis,M.smeg)、大肠杆菌6xhis标签融合蛋白表达系统质粒pET28a由复旦大学张鹭课题组赠送;E.coliBL21(DE3)、E.coliDH5a购自北京全式金生物公司。
1.1.2试剂限制内切酶、T4DNA购自NEB公司,DNAmarker、异丙基-B-D-硫代半乳糖苷(isopropyl-B-D-thiogalactoside,IPTG)购自TaKaRa公司;蛋白预染Marker购自ThermoFisher公司;胶回收试剂盒、质粒提取盒购自TIANGEN公司;Middlebrook7H9、7H10购自美国Gibco公司;Ni-NTAHis·Bind®Resin镍柱填料介质、细胞裂解液Bugbuster®蛋白提取剂购自Novagen公司;其余试剂购自国药集团化学试剂有限公司。
1.2方法
1.2.1噬菌体TM4LysinB蛋白的生物信息学分析利用Prot-Param软件分析噬菌体TM4LysinB蛋白的氨基酸序列、理化性质,利用Protscale了解蛋白的亲水性或疏水性;利用SOPMA预测二级结构和卷曲螺旋;利用TMHMM和SignalIP5.0预测跨膜区和信号肽;利用SWISS-MODEL模拟三级结构;采用BepipredLinearEpitopePrediction2.0和ABCpred预测B细胞抗原表位,用NetMHCⅡpan3.2Server和NetMHCpan-4.0Server测T细胞表位。
1.2.2噬菌体TM4LysinB重组表达载体的构建从美国国家生物技术信息中心(NationalCenterofBiotechnologyInformation,NCBI)获取分枝杆菌噬菌体TM4LysinBDNA序列,根据pET-28a质粒多克隆位点,选择NdeⅠ和NotⅠ酶切位点。经擎科生物公司进行原核表达密码子优化后添加双酶切位点,人工合成DNA片段。LysinB基因片段与pET-28a质粒载体连接,连接产物转嫁E.coliDH5a感受态细胞,在卡那霉素50μg/ml抗性平板上挑取阳性单克隆,提取重组质粒并用NdeⅠ/NotⅠ双酶切检验,进一步通过测序确定载体构建成功。重组质粒转化到E.coliBL21(DE3)感受态细胞中,进行蛋白诱导表达。
1.2.3重组LysinB蛋白的表达及纯化从含卡那霉素的培养基(luria-bertani,LB)平板上挑取BL21(DE3)/pET28a-LysinB阳性克隆接种入LB,37℃220转/min震荡培养至光密度(opticaldensity,OD)600(OD600)值为0.6时加入0.05mmol/LIPTG,25℃诱导16h。4℃5000转/min分别离心10min收集诱导和未诱导的细菌沉淀,Bugbuster®裂解后离心,分别取上清液与等量磷酸盐缓冲液(phosphatebuffersolution,PBS)重悬的沉淀加入蛋白预制胶(loadingbuffer),100℃水浴10min进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodiumdodecylsulfatepolyacrylamidegelelectrophoresis,SDS-PAGE),分析重组LysinB蛋白表达及可溶性。
2LLB培养液大量培养BL21(DE3)/pET28a-LysinB菌株。37℃200转/min至OD600值为0.6时冰浴降温,加入0.05mmol/LIPTG,25℃过夜诱导。离心收集菌体(5000转/min,4℃离心10min),并重悬于40mlPBS缓冲液。40W、开4s、关5s超声破碎40min,12000转/min、4℃离心15min取上清液,在镍柱纯化目标蛋白。用含不同浓度咪唑的缓冲液洗脱,选取100mmol/L、300mmol/L洗脱液在含10%甘油的PBS中进行透析。15%SDS-PAGE电泳检测重组蛋白的纯度,采用布拉得福(Bradford)法测定蛋白浓度。
1.2.4TM4LysinB蛋白的杀分枝杆菌效果在7H9培养基中培养M.smeg至OD600值为0.6,用无菌7H9稀释100倍,25℃、10000转/min离心10min后,用等体积磷酸盐吐温缓冲液PBST(PBS+0.1%Tween80,pH7.4)洗涤1次,离心后2倍初始体积PBST重悬,50μl/管分装。25℃、10000转/min再次离心10min后,对照组用100μlPBS重悬菌体,实验组用等体积LysinB溶液重悬菌体、37℃孵育1h后用PBST终止反应;系列稀释后取5μl在7H10平板点样,37℃培养48h后观察结果。实验组中,LysinB蛋白用不同pH值的PBST缓冲液溶解,这些蛋白溶液与耻垢分枝杆菌在37℃共孵育1h,之后用pH7.4的PBST缓冲液置换LysinB溶液以终止反应。后续耻垢分枝杆菌在7H10平板上培养48h后观察结果。用不含LysinB蛋白的pH8.0的PBST溶液与耻垢分枝杆菌作用1h后涂板,作为阴性对照。
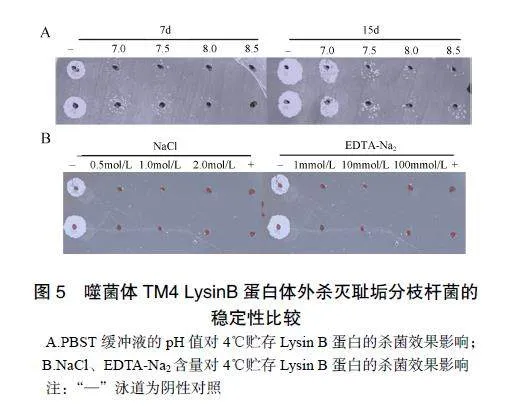
1.2.5TM4LysinB蛋白的稳定性实验配制pH分别为7.0、7.5、8.0、8.5的PBST缓冲液,溶解和稀释LysinB蛋白后,4℃贮存7d、15d,按1.2.4的实验方法开展体外杀菌试验,根据7H10平板上耻垢分枝杆菌生长情况,评估LysinB在4℃贮存条件下维持稳定杀菌活性的最适pH。
在最适pH值条件下,分别向PBST缓冲液中添加终浓度为0.5mol/L、1.0mol/L、2.0mol/L的NaCl,或终浓度为1mmol/L、10mmol/L、100mmol/L的EDTA-Na2,比较缓冲液中盐和金属螯合剂对LysinB蛋白杀菌稳定性的影响。以最适pH值的PBST缓冲液作为阴性对照,以含等量LysinB蛋白的最适pH的PBST缓冲液作为阳性对照。
2结果
2.1噬菌体TM4LysinB蛋白理化性质
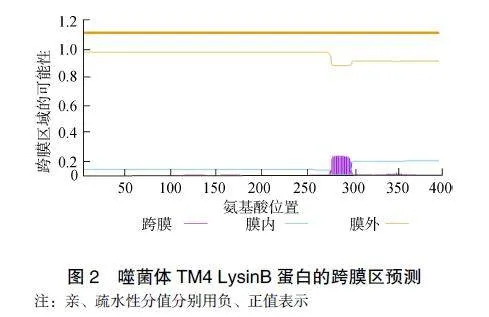
经ProtParam分析,噬菌体TM4LysinB蛋白的400个氨基酸中,碱性氨基酸(K,R)31个,酸性氨基酸(D,E)32个。疏水氨基酸(A,V,L,I,P,F,W,M,G)共250个,占62.5%;亲水氨基酸(Y,S,T,C,N,Q,K,R,H,D,E)共150个,占37.5%。分子式C1915H2978N520O543S12,理论等电点为6.66。不稳定指数为28.71,蛋白质归类为稳定蛋白质。脂溶性指数92.22,亲水性总平均值0.067,280nm波长处吸光度值为1.438。Protscale分析显示蛋白具有两亲性,见图1。
2.2噬菌体TM4LysinB蛋白的二级、三级结构
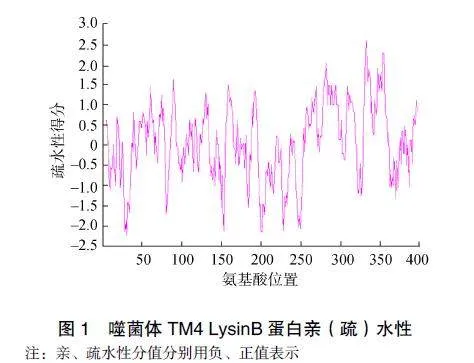
SOPMA分析噬菌体TM4LysinB蛋白二级结构中,无规则卷曲、a-螺旋、β-折叠和转角分别占42.00%、40.25%、12.00%和5.75%。卷曲螺旋分析表明该蛋白无卷曲螺旋。TMHMM跨膜区分析显示LysinB蛋白存在较少跨膜区,见图2,SignalP预测值<阈值0.5,即LysinB蛋白无信号肽序列。
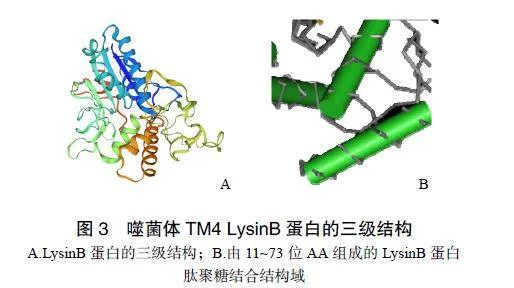
利用SWISS-MODEL模拟噬菌体TM4LysinB蛋白的三级结构中,结果显示无规则卷曲含量高,结构较紧密,见图3A;由11~73位氨基酸(aminoacid,AA)组成的肽段包含3个α-螺旋,构成肽聚糖结合结构域,见图3B。
2.3噬菌体TM4LysinB蛋白的B细胞、T细胞抗原表位
采用BepipredLinearEpitopePrediction2.0和ABCpred预测噬菌体TM4LysinB蛋白,共有13个B细胞抗原表位(临界值0.65),分别为5~17、27~43、58~63、68~82、122~132、148~154、200~233、244~252、298~310、313~327、362~366、372~379、387~396。同时结合LysinB蛋白的二级结构中无规则卷曲存在的区段,探测B细胞抗原表位可能位于5~17、27~43、58~63、122~132、200~233、244~252、362~366等氨基酸区段。
采用NetMHCⅡpan3.2Server软件测LysinB蛋白的CD4+T细胞表位。将肽段的长度设置为15个AA,选取人类白细胞Ⅱ类抗原(humanleukocyteantigen,HLA-Ⅱ)基因分布较广的亚型(HLA-DRB1-0101、0301、0401、0701、0801、0901、1101、1302、1501)评估亲和值。预测结果显示HLA-DR蛋白的总肽段数149,见表1。除DRB1-0301外,LysinB共有26个强结合肽段,HLA-DRB1-0101的强弱结合肽段总数最多。在强结合肽段中,YATQVRLGA(68~76)是DRB1-0801和DRB1-1101的结合表位;LQRFKSKLI(182~190)是DRB1-0701和DRB1-1501的结合表位;FIATNPPTA(356~364)是DRB1-0401、DRB1-0701和DRB1-0901的结合表位。
利用在线软件NetMHCpan4.00Server预测LysinB的CD8+T细胞表位。将肽段的长度设置为9个AA,选择人类可能性最大的Ⅱ类白细胞抗原:A2(HLA-A0201)和A3(HLA-A0301)进行预测。结果得到6条HLA-A0201结合能力较强的肽段,分别为GMQGEQVKV(8~16)、KLIAKYQWV(20~28)、GIADYATQV(62~70)、VLIGYSQGA(158~166)、GLVEAVLAL(334~342)、FIATNPPTA(356~364);2条HLA-A0301的强结合肽段:VIQQKLIAK(16~24)、RILSGDLQR(175~183)。
2.4噬菌体TM4LysinB蛋白的原核表达
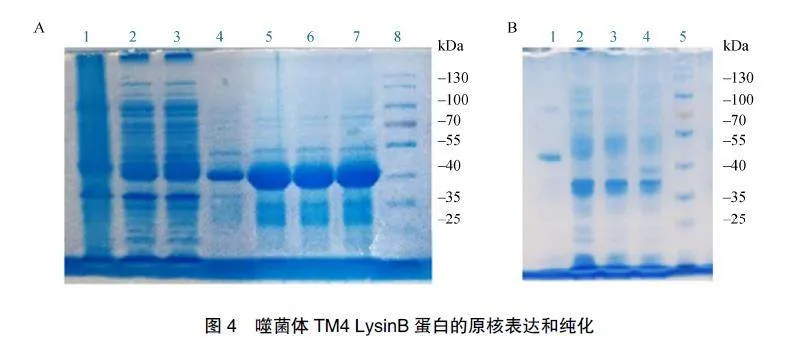
人工合成LysinB基因片段,与pET-28a质粒载体连接后,转化到E.coliBL21(DE3)感受态细胞中,进行蛋白诱导表达。在37℃用1mmol/LIPTG小剂量诱导表达,同时设置不加诱导剂的对照组,见图4A,显示44kDa的重组LysinB蛋白能够表达,但主要为包涵体形式。优化IPTG浓度和细菌培养条件,发现在25℃、IPTG浓度为0.05mmol/L时,蛋白表达相对较多,且更多以可溶状态存在。
扩大至2LLB培养体系,收集菌体纯化蛋白。Ni-NTA亲和层析柱中孵育菌体蛋白,依次用含20mmol/L、50mmol/L、100mmol/L、300mmol/L咪唑的洗脱液洗脱,收集100mmol/L、300mmol/L洗脱液进行透析,获得蛋白约10mg,SDS-PAGE电泳显示目标蛋白纯度符合实验要求,见图4B。
2.5TM4LysinB蛋白的体外杀菌能力及稳定性
纯化获得的LysinB重组蛋白溶解在pH7.5的PBST缓冲液中,比较不同蛋白工作浓度,发现0.1mg/ml的LysinB蛋白具有最强杀灭耻垢分枝杆菌的活力,后续实验采用这一工作浓度。
为进一步优化蛋白的杀菌和贮存条件,本研究比较蛋白储存液的不同pH值、4℃下贮存时间、储存液中NaCl、金属螯合剂的添加等因素。
A.LysinB蛋白的小量诱导表达。泳道1:重组菌株未诱导培养后裂解液可溶部分;泳道2、3:重组菌株IPTG诱导培养后裂解液可溶部分,为2个单克隆重复;泳道4:重组菌株未诱导培养后裂解液包涵体部分;泳道5、6、7:重组菌株IPTG诱导培养后裂解液包涵体部分,为3个单克隆重复;泳道8:Marker。B.LysinB蛋白的纯化。泳道1:LysinB蛋白纯化结果;泳道2、3、4:细菌裂解液可溶部分挂柱流出液、洗涤液对照;泳道5:Marker
在4℃贮存7d,蛋白活性基本不变,pH8.0的贮存液中蛋白杀菌活力最强,见图5A。15d后,这一缓冲液中的LysinB蛋白杀菌活性基本不变。在pH为8.0的PBST缓冲液中添加NaCl或EDTA-Na2,对LysinB的杀菌能力没有影响,见图5B。
3讨论
分枝杆菌噬菌体来源广泛,其裂解酶也成为新型抗菌制剂的研究热点[11]。裂解酶作为一种蛋白质,可通过基因工程的方法获得。虽然已对部分噬菌体裂解酶的功能进行探索,但研究工作更多集中在不同蛋白的酶学验证阶段,临床试验进展缓慢。面对耐药结核菌复杂的表型特征,不仅需要筛选、获得更大量的分枝杆菌噬菌体,而且需要对其裂解酶蛋白质特征和抗菌特性开展全面而深入的研究。
随着生物信息学的快速发展,蛋白质结构预测和抗原表位的预测为蛋白质功能研究提供极大便利[12-13]。本研究运用生物信息学方法预测发现TM4噬菌体来源的LysinB蛋白N端11~73位AA组成蛋白的肽聚糖结合位点,决定LysinB蛋白的酶解场所,也是噬菌体特异性识别并裂解分枝杆菌细胞壁的结构基础。蛋白B细胞和T细胞表位的分析结果有助于预测噬菌体治疗过程中诱发的潜在免疫反应[5,13]。LysinB蛋白预测的B细胞和T细胞抗原表位不存在交叉,但FIATNPPTA(356~364)肽段作为T细胞表位,可同时与HlA-Ⅰ和HLA-Ⅱ型受体结合,激起CD4和CD8型细胞免疫反应。暗示LysinB蛋白在杀菌作用的同时,还具有免疫调节的功能,可为结核早期快速诊断和候选疫苗的筛选提供候选肽表位。
分枝杆菌噬菌体裂解酶被认为是应对细菌耐药性的有效解决手段,但在进入临床应用前,作为蛋白多肽类药物,裂解酶也存在贮存期间保持稳定性以防止蛋白失活的问题。诱发蛋白酶类变性失活的因素主要包括温度、pH、盐类、表面活性剂等[14]。本研究重点考察pH调节剂(缓冲体系)、盐类、表面活性剂类在内的稳定剂,以防止蛋白质在水中发生表面吸附、聚集、沉淀,从而失活,而螯合剂可减少对酶的氧化还原反应起催化作用的金属离子,同样也可提高蛋白多肽类药物的化学稳定性。本研究为上述各组分的优化提供前期定性试验证据,进一步的定量结果则可能需要通过更严格地控制实验条件、延长实验周期,或改用可定量反映杀菌活性的试验方法进行确定。
总之,目前已上市的裂解酶制剂主要针对常见的革兰阳性菌及阴性菌感染,还未见分枝杆菌裂解酶制剂注册上市[15]。本研究建立的基于LysinB蛋白特征的免疫反应预测及LysinB蛋白杀菌特性的观察,不仅有助于深入了解分枝杆菌噬菌体裂解酶,也为研制可稳定贮存的噬菌体酶制剂及其临床应用提供参考。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] BAGCCHIS.WHO’sglobaltuberculosisreport2022[J].LancetMicrobe,2023,4(1):e20.
[2] AZIMIT,MOSADEGHM,NASIRIMJ,etal.Phagetherapyasarenewedtherapeuticapproachtomycobacterialinfections:Acomprehensivereview[J].InfectDrugResist,2019,12:2943–2959.
[3] HATFULLGF.Mycobacteriophages[J].MicrobiolSpectr,2018,6(5):10.
[4] DEDRICKRM,SMITHBE,GARLENARA,etal.Mycobacteriumabscessusstrainmorphotypedeterminesphagesusceptibility,therepertoireoftherapeuticallyusefulphages,andphageresistance[J].mBio,2021,12(2):e03431–20.
[5] DEDRICKRM,FREEMANKG,NGUYENJA,etal.Potentantibody-mediatedneutralizationlimitsbacteriophagetreatmentofapulmonaryMycobacteriumabscessusinfection[J].NatMed,2021,27(8):1357–1361.
[6] RUSSELLDA,HATFULLGF.PhagesDB:Theactinobacteriophagedatabase[J].Bioinformatics,2017,33(5):784–786.
[7] KORANYAH,ABOUHMADA,BAKEERW,etal.Comparativestructuralanalysisofdifferentmycobacteriophage-derivedmycolylarabinogalactanesterases(LysinB)[J].Biomolecules,2019,10(1):45.

