生物相分离和无膜细胞器
细胞是生物体结构和功能的基本单位,细胞内部每时每刻都在进行着成百上千种生物化学反应以保证生命的持续维持。为实现这些反应有序进行并受到精准严格的调控,细胞演化出细胞器结构,如生物氧化反应主要在线粒体完成。另一种策略就是反应组分之间进行有序的可逆性聚集和分散,基于“合则共赢,散则俱败”原则调控反应的启动和终止,如大家较熟悉的由大小亚基构成的核糖体。核糖体是蛋白质合成场所,无蛋白质合成时大小亚基处于分散状态,合成时大小亚基及辅助因子迅速聚集,合成结束后再次分开。细胞内有多种完成这种功能过程的结构,称之为生物分子凝聚体(biomolecular condensate)或无膜细胞器。最近10余年的一系列研究揭示了驱动无膜细胞器形成的相分离(phase separation)机制,在进一步理解诸多生命现象机制同时,也为疾病治疗提供了新思路[1]。
相分离
相(phase)是物质展现出的一种状态,如水存在固相、液相和气相,相变则是不同相之间的变化,加热可使水从液相变为气相的蒸汽,而降温则使水变为固相的冰,因此相变现象在自然界普遍存在。
两种或两种以上处于同相或不同相的物质可通过物理过程(不涉及化学反应)结合在一起形成混合物,如固相葡萄糖和液相水混合出糖水。混合物根据溶质大小和分散程度分为均质、非均质和中间态:均质混合物中溶质小于1纳米,性质稳定,如临床上常用的0.9%氯化钠和10%葡萄糖溶液;非均质混合物溶质大于100纳米,稳定性较差,如悬浊液和乳浊液,悬浊液溶质是固体小颗粒(如泥水)、乳浊液是小液滴(如油水混合物);中间态为胶体,溶质大小在1纳米到100纳米之间(如蛋白质溶液),稳定性居于前二者之间。
相分离是指相对稳定混合物产生不同相,进而分离的过程。均质化合物不发生相分离,不均质化合物易发生相分离,这些现象在生活中随处可见,如泥水发生分离形成上面水下面泥,油水混合物分离出油浮于水表层的现象(称为液液相分离)。胶体溶液则是具有相分离趋势,但需外部环境的影响。
早在1911年,法国生物学家勒杜克(S. Leduc)在《生命的机制》一书中就提出,生命研究最好从研究两种不同液体接触产生的物理化学现象开始,说明他已敏锐意识到相分离在细胞生命活动过程发挥着的重要作用。1913年,英国生物化学家诺贝尔生理学或医学奖获得者霍普金斯(F. G. Hopkins)在一次演讲中提出,细胞可视为“多相系统的特定动态系统”。1920年代,苏联生物化学家奥巴林(A. I. Oparin)和英国进化生物学霍尔丹(J. B. S. Haldane)提出生命起源的“原始汤”假说就认为,生命早期大分子可能通过相分离形成液滴状结构,可看作生命的雏形。
但对生物相分离系统研究则开始于2009年对P颗粒(P granule)形成机制的探索。
P颗粒
自19世纪上半叶细胞学说提出后,研究人员就对细胞展开了广泛研究。1858年,瑞士植物学家冯·内格里(C. W. von N?geli)在植物细胞中发现淀粉颗粒。19世纪末,英国生物学家哈迪 (W. B. Hardy)和美国细胞生物学家威尔逊(E. B. Wilson)就将细胞质看作胶体,其中还悬浮着许多小液滴,这一说法意味着细胞质具有相对稳定性(胶体性质)和相分离趋势(小液滴的存在)的双重性。细胞生物学家随后借助电子显微镜等工具在细胞内发现了大量不被膜包围的结构,它们可产生独立的微小空间,就像细胞中出现的相对隔绝的“世外桃源”,著名的如核仁等。
线虫(C. elegans)是一种多细胞生物,所有细胞都来源于一个共同细胞——受精卵,受精卵经多次分裂和分化后产生多种类型细胞进而形成组织和器官,如肌肉、血液、心脏和神经系统等,最初细胞与后来分化细胞的先后连续关系称为谱系(cell lineage),与人类族谱概念相似,如线虫P谱系的名称源于首次分裂后位于后部(posterior)。1982年,美国科罗拉多大学斯特罗姆(S. Strome)和伍德(B. Wood)在研究线虫胚胎过程中,偶然发现兔IgG血清可识别一种“颗粒”状结构,该结构仅存在于P谱系,故命名P颗粒[2]。进一步借助电子显微镜在果蝇等其他物种生殖种系(germline)也观察到类似结构,证明其普遍性。电子显微镜图像显示P颗粒内部具有致密结构;借助绿色荧光蛋白标记和共聚焦显微镜可观察到P颗粒具有液体样结构。
P颗粒是一种生殖颗粒,存在线虫整个生命周期,随机分布于受精前的卵子中,受精后向后端集聚,在随后细胞分裂过程中发生不对等分配,保留P颗粒的细胞才能最终发育为生殖细胞——卵细胞[3]。
线虫的P颗粒成分主要是两类RNA结合蛋白:RGG结构域蛋白(如PGL-1和PGL-3)和DEAD盒蛋白(如GLH-1到GLH-4),现在的问题是P颗粒如何实现从分散到集中,最初认为这是细胞质定向流动的缘故,但后续的研究否定了这一看法。
P颗粒与相分离
布朗温(C. P. Brangwynne)是一位美国材料科学家,大学期间原本喜欢西班牙语,后来却对细胞生物学产生浓厚兴趣,并跟随老师开展一些科学研究,却阴差阳错选择了研究材料科学,但并未放弃生物学,主要因为他了解到材料科学和细胞生物学的融合将会非常有趣,又获悉生物学家大多对材料学一无所知,更谈不上如何在研究中应用材料学知识。因此,布朗温在完成本职学业同时,尽可能抽出时间开展细胞生物学方面的研究,理解并掌握细胞扩散、自组织等知识。
布朗温在随后的哈佛大学博士期间,主要研究软物质材料的物理学性质,重点关注细胞骨架中微管的生物力学和动态平衡,实现材料科学和生物学的融合。2006年,在即将毕业之际,布朗温参加了美国海洋生物实验室举办的著名生理学课程,并被其内容深深吸引,更坚定了从事细胞生物学研究的决心,他喜欢旅游和开阔视野的性格,让他选择到德国马克斯·普朗克分子细胞生物学和遗传学研究所海曼(A. A. Hyman)实验室从事博士后研究[4]。
海曼是一位英国细胞生物学家,在剑桥大学学习期间,对线虫的胚胎发育产生了浓厚兴趣,博士后期间开始利用物理学方法研究微管动力学,相信从物理学视角去研究细胞生物学,会获得独特见解。海曼加入马克斯·普朗克研究所后,重回线虫胚胎发育的研究工作,不过这次是借助物理学方法研究线虫细胞质组装过程和功能。

布朗温和海曼经过深入讨论后,决定研究P颗粒的不对称分离机制。布朗温使用共聚焦成像和粒子示踪法,确定细胞质流动不会导致P颗粒分离;相反,P颗粒稳定性存在时空调节,胚胎一侧的P颗粒会逐渐缩小直至消失,而另一侧的会逐渐增长。布朗温还开发了一些简单聚集模拟,试图解析P颗粒的形成原因,但未成功。
2008年夏,布朗温和海曼被邀去美国海洋生物实验室进行生理学方面的讲学。其间,布朗温让学生拍摄了一系列显微镜下观察P颗粒融合过程的视频,在分析视频时惊奇地发现这些颗粒像气泡一样进行碰撞和聚集,其行为看起来非常像“液滴”,而不是固体颗粒[5]。他们立刻意识到P颗粒并不像最初命名时认为的那样拥有坚硬内核,相反它们更像油滴,先分散后融合,并混合成更大的液滴。这一发现使布朗温豁然开朗,拥有材料科学和软物质物理学深厚背景的他,立刻意识到自己以前胶体物理、表面张力、黏度和液滴聚集动力学等方面的知识非常有用,这种现象非常容易解释,因为那就是发生了相变,胶体通过相分离成为乳浊液。
布朗温和海曼回到马普研究所后又补充了体外实验,将充满P颗粒的线虫性腺粘在两块薄薄玻璃板之间,然后将玻璃板相互滑过,P颗粒会像雨点般融合、滴落和凝结,这进一步证实了他们最初的推测。
2009年,这项研究发表在《科学》(Science)杂志上[6],标志着这个新领域的诞生。这一发现的重要性在于提出相分离是某些大分子从无序的分散状态浓缩形成有序的凝聚体过程的重要驱动力。
最初科学家对此持一定的怀疑态度,2011年,布朗温和海曼进一步证明细胞核中核仁也表现出液液相分离机制,说明这种现象是普遍存在的。
全面研究
2009年之前,一些科学家其实已在体外观察到相分离,如蛋白质晶体制备过程中蛋白质从溶液中析出可看作固液相分离,但很少人关注这一现象,也没有将其与无膜细胞器相关联。2009年后,多家实验室开始关注相分离。
罗森(M. K. Rosen)是一位美国结构生物学家,他主要采用磁共振光谱和生物化学方法,研究细胞骨架控制的信号通路,其中N-WASP蛋白是其研究内容之一。2008年,罗森研究组决定探索N-WASP和它的多价结合蛋白(Nck)间关系,多价结合蛋白是指两种蛋白的结合是一对多,而非一对一,因此更容易形成多聚体而不是二聚体,这种现象在信号转导复合物中较为常见。他们发现,两种蛋白的浓度超过一定数值(如30微摩尔)时,溶液会立即变得浑浊,最初假定形成一种大的聚合物,但进行离心操作使溶液变得澄清时,离心管底部并未发现沉淀,震荡后浑浊重新出现。进一步借助显微镜观察,惊喜地发现溶液中充满着微小液滴,类似于乳浊液中的油。这些小液滴对光具有散射效应,故溶液出现浑浊;但形成的小液滴由于体积太小,离心后无法发现,因此未能发现沉淀[7]。这是在体外证实蛋白质发生相分离形成液滴的现象。

麦克奈特(S. L. McKnight)是一位美国生物化学家,主要研究基因转录调控。麦克奈特组发现构成RNA颗粒中的RNA结合蛋白,可在特定化合物介导下发生凝聚形成水凝胶样结构,显微镜下观察到它们由均匀的淀粉样纤维组成,与致病性纤维不同,这些结构呈现动态变化,一直处于聚合和解聚的平衡之中[8]。这一发现进一步证实了相分离的重要性。
这两项研究表明相分离可在试管中以如此简单的方式重现,从而极大简化这一领域的研究,推动了后续研究的快速发展。2015年,多个研究团队发现,不同蛋白均可通过相分离机制形成凝聚体进而发挥生物学活性,这使相分离的重要性逐渐得到科学界认可。
后续研究发现,大量无膜细胞器如卡哈尔体(Cajal body, CB)、核孔复合物、核散斑(nuclear speckle)、P小体(processing body, P-body)、应激颗粒(stress granule, SG)等,都通过相分离过程形成进而完成相应的生理功能,包括RNA代谢、核糖体生成和信号转导等。
生理功能
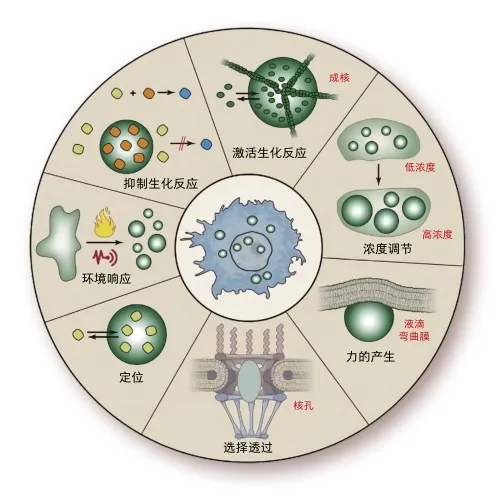
细胞内正常相分离对生物功能的完成至关重要[9]。相分离产生无膜细胞器的意义主要体现在三个方面:一是制造相对独立的密闭空间,保证反应过程少受周围环境影响,有利于反应物浓缩;二是这些细胞器的构成本身成分可作为反应物参与生化反应;三是作为聚集体形成的组织中心。参与生物凝聚体形成的蛋白质通常具有多价结合能力,如携带多个富含脯氨酸基序性,或拥有多个内在无序区域(intrinsically disordered region, IDR)等。
转录是细胞内最为重要的生物过程,其中负责mRNA转录的RNA聚合酶Ⅱ及其借助相分离形成的凝聚体最为关键。许多RNA结合蛋白拥有IDR,可与RNA结合,因此与RNA聚合酶Ⅱ共定位于启动子或增强子,有利于转录的启动。RNA拼接过程也具有类似机制。
最早发现具有明确生理功能的高动态细胞内凝聚体,是Wnt信号通路成分借助相分离形成的超分子复合物(Wnt信号体)。Dvl蛋白通过特定结构域在细胞质中聚集形成信号体,从而启动下游信号。
疾病发生
细胞需时刻保持内部的高度有序,相分离异常容易破坏有序性,引发功能紊乱进而导致疾病发生,常见的如神经退行性疾病和癌症等[10]。
神经退行性疾病是一类表现为认知功能丧失或运动功能缺陷等的疾病,前者有阿尔茨海默病(Alzheimer’s disease, AD)和额颞叶痴呆(frontotemporal dementia, FTD)等,后者包括亨廷顿舞蹈症(Huntington disease, HD)、肌萎缩侧索硬化(amyotrophic lateral sclerosis, ALS)和帕金森病(Parkinson’s disease, PD)等。这类疾病的一个共同特征是,某些关键蛋白在细胞内特定区域出现异常聚集并沉积,破坏神经元活性,最终造成功能性丧失而出现多种症状。
几种RNA结合蛋白,如TDP-43(TAR DNA binding protein of 43 kDa)和FUS(Fused in Sarcoma)等突变,与FTD和ALS相关,部分致病原因在于正常相分离被破坏。这些蛋白质的突变一方面引发了应激颗粒过度形成和蛋白质大量堆积,另一方面还破坏了解离过程。体外实验表明,突变的TDP-43或FUS首先通过相分离形成小液滴,但随着时间推移,可进一步转变为固态小颗粒而易沉淀,该过程称为体外老化,模拟了FTD和ALS发生过程。此外,蛋白异常翻译后修饰,如FUS精氨酸低甲基化和TDP-43过度磷酸化也可破坏相分离平衡,造成过量凝聚体形成。tau蛋白具有微管结合功能,在正常神经元中通过相分离促进微管蛋白聚集实现微管成核作用。但是,AD相关的tau蛋白突变或异常翻译后修饰,也将导致相分离失衡而使凝聚体增多,并促进随后的固化和聚集,造成疾病发生。
TP53是人类癌症中最常见的突变基因,在超过50%的肿瘤中观察到其突变。部分突变造成TP53蛋白更容易形成聚集体,该现象已在乳腺癌、皮肤癌和前列腺癌等中发现,且与临床不良预后相关。
近年来,在确定各种人类疾病遗传原因方面取得快速进展。借助遗传学或者基因组测序方法鉴定出多种致病基因,但这些突变基因如何导致疾病表型大多尚不清晰。部分原因在于传统分子生物学研究模式更多关注的是单一分子功能改变与复杂疾病表型的线性对应关系,较少对多分子相互作用进行研究。相分离现象的发现无疑为探索这些基因致病机制提供新方向。
重要意义
相分离很好地解释了细胞内,生物大分子的时空分配、无膜细胞器形成和解离过程,进一步对诸多生命现象有了新理解。自2009年取得突破以来,相分离研究已成为当前生命科学的一个前沿领域和研究热点。相分离概念的提出和深入研究将为许多生命现象的理解提供了新的纬度,有望为疾病治疗提供新的策略。
在相分离研究过程中做出奠基性贡献的多位科学家正在逐渐得到科学界认可。2021年,布朗温、海曼和罗森分享了第19届威利生物医学科学奖;布朗温和海曼还获得2023年生命科学突破奖等。
经过十几年的发展,生物液液相分离和无膜细胞器领域已取得一系列重要发展,对不同外界因素(如静电效应、温度、pH等)和蛋白内部特定结构域在无膜细胞器组装和形成过程中的作用已有较全面的理解,并对蛋白质结构变异造成疾病发生的机制有了初步认识,有望在治疗手段和效果方面取得突破。但也应看到相对于传统生物学领域,相分离领域的研究手段和深度较为有限,许多问题尚待进一步阐明,如相分离发生过程中特定结构随时间的变化、无膜细胞器形成和解离过程的详细机制、凝聚物从液态转化为老化态(易沉淀)的内在原因等。但随着越来越多研究人员的关注和加入,生物相分离研究的前进步伐在逐渐加快,也有望在应用方面大展身手。
[1]Alberti S, Hyman A A. Biomolecular condensates at the nexus of cellular stress, protein aggregation disease and ageing. Nat Rev Mol Cell Biol, 2021, 22(3):196-213.
[2]Strome S, Wood W B. Immunofluorescence visualization of germ-line-specific cytoplasmic granules in embryos, larvae, and adults of Caenorhabditis elegans. Proc Natl Acad Sci USA, 1982, 79(5):1558-1562.
[3]Seydoux G. The P granules of C. elegans: A genetic model for the study of RNA-protein condensates. J Mol Biol, 2018, 430(23):4702-4710.
[4]Brangwynne C, Hyman A A, Rosen M K. The path to condensates—19th Wiley Prize in biomedical sciences laureates share their discovery stories. Nat Sci, 2022, 2: e20210091.
[5]Dolgin E. What lava lamps and vinaigrette can teach us about cell biology. Nature, 2018, 555(7696):300-302.
[6]Brangwynne C P, Eckmann C R, Courson D S, et al. Germline P granules are liquid droplets that localize by controlled dissolution/ condensation. Science, 2009, 324(5935): 1729-1732.
[7]Li P, Banjade S, Cheng H C, et al. Phase transitions in the assembly of multivalent signalling proteins. Nature, 2012, 483(7389):336-340.
[8]Kato M, Han T W, Xie S, et al. Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels. Cell, 2012, 149(4):753-767.
[9]Banani S F, Lee H O, Hyman A A, et al. Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Biol, 2017, 18(5):285-298.
[10]Shin Y, Brangwynne C P. Liquid phase condensation in cell physiology and disease. Science, 2017, 357(6357): eaaf4382.
关键词:相分离 无膜细胞器 生物凝聚体 神经退行性疾病 ■

