微纳机器人:神经疾病治疗的新技术尝试
中枢神经系统由脑和脊髓组成,是人体神经系统的主体部分,其主要功能是传递、储存和加工信息,产生各种心理活动,支配与控制人体的全部行为。神经系统疾病是指影响中枢神经系统或周围神经系统的一类疾病,它们可能导致神经元的异常功能,进而影响身体的正常运作。这类疾病具有多样性、复杂性和难治性的特点。常见的神经系统疾病包括神经退行性疾病,如阿尔茨海默病和帕金森病。神经系统发育障碍疾病,包括自闭症谱系障碍、颅脑损伤,以及精神疾病,如抑郁症和焦虑症。神经系统疾病对患者的日常生活、职业和社交功能都可能造成严重影响,因此研究和治疗这些疾病具有重要意义。
电神经调节是治疗神经疾病有效的物理治疗方式,许多基于细胞外电刺激的植入性医学器件已应用于治疗帕金森病、抑郁症和癫痫等疾病。尽管传统的电极刺激方式能够显著缓解患者的病痛,但在实际应用中须通过导线供电,可能对生物组织产生感染,并且传统尺寸的器件难以实现单细胞的精准靶向。另一种通过光进行神经调节的方法是光遗传技术,提供了具有更大灵活性和分辨率的调控手段,并能够显著减轻组织的炎症反应。然而,光遗传技术依赖于基因修饰,可能在实际应用中带来不可预测的风险或副作用,因此在实际应用于人体时存在较大的争议。
近年来发展的基于非遗传的光神经调节技术提供了一种具有应用潜力的神经调节方式。与光遗传技术不同,非遗传的神经调节技术无需对基因进行编辑,而是通过递送至细胞或组织的光电响应性材料产生的物理化学信号输出进行作用。因此,这种方法具有最小侵入性和高时空精确度的优势。目前,已有多种光响应材料用于光神经调节,包括量子点、金纳米颗粒、半导体材料等。然而,如何实现细胞尺度的精确靶向控制仍然面临巨大挑战,高效生物兼容性的光响应材料的开发将极大推动该技术的发展。
微纳机器人简介
微纳机器人,又被称为微纳米马达,是近年来崭露头角的一类微观尺度上具备特定功能的新型微纳器件。它们通过将环境中存在的化学、声音、光、电、磁、热等能量转化为动力,从而实现可控运动。随着微纳米马达研究的不断深入,各种基于不同场景和操控方式的微纳马达相继问世,并在生物医学、纳米制造、环境修复等多个领域展现出卓越的性能。在生物医学方面,微纳米马达以其精准操控的特性为医学领域提供了备受瞩目的选择,有望实现人体生理指标的实时检测、靶向药物传输以及无创手术等领域的重大突破,成为该领域的研究热点。
近年来,随着微纳机器人研究的深入和应用的细化,对其功能的要求也日益提高。在这一背景下,耦合多信号的复合微纳马达成为一种行之有效的设计策略,也成为当前研究的焦点。复合微纳机器人的理念主要将多种功能与操控方式进行耦合,从而实现那些通过单一驱动方式难以实现的功能化目标。其中,磁控马达作为研究最为成熟且操控精度最高的方式之一,结合成像技术的反馈磁控技术已在医学应用中展现出巨大的潜力。因此,充分发挥磁操控马达的精确操控性,结合非遗传光神经调节的应用需求,采用高效光电转换材料构建光磁复合微纳马达体系有望为实现细胞级别的靶向光神经调节提供一种有效的解决方案,并为独立神经元刺激操控以及揭示它们之间相互作用的机制提供新的可能性。
非遗传光神经调节
目前,非遗传光神经调节的研究策略主要分为两类:传统的非主动式策略和主动可操控型策略。传统的非主动式方法主要通过使用光电材料或器件进行调节,然而其存在精度有限的问题,容易对周围神经元产生干扰,同时也可能引起一定程度的侵入性困扰。相比之下,主动可操控型策略旨在通过外部无线操控,将响应性材料输送至靶细胞位置,以实现高精度和最小侵入性,展现了卓越的研究和应用潜力。
在主动可操控型策略中,微纳机器人在神经调节中的应用正受到广泛关注。相对于传统方法,微纳机器人的主动操控性为研究人员提供了更为灵活和精确的工具,能够将响应性材料准确输送至特定神经元位置,从而实现对神经调节的高度精准性,有望在神经科学领域带来重大突破。然而,鉴于该技术仍处于发展阶段,未来仍需要深入研究和进一步验证其可行性,以更全面地了解其在神经调节中的潜在应用。
非主动式光神经调节策略
传统的非主动式调节策略主要利用光响应材料,如量子点、金纳米颗粒、半导体材料或器件等,通过与神经元共培养或者组织器官贴附的方式进行非遗传光刺激神经调节的研究。例如,通过光激发CdSe量子点修饰的碳纳米管仿生功能膜能够有效激活视网膜神经细胞[1]。此外,有机半导体膜材料器件展现出对培养的神经网络、视神经元等良好的刺激激活作用[2]。
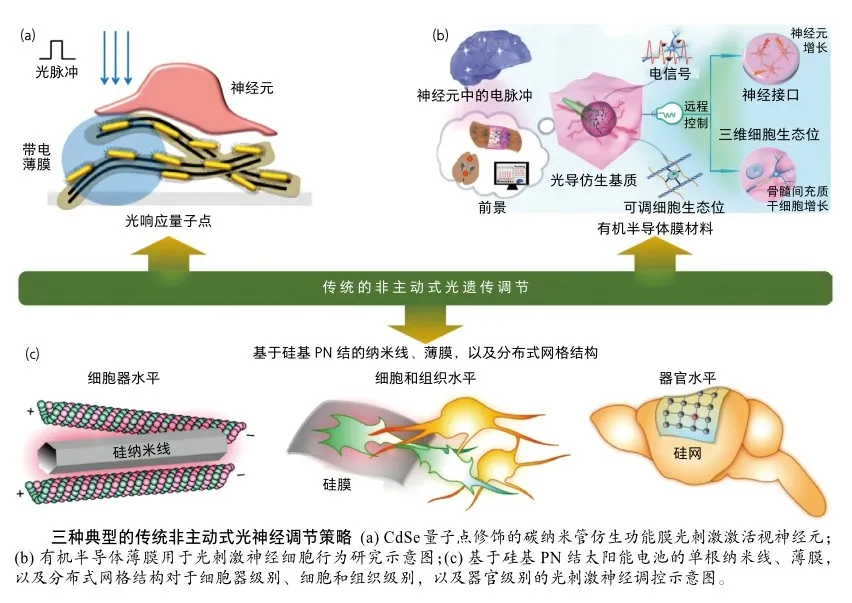
硅基半导体材料也是非遗传光神经调节方面研究较为成熟的材料体系,芝加哥大学的田博之教授在这个领域做出了卓越的贡献[3]。硅基纳米材料具有生物兼容性好、光电性质可控、吸光范围宽且易于器件化的优点。该团队系统研究了基于硅基PN结太阳能电池的单根纳米线、薄膜以及分布式网格结构对于细胞器级别、细胞和组织级别,以及器官级别的光刺激神经调控的影响。由于高效的光电转换性能,硅基材料在非遗传光神经调节方面显示出独特的优势。以上研究表明,基于光电转换材料的非遗传光神经调节具有巨大的发展潜力。此外,提高基于块体材料、薄膜材料或纳米材料随机分布的刺激模式,以实现更高的非侵入性和刺激精度,将有利于更深入的生物机制研究。
微纳机器人神经调节策略
为提高刺激精度并减小侵入性问题,结合微纳机器人技术发展起来的主动可操控型策略有望为非遗传神经调节提供新的方式。目前,基于微纳机器人在神经调节方面的研究尚处于起步阶段,主要利用耦合压电、软磁、磁电以及光电转换材料的复合微纳机器人体系。2021年,研究人员通过磁控螺旋马达耦合超声压电材料BaTiO3纳米颗粒实现了靶向神经元的超声刺激定向分化[4]。该团队又通过Ni-Zn材料制作的微机器人产生自建电场导致Ca2+通道的开放,增加Ca2+内流,从而增加细胞内Ca2+水平,从而诱导神经干细胞分化[5]。此外,利用激光烧蚀技术开发了基于软体压电聚合物螺旋结构的磁控复合微纳马达,旋转磁场的操控能够实现细胞的运载,并且能够在超声压电刺激下实现神经元的定向分化[6]。通过双光子3D打印技术开发了软体水凝胶螺旋结构马达,掺杂具有磁电性质的纳米颗粒也能够实现细胞的刺激分化[7]。
在光刺激神经调节方面,涂盈锋教授和彭飞教授于2023年设计了一个由近红外光驱动的可控性高的纳米机器人集群,通过近红外光照射,纳米机器人群呈现周期性化学-电场和可逆收缩-膨胀-收缩(振荡)行为,并利用集群产生的振荡激活电场局部视网膜神经节细胞[8]。此外,该团队还开发了基于TiO2-Au的纳米线马达,通过不同入射方向的紫外光进行驱动和操控,同时利用光激发产生的光电信号实现了有效的靶向光刺激视神经元激活[9]。该研究为基于微纳马达的靶向光刺激神经调控提供了非常好的借鉴。

因此,开发可见光激发的高效光电材料以及耦合灵活的操控方式能够大大提高其适用性。充分发掘非遗传光神经调节的优势,结合微纳马达的特点,开发兼具精确操控性与高效光电转换性能的复合微纳马达体系能够为单细胞精度的靶向光神经调节提供新的手段,也能够为更加深入的生物机制研究提供可行性。
磁控复合微机器人
2023年,笔者团队成功开发了一种基于硅纳米线太阳能电池结构的磁控复合微机器人(MOHR)[10]。MOHR具备通过旋转磁场实现精准磁操控的能力,同时硅基太阳能电池结构能够高效地提供光电刺激信号,从而实现在可见光激发下的非遗传光神经调节。通过对构建的阿尔茨海默病(Alzheimer’s disease, AD)神经元模型进行治疗实验,研究结果表明,该微机器人能够显著促进AD病理中神经元的功能恢复,并在体内展现出卓越的神经元激活效应。
靶向光神经调节
光磁复合微机器人(MOHR)的设计基于硅纳米线金属-绝缘体-半导体(MIS)结构,通过对MIS结构的优化,合理选择磁性金属作为金属端,同时也可作为磁控组分,为MOHR的精确磁操控提供了可能。此外,高效的光电转换性也能够为神经调控提供足够的刺激信号。
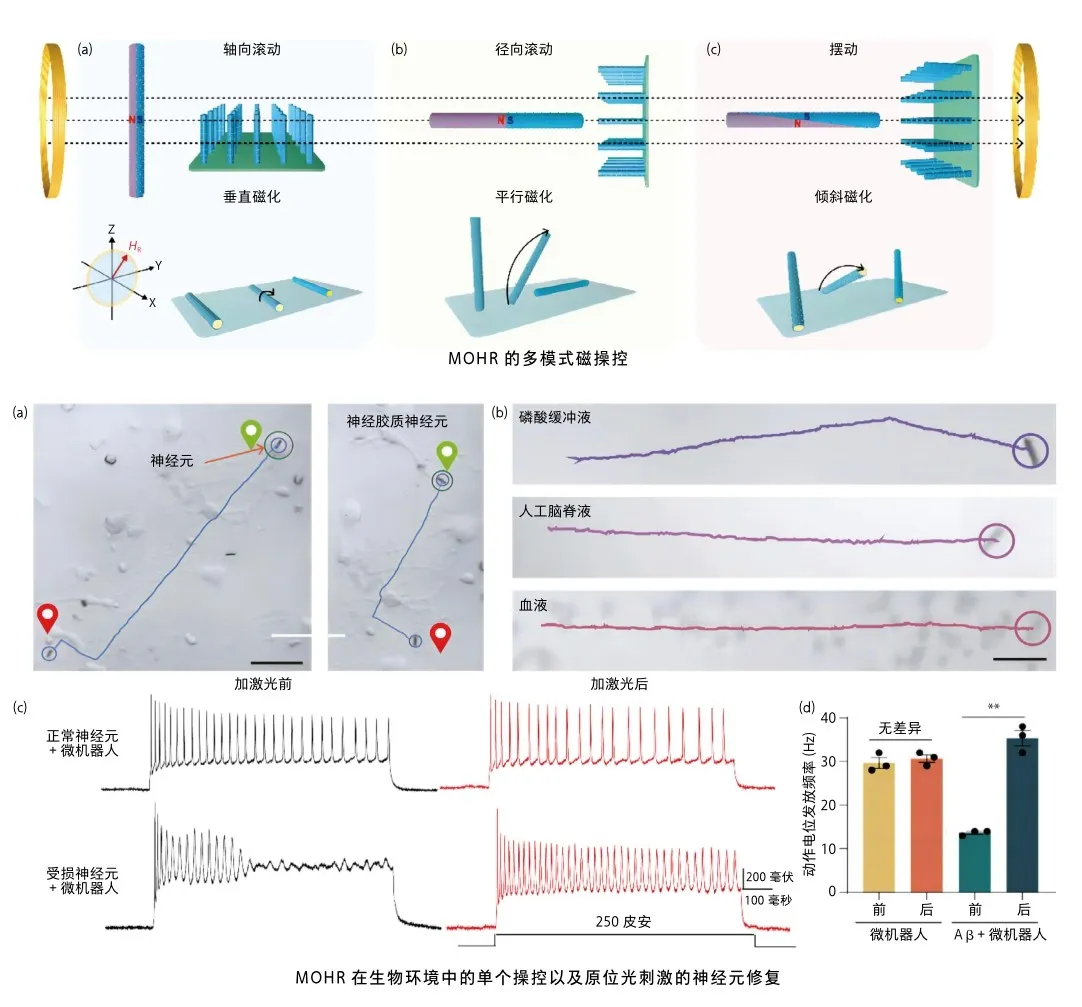
复合微机器人的多模式磁操控
利用磁场可编程的三维亥姆霍兹线圈可对MOHR实现精确的磁操控。可以利用MOHR的纳米棒结构预设磁化方向获得多模式的驱动,包括轴向滚动、径向滚动和摆动,而不同的运动方式使得MOHR可以应对不同的生物环境。三种运动模式下的MOHR均具备很好的磁驱动性能,同时,也可通过预设程序实现MOHR自动控制的精准路径运行,证明了其操控的精确性。
生物环境中的单个和群体操控以及原位光刺激的神经元修复
MOHR在实际生物环境中的操纵能力奠定了其应用的基础。通过在细胞环境和不同生物体液中进行运动测试,MOHR不仅在不同液体环境(如PBS、人工脑脊液和血液)中表现出良好的运动能力,而且其运动状态受到不同液体环境的影响较小。此外,MOHR能够精准靶向到特定神经元,在流动的血液环境中展示出对抗血流的效果。
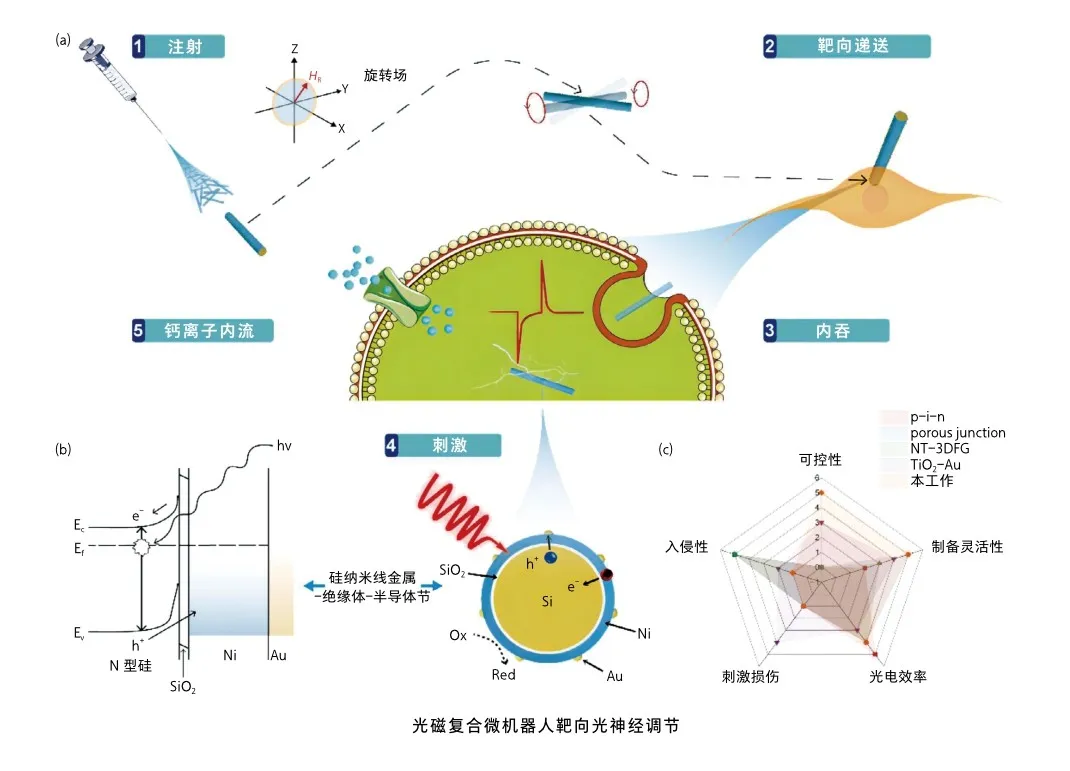
在模拟AD神经元的实验中,通过构建AD致病因子β淀粉样蛋白多肽Aβ42寡聚物损伤的海马神经元模型,研究者在MOHR刺激前后将递增电流注入神经元。结果显示,Aβ42损伤神经元的放电频率降低,然而,在这些受损神经元被激光照射激活后,神经元的兴奋性得到了恢复。同时,研究人员发现,具有内化MOHR的正常神经元的兴奋性未受激光照射影响,表明MOHR不仅不影响健康神经元的基础兴奋性,而且能够对受损伤的神经元进行再激活。这一系列实验证明了MOHR在复杂生物环境中的卓越性能,为其在神经调控领域的广泛应用奠定了坚实的基础。
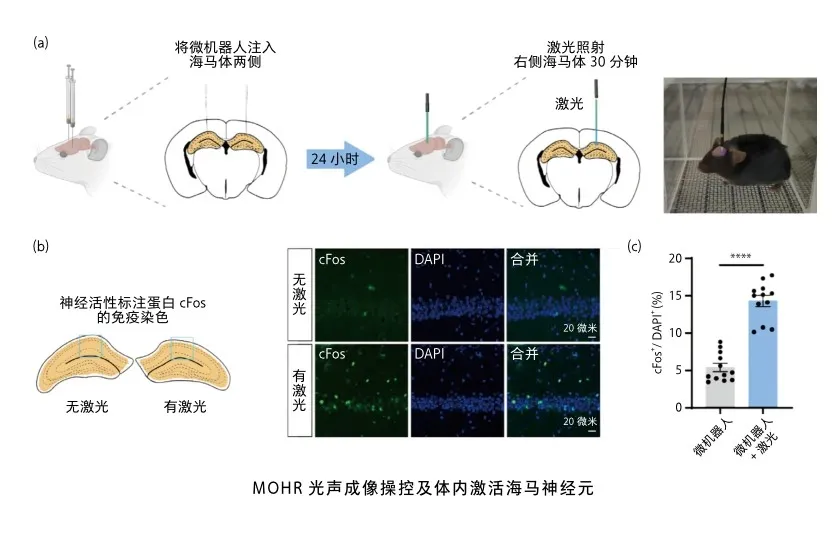
微机器人光声成像操控及体内激活海马神经元
光声成像作为一种高精度、无损伤的成像方式,极为适用于微纳机器人在生物体内的显像引导。为验证复合微机器人在体内对神经系统的作用,研究人员通过脑立体定向注射将MOHR集群注入C57BL/6小鼠的海马区。经过24小时的内化后,激光照射30分钟,海马神经元明显激活,神经活性标记蛋白cFos的表达显著增加。为了评估MOHR是否能引发免疫应答,研究人员测量了MOHR治疗后24小时海马区炎症因子的表达水平。结果显示,在MOHR注射后,白细胞介素(IL)-1β、IL-6和肿瘤坏死因子(TNF)-α的水平未显著升高。这一系列实验结果表明,MOHR在脑内神经元细胞激活方面具备广泛的应用潜力。
总的来说,该复合微机器人具备精准磁控靶向操控的能力,通过耦合光电刺激诱导细胞内钙浓度迅速升高并导致细胞膜去极化。这些特性使MOHR能够恢复AD样(Aβ42损伤)神经元的兴奋性。此外,在小鼠体内实验证明,MOHR可引发明显的神经元活动,而不会引起严重的免疫副作用。这种微纳机器人技术在精确定向的非遗传光神经调节方面表现出卓越的潜力,能够原位调节所需的细胞群,提高细胞兴奋性,促进AD病理中神经元的功能恢复。在体内表现出良好的神经元激活效应,为神经元调控以及相关作用机制的深入研究提供了一种可靠的工具。
结 语
随着微纳技术的蓬勃发展,微纳机器人正逐渐显露出在各个领域卓越的应用潜能。我们深信,随着研究的不断深入,微纳机器人在神经系统的精准调控和研究中将扮演越来越关键的角色,其更为精准的信号刺激递送功能在神经调节研究中有望推动脑科学的发展。研究人员通过将微纳机器人引入特定脑区域,能够实现对神经环路的定点操控,从而深入研究不同脑区域之间的相互作用和信息传递机制,为理解认知、情感和运动等复杂脑功能提供了前所未有的研究手段。
此外,微纳机器人在神经调节研究方面的应用将有助于治疗神经系统疾病。通过其精准的神经调节功能,为神经疾病的治疗提供了新的途径,可以更直接、更精准地干预异常的神经活动,从而减轻患者的症状。
总体而言,微纳机器人在神经调节研究中的前景令人期待。这一领域的不断创新将有助于拓展我们对神经科学的理解,为人类健康提供更为先进、更个性化的医疗解决方案。
[1]Wu C, Pu Y, Zhang Y, et al. A bioactive and photoresponsive platform for wireless electrical stimulation to promote neurogenesis. Advanced Healthcare Materials, 2022, 11 (20): 2201255.
[2]Fang Y, Jiang Y, Acaron L H, et al. Texturing silicon nanowires for highly localized optical modulation of cellular dynamics. Nano Letters, 2018, 18 (7): 4487-4492.
[3]Rotenberg M Y, Tian B. Talking to cells: Semiconductor nanomaterials at the cellular Interface. Advanced Biosystems, 2018, 2 (4): 1700242.
[4]Liu L, Wu J, Wang S, et al. Control the neural stem cell fate with biohybrid piezoelectrical magnetite micromotors. Nano Letters, 2021, 21 (8): 3518-3526.
[5]Feng Y, Gao C, Xie D, et al. Directed neural stem cells differentiation via signal communication with Ni–Zn micromotors. Advanced Materials, 2023, 35 (35): 2301736.
[6]Chen X Z, Liu J H, Dong M, et al. Magnetically driven piezoelectric soft microswimmers for neuron-like cell delivery and neuronal differentiation. Materials Horizons, 2019, 6 (7): 1512-1516.
[7]Dong M, Wang X, Chen X Z, et al. 3D-printed soft magnetoelectric microswimmers for delivery and differentiation of neuron-like cells. Advanced Functional Materials, 2020, 30 (17): 1910323.
[8]Chen B, Tan H, Ding M, et al. Nanorobot-mediated synchronized neuron activation. ACS Nano, 2023 17 (14): 13826-13839.
[9]Chen B, Liu L, Liu K, et al. Photoelectrochemical TiO2-Aunanowire-based motor for precise modulation of single-neuron activities. Advanced Functional Materials, 2021, 31 (10): 2008667.
[10]Gao Y, Guo Y, Yang Y, et al. Magnetically manipulated optoelectronic hybrid microrobots for optically targeted nongenetic neuromodulation. Advanced Materials, 2023, 36(8): 2305632.
关键词:光磁复合微机器人 磁控靶向操控 光电转换非遗传光神经调节 ■

