双孢蘑菇栽培基质二次发酵过程真菌群落结构变化分析




摘要:为明确双孢蘑菇栽培基质二次发酵过程中微生物动态和多样性,采用高通量测序技术,测定了双孢蘑菇栽培基质的二次发酵过程中真菌群落结构变化,并探究群落组成与环境因子的关系。结果表明:双孢蘑菇栽培基质二次发酵过程4个发酵阶段真菌分类单元(OTU)总数999个,包含10个门、26个纲、56个目、126个科、240个属和403个种,其中嗜热链球菌属(12.72%~42.63%)、unclassifiedfSordariaceae(0.12%~31.63%)、念球菌属(1.30%~17.32%)、曲霉属(2.57%~8.98%)、青霉属(2.88%~9.76%)和丝壳属(0.89%~4.18%)等属真菌占主导地位。发酵过程中,嗜热链球菌属、念球菌属、曲霉属、青霉属等属丰度在发酵的早、中期呈上升趋势,后期下降;嗜热链球菌属和青霉属真菌相对丰度于发酵中期达到高峰。氨气排放与堆体温度为发酵终点关键指标,冗余分析真菌群落与氨气排放和堆体温度的相关性表明,嗜热链球菌属、青霉属和念球菌属丰度与发酵温度和氨气排放呈正相关,其丰度越高,二次发酵周期短且发酵质量优。
关键词:双孢蘑菇;栽培基质;二次发酵;真菌多样性
中图分类号:S646文献标志码:A文章编号:0253−2301(2024)04−0017−08
DOI:10.13651/j.cnki.fjnykj.2024.04.003
Change Analysis of Fungal Community Structure During the Secondary Fermentation Process ofAgaricusbisporus Cultivation Substrate
CHEN De-ju,CHEN Mei-chun,LAN Jiang-lin,WANG Jie-ping *,ZHANG Hai-feng
(Institute of Resources, Environment and Soil Fertilizer, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian350003, China)
Abstract: In order to clarify the microbial dynamics and diversity during the secondary fermentation of Agaricusbisporus cultivation substrate, the high-throughput sequencing technology was used to determine the changes of fungalcommunity structure during the secondary fermentation of Agaricus bisporus cultivation substrate, and to explore therelationship between community composition and environmental factors. The results showed that the total number offungal taxonomic units (OTUs) in the four fermentation stages of the secondary fermentation process of Agaricusbisporus cultivation substrate was 999, including 10 phyla, 26 classes, 56 orders, 126 families, 240 genera, and 403species. Among them, thespeciesof Streptococcusthermophilus (12.72%−42.63%), unclassifiedfSortariaceae(0.12%−31.63%),Candida (1.30%−17.32%), Aspergillus (2.57%−8.98%), Penicillium (2.88%−9.76%), and Kernia(0.89%−4.18%) occupied the dominant position. During the fermentation process, the abundance of fungi belonging togenera such as Streptococcus thermophilus, Candida, Aspergillus, and Penicillium increased at the early and middle stages of fermentation, and then decreased at the later stage. The relative abundance of Streptococcus thermophilus and Penicillium reached the peak in the middle stage of fermentation. Ammonia emission and pile temperature were the key indicators of fermentation endpoint. The correlation between fungal community and ammonia emission and piletemperaturewasanalyzedbyusingtheredundancyanalysis. Theresultsshowedthattheabundanceof Streptococcus thermophilus, Penicillium and Candida was positively correlated with the fermentation temperature and ammonia emission. The higher the abundance was, the shorter the secondary fermentation cycle was and the better the fermentation quality was.
Key words: Agaricusbisporus;Cultivation substrate ;Secondary fermentation;Fungal diversity
双孢蘑菇Agaricusbisporus是我国重要的食用菌栽培品种,富含氨基酸、蛋白质、糖类、脂类、矿质元素等多种营养成分,备受人们喜爱[1]。双孢蘑菇是一种担子菌门真菌,属于草腐菌,其栽培基质需进行发酵腐熟后才可被菌丝吸收利用。生产上,常采用发酵后的麦秸或稻草和畜禽粪等农业废弃物作为双孢蘑菇栽培基质,这类农业废弃物经过一次腐熟后需要进行二次高温发酵后杀灭有害微生物后才能用于双孢蘑菇的栽培[2−4]。
基质二次发酵是一个自产热的过程,通过多种微生物的协同作用来完成生物质物料的降解,其中嗜热真菌、嗜热细菌和放线菌为优势菌群[5],这些微生物交替作用于基质,细菌在发酵初期通过破坏木质纤维素的外部结构,同时释放热量,使基质料堆温度升高;在发酵后期,真菌及放线菌使木质纤维素内部结构发生变化,分泌木质纤维素降解酶,促进基质料堆物质的降解和转化,创造适宜双孢蘑菇生长的营养环境[6−7],从而提高双孢蘑菇的产量和降低病害。不同发酵基质微生物组成不同,王鸿磊等[8]研究发现,在麦草鸡粪培养料发酵过程中,细菌数量最多,高于放线菌和真菌;Sharma 等[9]研究发现,基质料发酵过程中的中温菌群包括真菌和单胞细菌,嗜热菌群包含高丰度的放线菌。然而,双孢蘑菇培养料发酵过程中真菌群落变化研究较少,尤其是二次发酵过程中功能真菌研究。
双孢蘑菇培栽培基质二次发酵过程中微生物群落结构变化受发酵基质和发酵条件影响,明确栽培基质发酵过程中真菌动态变化和多样性,有利于指导发酵过程的补料,选择性地培养出双孢蘑菇生长的最佳微生态环境。本研究采用高通量测序技术,测定了双孢蘑菇栽培基质的二次发酵过程中真菌群落结构变化,探究群落组成与环境因子的关系,为栽培基质的二次发酵提供基础数据支撑。
1材料与方法
1.1基质材料
双孢蘑菇栽培基质一次发酵料(菇渣︰牛粪=70︰30质量比)由漳州角美镇宏发公司提供。样本采集时间为2021年3月。
1.2试剂与仪器
DNA 抽提试剂盒(E.Z.N.A.® Soil DNA Kit,美国 Omega 公司);FastPfu Polymerase(北京全式金生物技术有限公司);DNA 凝胶回收纯化试剂盒(PCRClean-UpKit ,中国逾华); ABIGeneAmp®9700型 PCR 仪(美国 BIO-RAD 公司); JY600C 电泳仪(北京君意东方电泳设备有限公司);驰诚电气 GC310复合式气体检测仪(许昌驰诚电气有限公司);Illumina PE300/PE250高通量测序由上海美吉生物医药科技有限公司完成。
1.3试验方法
1.3.1双孢蘑菇栽培基质二次发酵制备过程双孢蘑菇栽培基质二次发酵料初始温度为45℃ , 每天通风2~3次,每次30 min,发酵持续14 d,每天测定发酵温度和氨气浓度。于发酵开始(第0 d),早期(第3 d)、发酵中期(第8 d)及发酵末期(第14 d)分别取样,每次取样200 g ,样品编号为 Day0、Day3、Day8及 Day14。
1.3.2栽培基质样本微生物组宏基因组测序
(1)样本 DNA 抽提。利用 E.Z.N.A.® soil DNA
kit(Omega Bio-tek, Norcross, GA, U.S.)说明书进行微生物群落总基因组 DNA 抽提,使用 NanoDrop-2000(美国Thermo Scientific 公司)测定 DNA 浓度和纯度。
(2)PCR 扩增、文库构建与测序。以提取的 DNA 为模板,对 ITS 基因(上游引物 ITS1F: CTTGGTCATTTAGAGGAAGTAA;下游引物 ITS-2R: GCTGCGTTCTTCATCGATGC)进行 PCR 扩增。PCR 反应体系为20μL ,包括4μL5×Trans- StartFastPfu缓冲液,2μL dNTPs(2.5 mmol·L−1),0.8μL 上游引物(5μmol·L−1),0.8μL 下游引物(5μmol·L−1), 0.4μL TransStartFastPfu DNA 聚合酶、10 ng 模板 DNA 。扩增程序为:95℃预变性3 min ,27个循环(95℃变性30 s ,55℃退火30 s, 72℃延伸30 s),72℃稳定延伸10 min ,最后4℃保存。PCR 产物回收、纯化及定量分析后,进行文库构建,进一步利用 Illumina PE300/PE250平台进行测序。
1.3.3真菌物种注释、组成在Majorbio平台上,将测序下机的序列(reads)进行聚类、转化,与相应物种数据库比对,获得样本中真菌分类学和丰度信息,通过 Rank-abundance 曲线评估样本中物种的丰度高低和分布的均匀性,利用 Pan-core 物种分析方法来评估所测的样本量。采用 Alpha 多样性分析,分析的指数包括 chao 、shannon、ace、simpson、coverage ,进而评估样本中真菌群落的丰富度和多样性等信息。采用VennDiagram软件生成 Venn 图,反映各样品之间的 OTU 数;进行不同分类学水平上物种群落组成与丰度分析,根据物种或样本间丰度的相似性进行聚类,结果呈现在群落 heatmap 上。
1.3.4真菌群落丰度与环境因子相关性分析利用冗余分析(RDA)方法研究基质样本真菌群落与环境因子(氨气浓度和发酵温度)的关系,结合相关性 Heatmap 表示真菌群落与环境因子变量的相关性,分类水平为属水平,丰度前5的物种。
2结果与分析
2.1基质二次发酵过程温度和氨气浓度的变化
温度是决定微生物种群相对优势的一个重要因素[10]。由图1可知,二次发酵过程基质温度变化幅度较小,范围在55~63℃。基质二次发酵释放氨气浓度整体上随着发酵时间先上升后下降,变化范围为19~76μg·L−1。发酵早期(0~4 d)氨气浓度上升迅速(从38μg·L−1上升到72μg·L−1),发酵中期(5~10 d)氨气浓度变化平稳(72~74μg·L−1),发酵末期(11~14 d)氨气浓度迅速下降至19μg·L−1。发酵早期堆体的氨气释放速度快,表明发酵早期堆体内氮素被快速消化,以 NH3的形式释放出来。基质发酵过程中氮元素的转化与脲酶密切相关,该酶会促进尿素酰胺键的水解,从而产生氨气[11]。
2.2真菌群落多样性分析
由表1可知,二次发酵基质样本16S rDNA 基因序列被检测的覆盖率 Coverage 指数均达到0.99以上,表明测序结果能够很好反映样品的真实情况[12]。随着发酵时间延长,Chao 和 ACE 指数越来越大,表明发酵14 d 后显著增加了样本实际 OTU 数目,提高了真菌群落丰度。 Shannon 指数和 Simpson 指数体现了群落分布多样性和丰富度[13]。基质二次发酵过程,真菌群落多样性变化较大。与发酵初始相比,发酵末期 Shannon指数提高了,表明发酵后真菌群落多样性变高。
2.3真菌物种组成变化
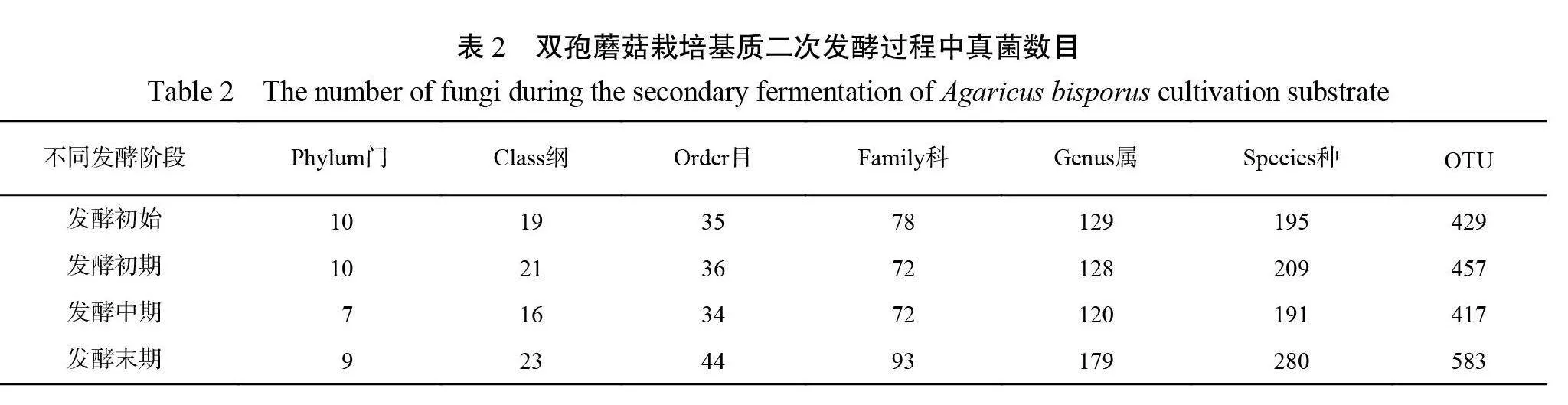
双孢蘑菇栽培基质二次发酵过程4个发酵阶段真菌分类单元(OTU)总数999个,包含10个门、26个纲、56个目、126个科、240个属和403个种。由表2可知,不同发酵阶段基质中真菌分类单元(OTU)数量存在差异,基质发酵初始阶段的有429个 OUT ,发酵末期有583个 OUT ,表明双孢蘑菇栽培基质经过二次发酵,微生物数目呈现上升趋势。在门、纲、目、科、属和种水平上,发酵末期的物种数目均高于发酵其他阶段,表明发酵末期双孢蘑菇栽培基质中真菌种类最为丰富。
2.4真菌物种丰度变化
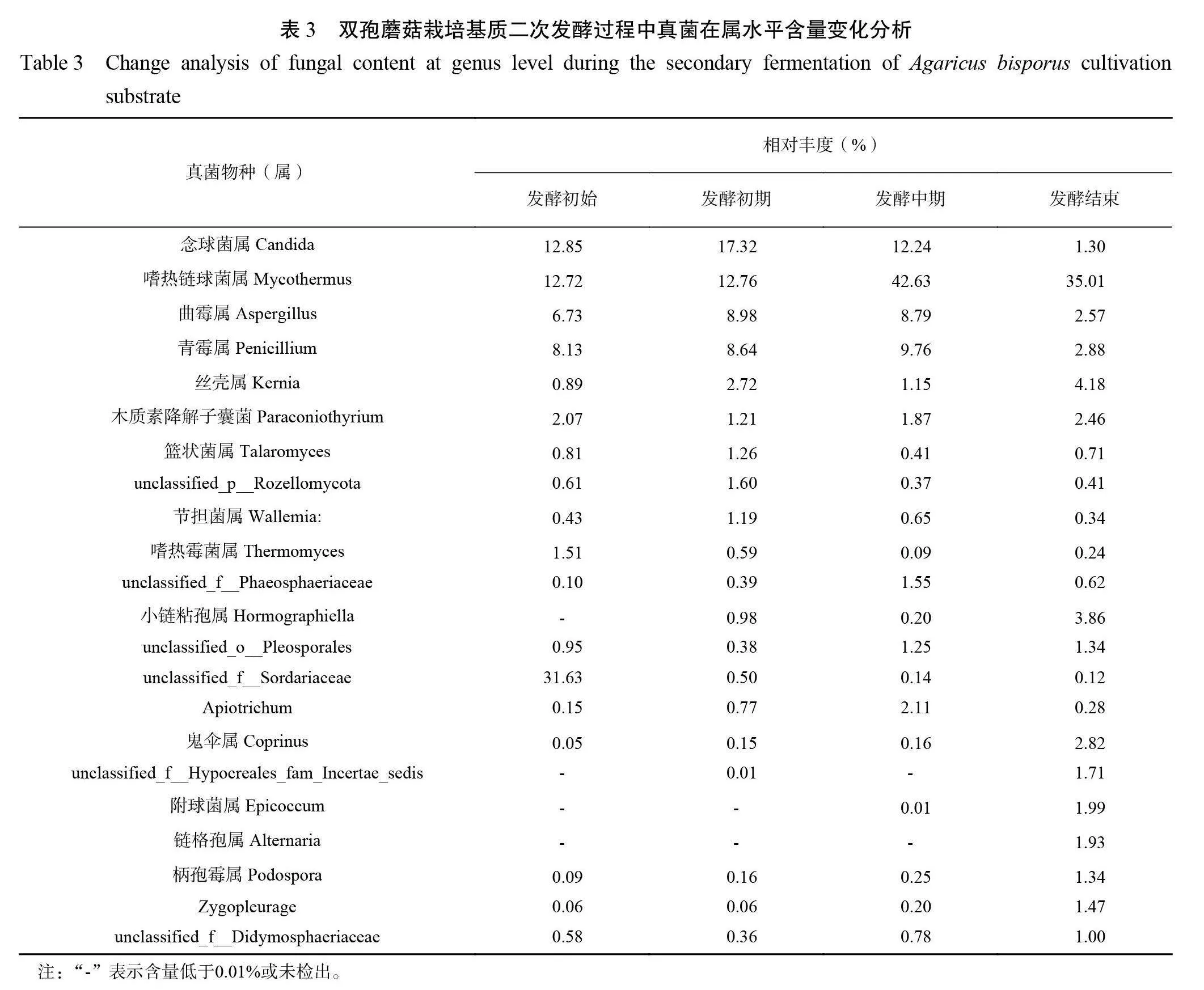
由表3可知,双孢蘑菇栽培基质发酵过程中丰度较高的真菌群落包括念球菌属(1.30%~17.32%)、嗜热链球菌属(12.72%~42.63%)、曲霉属(2.57%~8.98%)、青霉属(2.88%~9.76%)、丝壳属(0.89%~963ea51298eb74803cbc7fb7f64236524.18%)、unclassifiedf Sordariaceae(0.12%~31.63%)、鬼伞属(0.05%~2.82%)、Apiotrichum(0.15%~2.11%)等属真菌。热图直观分析4个不同发酵时期的样品中 Top 优势物种在不同样本中分布情况,探索发酵过程中物种变化趋势。结果显示,4个不同发酵时期的样品根据物种分布可聚为2类,一类为发酵初始和发酵早期,一类为发酵中期和发酵晚期(图2)。整个发酵过程中,念球菌属、嗜热链球菌属、曲霉属、青霉属等属真菌丰度随着发酵时间延长,丰度先上升后下降,嗜热链球菌属和青霉属真菌丰度于发酵中期达到高峰。unclassifiedfSordariaceae真菌在发酵第3 d ,相对丰度急剧下降,表明发酵温度上升后部分常温真菌被杀灭。与发酵初始相比,发酵末期真菌菌落组成更为丰富,增加了小链粘孢属、附球菌属和链格孢属等属真菌。
2.5真菌群落丰度与环境因子相关性
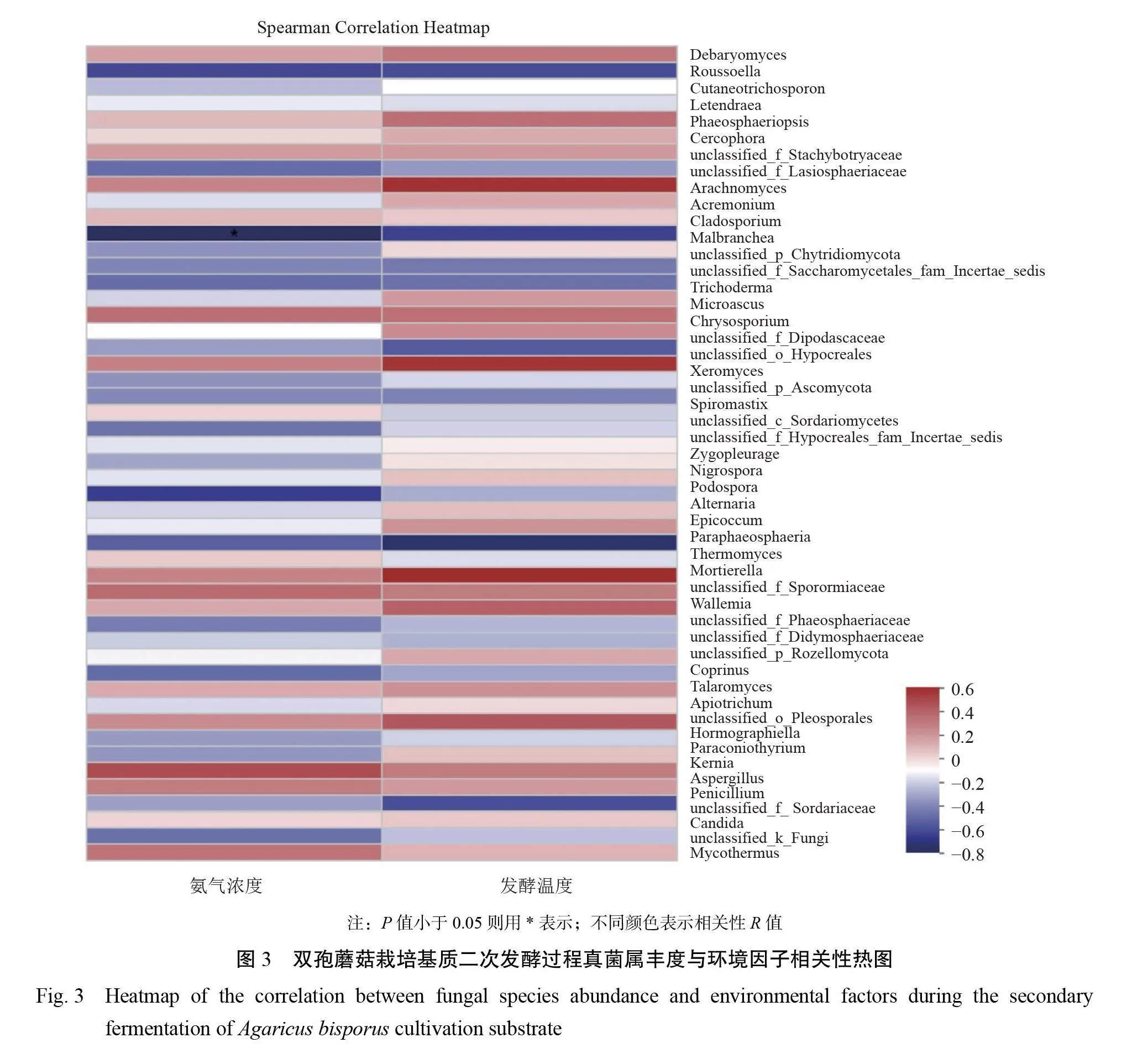
由图3可知,真菌群落中Hormographiella、耐干霉菌属(Xeromyces)、Arachnomyces、unclasified_ f_Sporormiaceae丰度与发酵温度呈正相关(P<0.05),Thermomyces与发酵温度呈负相关;Mal- branchea与氨气浓度呈显著负相关(P<0.05)。
冗余分析(RDA)结果(图4)显示,氨气浓度和温度所代表的红色箭头连线都很长,二者长度一样长,表明氨气浓度和温度这两个环境因子与双孢蘑菇栽培基质二次发酵过程中真菌群落结构相关性高。氨气浓度与发酵温度之间夹角为锐角,表示二者之间呈正相关,发酵温度越高,发酵过程释放的氨气量就越大。进一步分析了真菌物种丰度与环境因子氨气浓度和发酵温度的关系,结果显示嗜热链球菌属Mycothermus、青霉属 Penicillium 、念球菌属 Candida 丰度与2个环境因子的夹角均为锐角,说明这3类真菌的丰度与氨气释放和温度环境因子呈正相关,嗜热链球菌属、青霉属和念球菌属丰度越大,发酵温度越高;而 unclassifiedf Sordariaceae与环境因子的夹角为钝角,表明发酵温度越高,unclassifiedfSordariaceae丰度越低。
3讨论与结论
本研究对双孢蘑菇栽培基质二次发酵过程4个阶段发酵温度、氨气浓度和真菌群落结构进行了分析。二次发酵过程堆体温度变化小,变化范围为55~63℃ , 表明高温真菌代谢稳定发酵质量好;氨气浓度在发酵中期释放浓度达到高峰(76μg·L−1),发酵末期下降至19μg·L−1,氨气的释放量是发酵进展的重要的指示指标。利用高通量测序技术对4个发酵阶段的真菌群落及多样性差异进行分析,共检测出10个门、26个纲、56个目、126个科、240个属和403个种。真菌群落丰度较高的属主要包括嗜热链球菌属(12.72%~42.63%)、unclassi- fiedfSordariaceae(0.12%~31.63%)、念球菌属(1.30%~17.32%)、曲霉属(2.57%~8.98%)、青霉属(2.88%~9.76%)和丝壳属(0.89%~4.18%)。嗜热链球菌属、念球菌属、曲霉属、青霉属等属真菌丰度随着发酵进展先上升后下降,嗜热链球菌属和青霉属真菌丰度于发酵中期达到高峰,unclassifiedfSordariaceae真菌在发酵后丰度快速下降;物种与环境因子相关性分析结果显示嗜热链球菌属、青霉属和念球菌属与发酵温度和氨气浓度呈正相关,表明嗜热链球菌属、念球菌属、曲霉属、青霉属等为基质二次发酵的功能微生物。
双孢蘑菇栽培基质发酵过程各类物质在不同微生物的作用下发生降解。念球菌属是一类对糖类和油脂有较高降解能力的菌属[14],其相对丰度于发酵初期达到高峰(17.32%),而后随着发酵时间的延长相对丰度开始下降,到发酵末期念球菌属相对丰度仅为1.30%,表明念球菌属对基质中糖类和油脂的降解主要发生于发酵初始阶段。曲霉属真菌与半纤维素的降解有关[15],本研究中发酵初期和中期阶段的曲霉属丰度高于发酵末期,表明双孢蘑菇栽培基质中半纤维素的降解主要发生在发酵初期和中期。嗜热链球菌属被报道为牛粪堆肥发酵过程的典型菌属,该属会产生多种酶分解大分子物质,为后期发酵提供能量[16]。Wang 等发现在为期60 d 的牛粪堆肥中嗜热链球菌属的相对丰度在第10d 和30 d 达到90%以上,为优势菌群[17];葛勉慎等报道的牛粪好氧发酵腐熟阶段嗜热链球菌属相对丰度达到80%以上,为优势菌群[11]。本研究中双孢蘑菇栽培基质是由牛粪和菇渣组成,发酵过程中嗜热链球菌属属真菌丰度在发酵中期达到高峰(相对丰度42.63%)为优势菌群,与文献报道相一致。双孢蘑菇栽培基质二次发酵过程Apiotrichum相对丰度从初始的0.15%提高到2.11%(发酵中期),该菌属中某些物种被认为具有同化乙酸、丙酸、丁酸积累微生物油脂及将木质纤维素水解产物中的多种碳源转化为微生物油脂的能力[18]。本研究明确了双孢蘑菇栽培基质二次发酵过程中的优势功能真菌菌群,探究了优势菌与环境因子的关系,为栽培基质二次发酵提供基础数据支撑。
参考文献:
[1] WANGL , MAOJG , ZHAOHJ , etal. Comparisonofcharacterization and microbial communities in rice straw-and wheatstraw-based compost for Agaricus bisporus production[J]. Journalofindustrialmicrobiology & biotechnology ,2016,43(9):1249−1260.
[2]张丽,盛斌,李常凤,等.双孢蘑菇秸秆鸡粪发酵技术研究进展[J].安徽农业科学,2021,49(1):16−20
[3] BEYERDM.BasicproceduresforAgaricusmushroom growing[ M]. Philadelphia ,PennState: College of Agricultural Sciences Research,2003:5−7.
[4]蔡开地,黄梅卿,郑羡清,等.双孢蘑菇三次发酵高效优质栽培技术研究[J].热带农业科学,2014,34(12):26−29.
[5] MICHAEL A K , MEGHANN T. Compost bacteria and fungi that influencegrowthanddevelopmentof Agaricusbisporusandother commercial mushrooms[J]. Applied Microbiologyand Biotech- nology,2018,102(4):1639−1650
[6] BAN G H ,KIM J H ,KIM S A ,et al. Microbial succession duringbutton mushroom (Agaricus bisporus) productionevaluated viahigh-throughput sequencing[J]. Food microbiology ,2023,114:104307.
[7]李敏.双孢蘑菇培养料发酵过程中物质变化及微生物群落结构研究[ D].南京:南京农业大学,2015.
[8]王鸿磊,王红艳,宋俊芬,等.双孢蘑菇培养料工厂化发酵过程中微生物及物质变化研究[J].安徽农业科学,2011,39(1):94−96.
[9] SHARMAHS , KILPATRICKM.Mushroom (Agaricusbisporus) compost quality factors for predicting potential yield offruitingbodies[J]. CanadianJournalof microbiology ,2000,46(6):515−519.
[10] TAKII K ,FUKUI ,M ,TAKII , S. Microbial succession during acompostingprocessasevaluatedbydenaturinggradientgelelectrophoresisanalysis[J]. Journalof AppliedMicrobiology,2000,89(5):768−777.
[11]葛勉慎,周海宾,沈玉君,等.添加剂对牛粪堆肥不同阶段真菌群落演替的影响[J].中国环境科学,2019,39(12):5173−5181
[12]邓雯文,陈姝娟,何雪萍,等.鸡粪-堆肥中重金属残留、抗生素耐药基因及细菌群落变化研究[J].农业环境科学学报,2019,38(2):439−450.
[13] HUANG K ,LI F ,WEI Y ,et al. Changes of bacterial and fungalcommunity compositions during vermicomposting of vegetable wastesbyEisenia foetida[J]. BioresourceTechnology ,2013,150:235−241.
[14] SIMONETTA V,VALENTINA A,ANTONIO V ,et al. Molecularidentification and physiological characterization of yeasts ,lactic acidbacteria and acetic acid bacteria isolated from heap and box cocoabeanfermentationsinWest Africa[J]. International Journalof Food Microbiology,2016,216:69−78.
[15] ZHANG L ,ZHANG H ,WANG Z ,et al. Dynamic changes of the dominant functioning microbial community in the compost of a 90-m3 aerobic solid state fermentor revealed by integrated meta-omics[J]. Bioresource Technology,2016,203:1−10.
[16] BASOTRAN , KAURB , DIFALCOM , etal. Mycothermusthermophilus (Syn. Scytalidiumthermophilum): Repertoire of adiversearrayofefficientcellulasesandhemicellulasesinthesecretomerevealed[J]. BioresourceTechnology ,2016,222:413−421.
[17] WANGK , YINX , MAOH , etal. Changesinstructureand functionoffungalcommunityincowmanurecomposting[J]. Bioresource Technology,2018,255:123−130.
[18] QIAN X,ZHOU X ,CHEN L ,et al. Bioconversion of volatile fatty acidsintolipidsbytheoleaginousyeastApiotrichumporosum DSM27194[J]. Fuel,2021,290:119811.
(责任编辑:柯文辉)

