甜椒幼苗低温胁迫的生理响应与转录组分析


摘要:为了阐明甜椒响应低温胁迫的分子机制,对低温胁迫时甜椒幼苗的 MDA 含量、SOD 活性以及光合作用相关参数进行了测定,并结合转录组测序分析。结果表明:低温胁迫3d 时甜椒 MDA 含量显著升高,SOD 活性显著降低,光合相关参数显著下降;与低温处理前相比,转录组测序分析结果显示检测出差异基因主要涉及酶系统、光合作用、信号传导以及相关转录因子,其中SOD相关基因CaSOD呈示上调表达,光合作用关键基因 CaCP4与CaHCR的表达量则显著下调。研究结果为深入解析甜椒幼苗响应低温胁迫的分子机制及甜椒抗低温育种奠定了基础。
关键词:甜椒;低温胁迫;转录组;差异表达基因
中图分类号:S641.3文献标志码:A文章编号:0253−2301(2024)04−0006−11
DOI:10.13651/j.cnki.fjnykj.2024.04.002
Physiological Response and Transcriptome Analysis of Sweet Pepper SeedlingsUnder Low Temperature Stress
MA Xin-yi1 ,LIN Yi-hui1 ,YU Song-jin1 ,NI Hui2 ,LIN Wei3 ,WEI Mi1 ,CHEN Han-xin1*
(1. Zhangzhou Institute of Agricultural Sciences, Zhangzhou, Fujian 363005, China;2. School of Marine Food andBiotechnology, Jimei University, Xiamen, Fujian 361021, China;3. Subtropical Agriculture Research Institute,Fujian Academy of Agricultural Sciences, Zhangzhou, Fujian 363005, China)
Abstract: In order to clarify the molecular mechanism of sweet pepper in response to low temperature stress, the MDA content, SOD activity of sweet pepper seedlings and the relative parameters of photosynthesis under the low temperature stress were determined, and the transcriptome was sequenced and analyzed. The results showed that the contentofMDAinsweetpepperincreasedsignificantly,theactivityofSODdecreasedsignificantly,andthe photosynthetic relative parameters decreased significantly under the low temperature stress for 3 days. Compared with those before the treatment of low temperature, the transcriptome sequencing analysis showed that the differentially expressedgenesweremainlyinvolvedintheenzymesystem,photosynthesis,signaltransductionandrelated transcription factors. Among them, the expression of SOD-related gene CaSOD was up-regulated, and the expression of photosynthesis key genes CaCP4 and CaHCR was significantly down-regulated. The results laid a foundation for the further analysis of the molecular mechanism of sweet pepper seedlings in response to the low temperature stress and the anti-low temperature breeding of sweet pepper.
Key words: Sweet pepper;Low temperature stress;Transcriptome;Differentially expressed genes
低温胁迫作为植物常见的非生物胁迫之一,对其生长与发育有着较为严重的影响。植物在遭遇低温胁迫时,叶片常常表现为皱缩萎蔫、光合效率降低等特征,植株则整体表现出生长受阻与产量下降,对农业生产影响深远[1]。相关研究常以超氧化物歧化酶(SOD)、丙二醛(MDA)等生理生化指标作为植物面对低温胁迫的应答。低温下植物活性氧代谢系统受到影响,超氧阴离子自由基(O2−)等活性氧(ROS)含量增加,因此作为活性氧清除剂的 SOD 活性下降[2]。与此同时,植物在逆境胁迫下 MDA 含量会提高[3]。此外,对紫花苜蓿等植物的研究结果表明,低温可导致1,5-二磷酸核酮糖羧化酶(RuBPcase)等光合反应的相关酶降解或活性降低,从而影响植物的净光合速率[1]。但是,有关低温胁迫对植物生长影响的信号传导途径及基因表达调控机制还不明确。
近年来,高通量测序技术逐渐成为研究植物应对低温胁迫的分子调控机制的普遍技术途径。相关研究采用组学技术揭示了低温信号通过植物激素或者 Ca2+及 ROS 等第二信使向下传递。ROS 会激活包括 MAPK 级联、钙依赖性蛋白激酶(CDPKs)、钙调神经磷酸酶 B 型蛋白(CBLs)、与 CBL 相互作用的蛋白激酶(CIPK)等蛋白激酶(PKs)以及蛋白磷酸酶(PPs)。随后,PKs 和 PPs传递的信息至下游并引发一系列包括转录因子(TF)在内的磷酸化或去磷酸化级联,最终完成植物在低温逆境中信号传导和与低温胁迫有关基因的表达调控[4]。
甜椒 Capsicum annuum var.grossumL.又名青椒、菜椒、灯笼椒,属于茄科 Solanaceae辣椒属 Capsicum ,富含丰富的维生素 C 、多酚以及β-胡萝卜素等[5],是我国常见的设施栽培作物。甜椒属于冷敏感作物,当温度低于7℃时,可导致叶表面点蚀、叶片发黄等生理现象,进而严重影响其产量[6]。目前,对于甜椒低温胁迫的研究多集中在生理生化等方面[7]。近年来已有部分针对甜椒在低温逆境下转录组测序的研究。例如,Li 等[8]利用 RNA 测序技术研究甜椒幼苗在低温胁迫应答时发现钙离子(Ca2+)信号传导相关基因如 CBL 等下调,多数转录因子如 WRKY 等也下调。而 Shin 等[9]却发现甜椒在低温时次生代谢过程中的一些转录因子如 WRKY40、MKK9、MYB77等显示上调,同时相关低温胁迫响应基因如 POD 等也显著上调。Kong 等[10]测序发现甜椒果实中 AP2、MYB 、bHLH、WRKY 等转录因子也参与了低温反应。然而,甜椒整体响应低温胁迫机制以及关键基因尚不充分。因此,本研究以冷敏感甜椒品种博顿方椒 F1为试验材料,基于转录组测序技术结合生理生化指标对低温胁迫下的甜椒基因调节进行深入研究,探究甜椒及其他植物低温胁迫的分子响应机制。
1材料与方法
1.1试验材料
试验甜椒品种博顿方椒 F1为冷敏感品种,购自漳州美利德生物工程有限公司。
1.2试剂与仪器
主要试剂:液氮购于漳州市新兴气体有限公司;植物丙二醛(MDA)测试盒购于南京建成生物工程研究所;超氧化物歧化酶(SOD)活性检测试剂盒购于北京索莱宝科技有限公司
主要仪器:人工气候箱(RON-500C ,宁波扬辉仪器有限公司);分光光度计(L5S ,上海仪电分析仪器有限公司);便携式光合作用仪(GFS-3000,德国 WALZ)。
1.3试验方法
低温胁迫试验于2023年在漳州市农业科学研究所进行。种子经过温水浸泡催芽后,播种于50孔育苗盘内。当幼苗长至6~7片真叶时定植于小方盆中,并放置于人工气候箱,以温度28℃/18℃(昼/夜)、光照强度240μmol∙ m−2∙s−1、湿度70%的条件下缓苗3 d 。之后进行低温处理,光照强度与湿度不变,温度控制在15℃/5℃(昼/夜),处理7 d 。分别在处理后的0、3、5、7 d 时取功能叶(从上往下数第3~4叶)测定生理生化指标以及转录组测序,每次随机选取10株取样,重复3次。所有样品在采样后均在液氨中快速冷冻,并于−80℃中保存。
1.3.1生理指标测定使用植物丙二醛(MDA)测试盒和超氧化物歧化酶(SOD)活性检测试剂盒测定甜椒叶片在低温处理0、3、5、7 d 时 MDA 含量及 SOD 活性,方法按照试剂盒说明书进行测定。每个处理重复3次。
1.3.2叶片光合气体交换参数测定利用便携式光合作用仪 GFS-3000对功能叶片的净光合速率、蒸腾速率、气孔导度、胞间 CO2浓度进行测定。测定时间为08:00~11:30,测定光照度为800µmol·m−2·s−1,流速为500µmol·s−1, CO2浓度为400µmol·mol−1。每个处理重复3次。
1.3.3转录组测序委托深圳华大基因科技服务有限公司对0 d(ck)与3 d(cold)低温处理的甜椒叶片,共6个样品(各3个重复,分别为 ck1、ck2、 ck3、cold1、cold2、cold3)中总 RNA 进行提取,用 Agilent 2100检测提取结果,RIN(RNA integ- rity, RIN)≥8,结果 A 类;基于 DNBSEQ 平台进行转录组测序并对原始数据去冗余过滤。
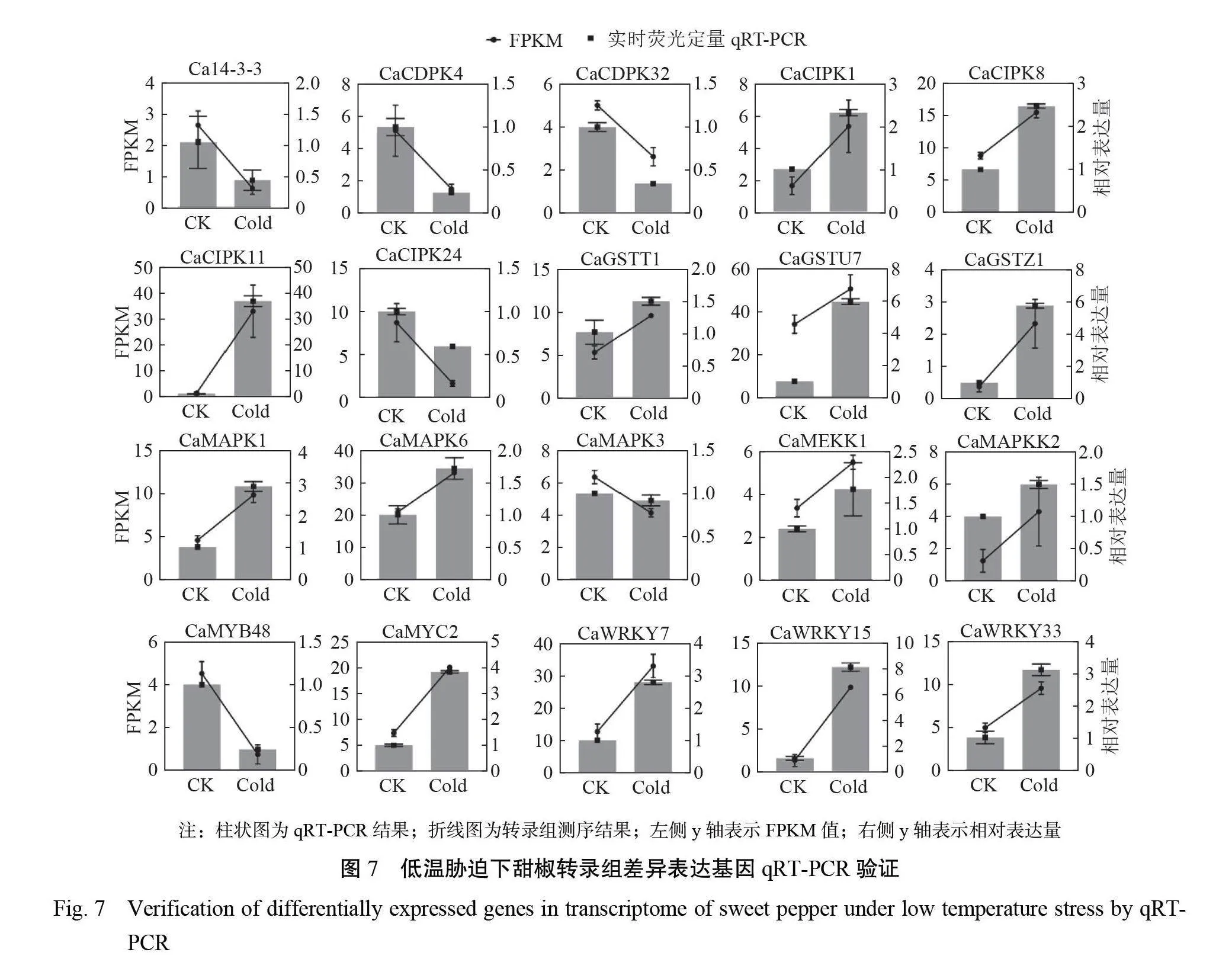
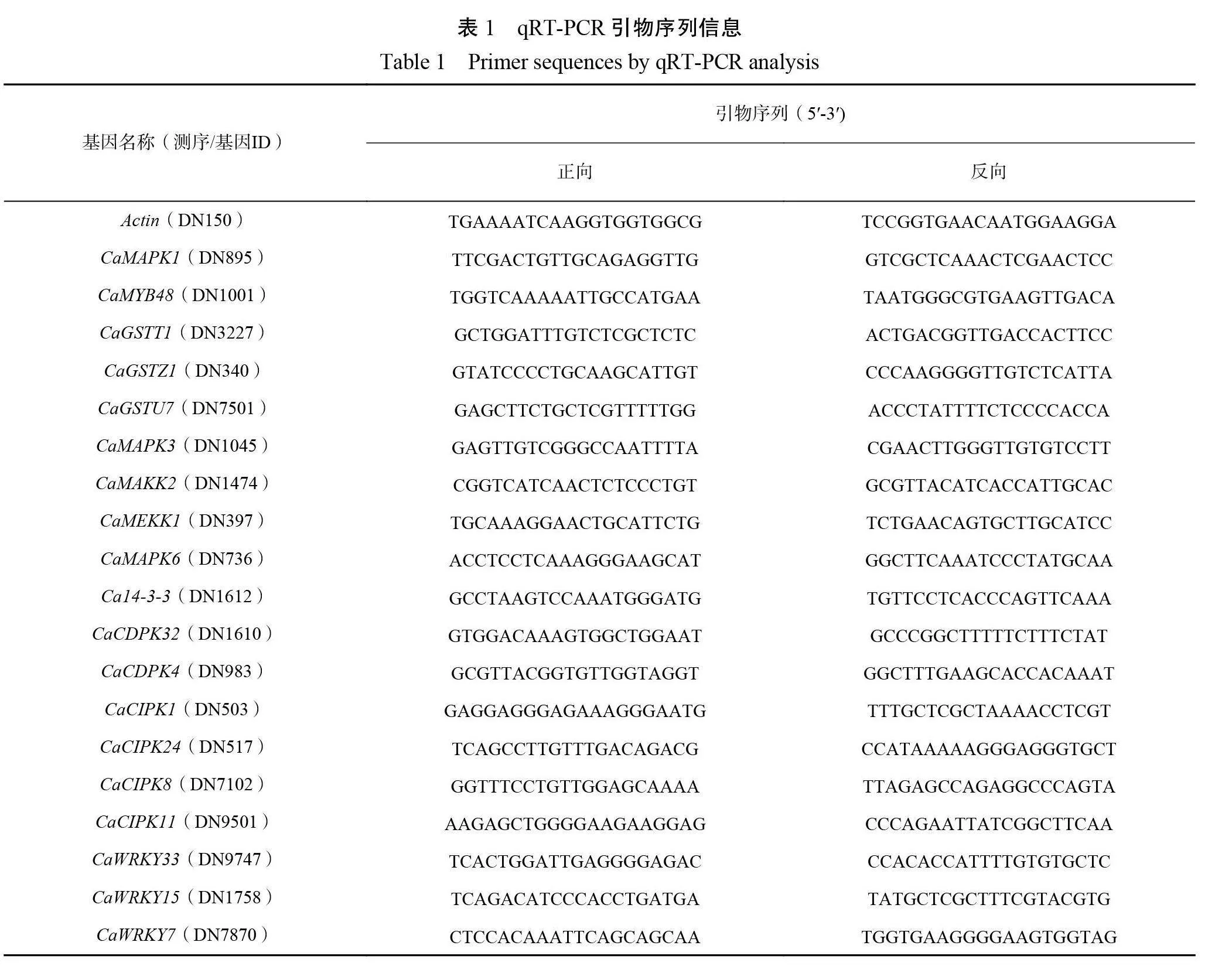
1.3.4转录组差异表达基因qRT-PCR 验证为验证转录组测序的准确性,本研究选择了20个差异表达的低温相关基因进行荧光定量 PCR 验证。基于基因组数据库获得的基因全长信息,使用 primer 5.0设计荧光定量特异引物(表1),内参基因为 ACTIN ,qRT-PCR 试剂盒(湖南艾科瑞生物工程有限公司)反应体系包括10μL 2×SYBR GreenPro Tap HS premix ,1μL 上下游引物,1μL 稀释后的 cDNA 模板(100 ng·μL−1),无菌水补充至20μL,反应步骤:95℃变性30 s, 95℃退火5 s ,60℃延伸20 s ,40个循环。最后以2−△△CT 计算差异表达基因的相对表达量。
1.4数据分析
1.4.1生理及光合参数数据分析使用 R 语言对数据进行统计分析,使用 Origin 2021及 GraphPad Prism 10.1.2绘制柱形图。
1.4.2转录组数据分析使用过滤软件 SOAP- nuke 过滤掉低质量、接头污染以及未知碱基 N 含量大于5%的 reads ,得到 clean reads 。不使用参考基因,使用 Trinity 对 clean reads 进行组装得到Unigene,用 BUSCO 对组装的转录本进行质量评估。之后对Unigene进行功能注释、SSR 检测,之后每个样品在 All-Unigene的基础上使用 Bowtie2将 clean reads 比对到基因组序列上,然后使用RSEM 计算各个样品的基因表达水平计算表达量。使用 DESeq2分析基因差异表达显著性,并使用 R 软件中的phyper对差异表达基因(DEGs)做 GO 和 KEGG 富集分析,以Qvalue≤0.05的功能视为显著富集。最后使用 R 软件的 ggplot2绘制基因统计柱状图、火山图、气泡图、GO 及 KEGG 富集图。
2结果与分析
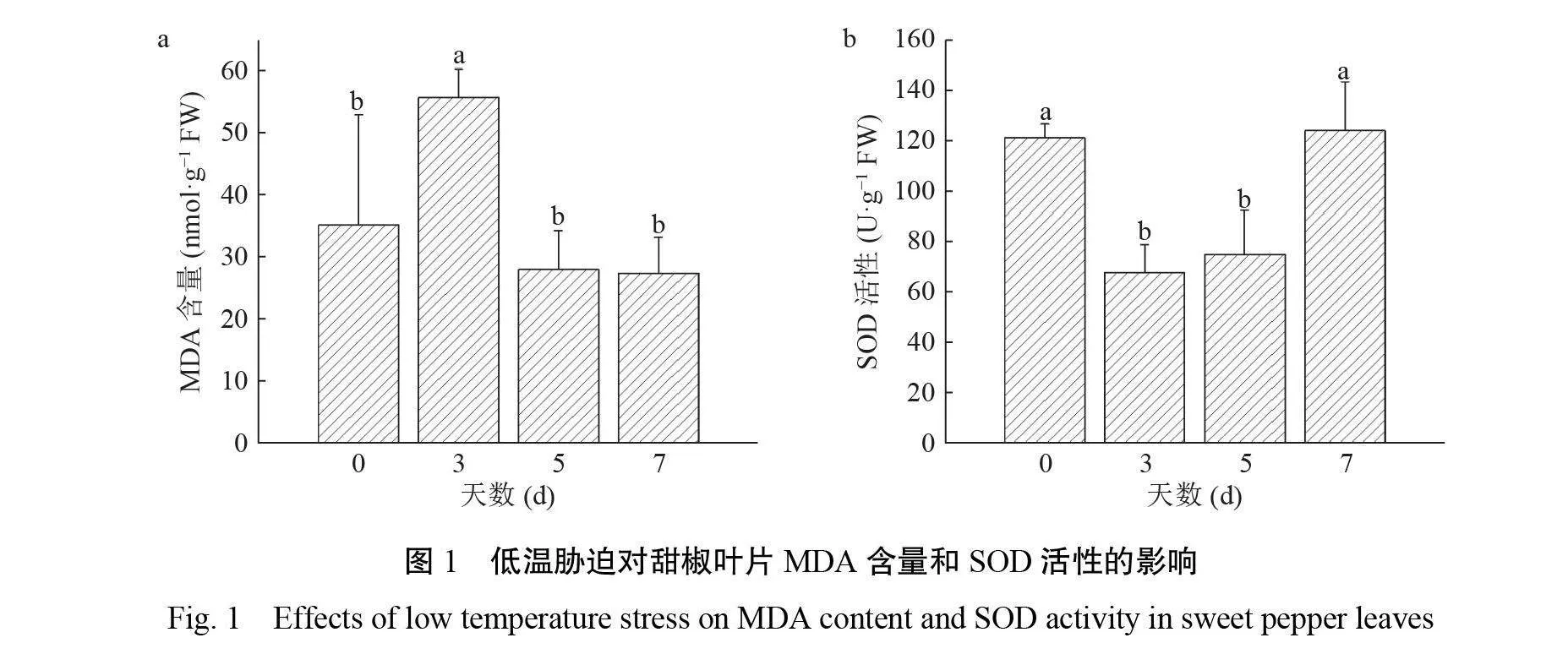
2.1低温胁迫对甜椒叶片 MDA 含量和 SOD活性的影响
MDA 作为膜脂过氧化的最终产物,是衡量植物低温逆境下细胞膜受损程度的常用理化指标之一。MDA 含量测定发现(图1a),在3 d 时甜椒幼苗叶片 MDA 含量与处理前相比显著提高,在5 d 和7 d 时又降低,并趋于稳定。孟雅宁等[11]发现甜椒低温胁迫时 MDA 含量在7 d 后才开始下降,而刘凯歌等[12]则发现在10 d 。本研究发现 MDA 含量在低温胁迫后迅速上升,说明甜椒产生了低温胁迫损伤,这与刘凯歌等研究结果相似。
植物在面对低温等逆境胁迫时,叶片中的 ROS 含量会提高,攻击其细胞膜,引起膜脂过氧化[13]。而 SOD 作为生物体内的活性氧清除剂,在植物面临逆境胁迫时处于重要地位,其活性随着 ROS 含量的增高而下降[14]。本试验 SOD 活性分析(图1b)表明,叶片中 SOD 在低温胁迫后先下降,在3 d 时甜椒幼苗叶片 SOD 活性与处理前相比显著下降,在7 d 时 SOD 活性恢复至处理前水平。本研究显示叶片中 SOD 在低温胁迫后先下降,说明产生了低温胁迫损伤;后期升高可能是 SOD 合成量增加。
2.2低温胁迫对甜椒叶片光合作用的影响
对低温肋迫下甜椒叶片的光合相关参数测定(图2)发现,低温胁迫下,甜椒叶片的净光合速率、蒸腾速率、气孔导度及胞间 CO2含量均发生显著下降。其中,净光合速率在3 d 时显著降低,5 d 时小幅提高,但7 d 时又降至3d 时的水平;胞间 CO2含量在3 d 时显著降低,5 d 时开始缓慢上升,但是7 d 时仍显著低于处理前;蒸腾速率与气孔导度在3 d 时显著下降后一直保持在同一地位水平,并无明显回升。莫亿伟等[15]认为低温逆境下,光合速率主要受到相关酶活的影响,RuBPcase活性降低导致 ATP 供应不足,暗反应受到影响;果糖-1,6-二磷酸酯酶(FBPase)在低温下也受到抑制,使电子传递速率降低;参与卡尔文循环的其他酶活也随之降低,影响叶绿素含量及 CO2固定能力,最终影响光合速率。本试验中低温胁迫对甜椒叶片的光合作用的影响较大,无法自行调节回到常温状态下的水平,这与相关研究报道的低温胁迫损伤导致光合作用下降的现象具有相似性。
2.3甜椒低温胁迫转录组结果分析
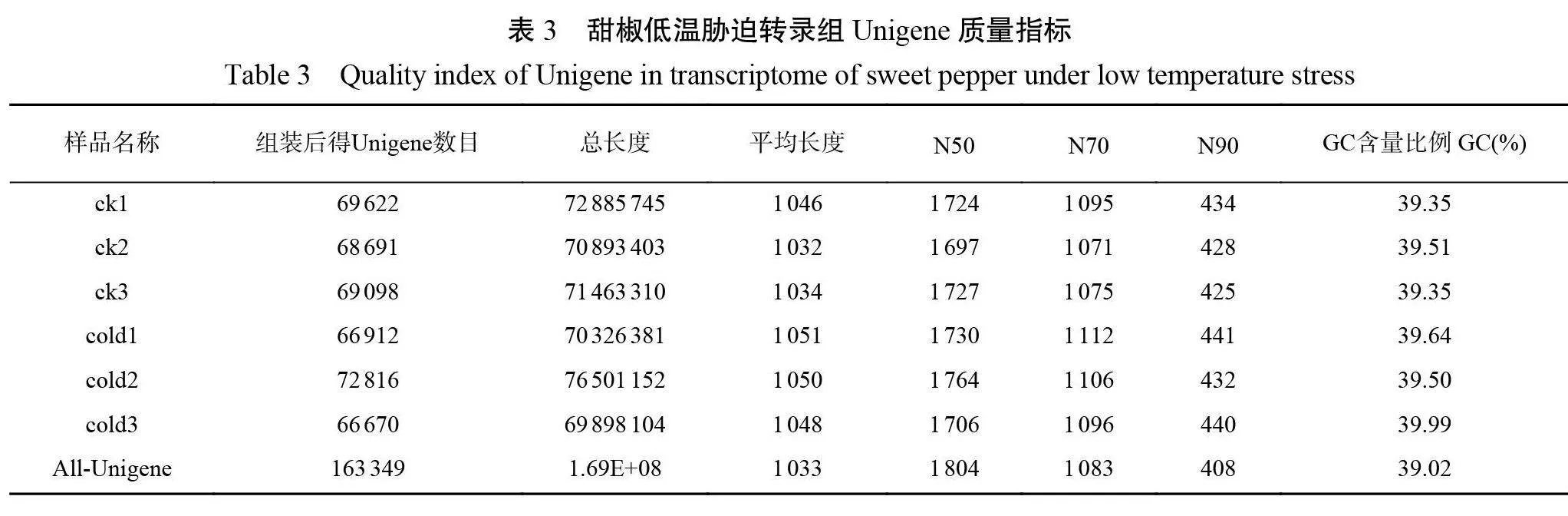
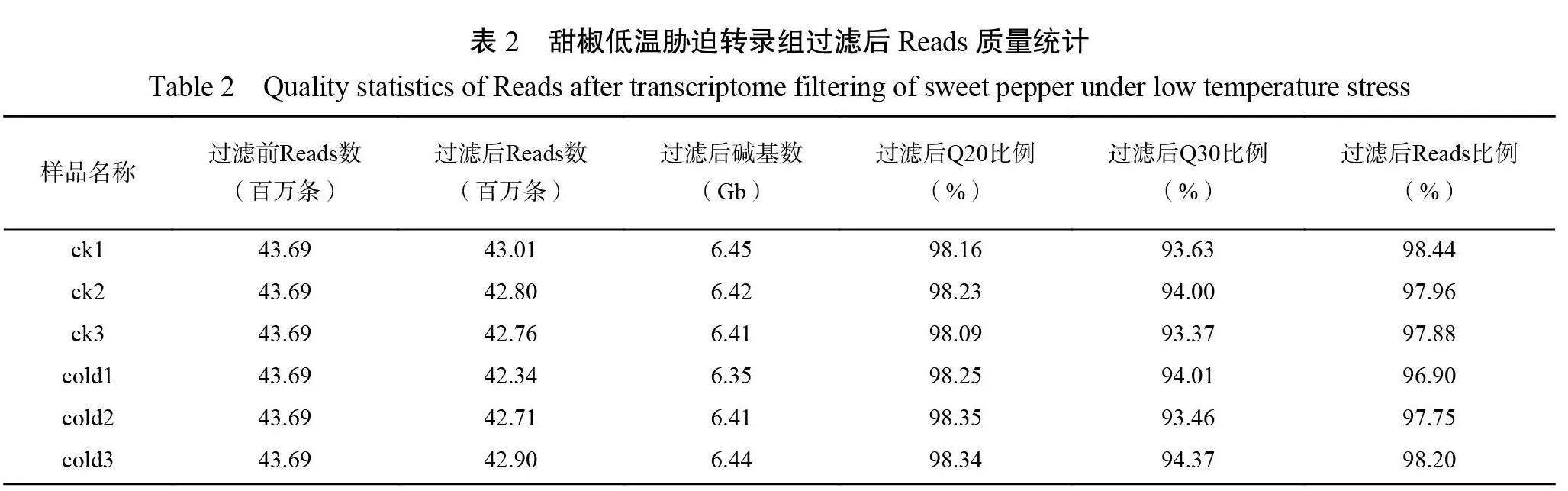
2.3.1低温胁迫下甜椒转录组数据质控及序列比对分析采用低温处理0 d(ck)及3 d(cold)的甜椒叶片共6个样本进行转录组测序(表2),一共测得38.48 Gb 数据。各样品过滤后碱基数均达到6.35 Gb 以上,Q20碱基百分比均在98.09%以上, Q30碱基百分比均在93.37%以上,过滤后 Reads 比例均在96.9%以上。由表3可知,对 clean reads 进行组装并去冗余后得到163349个Unigene,总长度、平均长度、N50以及 GC 含量分别为168775018 bp 、1033 bp 、1804 bp 和39.02%。以上指标数据说明本次测序质量良好,可进行下一步分析。将 clean reads 对比到参考基因序列得到对比序列,总对比率达90.13%以上。
2.3.2低温胁迫下甜椒转录组差异表达基因筛选
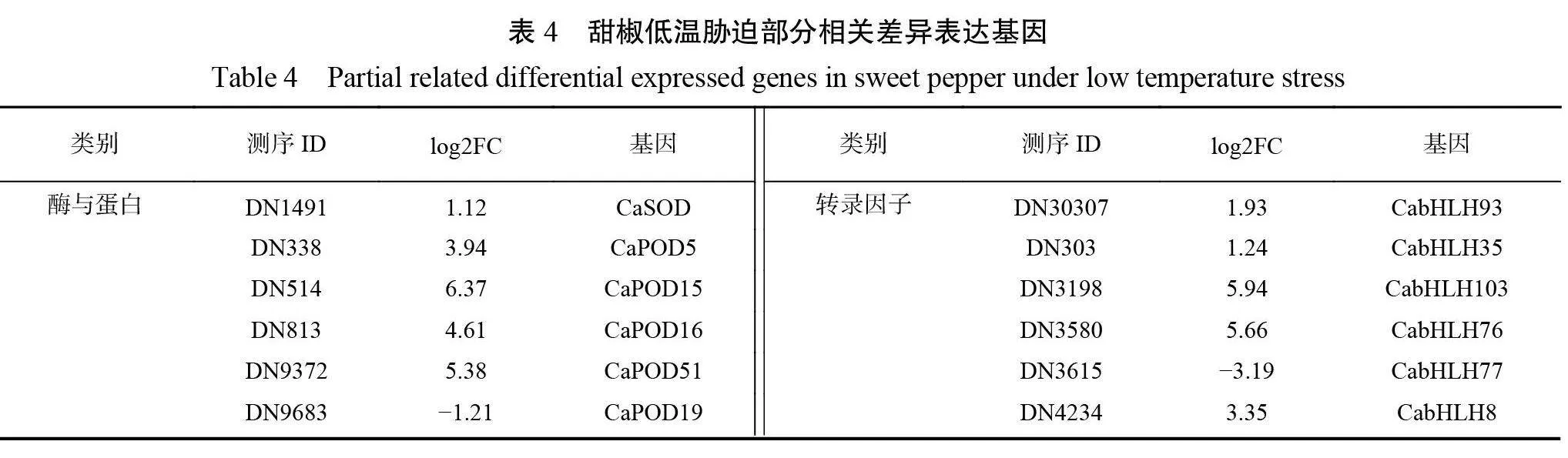
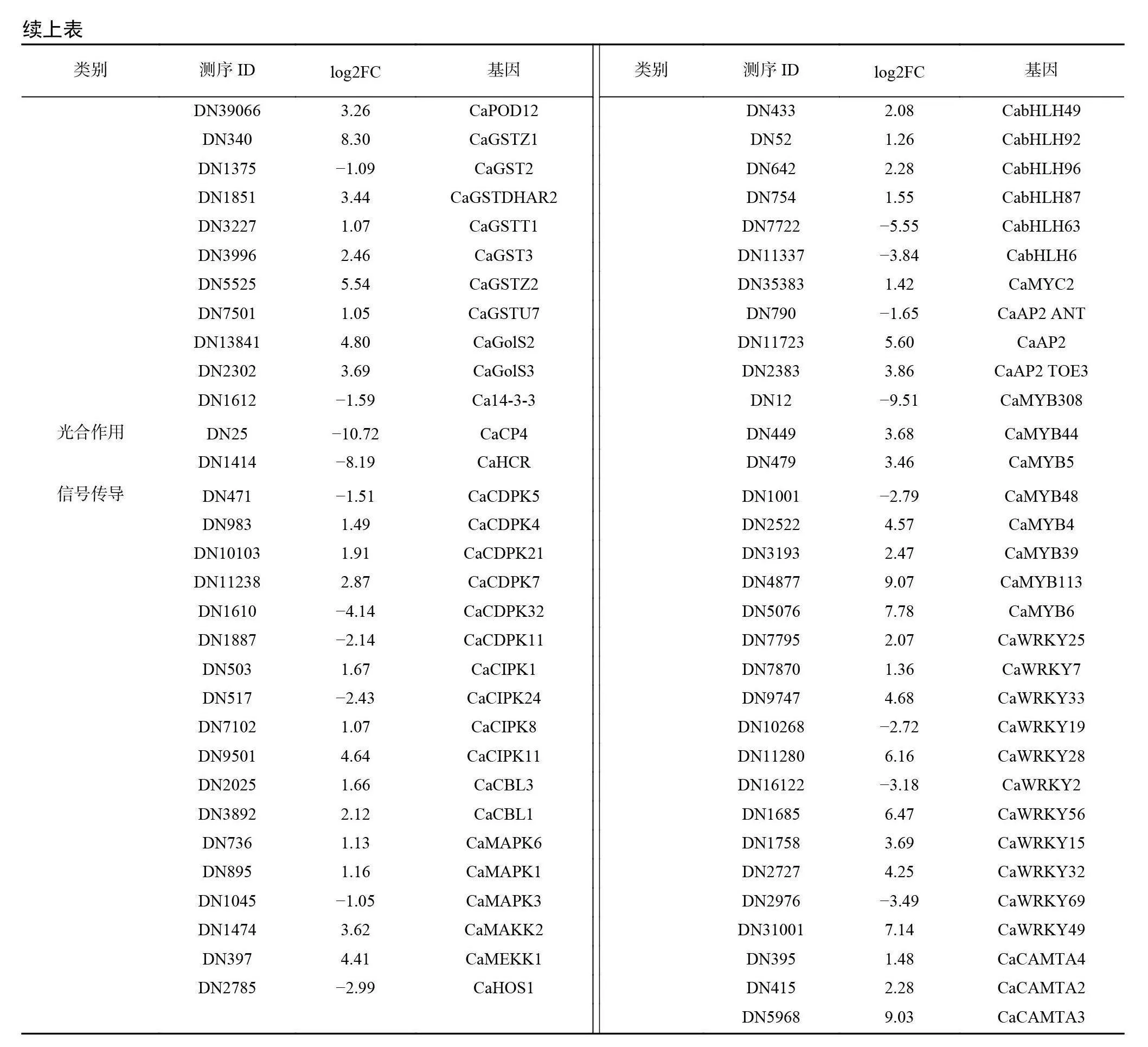
以 P<0.05、Qvalue≤0.05、|Log2FC|≥1为筛选条件,进一步对 ck 、cold 组间的 DEGs进行统计分析。结果显示,本次转录组测序 DEGs共有21862个,其中12156个 DEGs 上调(55.6%),9706个 DEGs 下调(44.4%)(图3)。从本次筛选出的 DEGs 中在蛋白/酶系统、光合作用、信号传导与转录因子等几个方面进一步筛选出低温胁迫相关基因(表4)。在酶相关 DEGs 中, SOD 差异表达基因CaSOD(ID :DN1491)、过氧化物酶(POD)基因(ID: DN338、DN39066、DN9372)、椒谷胱甘肽转移酶(GST)基因(ID: DN1851,ID : DN340、DN7501等)、肌醇半乳糖苷合成酶(GolS)(ID:DN13841、 DN2302)均呈现上调表达上调;在光合作用相关 DEGs 中,甜椒叶绿素 a/b 结合蛋白(CAB)4基因 CaCP4(ID :DN25)与7-羟甲基叶绿素 a 还原酶(HCR)基因CaHCR(ID : DN1414)呈现下调表达;信号传导相关 DEGs 中,钙依赖性蛋白激酶(CDPK)基因(ID :DN-10103、DN11238)、丝裂原活化蛋白激酶(MAPK)基因(ID:DN124、DN895、DN1474等)呈现上调表达;甜椒类钙调磷酸酶亚基 B 蛋白质(CBL)基因 CaCBL1(ID: DN3892)与 CaCBL3(ID : DN2025)上调;转录因子作为植物胁迫的主要调节因子也在本试验中筛选出大量 DEGs ,其中甜椒 AP2基因 CaAP2(ID:DN11723)等上调,而 CaAP2 ANT(ID: DN790)下调;甜椒 MYB 基因(ID : DN2522、DN1151等)上调;甜椒bHLH转录因子基因(ID: DN52、DN303、DN433等)上调;甜椒 WRKY 基因(ID :DN1758、DN7795等)上调;甜椒 CAMTA 转录因子全部基因(ID:DN415、 DN5968、DN395)上调。
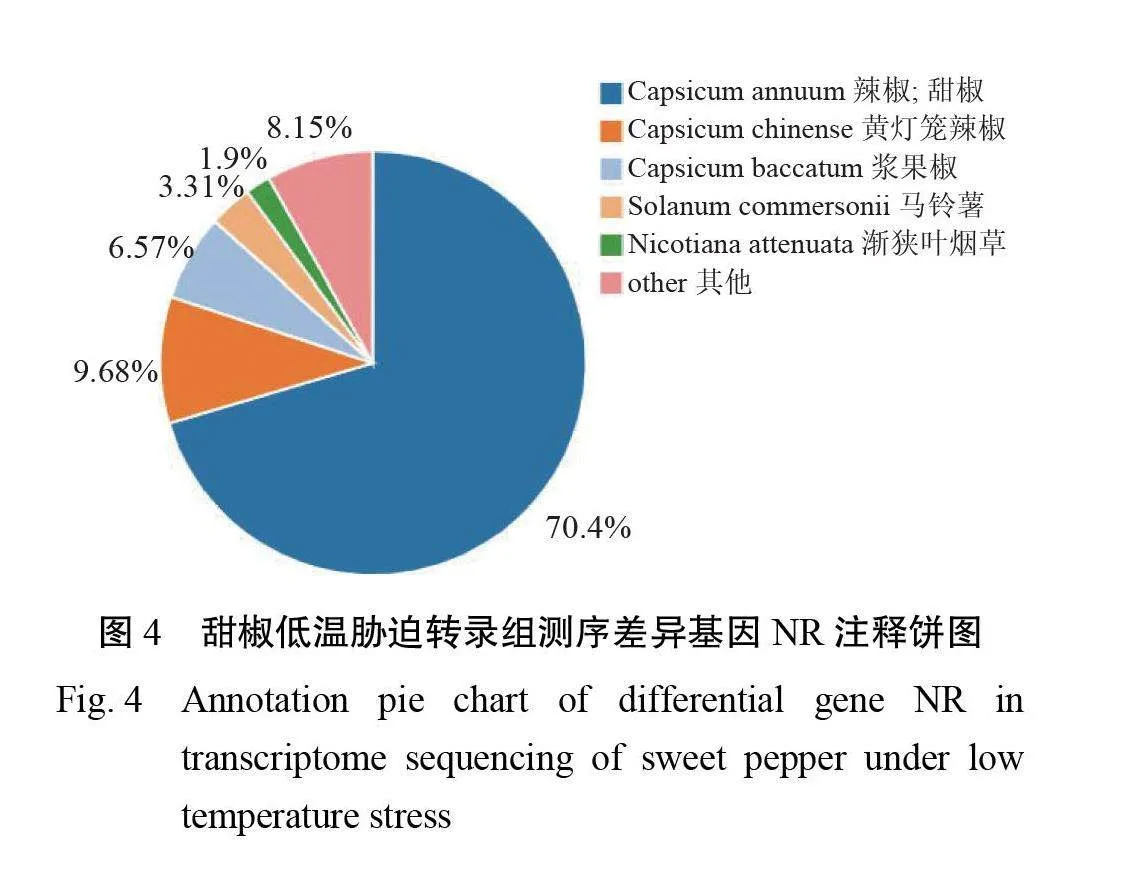
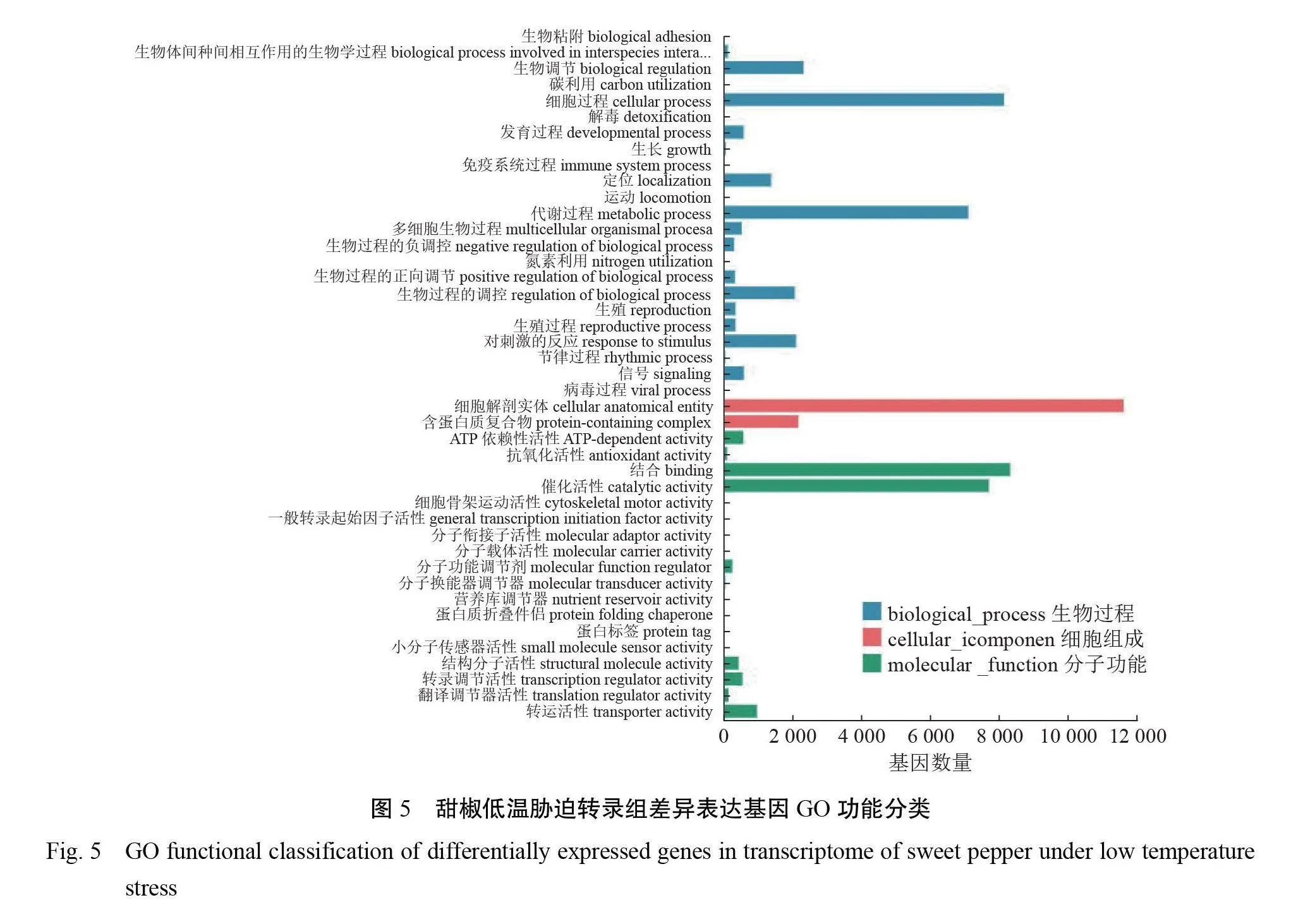
2.3.3低温胁迫下甜椒转录组差异基因 GO 、KEGG 富集分析将筛选出的Unigene进行 NR 注释,统计不同的物种比例。由图4可知,注释上共计70.40%的基因属于甜椒/辣椒(Capsicum annuum)。将在 NR 数据库上比对的Unigene结果注释到 GO 数据库3个方面:生物过程(Biological Process)、细胞组成(CellularComponent)、分子功能(Molecular Function)的分类图,见图5。其中,在生物过程中,细胞过程(cellular process)与代谢过程(metabolic process)这两个亚类占比最大;在细胞组成中,仅有细胞解剖实体(cellular anato- mical entity)与蛋白质复合物(protein-containingcomplex)这两个亚类;在分子功能中,结合(binding)与催化活性(catalytic activity)这两个亚类占比最大。对比 DEGs 与 KEGG 数据库,富集结果见图6。结果显示,本试验 DEGs 主要富集在碳代谢(Carbon metabolism)途径、植物激素信号转导(Plant hormone signal transduction)、氨基酸合成(Biosynthesis of amino acids)途径、辅助因子生物合成(Biosynthesis of cofactors)途径等。
2.3.4低温胁迫下甜椒转录组差异表达基因qRT- PCR 验证为了验证转录组数据的准确性,对20个低温相关 DEGs进行qRT-PCR 验证,结果表明这20个基因在甜椒叶片低温胁迫中的变化趋势与转录组的测序结果基本相符(图7)。
3结论与讨论
在甜椒生物酶系统中,SOD 及 POD 的 DEGs- CaSOD与CaPOD在低温胁迫时上调,与以往试验中水稻非生理胁迫[16]与甜椒低温胁迫[9]结果相符。这是因为植物在遇到低温时会引起其氧化应激产生过量的如 O2−、OH−等 ROS ,导致细胞损伤。而为防止其引起的氧化损伤,植物进化出了一些酶或者非酶的系统,其中就包括 SOD 及 POD 等[9]。当 O2−过量产生时, SOD 能将其转化为 H2O2, POD 能进一步的使其转化为水[17]。因此,本试验中上调表达的CaSOD与CaPOD证明了甜椒在低温胁迫时已启动相关保护机制。本研究中甜椒在低温环境下光合作用受到较大影响,而转录组结果也证实了这一点。甜椒叶绿素 a/b 结合蛋白(CAB)作为植物叶绿体中的重要组成成分之一,具有吸收光能并将其能量传递至光反应 I(PSI)与光反应 II(PSII)中等重要作用[18]。本次测序检测到甜椒中 CAB 的调控基因 CaCP4表达显著下调,与以往研究显示 CAB 在低温胁迫下调结果相似[19−20],说明甜椒叶片在低温胁迫时光合作用的光能吸收与传递受到影响。与此同时,植物进行光合作用时,叶绿素 a 能够吸收光能并将其转化成化学能,但是其本身不直接参与光合作用,需要被还原成一种更加活跃的酶,而 HCR 就是植物体内主要还原叶绿素 a 的酶[21]。作为光合作用中关键酶 HCR 的调控基因,CaHCR在本次测序结果中显著下调,说明甜椒叶片中光合反应中的电子传递链受阻,进而影响了光合作用中的化学反应。
甜椒在应对低温胁迫时,其对低温信号的传导也是胁迫应答的重要环节之一。此次转录组测序结果表明,甜椒低温胁迫时多数信号传导基因上调。其中,CDPK 与 CBL 作为钙结合蛋白,在植物低温胁迫下钙传递通路中发挥重要作用[22]。大米中 OsCDPK7过表达可提高其在低温等逆境下的抗性[23],这与本试验中 CaCDPK7上调结果相似,说明甜椒中 CDPK 对于传递低温信号有着重要的作用。除 CDPK 外,甜椒 CBL 调控基因 CaCBL1过表达。根据Conglin等[24]研究结果,CBL 相互作用蛋白激酶7(CIPK7)与 CBL1一同作用于低温信号传导,而 CBL1的功能缺失可导致植物对低温的敏感以及抗寒能力的降低。本次实验发现甜椒中 CaCBL1上调,说明低温胁迫时已启动相关抗寒基因。
转录因子(TF)是植物应对生物与非生物胁迫的重要调节因子[25]。在本试验中,甜椒转录因子bHLH、WRKY 与 CAMTA 等调控基因多数上调。其中,bHLH是 CBF1与 CBF2的调控因子,广泛存在于各种真核生物中[4, 24]。研究发现,bHLH-92、bHLH49与 AabHLH35在植物非生物胁迫中起到了重要作用[26]。这与本试验筛选出的 CabHLH-92、CabHLH35、CabHLH49等在低温环境中上调结果一致,证明了其在甜椒低温胁迫的作用。而 WRKY 作为绿色植物中常见的 TF ,常参与到植物的非生物胁迫中[4]。以往研究中, AtWRKY15、 WRKY25被证实在拟南芥非生物胁迫中作用显著[27−28],本研究中多数 WRKY 上调,与以往研究基本相似。除此之外,本试验还检测出CaCA- MTA2、CaCAMTA3与 CaCAMTA4这3个 CAMTA 转录因子基因在低温时过表达。在拟南芥中这3种 CAMTA 调控基因都对低温做出迅速反应, CAMTA3更是被证明能快速对 DREB1B 做出调控,而 DREB 也被认为是低温反应转录级联的第一步[29],由此可以看出 CAMTA 在植物尤其是甜椒低温胁迫反应中的重要性。
综上,本试验通过生理生化及转录组测序技术,比较分析甜椒幼苗在低温胁迫下的理化指标的变化及相关差异基因表达。理化试验从侧面证明了低温导致甜椒脂膜过氧化,活性氧含量增高,细胞膜受到损伤。转录组测序分析结果表明,低温促进了CaSOD的表达,消除了 ROS 等对细胞的毒性作用,提高了甜椒在低温环境下的适应性。转录组筛选出的光合作用关键基因 CaCP4与CaHCR显著下调,说明光合作用的下降可能是由于光能吸收与能量传递受阻。除上述差异基因外,转录组测序还发现甜椒在低温胁迫时其信号传导与转录因子中均存在大量差异性表达基因,且多数显著上调。本研究为甜椒低温胁迫下生理代谢及防御机制提供了更加全面的见解,为今后鉴定其低温胁迫过程中的关键基因和损伤机制提供理论基础。
参考文献:
[1]苗宇,赵尧尧,张丽佳,等.低温胁迫后紫花苜蓿叶片光合作用的恢复特性研究[J].中国农业科技导报,2024,26(2):80−89.
[2]李琬,项洪涛,何宁,等.初花期冷害对绿豆叶片生理的损伤及烯效唑的缓解效应[J].西北农业学报,2023,32(10):1566−1578.
[3]邱雨后,陈金玲,谢敏譞,等.碱胁迫对不同基因型培忠杉苗木生理生化特性的影响[J].中南林业科技大学学报,2024(1):97−108.
[4] KHAN S A ,LI M Z ,WANG S M , et al. Revisiting the Role of Plant Transcription Factors in the Battle against Abiotic Stress[J]. International journal of molecular sciences,2018,19(6):1634.
[5] Marín A ,Ferreres F ,Tomás-Barberán F A ,et al. CharacterizationandQuantitationofAntioxidantConstituentsofSweetPepper (Capsicum annuum L.)[J]. J Agric Food Chem ,2004,52:3861−3869.
[6]王洪涛,艾希珍,秦竞,等.几个甜椒砧木品种对低温弱光耐受性的差异[J].西北农业学报,2008(1):233−237.
[7]张天翔,曹明华,蔡坤秀,等.不同甜椒品种抗寒性研究初报[J].福建农业学报,2014,29(2):160−164.
[8] LI J ,YANG P ,KANG J ,et al. Transcriptome Analysis of Pepper (Capsicumannuum) RevealedaRoleof 24-EpibrassinolideinResponse to Chilling[J]. Frontiersin Plant Science ,2016,7:1281.
[9] SHINSY , PARKMH , CHOIJW , etal. Genenetwork underlying the response of harvested pepper to chilling stress[J]. Journal of Plant Physiology,2017,219:112−122.
[10] KONG X M ,ZHOU Q ,LUO F ,et al. Transcriptome analysis ofharvested bell peppers(Capsicum annuum L.) in response to coldstress[J]. PlantPhysiologyandBiochemistry ,2019,139:314−324.
[11]孟雅宁,严立斌,张红肖,等.低温弱光胁迫对甜椒幼苗生长及生理指标的影响[J].辣椒杂志,2019,17(1):22−25,30.
[12]刘凯歌,龚繁荣,宋云鹏,等.低温弱光对甜椒幼苗生长和生理生化的影响及其与品种耐性的关系[J].北方园艺,2020(3):8−14.
[13] SALEEM M H ,PARVEEN A ,PERVEEN S ,et al. AllewTTdjFuykmC/kXgwXLk00yWQiQZRBCBvUvKYaoATHQs=viation ofcadmium toxicity in pea (Pisum sativum L.) through Zn− Lyssupplementationanditseffectsongrowthandantioxidantdefense[J]. EnvironmentalScienceandPollutionResearch,2024,31:10594−10608.
[14] HOULDSWORTH A. Role of oxidative stress in neurodegenerativedisorders: A review of reactive oxygen species and prevention byantioxidants[J]. BrainCommunications ,2024,6(1): fcad356.
[15]莫亿伟,郭振飞,谢江辉.温度胁迫对柱花草叶绿素荧光参数和光合速率的影响[J].草业学报,2011,20(1):96−101.
[16]李德江,王薇,卢凤丹,等.盐胁迫对不同倍体水稻生理及抗氧化酶相关基因的影响[J/OL].吉林农业大学学报,1−13[2024-04-17]. http://kns.cnki.net/kcms/detail/22.1100.S.20220424.1137.005. html.
[17] GILLSS, TUTEJAN. Reactiveoxygenspeciesandantioxidant machineryinabioticstresstoleranceincropplants[J]. Plant PhysiolBiochem,2010,48:909−930.
[18] WEI X , SU X , CAO P , et al. Structure of spinach photosystemII–LHCIIsupercomplexat 3.2 Å resolution[J]. Nature ,2016,534(7605):69−74.
[19] XUE T ,WAN H ,CHEN J ,et al. Genome-wide identification and expression analysis of the chlorophyll a/b binding protein gene family in oilseed(Brassica napus L.) under salt stress conditions[J]. Plant Stress,2024,11:100339.
[20] LIXW , ZHUYL , CHENCY , etal.Cloningand characterizationof twochlorophyll A/B binding proteingenesand analysis of their genefamily inCamelliasinensis[J]. Scientific Reports,2020,10(1):4602.
[21] WANG X ,LIU L. Crystal structure and catalytic mechanism of 7- hydroxymethyl chlorophyll a reductase[J]. Journal of Biological Chemistry,2016,291(25):13349−13359.
[22] RENL , SUNJ , CHENS , etal. Atranscriptomicanalysisof Chrysanthemum nankingense provides insights into the basis of low temperature tolerance[J]. BMC Genomics,2014,15(1):844.
[23] GAO H ,ZHU L ,LIU T ,et al. Identification of a Novel OsCYP2 AllelethatWasInvolvedinRiceResponsetoLowTemperature Stress[J]. Phyton(0031−9457),2023,92(6):1743.
[24] FRANZ S E B , LIESE A , KURTH J , et al. Calcium-dependent proteinkinaseCPK21 functionsinabioticstressresponsein Arabidopsis thaliana[J]. Mol Plant,2011,4:83−96.
[25] RITONGA F N ,NGATIA J N ,WANG Y , et al. AP2/ERF , animportant cold stress-related transcription factor family in plants:Areview[J]. Physiologyand Molecular Biology of Plants ,2021,27(9):1953−1968.
[26] GHORBANIM , KAHRIZID , CHAGHAKABOODIZ , etal. EvaluationoftheexpressionofinducedgenesinresponsetodehydrationstressofCamelina (Camelinasativa)calli: dehydration stress genes in Camelina[J]. Cellular and MolecularBiology,2023,68(12):1−4.
[27] LIS , FUQ , CHENL , etal. ArabidopsisthalianaWRKY25, WRKY26, andWRKY33coordinateinductionofplantthermotolerance[J]. Planta,2011,233(6):1237−1252.
[28] VANDERAUWERA S ,VANDENBROUCKE K , INZé A , et al. AtWRKY15 perturbation abolishes the mitochondrial stress responsethat steers osmotic stress tolerance in Arabidopsis[J]. ProceedingsoftheNationalAcademyofSciences ,2012,109(49):20113−20118.
[29] KIDOKOROS , YONEDAK , TAKASAKIH , etal. DifferentCold-SignalingPathwaysFunctionintheResponsestoRapidandGradualDecreasesinTemperature[J]. ThePlantCell ,2017,29(4):760−774.
(责任编辑:柯文辉)

