基于SSR荧光标记的121份野生枸杞种质遗传结构解析
戴国礼 刘娜 秦垦 张波 尹跃 米佳 何昕孺

收稿日期:2023-05-22
基金项目:国家自然科学基金项目(32060360);宁夏重点研发计划项目(2020BBF02006;2021BEF02005)
作者简介:戴国礼(1984-),男,青海格尔木人,副研究员,主要从事林木遗传育种研究,(电话)13995203004(电子信箱)dgl2006swfc@163.com;通信作者,何昕孺(1988-),女,宁夏盐池人,助理研究员,主要从事枸杞育种与栽培研究,(电子信箱)hhexinru@163.com。
摘要:以采集的121份野生枸杞(Lycium barbarum L.)种质为材料,用9对SSR引物进行扩增,采用GeneALEX、Power Marker软件进行多态性分析,利用NTSYS、STRUC-TURE软件进行遗传多样性分析、聚类分析和主成分分析。结果表明,9对SSR引物共检测到108个等位基因,等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、多态信息含量(PIC)、Shannons信息指数分别为12个、4.620个、0.678、0.651、0.629、1.568;聚类结果显示121份野生枸杞种质可划分为5个亚群,群体遗传结构表明当K=5时,121个种质划分为5个亚群,来自宁夏的NXGY-02、NXGY-03 2个种质与来自内蒙古的6个种质之间的遗传距离最远,亲缘关系较远,来自青海省、新疆、甘肃省及内蒙古的其余野生枸杞种质之间存在广泛的基因交流现象;宁夏、内蒙古的野生枸杞种质具有独立起源进化的可能,而新疆、甘肃省、青海省的种质与宁夏种质亲缘关系较近,很可能属于同一起源。
关键词:野生枸杞(Lycium barbarum L.);种质;SSR荧光标记;遗传结构
中图分类号:S326 文献标识码:A
文章编号:0439-8114(2024)05-0207-08
DOI:10.14088/j.cnki.issn0439-8114.2024.05.036 开放科学(资源服务)标识码(OSID):
Genetic structure analysis of 121 wild goji berry germplasms based on
SSR fluorescence markers
DAI Guo-li,LIU Na,QIN Ken,ZHANG Bo , YIN Yue, MI Ja, HE Xin-ru
(Institute of Goji Berry Science, Ningxia Academy of Agriculture and Forestry Sciences, Yinchuan 740002,China)
Abstract: 121 wild goji berry(Lycium barbarum L.) germplasms were collected as materials, 9 pairs of SSR primers were used of amplification, and polymorphism was analyzed using GeneALEX and Power Marker software. Genetic diversity analysis, cluster analysis, and principal component analysis were performed using NTSYS and STRUC-TURE software.The results showed that a total of 108 alleles were detected using 9 pairs of SSR primers. The number of alleles (Na), effective alleles (Ne), observed heterozygosity (Ho), expected heterozygosity (He), polymorphic information content (PIC), and Shannons information index were 12, 4.620, 0.678, 0.651, 0.629, and 1.568, respectively;the clustering results showed that 121 wild goji berry germplasms could be divided into 5 subgroups. The genetic structure of the population showed that when K=5, 121 germplasms could be divided into 5 subgroups. The genetic distance between NXGY-02 and NXGY-03 germplasms from Ningxia and 6 germplasms from Inner Mongolia was the farthest, and the genetic relationship was relatively distant,there was extensive gene exchange among other wild goji berry germplasms from Qinghai Province, Xinjiang, Gansu Province, and Inner Mongolia;the wild goji berry germplasms in Ningxia and Inner Mongolia had the possibility of independent origin and evolution, while the germplasms in Xinjiang, Gansu, and Qinghai provinces were closely related to the germplasms in Ningxia and were likely to belong to the same origin.
Key words: wild goji berrie (Lycium barbarum L.); germplasms; SSR fluorescence markers; genetic structure
戴国礼,刘 娜,秦 垦,等. 基于SSR荧光标记的121份野生枸杞种质遗传结构解析[J]. 湖北农业科学,2024,63(5):207-214.
枸杞(Lycium barbarum L.)是茄科(Solanceae)枸杞属(Lycium)的落叶乔木,广泛分布于宁夏、甘肃省、青海省、内蒙古及新疆等地,枸杞的果实、叶和根可作为药用及食用,是一种具有很高经济价值和药用价值的植物[1-3]。枸杞具有防风固沙、开发盐碱地的功能,因此枸杞也具有很高的生态价值[4-6]。种质资源不仅是育种的前提,更是种质创新的物质基础,经过长时间的自然选择,野生种质资源发生丰富的遗传变异,因此,开展枸杞野生种质资源遗传多样性研究不仅有助于了解枸杞的遗传多样性水平、遗传结构及亲缘关系,还对保护和利用野生种质资源具有重要意义,同时可为后续枸杞的育种工作提供科学的理论基础[7, 8]。
目前,常用的分子标记方法有简单重复序列标记(Simple sequnece repeats,SSR)[9]、简单序列间重复(Intra-Simple sequnece repeats,ISSR)[10]、限制性片段长度多态性标记(Restriction fragment length polymorphism,RFLP)[11]及扩增片段长度多态性(Amplified fragment length polymorphism,AFLP)[12]等方法。其中SSR标记具有多态性高、位点丰富、重复性好、操作简便及不受环境条件影响等优点[13-15]。随着分子标记技术的快速发展,SSR分子标记技术已经成为一项重要的研究技术,并且广泛应用于遗传多样性[16]、遗传结构[17]、指纹图谱构建[18]、基因型研究[19]及亲缘关系鉴定[20]等方面。
石志刚等[21]利用nrDNA ITS序列对18份宁夏枸杞资源开展了遗传多样性研究;李彦龙等[22]利用AFLP分子标记技术对15份枸杞种质进行亲缘关系分析及聚类分析;安魏等[23]利用SRAP分子标记技术对29份枸杞种质材料进行亲缘关系研究和聚类分析;鲍红春等[16]利用ISSR分析标记技术对10份枸杞种质材料进行遗传多样性分析。近年来,枸杞遗传多样性的研究中种质数量均较少,多为栽培品种,且种质分布范围较集中。本研究中采用SSR分子标记对来自5个省份共121份野生枸杞种质资源进行相关研究,旨在探究其遗传多样性、遗传结构及亲缘关系,为后续的核心种质构建及分子辅助育种工作等提供科学依据。
1 材料与方法
1.1 试验材料
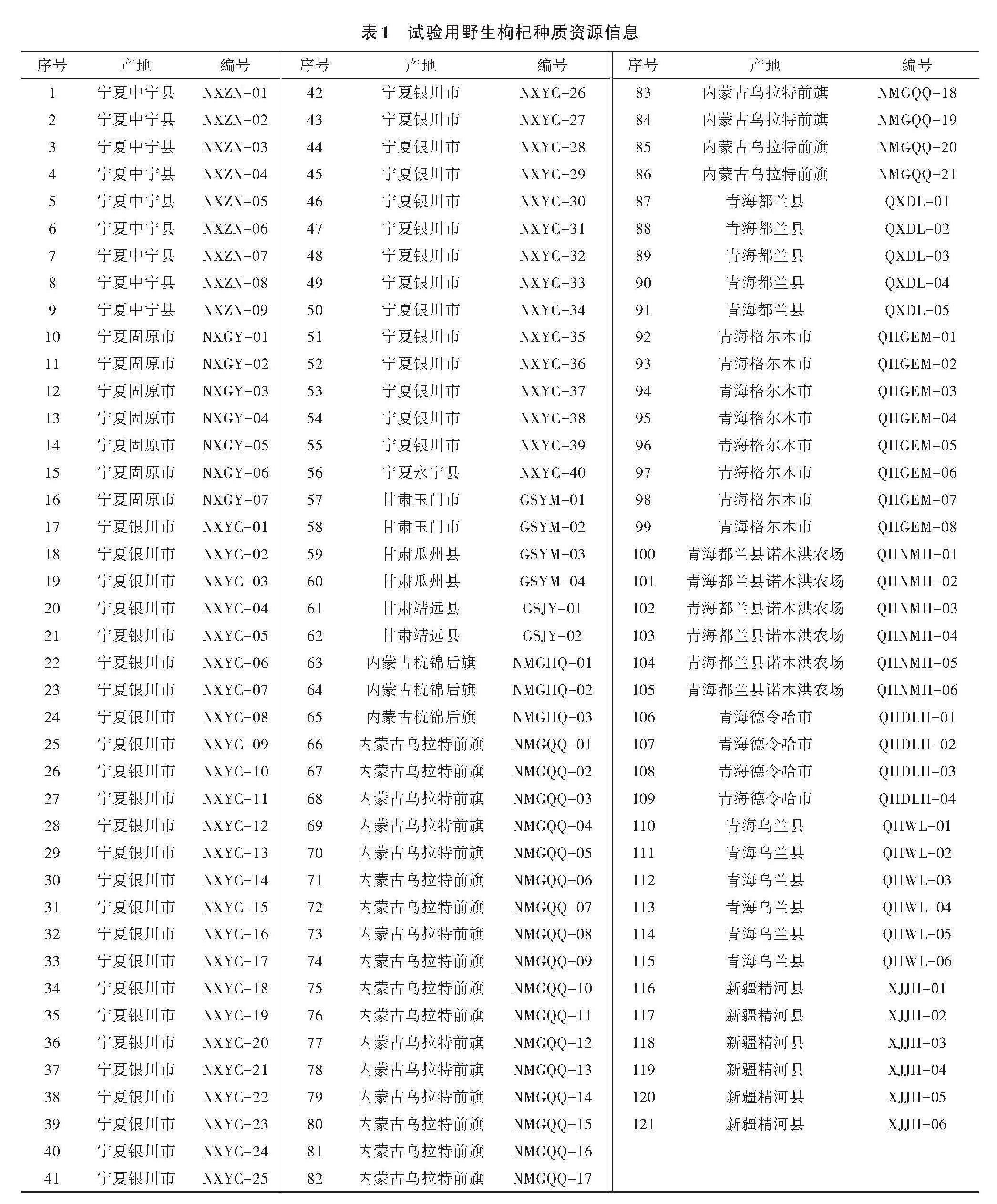
本试验共收集野生枸杞种质材料121份,其中56份材料来自宁夏,29份材料来自青海省,24份材料来自内蒙古,6份材料来自甘肃省,6份材料来自新疆。每个种质采集无病虫害的新鲜嫰叶5~10片,放入写有编号的管中并保存于液氮中,转运至实验室后放置于-80 ℃的冰箱中保存,用于DNA的提取。具体种质编号及分布见表1。
1.2 研究方法
1.2.1 基因组DNA提取 采用高效植物基因组DNA提取试剂盒[DP305,天根生化科技(北京)有限公司]从野生枸杞叶片中提取基因组DNA,用1%琼脂糖凝胶电泳检测DNA完整性,Nanodrop 2000型紫外分光光度计[赛默飞世尔科技(中国)有限公司]检测DNA浓度,用1%琼脂糖凝胶电泳检测DNA质量,将DNA质量浓度稀释至50 ng/μL,置于-20 ℃的冰箱中保存,用于后续PCR试验。
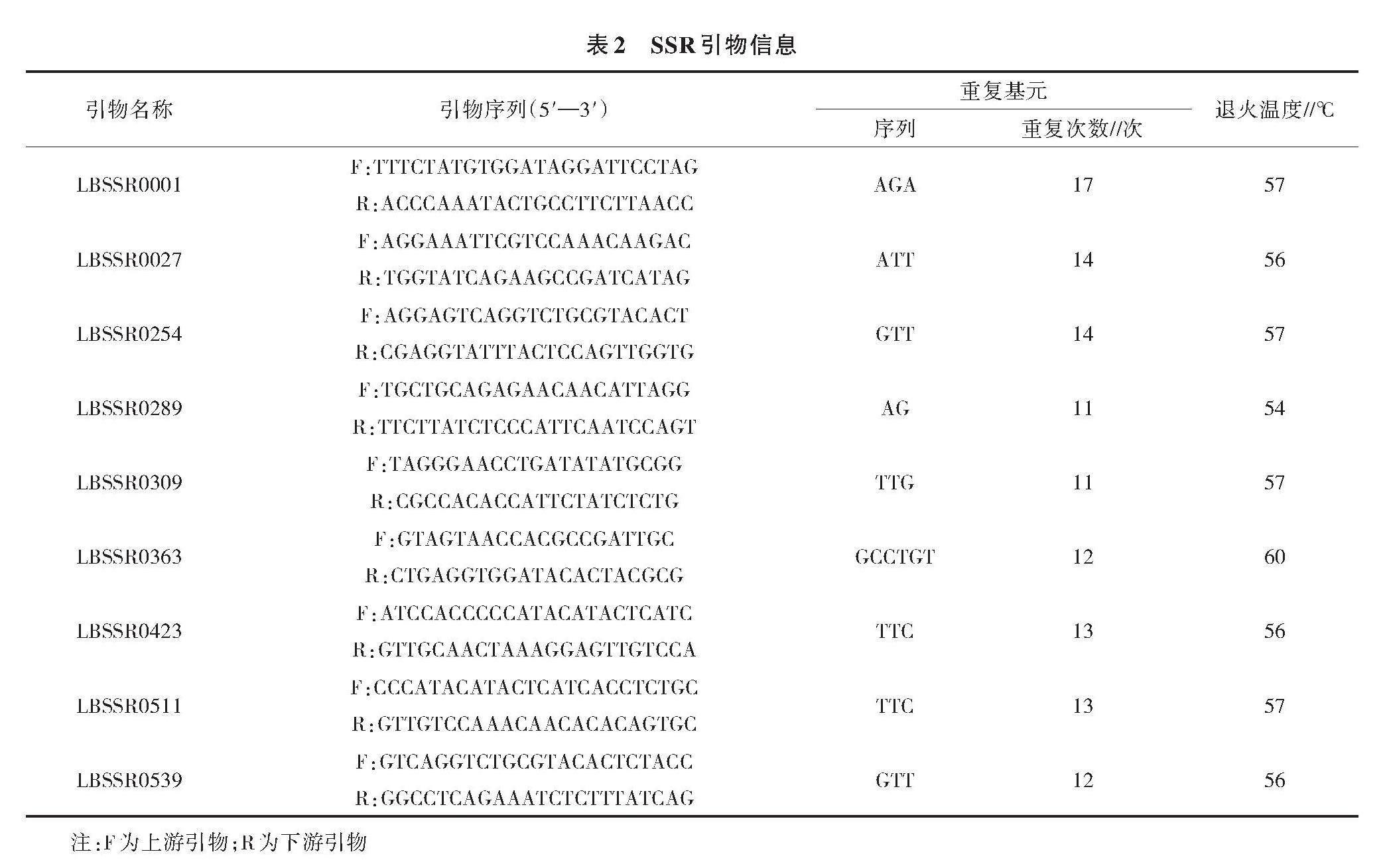
1.2.2 SSR引物及PCR扩增 采用尹跃等[24]开发设计的9对高多态性SSR引物(表2),在上游引物5′端添加18 bp的M13通用引物序列(TGTAAAACGACGGCCAGT),3′端保持不变,FAM和HEX 2种荧光基团修饰通用引物,所有引物均由英潍捷基贸易有限公司合成。
PCR扩增体系(10 μL):50 ng/μL DNA模板 1 μL,10×Buffer 1.5 μL,10 μmol/L dNTP 1.2 μL, 5 μmol/L上游引物0.1 μL,5 μmol/L下游引物0.4 μL,5 μmol/L M13荧光引物0.4 μL,Taq DNA聚合酶(5 U/μL)0.1 μL,去离子水5.3 μL。
PCR反应在Gene Amp PCR System 9600(Perkin Elmer,USA)仪上进行,扩增程序:95 ℃ 5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,25个循环;95℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,10个循环;最后60 ℃ 30 min。扩增产物经过ABI3730XL DNA(Applied Biosystems,USA)检测,采用LIZ-500作为分子量内标。
1.3 数据统计与分析
用Gene Mapper 4.0软件对ABI3730XL收集的原始数据进行分析,获得不同样品扩增片段的长度;采用Data Formatter软件将扩增片段转化为Power Marker V3.25、NTSYS-pc 2.20和STRUC-TURE 2.3.4输入格式。由Power Marker 3.25计算等位基因数(Number of alleles,Na)、观察杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)、多态信息含量(Polymorphism information content,PIC)等遗传多样性参数。用NTSYS-pc 2.20软件计算种质间的遗传距离,采用UPGMA法进行聚类分析,绘制系统聚类树。用STRUC-TURE 2.3.4软件对野生枸杞种质进行群体结构分析,设置群组数(K)为1~10,每个参数运行10次,每次运行的Buru-intime设置为10 000,重复次数为10 000。用STRUC-TURE HRVESTER在线软件对群体种质资源遗传结构进行可视化分析,用个体归属各组群的比例与群组数(K)来研究供试野生枸杞种质间是否存在基因交流。
2 结果与分析
2.1 SSR标记多态性分析
利用9对SSR标记在121个种质中共检测到108个等位基因,每个标记所检测到的等位基因数(Na)为2~23个,平均每个标记检测到等位基因数为12个,其中标记LBSSR0363检测到的等位基因数最多,高达23个,标记LBSSR0027检测到的等位基因数最少,仅有2个(表3);有效等位基因数(Ne)的变化范围为1.008~9.065个,平均每个标记检测到的有效等位基因数为4.620个;Shannons信息指数的变化范围在0.027~2.496,其中标记LBSSR0363的Shannons信息指数最高,为2.496,标记LBSSR0027的Shannons信息指数最低,为0.027;9对SSR标记的观测杂合度(Ho)的变化范围在0.008~0.967,平均值为0.678;9对SSR引物的期望杂合度(He)的变化范围在0.008~0.890,平均值为0.651;F检验值的变化范围在-0.245~0.785,平均值为0.022;基因多样性(GD)的变化范围在0~0.890,平均值为0.650;多态性信息含量(PIC)的变化范围在0~0.880,平均值为0.629,9对SSR引物中,SSR标记LBSSR0001、LBSSR0254、LBSSR0289、LBSSR0309、LBSSR0363、LBSSR0423及LBSSR0511的多态性较高,标记LBSSR0027的多态性较低,标记LBSSR0539的多态性适中(0.250 2.2 主成分分析 为进一步了解121份野生枸杞种质的遗传进化过程及其相似性程度,利用GeneALEX 6.51b2软件计算各群体间的Neis遗传距离,基于计算得到的遗传距离利用R语言中ade4包进行主成分分析。主成分分析结果(图1)表明,第一主成分占121份野生枸杞种质总遗传变异的22.81%,第二主成分占总遗传变异的16.40%,第三主成分占总遗传变异的10.33%,3个主成分的特征值为49.54%。主成分坐标图中各群体的样点位置和距离表示各种质间亲缘关系的远近,121份野生枸杞种质组成的5个群组分布相对较集中,说明参试野生枸杞种质总体的亲缘关系较近。群组A与其他群组种质间均存在一定的亲缘关系,群组A与群组B、D、E之间的亲缘关系较近,群组C与群组A可明显地区分为2个来源较远的群组。 2.3 聚类分析 通过 NTSYS软件中Find相似系数计算程序,得到121份野生枸杞种质间遗传相似系数,为0.734~1.000,平均遗传相似系数为0.847。基于遗传相似距离矩阵,运用非加权平均法(UPGMA)得出种质间的聚类树(图2)。聚类结果表明,121份野生枸杞种质可划分为5个亚群。第一亚群仅包含来自宁夏的NXGY-02、NXGY-03 2个种质,说明这2个种质与其他种质之间的亲缘关系较远。第二亚群共包含16个种质,其中宁夏的种质4个,内蒙古的种质9个,青海省的种质1个,新疆的种质2个。第三亚群共包含8个种质,其中宁夏的种质5个,内蒙古的种质3个。第四亚群共包含89个种质,第四亚群又可划分为2个小的组群,第一组群包含31个种质,其中第一分支包含来自宁夏的16个种质,第二分支包含15个种质,包含宁夏的6个种质,甘肃省的1个种质,青海省的8个种质;第二组群包含58个种质,其中23个种质来自宁夏,20个种质来自青海省,5个种质来自甘肃省,6个种质来自内蒙古、4个种质来自新疆。第五亚群仅包含来自内蒙古的6个种质。由以上结果可知,来自宁夏的NXGY-02、NXGY-03 2个种质与来自内蒙古的6个种质之间的遗传距离最远,亲缘关系较远;来自青海省、新疆、甘肃省及内蒙古的其余种质之间存在广泛的基因交流现象。 2.4 群体遗传结构分析 对121个野生枸杞种质进行群体遗传结构分析,结果(图3)显示,在K=3时,似然值最大,说明可将121个野生枸杞种质分为3个群组(图4),结合实际采样情况及聚类分析结果,采用K= 5时的遗传结构进行分析。当K=5时,将121个种质划分为5个亚群(图5、表4)。121个种质中分布于第三亚群的数量最多,共包含43个种质,36个种质分布于第二亚群,17个种质分布于第四亚群,16个种质分布于第一亚群,分布于第五亚群的种质数量最少,仅有9个种质。来自宁夏的56个种质分布于5个亚群,其中分布于第二亚群的种质数量最多,有26个种质,分布于第一亚群的种质数量最少,仅有4个种质,共有3个种质分布于第四亚群,9个种质分布于第五亚群,14个种质分布于第三亚群。来自甘肃省的6个种质中,仅有1个种质分布于第二亚群,其余5个种质分布于第三亚群。来自内蒙古的24个种质中,10个种质分布于第一亚群,3个种质分布于第三亚群,其余11个种质分布于第四亚群。来自青海省的29个种质中,8个种质分布于第二亚群,18个种质分布于第三亚群,3个种质分布第四亚群。来自新疆的6个种质中,2个种质分布于第一亚群,1个种质分布于第二亚群,3个种质分布于第三亚群。 3 小结与讨论 目前,SSR分子标记技术已成为科研学者开展遗传多样性相关研究的常用方法,已在枫香古树[25]、板栗[26]、绿豆[27]和江南牡丹[28]中进行了遗传多样性研究。许多学者针对枸杞开展了遗传多样性研究,胡永超等[29]利用SSR分子标记技术对43份枸杞样本进行遗传多样性研究,有效等位基因数平均值为2.018个,期望杂合度平均值为0.398,Shannons指数平均值为0.839;秦英之等[30]基于全长转录组开发了SSR标记,并对28个枸杞种质进行了遗传多样性分析,23对引物共扩增得到240个等位基因,每个位点的等位基因数为4~17个,Shannons信息指数为1.177~2.487,期望杂合度和观测杂合度分别为0.635~0.909和0.250~0.964,PIC为0.580~0.902;王红梅等[31]对22份西北荒漠野生黑果枸杞样本进行遗传多样性研究,发现平均有效等位基因数为1.331 4个,多样性指数为0.210 6,Shannons信息指数为0.338 4;黄兴发等[32]利用10对多态性引物对48份枸杞样本进行遗传多样性研究,共检测到186个等位基因,平均为19个;观察杂合度为0.615,期望杂合度为0.834,多态信息含量平均值为0.817。本研究中广泛收集分布于宁夏、甘肃省、青海省、新疆及内蒙古的野生枸杞样本121份,并利用9对SSR引物对收集的材料进行遗传多样性分析,共检测到等位基因108个,平均每个标记检测到的等位基因数为12个,平均有效等位基因数为4.620个,Shannons信息指数平均值为1.568,观测杂合度平均值为0.678,期望杂合度平均值为0.651,多态信息含量平均值为0.629。本研究的遗传多样性结果明显高于胡永超等[29]、王红梅等[31]的研究结果,黄兴发等[32]的研究结果中期望杂合度和多态性信息含量均高于本研究,但观测杂合度低于本研究。由此可见,本研究中的9对SSR分子标记能够反映出枸杞的遗传多样性。 遗传距离聚类法与群体遗传结构分析法是2种不同运算模式的聚类方式,遗传距离聚类法依据遗传距离或遗传相似性,而群体遗传结构分析法可将划分不明的群体(单株)归类到相应的群体中,聚类更明确,结合遗传距离聚类法与群体遗传结构分析法能更准确地确定种质间的亲缘关系[33]。本研究利用2种分析方法得到类似的聚类结果,即总体上,在遗传距离聚类法中按照地理距离将121份种质聚为5类,结果表明地理距离较近的群体基本聚在一起;在遗传结构的分析中,出现了聚类与地理种源不完全一致的现象,所以选择K=5,将121个材料分为5个亚群更为合适,尽管各群体的遗传组成是非均质的,但各群体间的遗传混合程度较低,说明地理和环境因子相较于地理距离对于枸杞群体间的遗传分化有更大的作用,群体之间的遗传混合通常与群体的地理分布相关。 枸杞种质资源具有丰富的遗传多样性,为其遗传改良和种质创新提供了广泛的遗传基础;其遗传变异主要来源于群体内的个体,应根据其遗传结构特征,在选择遗传多样性高的群体基础上,重点考虑群体内优良单株的选择;在核心种质及育种群体构建时,建议在表型选择的基础上,将种质资源的遗传结构特征及亲缘关系作为理论参考。 参考文献: [1] 张 欣,王 鑫,刘辉鹏,等.宁夏枸杞雄性不育品系和可育品系工厂化快繁体系的建立[J/OL].分子植物育种,2022.https://kns.cnki.net/kcms2/article/abstract?v=M7N75Hb03FX6fvGCfBn4Uer5v 3RLUDId7BEkT3bJ5OVaXfyx_fjowXkGJvHsBWfwmNwA16JGL8z AVy4BIa3fXka1GzZ4nlenlwu5qMPjgT9r_BDGQPqHcGvUDFrzNtmqJ7yvieQ3lWI=&uniplatform=NZKPT&language=CHS. [2] 肖 佳,高 昊,周正群,等.枸杞属中枸杞红素类成分研究进展[J].科学通报,2017,62(16):1691-1698. [3] 张 兴,冯嘉馨,陈 佳,等.雄性不育枸杞花药比较转录组分析[J].基因组学与应用生物学,2022,41(6):1274-1285. [4] 陈艳瑞,尹林克.人工防风固沙林演替中群落组成和优势种群生态位变化特[J].植物生态学报,2008(5):1126-1133. [5] 袁惠君,刘 轲,王春梅,等.两个宁夏枸杞品种的耐渗透胁迫和耐盐特征比较[J].草业科学,2016,33(4):681-690. [6] FAKHFAKH J,ATHMOUNI K,MALLEK-FAKHFAKH H, et al. Polysaccharide from Lycium barbarum: Structural features, in vitro antioxidant activities and protective effect against oxidative damage in human erythrocytes[J].Chemistry and biodiversity,2020,17(12):e2000614. [7] 裴红霞,高晶霞,王学梅.220个辣椒种质形态学性状的遗传多样性分析[J].分子植物育种,2022,20(4):1331-1347. [8] 尹莉岚,姚方杰,石晨阳,等.基于SSR标记的野生黑木耳种质资源遗传多样性研究[J].食用菌学报, 2022, 29(4):1-9. [9] HAMADA H, PETRINO M G, KAKUNAGA T.A novel repeated element with Z-DNA-forming potential is widely found in evolutionarily diverse eukaryotic genomes[J].Proceedings of the national academy of sciences,1982,79(21):6465-6469. [10] ZIETKIEWICZ E, RAFALSKI A, LABUDA D.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183. [11] BOTSTEIN D, WHITE R L, SKOLNICK M, et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].American journal of human genetics,1980, 32(3):314. [12] VOS P, HOGERS R, BLEEKER M, et al.AFLP: A new technique for DNA fingerprinting[J]. Nucleic acids research, 1995, 23(21): 4407-4414. [13] 蔡海滨,韩光煜,涂 敏,等.基于SSR荧光标记的江苏省杂草稻群体遗传多样性分析[J].分子植物育种,2022,20(21):7104-7115. [14] GUR-ARIE R, COHEN C J, EITAN Y,et al.Simple sequence repeats in Escherichia coli:Abundance, distribution, composition, and polymorphism[J].Genome research,2000,10(1):62-71. [15] MCCOUCH S R,CHEN X,PANAUD O, et al. Microsatellite marker development, mapping and applications in rice genetics and breeding[J].Plant molecular biology,1997,35:89-99. [16] 鲍红春,李小雷,王建平,等.枸杞遗传多样性的ISSR分析[J].华北农学报,2014,29(1):89-92. [17] FALAHATI-ANBARAN M,HABASHI A,ESFAHANY M, et al. Population genetic structure based on SSR markers in alfalfa (Medicago sativa L.) from various regions contiguous to the centres of origin of the species[J]. Journal of genetics,2007,86(1):59. [18] 梁 燕,韩传明,周继磊,等.山东核桃良种SSR指纹图谱及分子身份证的构建——基于毛细管电泳分析[J].中国农学通报,2022,38(15):113-121. [19] 石纹豪,黄振霖,杨水英,等.重庆马铃薯致病疫霉(Phytophthora infestans)的SSR基因型分析[J].西南大学学报(自然科学版),2014, 36(12):36-41. [20] CHIOU C Y, SHIH H C, TSAI C C, et al.The genetic relationships of Indian jujube (Ziziphus mauritiana Lam.) cultivars using SSR markers[J].Heliyon,2020,6(10):e05078. [21] 石志刚,安 巍,焦恩宁,等.基于nrDNA ITS序列的18个宁夏枸杞资源的遗传多样性[J].安徽农业科学,2008,(24):10379-10380. [22] 李彦龙,樊云芳,戴国礼,等.枸杞种质遗传多样性的AFLP分析[J].中草药,2011,42(4):770-773. [23] 安 巍,王亚军,尹 跃,等.枸杞种质资源的SRAP分析[J].浙江农业学报,2013,25(6):1234-1237. [24] 尹 跃,安 巍,赵建华,等.枸杞品种SSR荧光指纹图谱构建及遗传关系分析[J].西北林学院学报,2017,32(1):137-141. [25] 仲小茹,柯 叮,黄献峰,等.基于SSR标记的江西省枫香古树遗传多样性评价[J].植物遗传资源学报,2023,24(2):523-531. [26] 聂兴华,李伊然, 田寿乐,等.中国板栗品种(系)DNA指纹图谱构建及其遗传多样性分析[J].园艺学报,2022,49(11):2313-2324. [27] 张雨朋,丁冬会,李蒙鑫, 等.河南地方绿豆种质资源遗传多样性的SSR分析[J/OL].分子植物育种,2022.https://kns.cnki.net/kcms2/article/abstract?v=M7N75Hb03FWQfkOzfXDl0o_mILbmC 8zM25JjcGkBBB_3poIuoFBJVQ68elZjwlH4AZvYpMqM1I-oNfug 9QV9VfNKxf3mX9XeIgJUBgTxF4zSp9OrGLHZS-Hm-1iJGoIiwG Nd-9U2QpE=&uniplatform=NZKPT&language=CHS. [28] 张旻桓,姚奕平,黄 宇,等.基于SSR标记的江南牡丹品种群遗传多样性及亲缘关系[J].中南林业科技大学学报,2023, 43(1):164-172. [29] 胡永超,马 洁,唐建宁,等.不同树龄枸杞古树的遗传多样性研究[J].植物遗传资源学报,2022,23(3):755-67. [30] 秦英之,车佳航,尹 跃,等.基于全长转录组信息的枸杞SSR标记开发[J].植物遗传资源学报,2022,23(6):1816-1827. [31] 王红梅,陈玉梁,马彦军,等.西北荒漠区野生黑果枸杞种质资源遗传多样性分析[J].中国野生植物资源, 2020,39(11):27-33,38. [32] 黄兴发,尹 跃,赵建华,等.黑果枸杞基因组SSR标记开发及遗传多样性分析[J].西北农林科技大学学报(自然科学版),2021,49(1):126-135. [33] 卢俊浩,张 婷,张 鹏,等.基于SSR标记的花菜类作物遗传多样性及群体结构分析[J].西南农业学报,2022,35(8):1887-1894.

