苦黄注射液序贯苦黄颗粒治疗药物性肝损伤的疗效及安全性研究:一项非劣效性随机对照试验
张家腾 孔明 陈煜 段钟平

【摘要】 背景 药物性肝损伤是仅次于病毒性肝炎和脂肪性肝病的第3大肝脏疾病,及时诊断并给予有效治疗是阻断疾病进展、提高治愈率的关键。苦黄制剂已被广泛应用于治疗各种原因导致的急慢性肝炎,尤其是伴有黄疸的患者,其临床疗效及安全性确切。但是,尚缺乏对急性药物性肝损伤患者保肝退黄疗效和安全性的循证医学证据。目的 评价苦黄注射液序贯苦黄颗粒治疗药物性肝损伤的疗效及安全性。方法 采用随机、阳性对照、非劣效性试验设计,选择2021年11月—2023年9月在首都医科大学附属北京佑安医院诊断为急性药物性肝损伤患者93例,采用单中心随机化的方法,将患者随机分配到试验组(49例)和对照组(44例)。在常规保肝治疗4周的基础上,试验组和对照组分别应用苦黄注射液/注射用丁二磺酸腺苷蛋氨酸治疗2周,再改用苦黄颗粒/丁二磺酸腺苷蛋氨酸肠溶片治疗2周。比较两组患者入组时、治疗2周、治疗4周的退黄有效率、主要肝功能指标[丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转移酶(GGT)、总胆红素(TBIL)、总胆汁酸(TBA)]水平变化及其复常率。结果 治疗期间共脱落4例患者,其中试验组3例,对照组1例。两组治疗2、4周后退黄有效率比较,差异均无统计学意义(P>0.05)。两组治疗2、4周时ALT、AST、ALP、GGT、TBIL、TBA比较,差异均无统计学意义(P>0.05)。两组治疗2、4周时ALT、AST、ALP、GGT、TBIL复常率比较,差异均无统计学意义(P>0.05)。结论 苦黄注射液序贯苦黄颗粒治疗药物性肝损伤疗效确切,安全性良好,非劣效于注射用丁二磺酸腺苷蛋氨酸序贯丁二磺酸腺苷蛋氨酸肠溶片。
【关键词】 药物性肝损伤;苦黄注射液;苦黄颗粒;丁二磺酸腺苷蛋氨酸;非劣效性试验
【中图分类号】 R 575.1 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2024.0025
Study on the Efficacy and Safety of Kuhuang Injection and Kuhuang Granules in the Sequential Treatment of Drug-induced Liver Injury:a Non-inferiority Randomized Controlled Trial
ZHANG Jiateng1,2,KONG Ming1,2,CHEN Yu1,2,DUAN Zhongping1,2*
1.Difficult & Complicated Liver Diseases and Artificial Liver Center/Fourth Department of Liver Disease Center,Beijing Youan Hospital,Capital Medical University,Beijing 100069,China
2.Beijing Municipal Key Laboratory of Liver Failure and Artificial Liver Treatment Research,Beijing 100069,China
*Corresponding author:DUAN Zhongping,Chief physician/Professor/Doctoral supervisor;E-mail:duan@ccmu.edu.cn
【Abstract】 Background Drug-induced liver injury is the third major liver disease,following viral hepatitis and fatty liver disease. Timely diagnosis and effective treatment are crucial in halting disease progression and improving cure rates. Kuhuang preparation has been widely used in treating acute and chronic hepatitis stemming from various causes,particularly in patients manifesting jaundice,demonstrating clear clinical efficacy and safety. Nonetheless,there remains a dearth of evidence-based medical data concerning the efficacy and safety of hepatoprotective measures in patients with acute drug-induced liver injury. Objective To evaluate the efficacy and safety of Kuhuang injection sequential Kuhuang granules in the treatment of drug-induced liver injury. Methods Using a randomized,positive-controlled,non-inferiority trial design,93 patients diagnosed with acute drug-induced liver injury at Beijing Youan Hospital,Capital Medical University,between November 2021 and September 2023 were selected. These patients were allocated through single-center randomization,with 49 cases assigned to the experimental group and 44 cases to the control group. After receiving conventional hepatoprotective therapy for 4 weeks,the experimental group and the control group were treated with Kuhuang injection/ adenosylmethionine butanedisulfonate for injection for 2 weeks,followed by Kuhuang granules/enteric-coated tablets of adenosylmethionine butanedisulfonate for another 2 weeks. The efficacy rates of jaundice regression,as well as changes in key liver function parameters [alanine aminotransferase(ALT),aspartate aminotransferase(AST),alkaline phosphatase(ALP),gamma-glutamyltransferase(GGT),total bilirubin(TBIL),total bile acid(TBA)] at baseline,2 weeks,and 4 weeks of treatment,along with their normalization rates,were compared between the two groups. Results A total of 4 patients fell off during treatment,including 3 patients in the experimental group and 1 patient in the control group. Following 2 and 4 weeks of treatment,there was no significant difference observed in the efficient rate of jaundice regression between the two groups(P>0.05). Similarly,no significant differences were detected in the levels of ALT,AST,ALP,GGT,TBIL,and TBA between the two groups at the 2-week and 4-week marks of treatment(P>0.05). Additionally,there were no notable variations in the recurrence rates of ALT,AST,ALP,GGT,TBIL,and TBA between the two groups following 2 and 4 weeks of treatment(P>0.05). Conclusion Kuhuang Injection Sequential Kuhuang Granules has definite efficacy and good safety in the treatment of drug-induced liver injury,and is not inferior to adenosylmethionine butyldisulfonate for injection sequential enteric-coated tablets of adenosylmethionine butanedisulfonate.
【Key words】 Drug-induced liver injury;Kuhuang injection;Kuhuang granules;Adenosylmethionine butanedisulfonate;Non-inferiority trial
药物性肝损伤(drug-induced liver injury,DILI)是指药物暴露导致的肝脏损伤,可分为肝细胞性、胆汁淤积性或混合性,也可能涉及免疫反应[1]。根据DILI病程不同,又分为急性DILI和慢性DILI,以前者为主,表现为应用药物后,短期内发生肝脏损伤。据报道,我国DILI年发生率约为23.80/10万,近年来,随着各类新药不断上市及应用药物的不合理性,其发病率不断升高,DILI已成为仅次于病毒性肝炎和脂肪性肝病的第3大肝脏疾病[2]。DILI作为全球急性肝衰竭的主要病因,及时诊断并给予有效治疗是阻断疾病进展、提高治愈率的关键[3-4]。DILI的治疗主要是在停用可疑导致肝损伤药物的基础上进行保肝退黄治疗,常用药物包括甘草酸类、水飞蓟素类、谷胱甘肽类、多烯磷脂酰胆碱等,对伴有胆汁淤积和黄疸的患者,可应用熊去氧胆酸和丁二磺酸腺苷蛋氨酸治疗[5]。苦黄制剂来源于中医经典名方茵陈蒿汤,主要功效为清热利湿、疏肝退黄,多年来临床广泛应用在各种原因导致的急慢性肝炎,尤其是伴有黄疸的患者,临床疗效确切[6]。但是,尚缺乏在急性DILI患者保肝退黄疗效和安全性的循证医学证据。因此,本研究创新性设计了一项前瞻性、非劣效性临床随机对照试验,以注射用丁二磺酸腺苷蛋氨酸序贯丁二磺酸腺苷蛋氨酸肠溶片作为阳性对照药物,比较分析伴有黄疸的急性DILI患者应用苦黄注射液序贯苦黄颗粒治疗4周的疗效和安全性,以期为临床治疗提供依据。
1 资料与方法
1.1 病例选择
选择2021年11月—2023年9月在首都医科大学附属北京佑安医院诊断为急性DILI患者93例,采用单中心随机化的方法,将患者随机分配到试验组(49例)和对照组(44例)。本研究经首都医科大学附属北京佑安医院伦理委员会审批,伦理存档编号为LL-2020-188-K。
1.1.1 诊断标准:根据《药物性肝损伤诊治指南》[7]确定急性DILI诊断标准如下,(1)肝功能损伤生化指标升高;(2)排除由其他原因引起的肝功能损伤;(3)Roussel Uclaf因果关系评估法(RUCAM)量表评分≥3分。
1.1.2 纳入标准:(1)年龄18~70岁,性别不限;(2)符合《药物性肝损伤诊治指南》[7]诊断标准,RUCAM因果关系评价量表评分≥6分,严重程度1~3级;(3)血清总胆红素(TBIL)≥2 ULN,并且<20 ULN;(4)血清丙氨酸氨基转移酶(ALT)≥1 ULN;(5)病程不超过90 d;(6)能理解并签署知情同意书。
1.1.3 排除标准:(1)本次肝损伤是由其他原因(如病毒性肝炎、酒精性肝病和非酒精性脂肪性肝病等)引起;(2)近4周内曾使用具有明确退黄作用的任何中药或化学药品(例如托尼萘酸片、丁二磺酸腺苷蛋氨酸、熊去氧胆酸等);(3)有急性肝衰竭或肝功能失代偿表现者,如出现肝性脑病、腹腔积液、白蛋白(ALB)≤35 g/L、凝血酶原时间国际标准化比值(INR)>1.5;
(4)血肌酐(Cr)大于正常值上限1.5倍;(5)白细胞计数(WBC)<3.0×109/L或血小板计数(PLT)<50×109/L;(6)合并严重的心血管、肾、内分泌、血液系统、神经系统疾病、精神病;(7)对研究药物过敏;(8)妊娠期及哺乳期妇女;(9)筛选前3个月内参加过其他临床试验;(10)研究者认为有任何不适合入选的情况。
1.1.4 脱落标准:随机化后无任何记录者。
1.2 治疗方法
试验期间禁止使用除方案规定外的其他可能对本试验造成影响的药物。治疗期内所有患者同时使用基础保肝药物治疗,试验组患者加用苦黄注射液(常熟雷允上制药有限公司,国药准字Z10960004),30 mL/次,1次/d,治疗2周,再改服苦黄颗粒(雷允上药业集团有限公司,国药准字Z20030141),1袋/次,3次/d,治疗2周。对照组患者加用注射用丁二磺酸腺苷蛋氨酸(意大利/ABBVIE S.R.L,国药准字HJ20171064),1.0 g/次,1次/d,治疗2周,再改服丁二磺酸腺苷蛋氨酸肠溶片(意大利/ABBVIE S.R.L,国药准字HJ20150629),1片/次,2次/d,治疗2周。
1.3 观察指标
本研究主要观察指标为治疗2周和4周后两组退黄有效率(TBIL下降≥基线值50%)。次要疗效指标为观察治疗2周、4周后ALT、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转移酶(GGT)、TBIL、总胆汁酸(TBA)的水平变化以及ALT、AST、ALP、GGT、TBIL的复常率。
1.4 安全性评价
安全性分析包括监控和记录所有的不良事件和严重不良事件(包括事件数量与受试者发生率)。本研究根据《常见不良反应事件评价标准(CTCAE)V5.0》描述不良事件的强度,一般分为1~5级。1级:轻度;无症状或轻度症状;仅临床或诊断发现;无须治疗。2级:中度;最小的、局部的或非侵入性治疗指征;年龄相关工具性日常生活活动受限。3级:重度或重要医学意义,但不会立即危及生命;住院治疗或延长住院时间指征;致残;个人日常生活活动受限。4级:危及生命,需紧急治疗。5级:死亡。
1.5 统计学方法
采用SPSS 26软件进行统计学处理。对两组基线资料进行全分析集(FAS)分析,对所有观察指标进行符合方案集(PPS)分析。对计量资料首先进行正态性分析,符合正态分布的计量资料采用(x-±s)表示,同组治疗前后比较采用配对t检验,组间比较采用独立样本t检验;非正态分布计量资料以M(QR)表示,同组治疗前后比较采用Friedman检验,组间比较采用秩和检验;计数资料以频数、百分比表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
治疗期间共脱落病例4例,其中试验组3例,对照组1例。两组ALP比较,差异有统计学意义(P<0.05);两组年龄、性别、ALT、AST、TBA、GGT、ALB、TBIL、凝血酶原活动度(PTA)、INR、Cr、尿素氮(BUN)、血红蛋白(HB)、WBC、PLT比较,差异均无统计学意义(P>0.05),见表1。
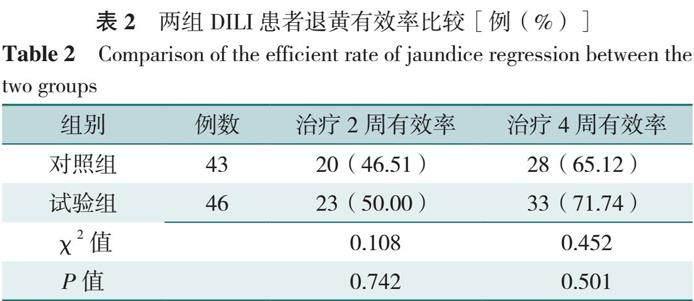
2.2 两组患者退黄有效率分析
通过PPS分析显示,两组治疗2、4周的退黄有效率比较,差异均无统计学意义(P>0.05),见表2。
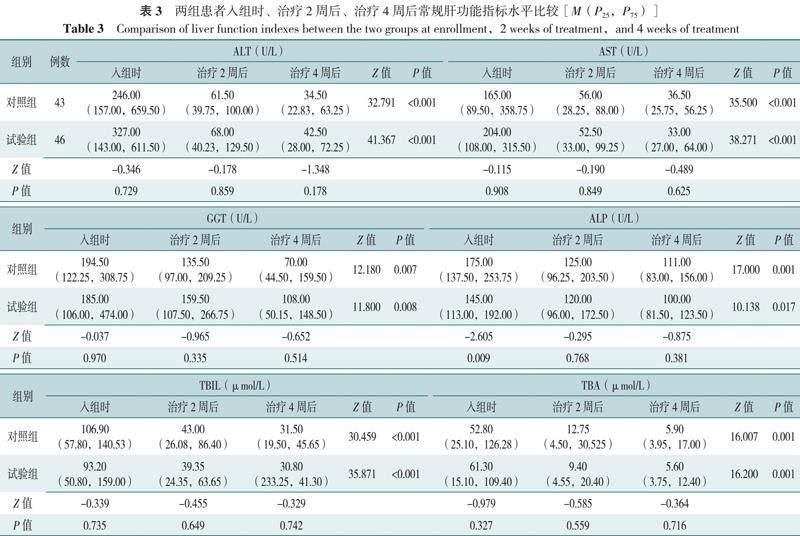
2.3 两组患者常规肝功能指标水平变化分析
通过PPS分析显示,入组时、治疗2周后、治疗4周后,两组ALT、AST、GGT、TBIL、TBA水平比较,差异均无统计学意义(P>0.05);两组组内不同时间点ALT、AST、GGT、ALP、TBIL、TBA水平比较,差异均有统计学意义(P<0.05),见表3。
2.4 两组患者常规肝功能指标复常率分析
通过PPS分析显示,治疗2周、4周时,两组患者ALT、AST、ALP、GGT、TBIL指标复常率比较,差异均无统计学意义(P>0.05),见表4。
2.5 安全性分析
试验组有1例患者出现不良反应,表现为皮疹,停药后好转。对照组有1例患者出现不良反应,表现为胃部不适,停药后好转。试验组和对照组CTCAE均为1级,均无严重不良反应,安全性良好。
3 讨论
DILI是指在药物使用过程中因药物本身或代谢产物或由于特殊体质对药物的超敏感性或耐受降低所导致的肝脏损伤,其发生给多种疾病治疗的连续性造成严重影响,是常见和严重的药物不良反应之一[8]。DILI已成为严重的公共卫生问题之一。因此,及时有效治疗DILI、防止病情进展导致肝衰竭的发生具有重要的临床意义。
近年来中药已成为国内防治肝损伤研究的热点。中药的作用机制是多环节、多靶位的,例如可以减少肝细胞炎症坏死、增强肝细胞的再生、改善肝脏的血液循环。苦黄注射液和苦黄颗粒源于医圣张仲景所著《伤寒论》中的治疗湿热黄疸名方“茵陈蒿汤”,由五味中药(苦参、大黄、茵陈、春柴胡、大青叶)组成。其中君药茵陈是清热利湿、利胆退黄的中药要药;春柴胡和大青叶二者为臣药,具有疏肝、泄热、凉血、解毒之功效;苦参和大黄二者为使药,其中苦参主要用其燥湿之效,佐助君药利湿,大黄主要用其泻下之效,使“湿、热、黄”排出体外[9-10]。现代药理研究表明,苦黄可以改善肝细胞膜功能、恢复胆汁酸转运受体表达,降低转氨酶水平、防止肝细胞和毛细胆管坏死、下调促纤维化基因表达,从而起到缓解胆汁淤积和保肝护肝的作用[11-12]。此外苦黄注射液和苦黄颗粒善于治疗湿热内蕴而引起的黄疸型病毒性肝炎的退黄和降酶[13]。苦黄制剂多年来在各种肝功能异常和黄疸患者中得到广泛应用,前期研究也证明了其在病毒性肝炎治疗中的确切疗效[14]。但是由于传统中药是我国DILI的常见药物之一,以及中药注射制剂静脉滴注安全性等原因,苦黄制剂在DILI的安全性和疗效尚需进一步循证医学证据支持。
临床上常应用复方甘草酸苷或多烯磷脂酰胆碱注射液和丁二磺酸腺苷蛋氨酸制剂治疗DILI患者[15]。丁二磺酸腺苷蛋氨酸是机体内重要的生理活性物质,可以通过促进胆汁分泌加强胆汁酸的排泄以及增加谷胱甘肽的合成,对促进肝细胞再生和肝功能恢复具有重要价值[16]。据报道,丁二磺酸腺苷蛋氨酸可有效抑制DILI患者的炎症发生,降低血清ALT、AST、ALP、GGT、TBIL水平,改善肝功能,提高临床疗效[15,17]。在药物性肝炎患者中也同样发现丁二磺酸腺苷蛋氨酸能够改善ALT、TBIL水平,对肝脏起保护作用[18]。同时其也是指南推荐的可用于胆汁淤积型或混合型DILI的药物[7]。因此,本研究根据苦黄擅长退黄的特点,选择注射用丁二磺酸腺苷蛋氨酸序贯丁二磺酸腺苷蛋氨酸肠溶片作为阳性药物对照,临床观察了在常规使用复方甘草酸苷注射液和多烯磷脂酰胆碱注射液治疗基础上加用苦黄制剂的疗效和安全性。
急性DILI一般无特异性临床表现,可出现无症状的ALT水平轻微升高、黄疸(TBIL逆流入血导致)、脑病和急性肝功能衰竭[1]。肝脏疾病血生化指标的检测至关重要,ALT和AST主要存在于肝组织细胞质的可溶性部分中,当肝细胞膜结构受到破坏,血清中两种转氨酶水平会迅速升高,是反映肝细胞完整性的重要指标;ALP和GGT主要存在于肝细胞血窦侧、毛细胆管及胆管细胞微绒毛上,随胆汁排泄,在药毒性造成的胆汁淤积的初期表现中,ALP和GGT水平的升高最具特征性;胆红素指标反映了肝脏部分功能(如排泄功能和合成功能)受损或障碍,因此这些指标可以反映DILI的严重程度和治疗效果[19-22]。本研究的主要观察指标为治疗2周和4周后,两组退黄有效率(TBIL下降≥基线值50%)比较无显著性差异。已有研究在病毒性肝炎患者中应用苦黄注射液或苦黄颗粒,结果显示其可以明显改善临床症状和体征,显著降低血清TBIL、ALT水平,本研究结果与之一致[23-24]。此外,本研究结果显示两组患者ALT、AST、ALP、GGT、TBIL以及TBA水平组内比较有差异,其复常率不断升高,且两组组间比较均无显著性差异。在81例DILI患者中应用苦黄注射液观察其疗效,本研究结果与之一致[25]。还有研究应用苦黄注射液治疗慢性乙型肝炎患者,结果显示TBIL、AST、ALT水平改善情况均优于西药常规治疗,说明苦黄注射液可提高疾病疗效,改善肝功能,本研究结果与之一致[26]。有研究显示,在急性、慢性病毒性肝炎,尤其是黄疸型肝炎中,苦黄注射液降低TBIL和ALT水平疗效与丁二磺酸腺苷蛋氨酸相当,且增加其剂量可提高疗效水平,本研究的主要结果与之一致[27]。本研究安全性评价显示试验组与对照组均存在1例患者出现不良反应,均无严重不良反应发生。通过对以往应用苦黄注射液产生不良反应的案例进行分析,表明其导致严重不良反应发生的概率较小,罕见过敏反应,安全性良好,本研究结果与之一致[28]。
本研究具有一定的局限性,如病例均来自首都医科大学附属北京佑安医院,为单中心临床研究;临床样本量较小;可能存在选择偏倚。未来需要开展大样本、多中心的临床研究来进一步验证其疗效,探究其作用机制。总之,苦黄注射液序贯苦黄颗粒治疗DILI可明显改善临床症状,退黄疗效确切,安全性良好,可有效进行保肝降酶治疗。此外,其与丁二磺酸腺苷蛋氨酸序贯丁二磺酸腺苷蛋氨酸肠溶片疗效水平相当,属于非劣效性,进一步凸显了中医药特色疗法的优势。未来苦黄制剂在DILI患者的临床治疗中可发挥重要作用。
作者贡献:张家腾进行数据的收集与整理,撰写论文;孔明负责研究的实施,进行论文的修订;陈煜、段钟平提出主要研究目标,负责研究的构思与设计;段钟平负责文章的质量控制与审查,对文章整体负责,监督管理。
本文无利益冲突。
张家腾:https://orcid.org/0000-0002-6841-6358
参考文献
ALLISON R,GURAKA A,SHAWA I T,et al. Drug induced liver injury-a 2023 update[J]. J Toxicol Environ Health B Crit Rev,2023,26(8):442-467. DOI:10.1080/10937404.2023.2261848.
LI X Y,TANG J T,MAO Y M. Incidence and risk factors of drug-induced liver injury[J]. Liver Int,2022,42(9):1999-2014. DOI:10.1111/liv.15262.
LIM J,KIM J S,KIM H W,et al. Metabolic disorders are associated with drug-induced liver injury during antituberculosis treatment:a multicenter prospective observational cohort study in Korea[J]. Open Forum Infect Dis,2023,10(8):ofad422. DOI:10.1093/ofid/ofad422.
KOBAYASHI T,IWAKI M,NOGAMI A,et al. Epidemiology and management of drug-induced liver injury:importance of the updated RUCAM[J]. J Clin Transl Hepatol,2023,11(5):1239-1245. DOI:10.14218/JCTH.2022.00067S.
马世武,刘成海,刘晓琰,等. 中国药物性肝损伤诊治指南(2023年版)[J]. 胃肠病学,2022,27(6):341-375.
林笑晗,贲腾,田尧,等. 苦黄注射液联合复方蛋氨酸胆碱治疗酒精性脂肪肝的疗效及对肝纤维化的影响研究[J]. 转化医学杂志,2022,11(4):233-236,217. DOI:10.3969/j.issn.2095-3097.2022.04.010.
于乐成,茅益民,陈成伟. 药物性肝损伤诊治指南[J]. 实用肝脏病杂志,2017,20(2):257-274.
耿文静,刘晖,丁惠国. 药物性肝损伤的潜在机制、病理特点及生物标志物[J]. 临床肝胆病杂志,2019,35(4):925-929. DOI:10.3969/j.issn.1001-5256.2019.04.049.
中华医学会急诊医学分会. 苦黄注射液治疗急性消化系统疾病的临床应用专家共识[J]. 中华急诊医学杂志,2023,32(5):593-599. DOI:10.3760/cma.j.issn.1671-0282.2023.05.005.
中国中西医结合学会消化疾病专业委员会,肝病专业委员会. 苦黄颗粒治疗急慢性肝炎湿热内蕴证的专家共识意见[J]. 中西医结合肝病杂志,2022,32(9):后插1-后插3,封3.
WU Q,DUAN Z P,HUANG L,et al. Kuhuang injection exerts a protective effect by activating PPAR-γ in an in vitro model of chlorpromazine-induced cholestatic liver injury constructed by tissue engineering[J]. Pharm Biol,2022,60(1):1679-1689. DOI:10.1080/13880209.2022.2110128.
SHEN B,ZHOU C,GU T Y,et al. Kuhuang alleviates liver fibrosis by modulating gut microbiota-mediated hepatic IFN signaling and bile acid synthesis[J]. Front Pharmacol,2022,13:1080226. DOI:10.3389/fphar.2022.1080226.
刘成海,孙明瑜,吕靖. 苦黄颗粒治疗急慢性肝炎湿热内蕴证的专家共识意见[J]. 中西医结合肝病杂志,2022,32(9):865-868.
赵君,廖星,赵晖,等. 苦黄注射液治疗病毒性肝炎的有效性和安全性:随机对照试验的系统评价和Meta分析[J]. 中国中药杂志,2017,42(20):4007-4026. DOI:10.19540/j.cnki.cjcmm.20170901.007.
赵阳,刘景华. 异甘草酸镁联合丁二磺酸腺苷蛋氨酸对药物性肝损伤患者肝功能、肝纤维化指标的影响[J]. 青岛医药卫生,2023,55(4):279-282. DOI:10.3969/j.issn.1006-5571.2023.04.011.
朱娅鸽,刘锦峰. 丁二磺酸腺苷蛋氨酸联合复方甘草酸苷治疗酒精性肝硬化患者疗效及其对血清BGP水平的影响[J]. 实用肝脏病杂志,2019,22(6):872-875. DOI:10.3969/j.issn.1672-5069.2019.06.024.
林成,王同彪,李岳勇,等. 甘草酸镁联合丁二磺酸腺苷蛋氨酸治疗药物性肝损伤患者疗效研究[J]. 实用肝脏病杂志,2021,24(2):232-235. DOI:10.3969/j.issn.1672-5069.2021.02.021.
伍林秀. 丁二磺酸腺苷蛋氨酸联合熊去氧胆酸在药物性肝炎患者中的治疗效果评估[J]. 中外医疗,2022,41(30):103-106,115. DOI:10.16662/j.cnki.1674-0742.2022.30.103.
林文海. 芪苓散粗多糖对四氯化碳引起急性肝损伤雏鸡血清中ALT和AST的影响[J]. 福建畜牧兽医,2020,42(2):4-6. DOI:10.3969/j.issn.1003-4331.2020.02.002.
王俊峰,赵亮,王俊杰,等. 脓毒血症肝损伤患者血清TBA、ALP水平与凝血功能特征观察[J]. 肝脏,2022,27(5):593-595. DOI:10.14000/j.cnki.issn.1008-1704.2022.05.024.
郭丰昌. GGT、ALP对药物性肝损伤的临床诊断价值研究[D]. 长春:吉林大学,2019.
TESCHKE R,DANAN G. Molecular research on drug induced liver injury[J]. Int J Mol Sci,2018,19(1):216. DOI:10.3390/ijms19010216.
陆云飞. 苦黄颗粒治疗病毒性肝炎疗效观察及药物经济性评价[J]. 中国临床医生杂志,2021,49(11):1381-1383. DOI:10.3969/j.issn.2095-8552.2021.11.039.
陆云飞,陆伟,王雅俊,等. 苦黄颗粒用于黄疸型病毒性肝炎的网状Meta分析及药物经济学评价[J]. 中国药物经济学,2022,17(8):5-10. DOI:10.12010/j.issn.1673-5846.2022.08.001.
曹兴国,潘剑,丁巧云,等. 苦黄注射液治疗药物性肝损伤81例疗效观察[J]. 临床合理用药杂志,2020,13(32):9-10,26. DOI:10.15887/j.cnki.13-1389/r.2020.32.004.
廉华,周涛,胡莲,等. 苦黄注射液、复方甘草酸苷、阿德福韦酯三联疗法治疗HBeAg阳性慢性乙型肝炎的临床疗效及对患者免疫功能的影响[J]. 现代中西医结合杂志,2017,
26(12):1314-1316. DOI:10.3969/j.issn.1008-8849.2017.12.020.
牟金金,杨敏,唐尧. 苦黄注射液对黄疸型病毒性肝炎退黄降酶效果及安全性的系统评价[J]. 中国药房,2011,22(32):3044-3047.
郭锦辉,高卫芳,贾素洁. 苦黄注射液致不良反应文献分析[J]. 中国医院用药评价与分析,2014,14(1):72-74. DOI:10.14009/j.issn.1672-2124.2014.01.004.
(本文编辑:贾萌萌)
*通信作者:段钟平,主任医师/教授/博士生导师;E-mail:duan@ccmu.edu.cn
引用本文:张家腾,孔明,陈煜,等.苦黄注射液序贯苦黄颗粒治疗药物性肝损伤的疗效及安全性研究:一项非劣效性随机对照试验[J]. 中国全科医学,2024,27(26):3249-3254. DOI:10.12114/j.issn.1007-9572.2024.0025. [www.chinagp.net]
ZHANG J T,KONG M,CHEN Y,et al. Study on the efficacy and safety of Kuhuang injection and Kuhuang granules in the sequential treatment of drug-induced liver injury:a non-inferiority randomized controlled trial[J]. Chinese General Practice,2024,27(26):3249-3254.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.

