原发性高血压患者血浆致动脉粥样硬化指数及血清脂蛋白相关磷脂酶A2水平与左心室肥厚的关系研究
秦瑞丹 张娟 梁营营 吕露露 李祎珂


【摘要】 背景 高血压是当前临床上常见的慢性非传染性疾病,由于人口老龄化和人类生活方式的改变,全球高血压患病率呈上升趋势。长期血压增高会导致心、脑、肾、眼底等多种靶器官的损害,严重威胁人类健康,是全球疾病负担的主要原因。而左心室作为终末器官损伤的主要靶点,其结构改变也是许多心血管疾病发生、发展的病理基础。目的 探讨原发性高血压患者血浆致动脉粥样硬化指数(AIP)及血清脂蛋白相关磷脂酶A2(Lp-PLA2)水平与左心室肥厚(LVH)的关系。方法 纳入2021年10月—2023年6月就诊于郑州大学第二附属医院心血管内科的原发性高血压患者167例为研究对象,收集患者基线资料,收集患者空腹肘静脉血检测生化指标,入院后24 h内进行超声心动图检查,计算左心室质量(LVM)、左心室质量指数(LVMI)。根据LVMI将患者分为非左心室肥厚组(NLVH组)87例、LVH组80例。采用Pearson相关性检验及Spearman秩相关分析探究血清Lp-PLA2水平及AIP与超声心动图参数的相关性。采用多因素Logistic回归分析探究高血压患者发生LVH的影响因素。绘制受试者工作特征曲线(ROC曲线)探究血清Lp-PLA2水平及AIP对高血压患者合并LVH的诊断价值,并计算ROC曲线下面积(AUC)。结果 LVH组患者年龄、高血压病程、N末端B型尿钠肽前体(NT-proBNP)、超敏C反应蛋白(hs-CRP)、左心室后壁厚度(LVWPT)、室间隔厚度(IVST)、左心室舒张末期内径(LVEDd)、左心房收缩末期内径(LAESd)、Lp-PLA2水平、AIP、LVM及LVMI高于NLVH组(P<0.05)。相关性分析结果显示,LVMI与Lp-PLA2、AIP、NT-proBNP、hs-CRP、年龄、高血压病程呈正相关(P<0.05),LVWPT与Lp-PLA2、AIP、NT-proBNP、hs-CRP、高血压病程呈正相关(P<0.05),IVST与Lp-PLA2、AIP、hs-CRP、年龄、高血压病程呈正相关(P<0.05),LVEDd与Lp-PLA2、AIP、NT-proBNP、hs-CRP呈正相关(P<0.05)。多因素Logstic回归分析结果显示,hs-CRP升高(OR=1.249,95%CI=1.007~1.548,P=0.043)、NT-proBNP升高(OR=1.009,95%CI=1.002~1.017,P=0.011)、AIP升高(OR=14.557,95%CI=1.220~173.753,P=0.034)、Lp-PLA2升高(OR=1.042,95%CI=1.024~1.059,P<0.001)是高血压患者发生LVH的危险因素。ROC曲线结果显示,AIP、Lp-PLA2及联合检测诊断高血压合并LVH的AUC分别为0.649(95%CI=0.566~0.733)、0.780(95%CI=0.705~0.854)、0.804(95%CI=0.733~0.874)。结论 血清Lp-PLA2水平及AIP值与左心室形态结构改变紧密相关,两者联合检测有助于高血压左心室肥厚的早期临床诊断,对临床诊疗具有指导意义。
【关键词】 原发性高血压;肥大,左心室;血浆致动脉粥样硬化指数;脂蛋白相关磷脂酶A2
【中图分类号】 R 544.1 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0804
Relationship between Atherogenic Index of Plasma and Serum Lp-PLA2 Levels and Left Ventricular Hypertrophy in Patients with Hypertension
QIN Ruidan,ZHANG Juan*,LIANG Yingying,LYU Lulu,LI Yike
Department of Cardiovascular Medicine,the Second Affiliated Hospital of Zhengzhou University,Zhengzhou 450000,China
*Corresponding author:ZHANG Juan,Chief physician;E-mail:zj78420@163.com
【Abstract】 Background Hypertension is a common chronic non-communicable disease in clinical practice,and its prevalence is on the rise globally due to population aging and changes in human lifestyles. Prolonged high blood pressure can lead to damage to various target organs such as the heart,brain,kidneys,and retina,severely threatening human health and being a major cause of global disease burden. The left ventricle,as the primary target of end-organ damage,its structural changes are also the pathological basis for the development of many cardiovascular diseases. Objective This study aims to explore the relationship between the atherogenic index of plasma(AIP)and serum lipoprotein-associated phospholipase A2(Lp-PLA2)levels and left ventricular hypertrophy(LVH)in patients with primary hypertension. Methods A total of 167 patients with primary hypertension who visited the Department of Cardiovascular Medicine at the Second Affiliated Hospital of Zhengzhou University from October 2021 to June 2023 were enrolled in this study. Baseline data of the patients were collected,and fasting venous blood biochemical markers were measured. Echocardiograms were conducted within 24 hours of admission to calculate left ventricular mass(LVM)and left ventricular mass index(LVMI). Patients were divided into non-left ventricular hypertrophy(NLVH)group(87 patients)and LVH group(80 patients)based on LVMI. Pearson correlation test and Spearman rank correlation analysis were used to investigate the correlation between serum Lp-PLA2 level,AIP and echocardiographic parameters. Multivariate Logistic regression analysis was used to explore the influencing factors of LVH in hypertensive patients. Receiver operating characteristic(ROC)curve was plotted to explore the diagnostic value of serum Lp-PLA2 level and AIP in hypertensive patients with LVH, and the area under ROC curve(AUC)was calculated. Results Patients in the LVH group had higher age,duration of hypertension,levels of N-terminal pro B-type natriuretic peptide(NT-proBNP),high-sensitivity C-reactive protein(hs-CRP),left ventricular posterior wall thickness(LVWPT),interventricular septal thickness(IVST),left ventricular end-diastolic diameter(LVEDd),left atrial end-systolic diameter(LAESd),Lp-PLA2 levels,AIP,LVM,and LVMI compared to the NLVH group(P<0.05). Correlation analysis showed that LVMI was positively correlated with Lp-PLA2,AIP,NT-proBNP,hs-CRP,age,and duration of hypertension(P<0.05). LVWPT was positively correlated with Lp-PLA2,AIP,NT-proBNP,hs-CRP,and duration of hypertension(P<0.05). IVST was positively correlated with Lp-PLA2,AIP,hs-CRP,age,and duration of hypertension(P<0.05). LVEDd was positively correlated with Lp-PLA2,AIP,NT-proBNP,hs-CRP(P<0.05). Multivariate Logistic regression analysis showed that elevated hs-CRP(OR=1.249,95%CI=1.007-1.548,P=0.043),elevated NT-proBNP(OR=1.009,95%CI=1.002-1.017,P=0.011),increased AIP(OR=14.557,95%CI=1.220-173.753,P=0.034),and increased Lp-PLA2(OR=1.042,95%CI=1.024-1.059,P<0.001)were risk factors for LVH in hypertensive patients. ROC curve results showed that the AUC for diagnosing hypertension combined with LVH using AIP,Lp-PLA2,and combined testing were 0.649(95%CI=0.566-0.733),0.780(95%CI=0.705-0.854),and 0.804(95%CI=0.733-0.874),respectively. Conclusion Serum Lp-PLA2 levels and AIP are closely related to changes in the morphological structure of the left ventricle. Combined testing of both can aid in the early clinical diagnosis of left ventricular hypertrophy in hypertensive patients,providing guidance for clinical diagnosis and treatment.
【Key words】 Essential hypertension;Hypertrophy,left ventricular;Atherogenic index of plasma;Lipoprotein-associated phospholipase A2
高血压是目前临床上最常见的慢性非传染性疾病,严重威胁着人类健康[1],被认为是心血管疾病不良事件发生及预后的主要危险因素[2]。长期血压增高会导致心、脑、肾等多种靶器官的损害,最主要为左心结构的改变,继而引起左心室器质性病变,主要表现为左心室心肌细胞肥厚和心室扩大,并会出现心脏舒张及收缩功能障碍,继而演变为高血压心脏病,最终引起心力衰竭[3]。脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)作为新生炎症标志物,目前其在血管炎症相关疾病中的作用已被广泛研究,且被确定为动脉粥样硬化相关心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的独立风险生物标志物[4-6]。血浆致动脉粥样硬化指数(atherogenic index of plasma,AIP)是近几年新定义的非传统脂质参数之一,目前研究也证实其是严重不良心血管事件和动脉粥样硬化的危险因素[7-9]。但目前关于AIP与左心室肥厚(left ventricular hypertrophy,LVH)之间关系的研究尚较少,且两者联合对于LVH的预测价值尚不明确,本研究旨在探讨血清Lp-PLA2水平、AIP与LVH之间的关系,并预测其在高血压合并LVH中的诊断价值,为LVH的临床诊疗提供思路及依据。
1 对象与方法
1.1 研究对象
纳入2021年10月—2023年6月就诊于郑州大学第二附属医院心血管内科的原发性高血压患者167例。纳入标准:(1)年龄≥18岁;(2)符合《中国高血压防治指南2018年修订版》[10]的诊断标准;(3)病案信息完整、病情可控、依从性良好。排除标准:(1)继发性高血压;(2)患有冠心病、糖尿病;(3)合并严重肝、肾功能不全;(4)近期有重大手术史;(5)甲状腺功能不全;(6)患有血液系统及风湿免疫系统疾病;(7)合并恶性肿瘤。本研究经郑州大学第二附属医院伦理委员会审核通过(伦理批号:2023095),入组患者均签署知情同意书。
1.2 研究方法
1.2.1 基线资料收集:详细记录患者入院24 h内的一般资料,包括性别、年龄、BMI、吸烟史(吸烟定义为至少吸1支/d且连续或累计吸烟≥6个月,或戒烟<5年且至住院时戒烟<1个月或目前仍在吸烟)、饮酒史(饮酒定义为酒精摄入量女性>40 g/d,男性>80 g/d,且时长>5年)、高血压病程、高脂血症、血压等,并于入院后次日采集患者晨起空腹肘静脉血,采用全自动生化分析仪检测空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、小而密低密度脂蛋白、肌酐、尿素、尿酸、N末端B型尿钠肽前体(NT-proBNP)、超敏C反应蛋白(hs-CRP)等指标,并计算AIP=Lg(TG/HDL-C)。
1.2.2 血清Lp-PLA2水平检测:取静脉血4 mL,于4 ℃下离心15 min,离心半径10 cm,离心后取上清液,采用酶联免疫吸附法检测血清Lp-PLA2水平。
1.2.3 超声心动图检查:患者入院后24 h内进行超声心动图检查。测定左心室后壁厚度(LVWPT)、室间隔厚度(IVST)、左心室舒张末期内径(LVEDd)、左心房收缩末期内径(LAESd)、左心室射血分数(LVEF)等超声心动图参数,连续测量3个心动周期,取平均值。计算左心室质量(LVM,g)=0.8×1.04×[(LVEDd+IVST+LVPWT)3-(LVEDd)3]+0.6,体表面积(BSA,m2)=0.006 1×身高(cm)+0.012 8×体质量(kg)-0.152 9。相对室壁厚度=(2×LVWPT)/LVEDd,根据LVM和BSA计算左心室质量指数(LVMI,g/m2)=左心室质量(g)/体表面积(m2),并依据《中国高血压防治指南2018年修订版》[10]将男性LVMI≥115 g/m2和女性LVMI≥95 g/m2定义为LVH,根据LVMI分为非左心室肥厚组(NLVH组)87例、LVH组80例。
1.3 统计学方法
采用SPSS 26.0统计学软件进行数据分析。计数资料以相对数表示,组间比较采用χ2检验;符合正态分布的计量资料以(x-±s)表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney U检验。采用Pearson相关性检验及Spearman秩相关分析探究血清Lp-PLA2水平及AIP与超声心动图参数的相关性。采用多因素Logistic回归分析探究高血压患者发生LVH的影响因素。绘制受试者工作特征曲线(ROC曲线)探究血清Lp-PLA2水平及AIP对高血压患者合并LVH的诊断价值,并计算ROC曲线下面积(AUC)。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料
LVH组患者年龄、高血压病程、NT-proBNP、hs-CRP、LVWPT、IVST、LVEDd、LAESd高于NLVH组,差异有统计学意义(P<0.05);两组患者性别、吸烟史、饮酒史、高脂血症、BMI、收缩压、舒张压、TC、LDL-C、HDL-C、小而密低密度脂蛋白、FPG、肌酐、尿素、LVEF、相对室壁厚度、相对体表面积、TG比较,差异无统计学意义(P>0.05),见表1。
2.2 两组血清Lp-PLA2水平、AIP、LVM及LVMI比较
LVH组血清Lp-PLA2水平、AIP、LVM及LVMI高于NLVH组,差异有统计学意义(P<0.05),见表2。
2.3 血清Lp-PLA2水平、AIP及一般资料与超声心动图参数的相关性分析
将血清LP-PLA2水平、AIP及两组间差异有统计学意义的一般资料纳入相关性分析,结果显示,LVMI与Lp-PLA2、AIP、NT-proBNP、hs-CRP、年龄、高血压病程呈正相关(P<0.05),LVWPT与Lp-PLA2、AIP、NT-proBNP、hs-CRP、高血压病程呈正相关(P<0.05),IVST与Lp-PLA2、AIP、hs-CRP、年龄、高血压病程呈正相关(P<0.05),LVEDd与Lp-PLA2、AIP、NT-proBNP、hs-CRP呈正相关(P<0.05),见表3。
2.4 高血压患者发生LVH影响因素的多因素Logstic回归分析
以患者是否发生LVH为因变量(赋值:否=0,是=1),以年龄、高血压病程、hs-CRP、NT-proBNP、AIP、Lp-PLA2(赋值均为实测值)为自变量进行多因素Logstic回归分析,结果显示,hs-CRP升高、NT-proBNP升高、AIP升高、Lp-PLA2升高是高血压患者发生LVH的危险因素(P<0.05),见表4。
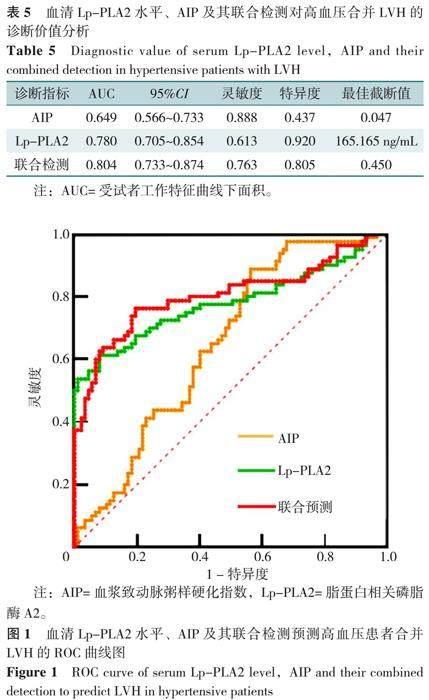
2.5 血清Lp-PLA2水平、AIP及其联合检测对高血压患者合并LVH的诊断价值分析
ROC曲线结果示,AIP、Lp-PLA2及联合检测诊断高血压合并LVH的AUC分别为0.649(95%CI=0.566~0.733)、0.780(95%CI=0.705~0.854)、0.804(95%CI=0.733~0.874),见表5、图1。
3 讨论
我国人群高血压的患病率呈上升趋势,并呈现年轻化趋势,对我国卫生是一项巨大挑战[10]。目前多项研究证实,血压水平与心脑血管疾病的发生和死亡风险呈独立、持续、直接的正相关关系[11-12]。长期血压升高-LVH-心力衰竭是一条重要的事件关系链[13-14],早期诊断、预防长期高血压引起的LVH可显著降低高血压患者发生心血管不良事件的风险,并可能成为未来高血压及心血管治疗的靶点。
有报道指出,高血压患者在血压控制欠佳、心室长期后负荷偏高的情况下,心肌细胞会发生增生、肥大、顺应性降低,并出现心肌纤维化及心室重构等,且随着年龄增加,心肌纤维本身也会发生变化[1,15-16]。本研究结果显示,LVH组患者的年龄及高血压病程高于NLVH组患者,并且年龄与高血压病程均与LVMI呈正相关,提示年龄较大、病程较长的患者发生LVH的风险更高。本研究还发现,LVH组的NT-proBNP及hs-CRP水平高于NLVH组,并与LVMI呈正相关,多因素Logistic回归结果也提示两者是高血压患者合并LVH的危险因素。NT-proBNP是由心肌细胞收到刺激后合成并释放的利钠肽成员,这些刺激包括心肌自身容量增加和压力超负荷引起的心肌伸展、局部缺血、纤维化和炎症等[14],其原因可能为高血压患者长期血压增高,后负荷增大,使心肌细胞受到刺激,从而导致其分泌增多,并与LVH互为因果关系。hs-CRP作为重要的炎症标志物,其检出率要较C反应蛋白高,且常作为高血压和动脉粥样硬化等血管损伤性疾病的预测因子[15]。
由于Lp-PLA2对血小板活化因子的水解作用,其最初被命名为血浆血小板活化因子乙酰水解酶,Lp-PLA2还可以水解氧化的LDL为两种生物活性产物,溶血磷脂酰胆碱和氧化的非酯化脂肪酸,并通过调节血液中的脂质代谢介导血管炎症[16],并被认为是新出现的与动脉粥样硬化相关的炎症生物标志物[17]。且LV等[6]研究发现,在应用Lp-PLA2抑制剂后,机体能通过抑制心脏巨噬细胞表面的受体蛋白表达,从而抑制心脏炎性反应和心肌纤维化,保护长期血压增高所致心肌损伤。本研究发现LVH组血清Lp-PLA2水平明显高于NVLH组,相关性分析显示Lp-PLA2与LVH呈正相关,且多因素Logistic回归分析结果显示,Lp-PLA2为高血压合并LVH的独立危险因素。究其原因可能是由于Lp-PLA2水平越高,导致机体发生氧化应激及诱导炎症反应的能力越强,血管内皮功能紊乱,加速心肌纤维增生和胶原合成增加,从而促进了LVH的形成。
AIP是一种新出现的生物标志物,其由摩尔浓度下TG与HDL-C的对数转换比率组成[18]。既往研究可得知,高TG血症和低HDL-C水平是冠心病的高风险标志物[19]。AIP将这两个脂质参数组合成一个新的单一的生物标志物,且相较于传统的脂质参数及心血管危险因素,其预测能力得到大幅提升[20]。沈飞燕等[21]以AIP为切入点分组分析AIP与左心室质量指数(LVMI)的关系,发现AIP可能为LVMI的独立危险因素,并解释其引起LVH的机制可能是胰岛素抵抗。本研究以高血压是否合并LVH为切入点分组,分析两组之间AIP值的关系,发现LVH组AIP值高于NLVH组,且与LVMI呈正相关,多因素Logistic回归分析结果也得出其是LVH的独立危险因素,与既往研究结果一致。且目前研究发现炎症在高血压心脏重塑的发病机制中起着重要作用[22]。考虑可能是由于AIP作为非传统脂质参数,通过介导脂质代谢促进血管内皮炎症及胰岛素抵抗进一步加速LVH的程度,并加重心血管疾病发生的风险。由于降脂药的应用,多数患者LDL-C在正常范围内,但是仍可检出斑块[23]。AIP的出现可能为早期发现LVH提供依据。
此外,本研究进一步绘制ROC曲线发现,血清Lp-PLA2水平及AIP的联合检测对高血压合并LVH的诊断价值最高,表明上述两项指标均参与左心室重构过程,且两项指标联合评估可以更准确地确定LVH的发生。因此,在临床工作中,可积极检测Lp-PLA2、血脂等指标,并计算AIP,如有升高,可快速进行干预并对症处理,防控LVH的发生、发展。但本研究为单中心小样本量、横断面研究,还需进一步完善多中心、大样本研究证实,且其参与高血压合并LVH的具体机制尚未完全明确,也需要行进一步研究证实。
4 小结
综上所述,AIP及血清Lp-PLA2水平与LVH存在紧密联系,与LVMI呈正相关,AIP及Lp-PLA2水平是高血压患者发生LVH的独立危险因素,并有一定的诊断价值,且二者联合检测诊断价值较高,通过早期检测发现并及时干预,降低远期不良心血管事件的发生率及死亡率。
作者贡献:秦瑞丹提出主要研究课题,负责整体研究的构思设计并实施研究及撰写论文;秦瑞丹、梁营营进行数据的收集与整理,统计学处理;梁营营、吕露露、李祎珂进行图、表的绘制与展示及论文的修订;张娟对文章整体负责,负责文章的质量控制与审查。
本文无利益冲突。
参考文献
李依朔,刘宁,杨明等.心肌纤维化在高血压心脏病中的研究进展[J].心血管病学进展,2023,44(7):627-630,639.DOI:10.16806/j.cnki.issn.1004-3934.2023.07.012.
YILDIZ M,OKTAY A A,STEWART M H,et al. Left ventricular hypertrophy and hypertension[J]. Prog Cardiovasc Dis,2020,63(1):10-21. DOI:10.1016/j.pcad.2019.11.009.
RISMIATI H,LEE H Y. Hypertensive heart failure in Asia[J]. Pulse,2021,9(3/4):47-56. DOI:10.1159/000518661.
MA S,DING L C,CAI M D,et al. Association Lp-PLA2 gene polymorphisms with coronary heart disease[J]. Dis Markers,2022,2022:9775699. DOI:10.1155/2022/9775699.
HUANG F B,WANG K,SHEN J H. Lipoprotein-associated phospholipase A2:the story continues[J]. Med Res Rev,2020,40(1):79-134. DOI:10.1002/med.21597.
LV S L,ZENG Z F,GAN W Q,et al. Lp-PLA2 inhibition prevents AngⅡ-induced cardiac inflammation and fibrosis by blocking macrophage NLRP3 inflammasome activation[J]. Acta Pharmacol Sin,2021,42(12):2016-2032. DOI:10.1038/s41401-021-00703-7.
QIN Z,ZHOU K,LI Y P,et al. The atherogenic index of plasma plays an important role in predicting the prognosis of type 2 diabetic subjects undergoing percutaneous coronary intervention:results from an observational cohort study in China[J]. Cardiovasc Diabetol,2020,19(1):23. DOI:10.1186/s12933-020-0989-8.
LIU H B,LIU K,PEI L L,et al. Atherogenic index of plasma predicts outcomes in acute ischemic stroke[J]. Front Neurol,2021,12:741754. DOI:10.3389/fneur.2021.741754.
KIM J J,YOON J,LEE Y J,et al. Predictive value of the atherogenic index of plasma(AIP)for the risk of incident ischemic heart disease among non-diabetic koreans[J]. Nutrients,2021,13(9):3231. DOI:10.3390/nu13093231.
《中国高血压防治指南》修订委员会. 中国高血压防治指南2018年修订版[J]. 心脑血管病防治,2019,19(1):1-44. DOI:10.3969/j.issn.1009-816X.2019.01.001.
MACKENZIE I S,ROGERS A,POULTER N R,et al. Cardiovascular outcomes in adults with hypertension with evening versus morning dosing of usual antihypertensives in the UK(TIME study):a prospective,randomised,open-label,blinded-endpoint clinical trial[J]. Lancet,2022,400(10361):1417-1425. DOI:10.1016/s0140-6736(22)01786-x.
LAWES C M M,RODGERS A,BENNETT D A,et al. Blood pressure and cardiovascular disease in the Asia Pacific region[J]. J Hypertens,2003,21(4):707-716. DOI:10.1097/00004872-200304000-00013.
HENGEL F E,SOMMER C,WENZEL U. Arterial hypertension[J]. Dtsch Med Wochenschr,2022,147(7):414-428. DOI:10.1055/a-1577-8663.
KUWAHARA K. The natriuretic peptide system in heart failure:diagnostic and therapeutic implications[J]. Pharmacol Ther,2021,227:107863. DOI:10.1016/j.pharmthera.2021.107863.
SILVA D,ANT?NIO PAIS DE LACERDA. High-sensitivity C-reactive protein as a biomarker of risk in coronary artery disease[J]. Rev Port Cardiol,2012,31(11):733-745. DOI:10.1016/j.repc.2012.02.018.
LI J P,CAO T Y,WEI Y P,et al. A review of novel cardiac biomarkers in acute or chronic cardiovascular diseases:the role of soluble ST2(sST2),lipoprotein-associated phospholipase A2(lp-PLA2),myeloperoxidase(MPO),and procalcitonin(PCT)[J]. Dis Markers,2021,2021:6258865. DOI:10.1155/2021/6258865.
IKONOMIDIS I,MICHALAKEAS C A,LEKAKIS J,et al. The role of lipoprotein-associated phospholipase A2(lp-PLA2)in cardiovascular disease[J]. Rev Recent Clin Trials,2011,6(2):108-113. DOI:10.2174/157488711795177903.
ULLOQUE-BADARACCO J R,HERNANDEZ-BUSTAMANTE E A,ALARCON-BRAGA E A,et al. Atherogenic index of plasma and coronary artery disease:a systematic review[J]. Open Med,2022,17(1):1915-1926. DOI:10.1515/med-2022-0590.
MILLER M,JR KWITEROVICH P O. Isolated low HDL-cholesterol as an important risk factor for coronary heart disease[J]. Eur Heart J,1990,11(Suppl H):9-14. DOI:10.1093/eurheartj/11.suppl_h.9.
HAN S H,NICHOLLS S J,SAKUMA I,et al. Hypertriglyceridemia and cardiovascular diseases:revisited[J]. Korean Circ J,2016,46(2):135-144. DOI:10.4070/kcj.2016.46.2.135.
沈飞燕,张政. 原发性高血压患者血浆致动脉硬化指数与左心室质量指数的相关性研究[J]. 心肺血管病杂志,2022,41(7):749-753. DOI:10.3969/j.issn.1007-5062.2022.07.008.
MCMASTER W G,KIRABO A,MADHUR M S,et al. Inflammation,immunity,and hypertensive end-organ damage[J]. Circ Res,2015,116(6):1022-1033. DOI:10.1161/CIRCRESAHA.116.303697.
PAN Z H,GUO H W,WANG Q Q,et al. Relationship between subclasses low-density lipoprotein and carotid plaque[J]. Transl Neurosci,2022,13(1):30-37. DOI:10.1515/tnsci-2022-0210.
(本文编辑:邹琳)
*通信作者:张娟,主任医师;E-mail:zj78420@163.com
基金项目:河南省医学科技攻关计划联合共建项目(LHGJ20220438)
引用本文:秦瑞丹,张娟,梁营营,等. 原发性高血压患者血浆致动脉粥样硬化指数及血清脂蛋白相关磷脂酶A2水平与左心室肥厚的关系研究[J]. 中国全科医学,2024,27(27):3359-3364. DOI:10.12114/j.issn.1007-9572.2023.0804. [www.chinagp.net]
QIN R D,ZHANG J,LIANG Y Y,et al. Relationship between atherogenic index of plasma and serum Lp-PLA2 levels and left ventricular hypertrophy in patients with hypertension[J]. Chinese General Practice,2024,27(27):3359-3364.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.

